Proverbes Indiens
"Fais du bien à ton corps pour que ton âme ait envie d'y rester."
"La terre n'est pas un don de nos parents, ce sont nos enfants qui nous la prêtent."
"Ne blâme pas Dieu d'avoir créé le tigre, mais remercie-le de ne pas lui avoir donné d'ailes."
"Parler de ce qu'on ne connaît pas, c'est vouloir jouer aux échecs sans échiquier."
La Covid 19 favorise une pathologie rare qui sévit sur le continent indien avec un gravité et une fréquence, accrues par rapport à la 1ère vague de 2020.
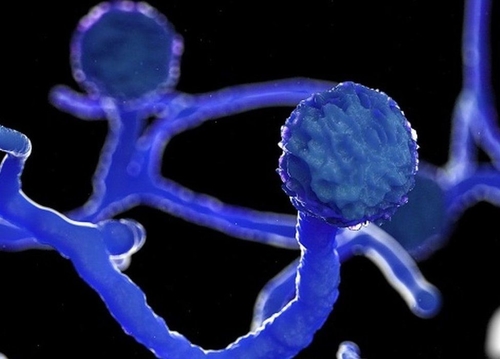
Ainsi alors qu’une deuxième vague mortelle de la Covid-19 ravage l’Inde, les médecins signalent l’éruption parmi les patients Covid-19 en convalescence et en rétablissement, de cas en nombre croissant d’une infection fongique opportuniste angioinvasive très rare, souvent aigue, potentiellement mortelle – parfois surnommée « maladie du champignon noir » (à cause de taches cutanées noires sur le visage) - la Mucormycosis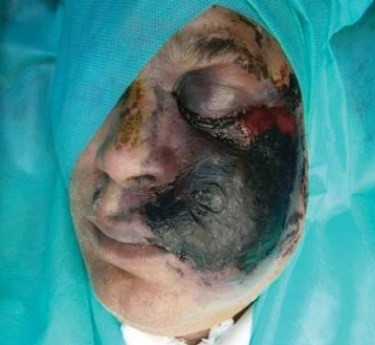
La maladie est rapportée pour la première fois en 1876 en Allemagne par Fürbinger qui a décrit le cas d’un patient mort du cancer avec au niveau du poumon droit un infarctus hémorragique et des sporanges.
En 1885, Arnold Paltauf publia le premier cas de mucormycose disséminée, qu’il nomma « Mycosis mucorina ».
Agent pathogène
Mucormycosis est causée par l’exposition à des champignons opportunistes et omniprésents de la classe Phygomycètes, (sous classe Zygomycètes, ordre des Mucomorales - 261 espèces dans 55 genres, dont 38 associés à des infections humaines). La moisissure mucor (mucorracae) est couramment rencontrée dans l’environnement, plus particulièrement dans les sols et en association avec les matières organiques en décomposition fruits, légumes, plantes, fumier/compost, bouse animale, bois pourri. Ce mucomycète est plus commun dans le sol que dans l’air, en été-automne plutôt qu’en hiver-printemps ; il semble impossible d’en éviter le contact : « Il est omniprésent et se trouve dans le sol et l’air et même dans le nez et le mucus de personnes en bonne santé », dit le Dr A. Nair, ophtalmologiste -Mumbai. La répartition des différentes espèces varie selon la zone géographique.
Son terrain de jeu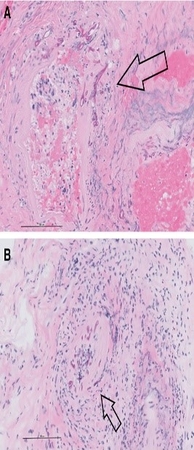
L’agent pathogène provoque des lésions nécrotiques invasives (cavités nasales – palais - peau). Il affecte les sinus, le cerveau et les poumons. Inoffensif pour la plupart des individus, il devient virulent sur des organismes fragilisés (diabète instable acidocétosique) immunodéprimés suite à une maladie (cancer - VIH...) un traitement (antirejet -immunomodulateurs - corticoïdes ou chélateur du fer …).
Histologiquement
La Mucormycosis inclut une infiltration mycotique des vaisseaux sanguins, une vascularite avec la thrombose, un infarctus tissulaire, l’hémorragie et l’infiltration neutrophile aiguë.
Incidence.
L’incidence de la maladie augmente et de façon significative chez les patients atteints de diabète, facteur de risque sous-jacent le plus commun au monde. L’incidence/prévalence exacte n’est pas connue parce qu’il y a peu d’études. Quelques chiffres cependant 1,7 cas pour 1 million de personnes/an (500 cas par an) en baie de San Francisco (1992- 1993) ; en France la prévalence était de 0,7 cas par million en 1997 et 1,2 par million en 2006 ; en Belgique, augmentation de 0,019 cas/10 000 jours-patients en 2000 à 0,148 cas/10 000 jours-patients en 2009. En Inde, la prévalence de la mucormycose est d’environ 0,14 cas pour 1000 habitants, soit environ 80 fois la prévalence de la mucormycose dans les pays développés.
La mucormycose est une maladie émergente dont l’augmentation de l’incidence est clairement démontrée avec l’augmentation des pourcentages de cas documentés par culture et par décennie : 50 % dans les années 1980 - 71 % dans les années 2000. Cette augmentation réelle bénéficie aussi d’une sensibilisation accrue à la maladie ou/et de meilleurs outils diagnostiques. Elle évolue à mesure que de nouveaux agents immunomodulateurs sont utilisés dans le traitement du cancer et des maladies auto-immunes.
Contamination
Les spores fongiques s’implantent dans l’organisme humain par inhalation, ingestion d’aliments contaminés ou inoculation directe vers les muqueuses orale nasale conjonctivale digestives. L’infection touche généralement le visage ou la sphère oro-pharyngée, les poumons. Elle entraîne une destruction du tissu atteint, des infarctus locaux, des thromboses. Elle est exceptionnelle chez la personne non immuno-déprimée. Il n’y a pas de contagion interhumaine (ni entre humains et animaux).
Facteurs favorisants l’expression de la maladie
Les plus importants facteurs de risque (parfois associés) comprennent le diabète sucré instable avec ou sans acidocétose, les cancers surtout hématologiques, la transplantation d’organes, la greffe de cellules souches, la neutropénie prolongée, le syndrome d’immunodéficience acquise, l’immunosuppression iatrogène, un usage long de corticostéroïdes, les traumatismes, la surcharge en fer hémochromatose, la consommation illicite de drogues intraveineuses, la prématurité néonatale et la malnutrition.
Les patients immunocompétents peuvent être affectés, lorsque les spores du champignon sont directement inoculées dans la peau, à la suite d’un traumatisme ou de brûlures.
Les facteurs de risque de mucormycose varient considérablement selon la zone géographique : en Europe la maladie sous-jacente la plus commune était le cancer hématologique ; en Inde Iran, au Mexique au Moyen-Orient et en Afrique du Nord le diabète sucré.
Plusieurs études ont montré que la maladie sous-jacente est corrélée au site de l’infection.
Mucormycosis & Covid 19.
Causée par le coronavirus-2 (SRAS-CoV-2), la Covid 19 peut progresser vers un syndrome de détresse respiratoire aiguë qui augmente la susceptibilité des coinfections fongiques pulmonaires. les co-infections fongiques avec Aspergillus et Candida ont été signalées dans un nombre limité d’études connues et prises en compte ; il n’en va pas de même pour la Mucormycosis beaucoup moins reconnue.
Fréquente en Inde où le diabète est très répandu (74 millions en 2017) et le climat chaud humide favorable au champignon, la mucormycosis a cependant connu une augmentation de son incidence chez les patients Covid 19 en rémission ou en convalescence.
Les médecins pensent que l’infection peut être déclenchée par l’utilisation de stéroïdes, traitement essentiel pour les patients Covid à formes sévères, qui réduit l’inflammation pulmonaire et semble stopper certains dommages qui peuvent se produire lorsque le système immunitaire de l’organisme s’emballe pour lutter contre le coronavirus. Mais il fait monter les taux de glycémie des diabétiques et des patients non diabétiques atteints de la Covid-19. Il induit aussi une baisse de l’immunité qui pourrait déclencher ces cas de mucormycose. « Le diabète abaisse les défenses immunitaires de l’organisme, le coronavirus l’exacerbe, puis les stéroïdes qui aident à combattre covid-19 agissent comme du carburant pour le feu » (Dr Nair Mumbai). En outre la virulence du variant indien participerait à cette recrudescence anormale de cas « La souche du virus semble virulente, ce qui fait grimper la glycémie à des niveaux très élevés. Et étrangement, l’infection fongique touche beaucoup de jeunes » (Dr Raghuraj Hegde, ophtalmologiste- Bangalore).
Symptômes.
De nombreuses espèces de champignons peuvent provoquer une mucormycose. Les manifestations cliniques dépendant de l’endroit où se développe le champignon. Une infection disséminée peut survenir chez les patients gravement immunodéprimés. Le signe clinique classique est le début rapide de la nécrose tissulaire avec ou sans fièvre. Il existe 5 formes cliniques majeures.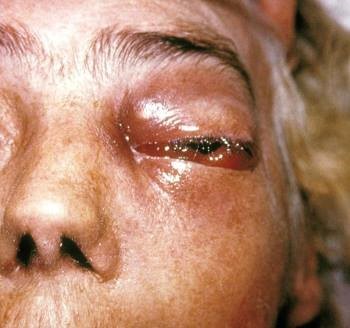
|
Figure 1 iamge de courtoisie Dr T.F.Seellers Emory University. CDC and prevention. |
Forme clinique la plus fréquente
Après inhalation de spores qui peuvent se disséminer vers les poumons puis au-delà, la Mucorycose Rhino(-orbito-)Cérébrale, généralement grave qui peut être rapidement mortelle (sauf diagnostic et thérapie agressive précoces). L'envahissement vasculaire entraîne une nécrose tissulaire évolutive qui peut impliquer la cloison nasale, le palais, les os périorbitaires ou les sinus. Fréquente chez les diabétiques instables et les transplantés rénaux, elle survient aussi chez les autres greffés en particulier de cellules souches. 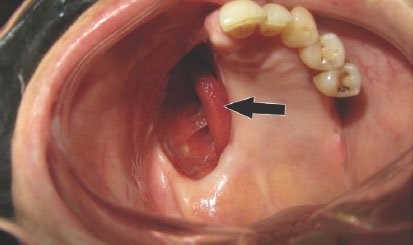
Les symptômes peuvent associer gonflement unilatéral du visage, congestion nasale ou sinusale, douleur faciale, fièvre, sécrétions nasales purulentes, céphalées, cellulite orbitaire, érythème orbitaire, exophtalmie, ophtalmoplégie, diplopie, fixité et dilatation pupillaire, perte de vision, écoulement purulent noir oculaire, nécrose de la muqueuse nasale et de la face interne de la bouche, ulcère de la voute du palais. L'extension intracrânienne de la nécrose peut entraîner des signes de thrombose du sinus caverneux, des convulsions, une aphasie ou une hémiplégie.
La Mucormycose RhinoPulmonaire évoque une aspergillose invasive. Les symptômes ne sont pas spécifiques mais sévères : fièvre élevée prolongée ne répondant pas aux antibiotiques à large spectre, toux productive ou non ; moins fréquentes les douleurs thoraciques, la dyspnée. La nécrose tissulaire conduit à la cavitation et/ou l’hémoptysie.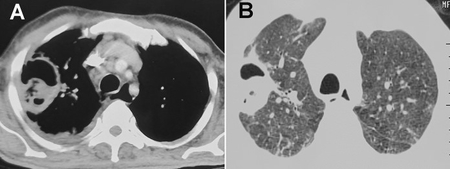 Les études d’imagerie (image de cavité à parois épaisses) jouent un rôle important dans la différenciation des infections fongiques invasives. Elle est fréquente chez les greffés (organe ou cellules souches) ou chez les patients neutropéniques ou cancéreux (hématologique notamment). Les malignités hématologiques et la neutropénie sont associées à la mucormycose pulmonaire.
Les études d’imagerie (image de cavité à parois épaisses) jouent un rôle important dans la différenciation des infections fongiques invasives. Elle est fréquente chez les greffés (organe ou cellules souches) ou chez les patients neutropéniques ou cancéreux (hématologique notamment). Les malignités hématologiques et la neutropénie sont associées à la mucormycose pulmonaire.
La Mucormycose Cutanée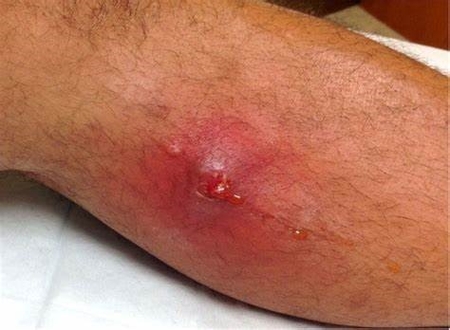 Elle est primaire ou secondaire. Primaire elle est opportuniste, provoquée par l’inoculation directe de la spore fongique dans la peau lésée par une brulure ou un traumatisme local (excoriations, lésions de grattage) (ou contamination lors de catastrophes naturelles ou lors de blessures par explosion liées aux combats) ou une plaie chirurgicale sous des pansements occlusifs.
Elle est primaire ou secondaire. Primaire elle est opportuniste, provoquée par l’inoculation directe de la spore fongique dans la peau lésée par une brulure ou un traumatisme local (excoriations, lésions de grattage) (ou contamination lors de catastrophes naturelles ou lors de blessures par explosion liées aux combats) ou une plaie chirurgicale sous des pansements occlusifs. 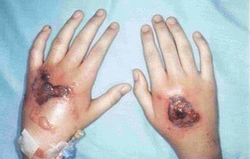 Forme la plus fréquemment rencontrée chez les individus non immunodéprimés, elle produit une réaction inflammatoire aigue (douleur + chaleur + rougeur) avec le pus, la formation d’abcès, le gonflement tissulaire au pourtour d’une plaie, des cloques ou ulcères sur la zone infectée qui noircit, et la nécrose. La lésion peut paraitre rouge et indurée évoluant vers l’escarre. Secondaire elle est favorisée par l’immunosuppression et la propagation se fait par voie sanguine. Elle débute comme une cellulite érythémateuse, indurée, douloureuse vers un ulcère couvert d’une escarre noire.
Forme la plus fréquemment rencontrée chez les individus non immunodéprimés, elle produit une réaction inflammatoire aigue (douleur + chaleur + rougeur) avec le pus, la formation d’abcès, le gonflement tissulaire au pourtour d’une plaie, des cloques ou ulcères sur la zone infectée qui noircit, et la nécrose. La lésion peut paraitre rouge et indurée évoluant vers l’escarre. Secondaire elle est favorisée par l’immunosuppression et la propagation se fait par voie sanguine. Elle débute comme une cellulite érythémateuse, indurée, douloureuse vers un ulcère couvert d’une escarre noire.
La Mucormycose Gastro-intestinale résulte de l’ingestion de la spore. Elle atteint le colon, l’iléon et l’estomac et se manifeste par des douleurs abdominales une distension non spécifiques, des nausées, des vomissements et des hémorragies gastro-intestinales. 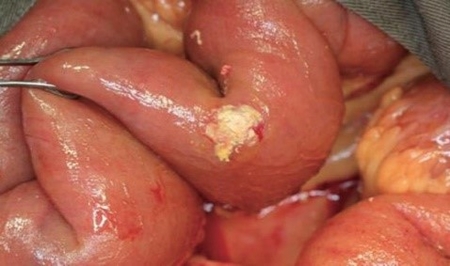
Elle est plus fréquente chez les patients malnutris, chez les jeunes enfants, nourrissons prématurés ou nourrissons de faible poids à la naissance de moins d’un mois ayant subi une antibiothérapie, une chirurgie ou un traitement immunodépresseur.
La Mucormycose disséminée peut faire suite à n’importe laquelle des 4 autres formes. Habituellement chez des patients neutropéniques quand l’infection se propage vers une autre partie du corps comme le cerveau, ce qui peut amener confusion, coma. Ou encore vers la rate, le cœur, la peau, l’os avec des forme plus rares telles que l’endocardite, l’ostéomyélite, la péritonite, la néphrite etc.
Diagnostics différentiels.
Anthrax staphylococcique, aspergillose, cellulite orbitaire, cellulite bactérienne.
Diagnostic positif.
La précocité du diagnostic est essentielle pour augmenter le taux de survie et améliorer les résultats de la prise en charge en réduisant les chirurgies délabrantes, la souffrance. Le diagnostic positif outre la clinique, exige l’évidence microbiologique et histologique des champignons.
Le diagnostic est clinique même si sensibilité et spécificité sont faibles (antécédents personnels, facteurs de risque, symptômes, forme clinique, traitement en cours). La marque de fabrique de la mucormycose est la nécrose tissulaire résultant de l’angioinvasion et de la thrombose, l’absence d’escarre nécrotique n’empêche pas le diagnostic. Bien que les signes cliniques et les symptômes ne soient pas spécifiques, certains d’entre eux peuvent avoir une valeur prédictive potentiellement élevée comme une prophylaxie antifongique ou la survenue de cavités sous traitement.
La Biologie sanguine associe des anomalies glycémiques (HBA1c 14%) (l’hémoglobine glycée devient peu fiable en présence de l’anémie grave, particulièrement dans les patients subissant l’hémodialyse), hématologiques (neutropénie), rénales (Insuffisance rénale sévère à modérée), inflammatoires et de gazométrie.
Un diagnostic sérologique n’est pas envisageable faute de marqueurs antigéniques disponibles.
L’imagerie,
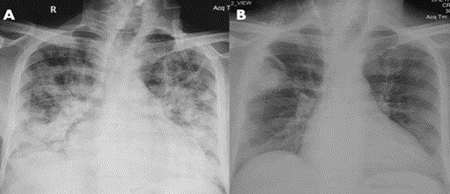
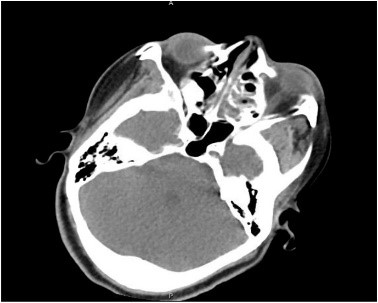
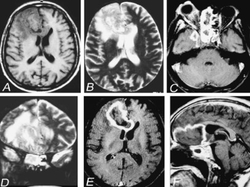
Radiographies standards TDM IRM mettent en évidence les atteintes pulmonaires (opacités interstitielles diffuses souvent bilatérales -pneumopathie -cardiomégalie) (cavité à parois épaisses), sinusales (épaississement mucosal des sinus), intracérébrales (infarctus), digestives.
Cependant ces techniques sous-estiment souvent ou sont insuffisantes pour mettre en évidence une destruction osseuse. Par ailleurs les déficiences de certains organes peuvent en limiter l’usage. La maladie est rare, sa progression est fulminante, il faut rapidement un diagnostic positif qui exige l’évidence microbiologique et histologique, qui repose sur l’étude et la culture des biopsies de tissus affectés, ou lavage bronchoalvéolaire. Elle distingue la présence du champignon en tant qu’agent pathogène dans l’échantillon d’un contaminant de culture et est indispensable pour définir s’il y a invasion de vaisseaux sanguins.
L’examen doit être approfondi car de nombreuses plages de nécroses ne contiennent pas de micro-organismes.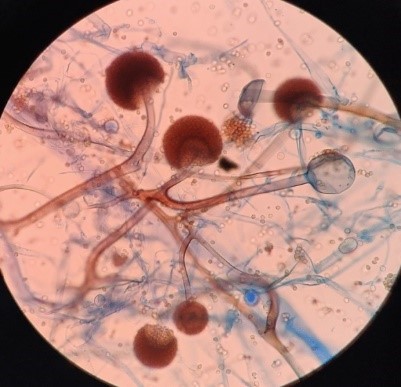 L’étude minutieuse des prélèvements et leur mise en culture, recherche des filaments typiquement non pigmentés, larges (5-20 μm), à paroi mince, en forme de ruban, non septés, avec des ramifications à angle droit.
L’étude minutieuse des prélèvements et leur mise en culture, recherche des filaments typiquement non pigmentés, larges (5-20 μm), à paroi mince, en forme de ruban, non septés, avec des ramifications à angle droit.
Pour des raisons mal connues, les cultures peuvent être négatives, même quand les filaments sont très bien visibles dans les tissus.
La culture des spécimens est essentielle au diagnostic de mucormycose car elle permet l’identification du genre et de l’espèce, et évalue l’essai antifongique de susceptibilité. De faible sensibilité, elle peut être faussement négative dans jusqu’à 50% des cas de mucormycose.
D’autres méthodes
Le PCR en temps réel détecte avec précision les zygomycetes.
- La microscopie directe intraopératoire de matériel frais est une méthode peu coûteuse, mais inestimable, pour définir des marges chirurgicales.
- Les méthodes moléculaires diagnostiques permettant le séquençage de la région ITS région d’ADN la plus séquencée pour les champignons en général. Le séquençage ITS est une méthode fiable recommandé en 1ère intention pour l’identification des espèces de Mucorales.
- Enfin il semblerait qu’il existe des profils de respiration distincts basés sur la présence d’un métabolite volatil et un test de l’haleine pourrait être utilisé pour identifier ces infections in vivo et peut-être surveiller la réponse à la thérapie.
Pronostic
Il dépend de la rapidité du diagnostic et de la prise en charge, du site de l’infection et des facteurs sous-jacents. Sans soins le taux de mortalité avoisine les 55 % (variant entre 50% et 80%), Et même sous traitement agressif, la mortalité reste élevée.
Traitement
Même si la COVID-19 a créé un scénario unique où les trois aspects de la gestion sont compromis, le traitement doit être précoce afin d’éviter la dissémination l’extension de l’infection, améliorer la survie. Il est multiple multifocal et repose sur
- le Contrôle de la maladie sous-jacente (correction des troubles métaboliques - équilibre du diabète - régression du déficit immunitaire - arrêt de la déféroxamine) « Les médecins devraient s’occuper des niveaux de sucre après la sortie des patients » « Une façon de bloquer la possibilité de l’infection fongique était de s’assurer que les patients covid-19 – avaient reçu la bonne dose et la durée adaptée des stéroïdes à la fois dans le traitement et après la récupération» (Dr Baxi diabétologue Mumbai).
- L’amphotéricine B lipidique bien tolérée le plus souvent (même chez le dialysé) ; en IV à dose élevée (7,5 à 10 mg/kg IV 1 fois/jour) est recommandée en traitement initial : médicament de choix chez les patients gravement malades. L'isavuconazole (IV ou oral) est approuvé en traitement primaire mais son expérience clinique est relativement limitée. Le posaconazole (IV ou oral) peut également être efficace, en particulier en traitement d’entretien.
La durée optimale de la thérapie dans mucormycosis n’est pas claire ; elle est guidée par la réponse clinique et la tolérance.
- Débridement chirurgical large et complet selon la localisation, est indispensable pour retirer les tissus nécrosés (voire énucléation de globe oculaire qui délabrante n’est pas gage de survie).
Sources consultées
- Alekseyev K, Didenko L, Chaudhry “Rhinocerebral Mucormycosis and COVID-19 Pneumonia” J Med Cases. 2021 Mar;12(3):85-89. doi: 10.14740/jmc3637. Epub 2021 Jan 19. PMID: 33984095
- Garg D, Muthu V, Sehgal IS, Ramachandran R, Kaur H, Bhalla A, Puri GD, Chakrabarti A, Agarwal R. “Coronavirus Disease (Covid-19) Associated Mucormycosis (CAM): Case Report and Systematic Review of Literature.” 2021 May;186(2):289-298. doi: 10.1007/s11046-021-00528-2. Epub 2021 Feb 5. PMID: 33544266
- John TM, Jacob CN, Kontoyiannis DP. "When Uncontrolled Diabetes Mellitus and Severe COVID-19 Converge: The Perfect Storm for Mucormycosis.” J Fungi (Basel). 2021 Apr 15;7(4):298. doi: 10.3390/jof7040298.PMID: 33920755
- Monte Junior ESD, Santos MELD, Ribeiro IB, Luz GO, Baba ER, Hirsch BS, Funari MP, de Moura EGH. “Rare and Fatal Gastrointestinal Mucormycosis (Zygomycosis) in a COVID-19 Patient: A Case Report” Clin Endosc. 2020 Nov;53(6):746-749. doi: 10.5946/ce.2020.180. Epub 2020 Nov 19.PMID: 33207116
- Rajendra Santosh AB, Muddana K, Bakki “Fungal Infections of Oral Cavity: Diagnosis, Management, and Association with COVID-19. Review” Compr Clin Med. 2021 Mar 27:1-12. doi: 10.1007/s42399-021-00873-9. Online ahead of print.v PMID: 33817556
- Skiada A, Pavleas I, Drogari-Apiranthitou M “Epidemiology and Diagnosis of Mucormycosis: An Update » J. Fungi 2020 déc, 6(4): 265; doi:10.3390/jof6040265 Epidemiology and Diagnosis of Mucormycosis: An Update (nih.gov)
- Waizel-Haiat S, Guerrero-Paz J, Sanchez-Hurtado L, et al. (February 05, 2021) A Case of Fatal Rhino-Orbital Mucormycosis Associated With New Onset Diabetic Ketoacidosis and COVID-19. Cureus 2021 fév; 13(2): e13163. DOI 10.7759/cureus.13163 A Case of Fatal Rhino-Orbital Mucormycosis Associated With New Onset Diabetic Ketoacidosis and COVID-19 (nih.gov)
- Zesemayat K. Mekonnen, M.S.*, Davin C. Ashraf, M.D.†, Tyler Jankowski, D.O.‡ and al “Acute Invasive Rhino-Orbital Mucormycosis in a Patient With COVID-19-Associated Acute Respiratory Distress Syndrome” Ophthalmic Plast Reconstr Surg, Vol. 37, No. 2, 2021 Acute Invasive Rhino-Orbital Mucormycosis in a Patient With COVID-19-Associated Acute Respiratory Distress Syndrome (nih.gov)
- https://www.sciencesetavenir.fr/sante/inde-une-multitude-de-convalescents-du-covid-19-agresses-par-le-redoutable-champignon-noir_154378
- https://upec.userservices.exlibrisgroup.com/view/delivery/33BUCRET_INST/1273074910004611
- https://upec.userservices.exlibrisgroup.com/view/delivery/33BUCRET_INST/1273087940004611
- https://tel.archives-ouvertes.fr/tel-03101351
Mucormycosis: The 'black fungus' maiming Covid patients in India - BBC News