"La connaissance des mots conduit à la connaissance des choses." Platon
"Je ne cherche pas à connaître les réponses, je cherche à comprendre les questions." Confucius
RECO1

Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19
(https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/)
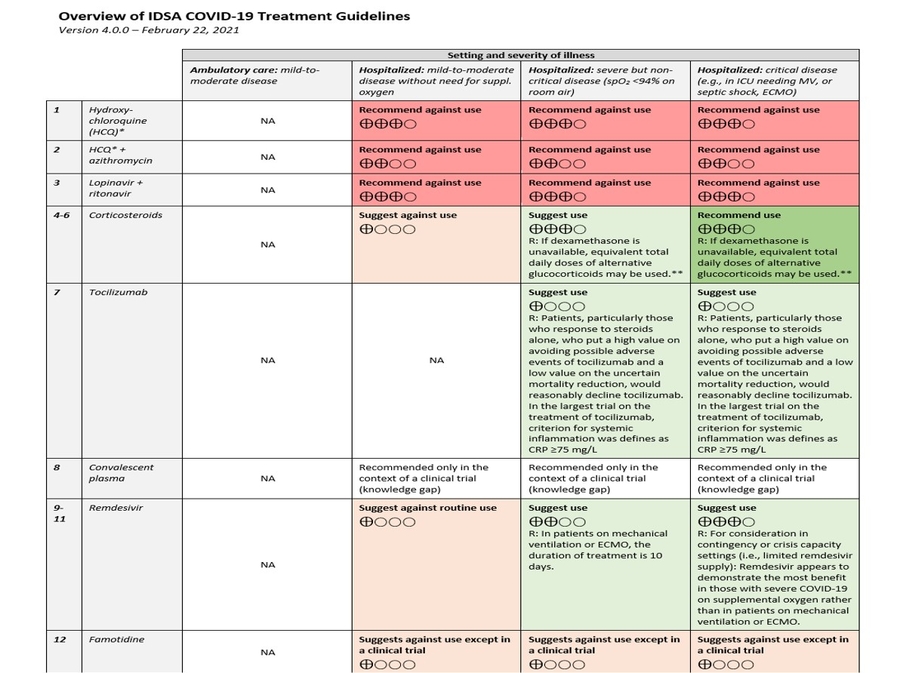
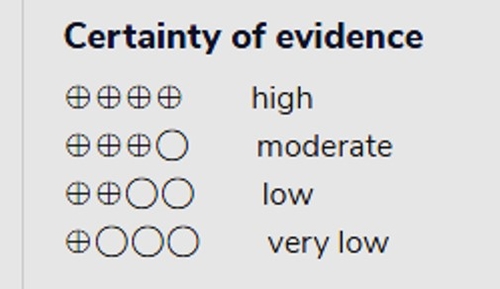
- Recommandation 1: Parmi les patients atteints de COVID-19, le groupe de recommandations IDSA recommande de ne pas utiliser l'hydroxychloroquine. (Forte recommandation, certitude modérée des preuves)
Remarque : La chloroquine est considérée comme une classe équivalente à l'hydroxychloroquine.
- Recommandation 2: Parmi les patients hospitalisés atteints de COVID-19, le comité des recommandations de l'IDSA recommande d'éviter l'hydroxychloroquine plus azithromycine. (Forte recommandation, faible certitude des preuves)
Remarque : la chloroquine est considérée comme une classe équivalente à l'hydroxychloroquine
- Recommandation 3: Parmi les patients hospitalisés atteints de COVID-19, le groupe de recommandations de l'IDSA recommande de ne pas utiliser l'association lopinavir / ritonavir. (Forte recommandation, certitude modérée des preuves)
- Recommandation 4: Parmi les patients hospitalisés gravement malades * atteints de COVID-19, le groupe de recommandations de l'IDSA recommande la dexaméthasone plutôt que l'absence de dexaméthasone. (Forte recommandation, certitude modérée des preuves)
- Recommandation 5: Parmi les patients hospitalisés atteints de COVID-19 sévère **, mais non critique, le panel des recommandations de l'IDSA suggère la dexaméthasone plutôt que l'absence de dexaméthasone. (Recommandation conditionnelle, certitude modérée des preuves)
Remarque : la dexaméthasone 6 mg IV ou PO pendant 10 jours (ou jusqu'à la sortie) ou une dose équivalente de glucocorticoïdes peut être substituée si la dexaméthasone n'est pas disponible. Les doses quotidiennes totales équivalentes de glucocorticoïdes alternatifs à la dexaméthasone 6 mg par jour sont la méthylprednisolone 32 mg et la prednisone 40 mg.
Une maladie grave est définie comme les patients avec une SpO 2 ≤ 94% à l'air ambiant, y compris les patients sous oxygène supplémentaire. - Recommandation 6: Parmi les patients hospitalisés atteints de COVID-19 non sévère *** sans hypoxémie nécessitant une supplémentation en oxygène, le panel des recommandations de l'IDSA suggère de ne pas utiliser de glucocorticoïdes. (Recommandation conditionnelle, faible certitude des preuves
Une maladie non grave est définie comme un patient avec une SpO 2 > 94% ne nécessitant pas d'oxygène supplémentaire. - Recommandation 7: Parmi les adultes hospitalisés atteints de COVID-19 progressif sévère * ou critique ** qui ont des marqueurs élevés de l'inflammation systémique, le panel de recommandations de l'IDSA suggère le tocilizumab en plus du traitement standard (c.-à-d., Les stéroïdes) plutôt que le standard de soins seul. (Recommandation conditionnelle, faible certitude des preuve)
- Recommandation 8: Parmi les patients qui ont été admis à l'hôpital avec COVID-19, le panel des lignes directrices de l'IDSA recommande le plasma de convalescence COVID-19 uniquement dans le cadre d'un essai clinique. (Écart de connaissances)
- Recommandation 9: Chez les patients hospitalisés atteints de COVID-19 sévère *, le panel IDSA suggère le remdesivir plutôt que l'absence de traitement antiviral. (Recommandation conditionnelle, certitude modérée des preuves)
Remarque: À prendre en compte dans les situations d'urgence ou de capacité de crise (c.-à-d. Apport limité de remdesivir): Le remdesivir semble démontrer le plus d'avantages chez les patients atteints de COVID-19 sévère sous oxygène d'appoint plutôt que chez les patients sous ventilation mécanique ou ECMO.
Maladie grave : est définie comme les patients avec une SpO 2 ≤ 94% à l'air ambiant et ceux qui nécessitent un supplément d'oxygène, une ventilation mécanique ou une ECMO. - Recommandation 10 : Chez les patients sous oxygène d'appoint mais non sous ventilation mécanique ou ECMO, le panel IDSA suggère un traitement avec cinq jours de remdesivir plutôt que 10 jours de remdesivir. (Recommandation conditionnelle, faible certitude des preuves)
Remarque: Chez les patients sous ventilation mécanique ou ECMO, la durée du traitement peut être de 10 jours. - Recommandation 11: Chez les patients atteints de COVID-19 admis à l'hôpital sans nécessité de supplémentation en oxygène et saturation en oxygène> 94% à l'air ambiant, le panel IDSA suggère de ne pas utiliser en routine le remdesivir. (Recommandation conditionnelle, très faible certitude des preuves)
- Recommandation 12: Parmi les patients hospitalisés atteints de COVID-19 sévère, le panel IDSA suggère de ne pas utiliser la famotidine dans le seul but de traiter le COVID-19 en dehors du contexte d'un essai clinique. (Recommandation conditionnelle, très faible certitude des preuves)
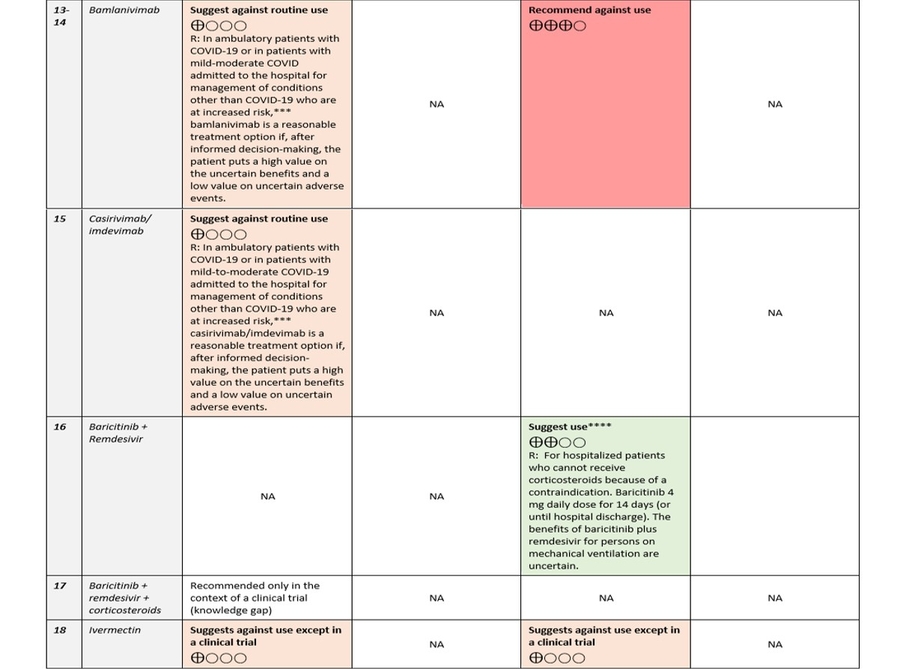
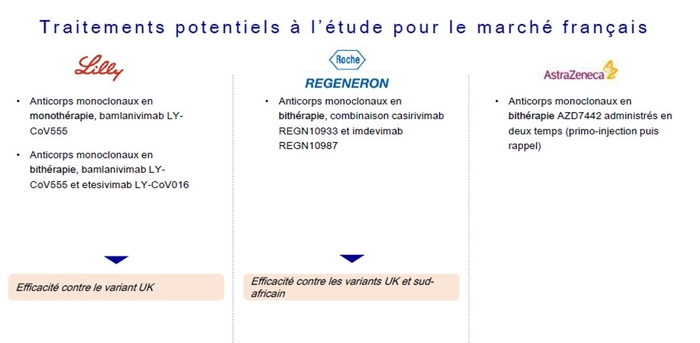
- Recommandation 13: Parmi les patients hospitalisés atteints de COVID-19 sévère, le comité des recommandations de l'IDSA recommande de ne pas utiliser bamlanivimab. (Forte recommandation, certitude modérée des preuves)
- Recommandation 14: Parmi les patients ambulatoires atteints de COVID-19, le panel des recommandations de l'IDSA suggère de ne pas utiliser systématiquement le bamlanivimab. (Recommandation conditionnelle, très faible certitude des preuves)
Remarque: Chez les patients ambulatoires atteints de COVID-19 ou chez les patients atteints de COVID-19 d'intensité légère à modérée admis à l'hôpital pour la prise en charge d'affections autres que le COVID-19 présentant un risque accru (défini par l' EUA de la FDA ), le bamlanivimab est une option de traitement raisonnable si, après une prise de décision éclairée, le patient accorde une valeur élevée aux bénéfices incertains et une valeur faible aux événements indésirables incertains. - Recommandation 15: Parmi les patients ambulatoires atteints de COVID-19, le panel des recommandations de l'IDSA suggère de ne pas utiliser en routine le casirivimab / imdevimab. (Recommandation conditionnelle, très faible certitude des preuves)
Remarque: Chez les patients ambulatoires atteints de COVID-19 ou chez les patients atteints de COVID-19 d'intensité légère à modérée, admis à l'hôpital pour la prise en charge d'affections autres que le COVID-19 et présentant un risque accru (tel que défini par la FDA EUA ), casirivimab imdevimab est une option de traitement raisonnable si, après une prise de décision éclairée, le patient accorde une valeur élevée aux bénéfices incertains et une valeur faible aux événements indésirables incertains. - Recommandation 16: Parmi les patients hospitalisés atteints de COVID-19 sévère qui ne peuvent pas recevoir de corticostéroïdes en raison d'une contre-indication, le panel des recommandations de l'IDSA suggère l'utilisation du baricitinib avec le remdesivir plutôt que le remdesivir seul. (Recommandation conditionnelle, faible certitude des preuves)
Remarque: dose quotidienne de baricitinib 4 mg pendant 14 jours (ou jusqu'à la sortie de l'hôpital). Les bénéfices du baricitinib plus remdesivir pour les personnes sous ventilation mécanique sont incertains. Voir la section remdesivir pour la dose et la durée.
La maladie grave est définie comme les patients avec une SpO 2 ≤ 94% à l'air ambiant, y compris les patients sous oxygène supplémentaire, oxygène via un appareil à haut débit ou ventilation non invasive.Définitions de gravité:
Une maladie grave est définie comme les patients avec une SpO 2 ≤ 94% à l'air ambiant, y compris les patients sous oxygène d'appoint.
La maladie grave est définie comme les patients sous ventilation mécanique et ECMO. La maladie grave comprend le dysfonctionnement des organes terminaux comme on le voit dans la septicémie / choc septique. Dans COVID-19, la forme la plus fréquemment rapportée de dysfonctionnement des organes terminaux est le SDRA. -
Recommandation 17: Parmi les patients hospitalisés atteints de COVID-19, le panel des recommandations de l'IDSA recommande un traitement par baricitinib plus remdesivir plus corticostéroïdes uniquement dans le cadre d'un essai clinique.
-
Recommandation 18: Chez les patients hospitalisés atteints de COVID-19 sévère, le panel IDSA suggère de ne pas utiliser l'ivermectine en dehors du contexte d'un essai clinique. (Recommandation conditionnelle, très faible certitude des preuves)
-
Recommandation 19: Chez les patients ambulatoires atteints de COVID-19, le panel IDSA suggère de ne pas utiliser l'ivermectine en dehors du contexte d'un essai clinique. (Recommandation conditionnelle, très faible certitude des preuves)
Il y a toujours plusieurs essais en cours évaluant des agents thérapeutiques pour le traitement du COVID-19. À mesure que les données de ces essais deviennent disponibles et s'il existe une prépondérance de preuves suggérant que l'utilisation d'un agent
thérapeutique, même dans le contexte d'essais cliniques, n'est plus justifiée, il sera supprimé des futures mises à jour de la ligne directrice (et la suppression sera noté dans les lignes directrices mises à jour). S'il existe des preuves émergentes sur l'efficacité ou l'innocuité d'un agent thérapeutique non mentionné dans la version actuelle de la ligne directrice, elles seront incluses dans les futures mises à jour de la ligne directrice.Ces recommandations visent à informer les patients, les cliniciens et les autres professionnels de la santé en fournissant les dernières données disponibles.RECO2

Les recommandations de l'ASH (American Society of Hematology) 2021 (https://ashpublications.org/bloodadvances/article/5/3/872/475154/American-Society-of-Hematology-2021-guidelines-on) sur la prophylaxie de la MTEV chez les patients Covid-19 sont publiées, en voici la synthèse en accord avec les recommandations précédentes.
e -
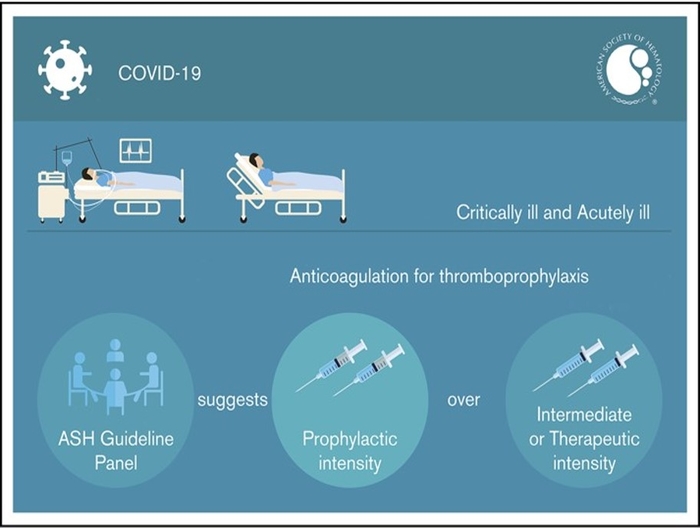 the ASH guideline panel suggests using prophylactic-intensity over intermediate-intensity or therapeuticintensity anticoagulation for patients with COVID-19–related acute illness who do not have suspected or confirmed VTE (conditional recommendation based on very low certainty in theevidence about effects Å◯◯◯)
the ASH guideline panel suggests using prophylactic-intensity over intermediate-intensity or therapeuticintensity anticoagulation for patients with COVID-19–related acute illness who do not have suspected or confirmed VTE (conditional recommendation based on very low certainty in theevidence about effects Å◯◯◯)
UNE QUESTION : utile ou inutile ? La reco 1 ne recommande pas les Ac Monoclonaux mais.........donc affaire à suivre.
L'état en a commandé sur les conseils de qui ? Anticorps monoclonaux : imbroglio autour d'un médicament risqué mais poussé par l'État La commande par le gouvernement du bamlanivimab a provoqué une levée de boucliers des pharmacologues et des infectiologues. Au point que les pouvoirs publics ont déjà en partie rétropédalé. Reste une question : pourquoi le gouvernement a-t-il autorisé un médicament sans preuve d'efficacité et pire, risquant de faire émerger de nouveaux variants ? (https://www.lexpress.fr/actualite/sciences/anticorps-monoclonaux-imbroglio-autour-d-un-medicament-risque-mais-pousse-par-l-etat_2145966.html)
Position de la Société Française de Pharmacologie et de Thérapeutique sur les
données d’évaluation clinique actuellement disponibles du bamlanivimab en
monothérapie à 700 mg (https://sfpt fr.org/images/documents/communiques/bamlanivimab_communique%CC%81_de_presse_SFPT.pdf)
En l’absence de différence statistiquement significative, il est impossible de conclure à un quelconque effet du traitement. En effet, en l’absence d’un réel effet du traitement, une fois sur deux, il y aura pourtant numériquement moins d’évènements dans le groupe traité que dans le groupe contrôle. Une différence numérique observée peut ainsi être due au hasard et ne permet pas de faire des conclusions si elle n’est pas statistiquement significative.Au total, compte tenu de ces éléments méthodologiques, les résultats observés ne suggèrent en rien un effet de la monothérapie qui pourrait potentiellement conduire à un bénéfice clinique et qui justifierait la réalisation d’un essai de phase 3.La gravité de la situation ne justifie pas l’abandon de la recherche de preuves
En marge de la problématique de cette étude, la SFPT rappelle, comme cela a déjà été fait à de nombreuses reprises, que la gravité de cette pandémie et l’urgence à traiter les patients ne justifient en rien l’utilisation à but compassionnel de traitement dont le bénéfice n’est pas connu. Les mécanismes d’action documentés in vitro ou in vivo et les résultats des études préliminaires exploratoires ne garantissent pas que des candidats traitements apportent in fine un bénéfice clinique, comme l’ont montré les échecs de plusieurs molécules initialement prometteuses observés dans des grands essais plateformes actuellement en cours (comme RECOVERY ou SOLIDARITY).
En l’absence de preuve, les patients sont exposés à un risque d’effets indésirables ou d’effets délétères et des ressources de soins potentiellement mobilisées de manière indue tant que l’utilité du traitement est inconnue.
Affaire à suivre
#complétementvacciné


