"Dépister ou ne pas dépister ?
Effectivement, comme l’affirme le titre de l’article de Prasad : « On n’a jamais montré que le dépistage sauve des vies » (au niveau de la population totale). Mais on n’a jamais montré, non plus, qu’il n’en sauve pas… De fait, comme l’indique l’étude de Yaffe et Mainprize, même le dépistage efficace d’un cancer fréquent ne peut avoir qu’un effet négligeable sur la mortalité globale évaluée sur dix ans :il faudrait un essai de longue durée portant sur plus de cent mille personnes pour pouvoir conclure dans un sens ou dans l’autre. Si les tests multicancers comme celui de GRAIL – biopsie liquide – tiennent leurs promesses, et parviennent à réduire la proportion de faux positifs tout en améliorant la sensibilité, ils pourraient à terme apporter une réponse plus solide. En attendant, une utilisation raisonnée de ceux des tests existants qui ont montré leur efficacité en termes de mortalité cancer-spécifique semble recommandée, en limitant leur emploi aux cas où la probabilité de cancer est relativement élevée (en fonction de l’âge, par exemple) afin de ne pas se trouver en présence d’un nombre élevé de faux positifs entraînant des investigations potentiellement nuisibles, sans parler de l’angoisse induite chez les patients . Mais, explicitement, tout dépistage n’est pas bon à prendre, et son emploi requiert une décision informée plutôt qu’une application aveugle"
https://www.medecinesciences.org/fr/articles/medsci/full_html/2023/10/msc230252/msc230252.htmlLeLaurin JH, Pluta K, Norton WE, Salloum RG, Singh Ospina N. Time to de-implementation of low-value cancer screening practices: a narrative review.
Il est temps de mettre fin aux pratiques de dépistage du cancer à faible valeur ajoutée : une revue narrative
Le recours continu à des pratiques de dépistage du cancer à faible valeur ajoutée représente non seulement un gaspillage de ressources médicales, mais aussi une cascade potentielle de procédures diagnostiques invasives, ainsi qu'une source d'anxiété et de détresse pour les patients.
Si des recherches antérieures ont montré qu'il faut en moyenne 15 ans pour mettre en œuvre des pratiques fondées sur des données probantes dans la lutte contre le cancer, on sait peu de choses sur le temps nécessaire à la suppression de ces pratiques.
Nous avons examiné les données probantes relatives à six pratiques de dépistage du cancer de niveau D du groupe de travail américain sur les services de prévention :
(1) le dépistage du cancer du col de l'utérus chez les femmes de moins de 21 ans et de plus de 65 ans,
(2) le dépistage du cancer de la prostate chez les hommes de 70 ans et plus,
(3) le dépistage du cancer de l'ovaire,
(4) de la thyroïde,
(5) des testicules
(6) du pancréas chez les adultes asymptomatiques.
Nous avons mesuré le délai entre la publication d'une publication phare soutenant la recommandation et la suppression ultérieure de cette pratique, définie comme une réduction de 50 % de son utilisation dans les soins de routine.
Le rythme de cette suppression a été évalué à l'aide de systèmes de surveillance représentatifs à l'échelle nationale et d'une littérature évaluée par des pairs aux États-Unis. Nous avons constaté que le délai de désactivation du dépistage du cancer du col de l'utérus était de 4 ans pour les femmes de moins de 21 ans et de 16 ans pour les femmes de plus de 65 ans. Le dépistage de la prostate chez les hommes de 70 ans et plus n'a pas atteint une réduction de 50 % depuis la publication des lignes directrices de 2012.
Nous n'avons pas identifié suffisamment de données probantes pour mesurer le délai de désactivation du dépistage des cancers de l'ovaire, de la thyroïde, des testicules et du pancréas chez les adultes asymptomatiques.
La surveillance des dépistages de cancer à faible valeur ajoutée est rare, ce qui constitue un obstacle évident au suivi de la désactivation de ces pratiques de dépistage. Nous devons améliorer la mesure systématique des pratiques de lutte contre le cancer à faible valeur ajoutée afin d'évaluer l'impact de la désactivation sur les résultats pour les patients, la prestation des soins de santé et les coûts des soins de santé.
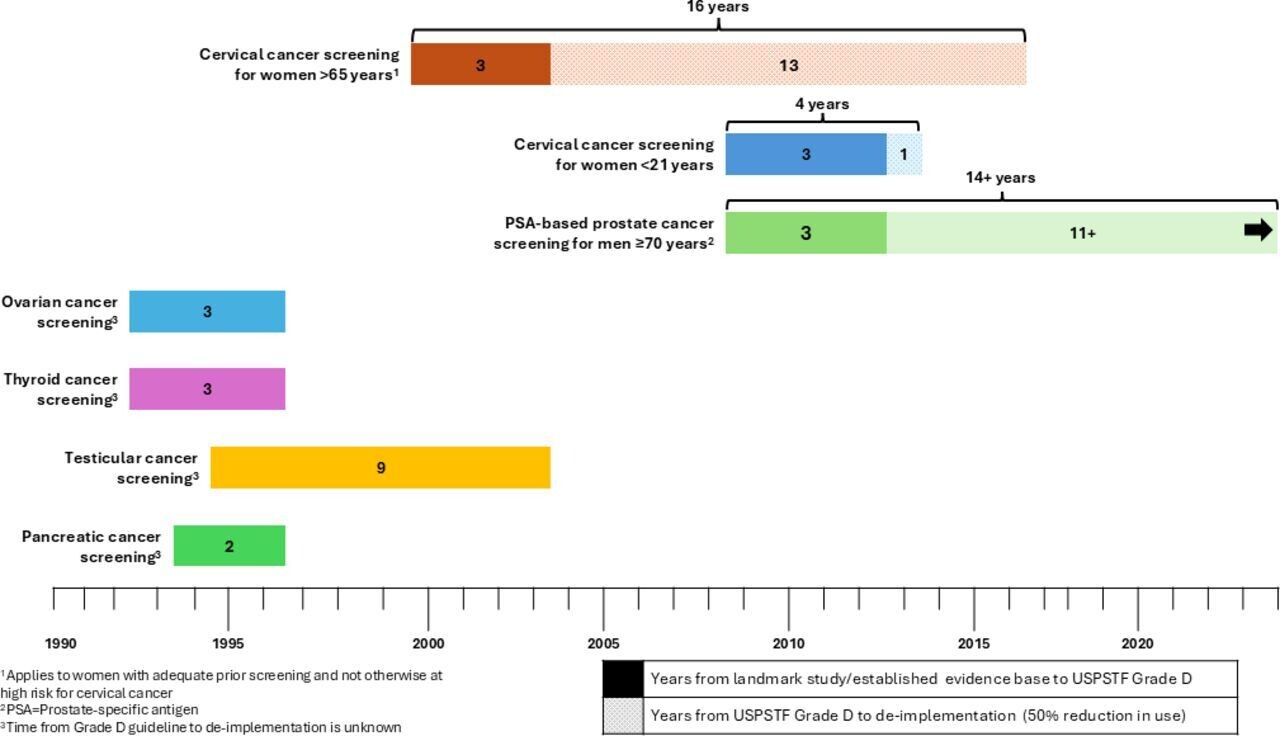
Il est temps de mettre fin à la mise en œuvre de certaines pratiques de dépistage du cancer de grade D de l'USPSTF. USPSTF, groupe de travail des services de prévention des États-Unis.
Discussion
Notre examen de six pratiques de dépistage du cancer de grade D de l'USPSTF nous a permis de mesurer le délai de désactivation des dépistages du cancer du col de l'utérus et de la prostate à faible valeur ajoutée. Le manque de données pour les quatre pratiques restantes illustre les difficultés considérables à mesurer ce délai.
Bien que la disponibilité des indicateurs de qualité HEDIS pour le dépistage du cancer du col de l'utérus et de la prostate représente une avancée significative dans la mesure des pratiques à faible valeur ajoutée, l'absence de mesures disponibles pour suivre l'utilisation des quatre autres pratiques de dépistage démontre la nécessité d'une attention accrue au niveau national. Compte tenu du coût substantiel, de la réduction de l'efficacité des soins de santé et des préjudices causés aux patients par le dépistage du cancer à faible valeur ajoutée, il est explicitement nécessaire d'améliorer le suivi et la désactivation active de ces pratiques.
Des mesures valides et accessibles et des sources de données avec une granularité suffisante pour surveiller la prestation de pratiques de soins à faible valeur ajoutée sont nécessaires pour établir des repères et surveiller les efforts de dé-mise en œuvre.
La grande majorité des mesures de performance clinique s'attaquent à la sous-utilisation des pratiques fondées sur des données probantes plutôt qu'à la surutilisation des soins à faible valeur ajoutée, et la plupart des mesures à faible valeur ajoutée existantes se concentrent sur le traitement plutôt que sur les services de dépistage et de prévention.
La nature fragmentée du système de santé américain rend l'obtention de données représentatives de la population particulièrement difficile. Les données administratives sont limitées aux régimes de santé inclus. Les enquêtes représentatives à l'échelle nationale sont sujettes à des biais de rappel et de désirabilité sociale. De plus, les deux approches ont une spécificité limitée en l'absence de données de dossiers médicaux couplées et de définitions de mesures très détaillées. 81 82 L'examen des dossiers se rapproche le plus d'une approche de mesure « standard de référence », mais il est peu pratique à réaliser, même dans un seul système de santé. De plus, par rapport aux pratiques avec des directives d'âge claires et des tests spécifiques (par exemple, le test PSA et le test Pap dans des groupes d'âge sélectionnés), les détails d'un examen physique ou l'intention d'un test diagnostique sont plus difficiles à obtenir à partir des dossiers de santé électroniques ou des données administratives.
Dans ces cas, l’intelligence artificielle est prometteuse pour surmonter les limites des autres méthodes. Pour l’instant, l’élargissement de la représentation des pratiques à faible valeur ajoutée dans les indicateurs de qualité des soins de santé et les grandes enquêtes nationales constitue l’approche la plus réalisable pour un suivi standardisé des soins à faible valeur ajoutée.
Khan et al. ont constaté que le délai entre la publication d'une étude phare et la mise en œuvre (définie comme une adoption à 50 %) de cinq pratiques de lutte contre le cancer variait de 13 à 21 ans.
Parmi les trois pratiques de dépistage du cancer, le délai de mise en œuvre était de 14 ans pour le co-test Pap et HPV chez les femmes de 30 à 65 ans, de 15 ans pour le dépistage du cancer colorectal chez les adultes de 50 à 75 ans et de 21 ans pour la mammographie chez les femmes de 50 à 74 ans.
En revanche, nous avons constaté que le délai avant une réduction de 50 % du dépistage du cancer du col de l'utérus à faible valeur ajoutée chez les femmes de moins de 21 ans et de plus de 65 ans variait de 4 à 16 ans
Cet écart de temps avant la fin de la mise en œuvre pourrait s'avérer encore plus prononcé car les taux de dépistage du cancer de la prostate chez les hommes de 70 ans et plus n'ont pas atteint ce seuil après 14 ans, et sont restés relativement inchangés depuis 2015.
Plusieurs explications existent pour le rythme variable de la désimplémentation.
* Premièrement, les taux de dépistage du cancer du col de l'utérus avant les lignes directrices chez les femmes de moins de 21 ans étaient inférieurs à ceux du dépistage du cancer du col de l'utérus ou de la prostate chez les personnes âgées, ce qui nécessitait moins de temps pour la désimplémentation.
* Deuxièmement, alors que la plupart des prestataires de soins primaires connaissent les recommandations de l'USPSTF, d'autres prestataires sont plus susceptibles d'adhérer aux lignes directrices des organismes professionnels spécifiques à leur spécialité.
Le Congrès américain des obstétriciens et gynécologues a émis des recommandations pour retarder le dépistage jusqu'à l'âge de 21 ans en 2009, contribuant probablement à une baisse du dépistage des femmes de moins de 21 ans avant la publication des lignes directrices de l'USPSTF en 2012. Pour le dépistage du cancer de la prostate, les recommandations actuelles de l'USPSTF divergent de celles d'autres sociétés et ont fait l'objet de controverses. De plus, les recommandations de dépistage du cancer de la prostate en fonction de l'âge ont fréquemment changé lors des deux dernières décennies.
Enfin, les prestataires de soins de santé peuvent rencontrer davantage de résistance de la part des patients lorsqu'un dépistage déjà effectué est interrompu, par rapport à un démarrage tardif du dépistage. La variation du rythme de désengagement de ces pratiques souligne la nécessité de stratégies de désengagement adaptées en même temps à la pratique à faible valeur ajoutée et au contexte dans lequel elle est dispensée.
Conclusion
La surveillance du dépistage du cancer à faible valeur ajoutée est rare et incohérente, ce qui constitue un obstacle évident au suivi efficace de la désactivation de ces pratiques. Bien que des mesures nationales de qualité soient disponibles pour certaines pratiques de dépistage du cancer à faible valeur ajoutée, nous avons identifié un besoin évident de développer une meilleure infrastructure pour surveiller systématiquement leur utilisation. De plus, le délai important de désactivation de ces pratiques démontre la nécessité d'adopter des stratégies de désactivation délibérées plutôt que de se fier uniquement à la publication de recommandations cliniques. Nous devons accroîtreours à des stratégies de désactivation fondées sur des données probantes, associées à une meilleure mesure des pratiques de lutte contre le cancer à faible valeur ajoutée, afin d'améliorer les résultats pour les patients, de réduire les coûts des soins de santé et d'accroître l'efficacité du système de santé.
SYNTHÈSE (NotebooKLM)
Cette publication analyse la durée de désimplémentation des pratiques de dépistage du cancer jugées de faible valeur, identifiant un écart entre la publication de preuves et l'abandon de ces pratiques. Les auteurs examinent six recommandations de dépistage classées 'D' par le groupe de travail américain sur les services préventifs (USPSTF), telles que le dépistage du cancer du col de l'utérus chez les femmes de moins de 21 ans et de plus de 65 ans, et le dépistage du cancer de la prostate chez les hommes de 70 ans et plus. Le texte met en lumière un manque de données suffisantes pour mesurer la désimplémentation de certains dépistages, comme ceux des cancers de l'ovaire, de la thyroïde, des testicules et du pancréas. Il souligne l'importance d'améliorer la surveillance et d'adopter des stratégies délibérées pour cesser l'utilisation des pratiques de faible valeur, afin de réduire les coûts et d'améliorer les résultats pour les patients.
Dépistage : les points essentiels (PERPLEXITY/IA)
-
Le dépistage doit être adapté à l'âge, au sexe et aux antécédents (personnels et familiaux).
-
Chez les personnes à risque élevé (facteurs familiaux, antécédents précis, population à risque accru), les modalités et la fréquence du dépistage peuvent être renforcées ou ajustées.
-
La décision de dépister (fréquence, méthode) doit toujours être partagée avec le patient, en s’appuyant sur les recommandations actualisées et en tenant compte de sa situation individuelle.
-
D’autres dépistages peuvent être recommandés pour des cancers ou maladies ciblant les populations à risques spécifiques.
L’ensemble de ces recommandations vise une détection précoce des pathologies pour mettre en place des stratégies de prévention ou de traitement adaptées et ainsi améliorer l’espérance et la qualité de vie.
Pour intégrer efficacement les facteurs de risque spécifiques lors du dépistage du cancer, il faut personnaliser la stratégie selon le profil de chaque patient en combinant l’analyse de l’historique personnel, familial et les expositions individuelles.
Voici les principes et règles à suivre :
1. Identification précise des facteurs de risque
-
Facteurs de risque majeurs et mineurs : on distingue les facteurs fortement associés à une hausse du risque de cancer (ex. : mutation génétique BRCA1/2, antécédents d’irradiation thoracique, hyperplasie atypique pour le sein) des facteurs de risque plus modestes (certaines habitudes de vie, environnement).
-
Facteurs de risque individuels : âge, sexe, antécédents familiaux ou personnels de cancer, exposition à des agents cancérigènes (tabac, alcool, HPV, radiations), antécédents d’affections précancéreuses ou maladies chroniques.
-
Classement du risque : les autorités comme la HAS recommandent une stratification des patients par niveaux de risque (moyen, élevé, très élevé). Par exemple, pour le cancer colorectal : antécédents familiaux ou maladies inflammatoires chroniques du côlon augmentent le niveau de dépistage et la précocité d’entrée dans les programmes.
2. Détermination de la stratégie de dépistage
-
Dépistage spécifique basé sur le risque : Certaines situations imposent d’adapter les examens (choix du test et fréquence). Par exemple : poursuite du dépistage du sein par IRM chez les femmes à très haut risque génétique, début plus précoce du dépistage colorectal en cas d’antécédent familial.
-
Modalités adaptées : pour chaque facteur reconnu comme entraînant un risque accru, la Haute Autorité de Santé a défini des modalités spécifiques, en collaboration avec des experts : âge de début, type et fréquence des examens, recours à des examens complémentaires (IRM, test génétique, coloscopie).
-
Exemple cancer du sein : facteurs nécessitent des modalités spécifiques : antécédent personnel ou familial, mutation génétique, irradiation thoracique, hyperplasies atypiques. Pour chacun, la modalité de dépistage change (âge, type d’imagerie, rythme).
3. Prise en compte des interactions et du cumul
-
Cumul de facteurs : Le risque s’accroît avec la multiplication des facteurs (ex. : femme, tabac, antécédent familial). Plus le score de risque est élevé, plus le dépistage doit démarrer tôt et être fréquent.
-
Outils d'évaluation intégrative : utilisation de scores de risque (comme le score d’Eisinger pour le sein) pour mieux guider les recommandations individuelles.
4. Dialogue et décision partagée
-
Information du patient : L’explication des enjeux du dépistage personnalisé est essentielle, pour éviter sur-dépistage ou oubli de situations à risque.
-
Suivi régulier : adapter au fil du temps la stratégie de dépistage en fonction de l'évolution des facteurs personnels (nouvel antécédent familial, modification des habitudes de vie).
Schéma général d'intégration
Intégrer les facteurs de risque spécifiques suppose donc : une identification rigoureuse, une adaptation personnalisée de la stratégie de dépistage, et une réévaluation continue du niveau de risque, tout en privilégiant la décision partagée avec le patient.

Commentaire
Cet article important nous rappelle que les préventions en médecine à faible valeur sont à remettre en question, et ce , au-delà du cancer. Prenons la prévention primaire et le dépistage des affections cardiovasculaires. Même problème, car on en fait trop ou pas assez. Une des solutions, ou la solution, c'est de dépister dans un premier temps les patients à risque afin d'orienter la prévention vers celles et ceux qui en ont besoin. Certains patients souhaitent tous les dépistages et d'autres aucun. Tout dépistage orienté et expliqué a le plus de chances d'être compris. Là encore la pédagogie est indispensable, c'est un passage obligé. Mais, aujourd'hui, compte tenu du manque de médecins, tout est compliqué et on assiste cependant à des retards de dépistage aux causes néfastes. Il y a en général en France beaucoup d'examens de dépistage à faible valeur, cela rentre dans la médecine mille-feuilles ou l'art d'emplir les examens inutiles, notamment ces scanners, IRM… Mais ça rassure, disent certains, et le patient souhaite finalement ces excès. Mais la situation de notre système de santé ne peut plus supporter ces excès. Les médecins comme les patients doivent recentrer la médecine sur l'utile face à l'inutile, sur les bénéfices coût/risques, redisons le sur une pédagogie de chaque instant. Toute exploration entrant dans le cadre d'un dépistage doit être expliquée, argumentée . Ce travail préalable est nécessaire… et OBLIGATOIRE. Savoir justifier ses décisions fait partie du métier de médecin. EXPLIQUER et encore EXPLIQUER, la consultation "minute" n'a pas sa place ici.
Tout dépistage primaire d'un cancer ou du risque CV débute par un examen clinique complet.
Ne prescrivez pas un TEPSCAN dans le cadre du dépistage primaire du cancer, sauf cas exceptionnels.
Ne prescrivez pas de coronaroscanner en prévention CV primaire de manière systématique .
Ne prescrivez pas de scanner des vaisseaux du cou, de scanner de l'aorte abdominale et de scanner des artères des MI en prévention primaire.
Demain, l'AI rendra les dépistages plus simples, mieux justifiés et débutera les dépistages dans une population de plus en plus jeune .
REDUIRE l'INUTILE, AMPLIFIER L'UTILE, telle est la solution du dépistage .
INTRODUISONS l'IA dans les dépistage : rapidité, efficacité .
ETC.
Copyright : Dr Jean-Pierre Laroche/2025

