Citations de prix Nobel
Préambule
Cellules T régulatrices pour le traitement des maladies auto-immunes
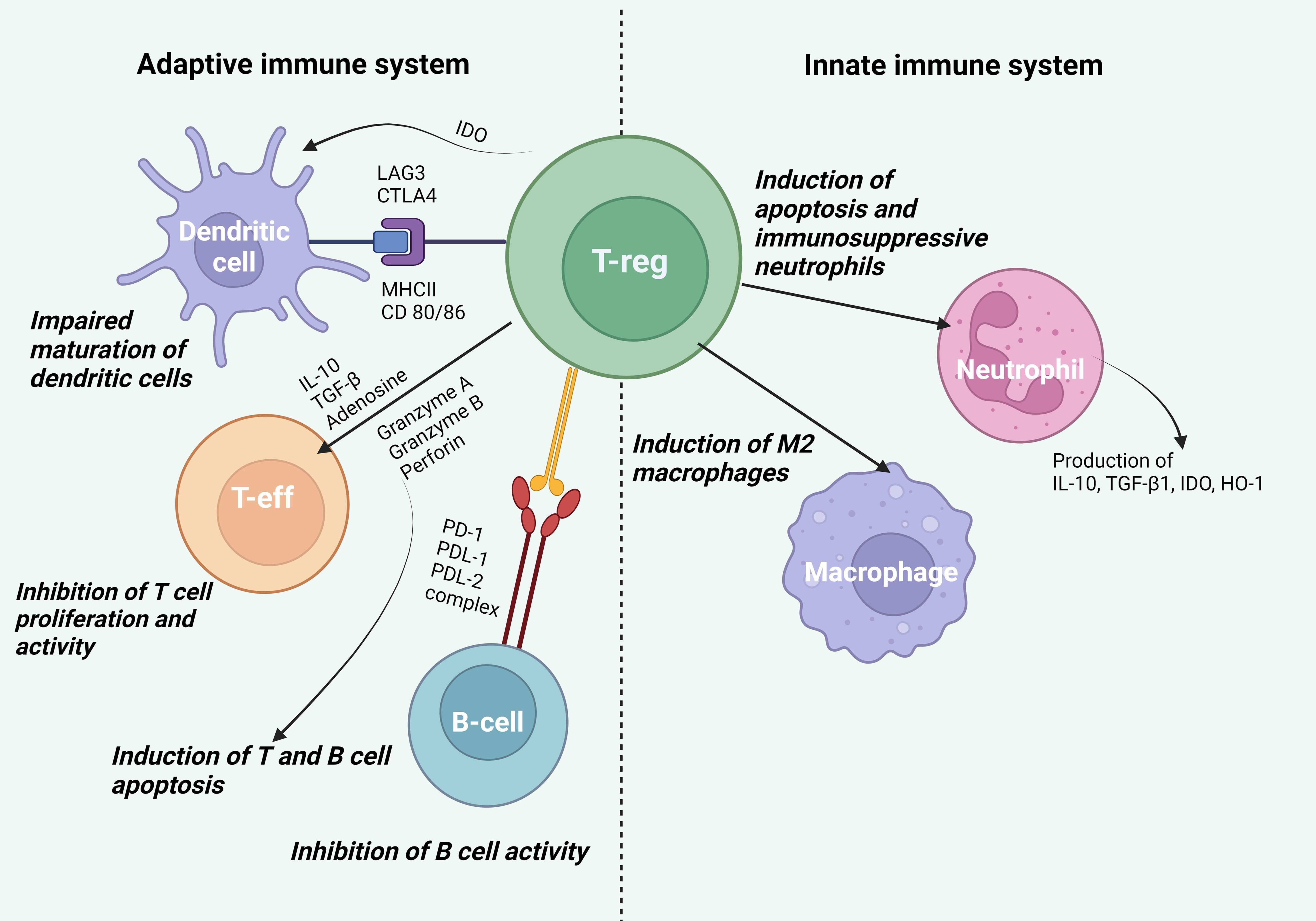
Les maladies auto-immunes résultent de déséquilibres du système immunitaire et de perturbations des mécanismes de tolérance immunitaire. Les lymphocytes T régulateurs (Treg) jouent un rôle clé dans la formation de la tolérance immunitaire. Les Tregs modulent les réponses immunitaires et les processus de réparation, contrôlant ainsi le système immunitaire inné et adaptatif. L'utilisation des Tregs dans le traitement des maladies auto-immunes a débuté par la manipulation de Tregs endogènes à l'aide de médicaments immunomodulateurs. Une méthode de transfert adoptif de Tregs cultivés in vitro a ensuite été développée. Le transfert adoptif de Tregs inclut les Tregs polyclonaux à effets non spécifiques et les Tregs spécifiques d'antigènes sous forme de CAR-Treg et de TCR-Treg. Cette revue examine les approches non spécifiques et spécifiques d'antigènes pour l'utilisation des Tregs, leurs avantages, leurs inconvénients, leurs lacunes en matière de développement et leurs perspectives d'avenir.
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2025.1511671/full
Entretien avec Simon Sakaguchi, prix Nobel de médecine
THE CONVERSATION / 10 OCTOBRE 2025

Les chercheurs japonais Shimon Sakaguchi (74 ans) et américains Mary Brunkow (64 ans) et Fred Ramsdell (65 ans) ont reçu le prix Nobel de médecine pour leur découverte des lymphocytes T régulateurs (Treg), qui protègent notamment l'organisme contre les maladies auto-immunes.
Auteur
Interviewé


Dans les années 1980, Shimon Sakaguchi, alors jeune chercheur en immunologie, peinait à obtenir des financements pour ses recherches. Aujourd’hui, ses travaux pionniers, qui ont permis de lever le voile sur la façon dont notre système immunitaire détermine à quoi s’attaquer (et à quel moment), viennent d’être récompensés par le prix Nobel de physiologie ou médecine. Dans cet entretien, il revient sur cette découverte majeure et ses implications médicales.
Le 6 octobre 2025, le Japonais Shimon Sakaguchi et les Américains Mary Brunkow et Fred Ramsdell se sont vu décerner le prix Nobel de physiologie ou médecine pour leurs travaux sur les lymphocytes T régulateurs (aussi appelés lymphocytes Treg), une classe particulière de cellules immunitaires qui empêchent notre système immunitaire de s’en prendre à notre propre corps.
Dans cet épisode du podcast The Conversation Weekly, Shimon Sakaguchi nous raconte comment il est parvenu à cette découverte, ainsi que son intérêt médical.
L’histoire commence par une intuition, née à la suite d’expérimentations réalisées par des collègues de Shimon Sakaguchi, au sein de l’Institut de recherche sur le cancer d’Aichi, à Nagoya. Ces dernières avaient subi l’ablation du thymus des souris nouvellement nées, trois jours après leur naissance. On savait déjà à cette époque que ce petit organe, situé derrière le haut du sternum chez l’être humain, jouait un rôle important dans le développement de l’autotolérance immunitaire. C’est en effet dans le thymus que les lymphocytes T qui risqueraient de s’attaquer à l’organisme sont isolés et détruits.
Si l’on retire le thymus d’une souris normale pendant la période néonatale, il semblait logique de s’attendre à ce qu’elle présente une déficience immunitaire, car ses lymphocytes auraient dû avoir disparu. Mais, c’est exactement le contraire qui s’est produit chez les souris dont on avait ôté le thymus : elles ont développé des maladies auto-immunes, autrement dit des maladies au cours desquelles le système immunitaire s’en prend au corps qu’il est censé protéger. Ces maladies se sont avérées très semblables à celles observées chez l’être humain.
Ce résultat a intrigué Shimon Sakaguchi. En effet, contrairement aux souris opérées par ses collègues, les patients victimes de maladies auto-immunes possèdent toujours leur thymus. Le chercheur a alors émis l’hypothèse de l’existence d’un mécanisme commun entre les deux situations. Celui-ci expliquerait à la fois la survenue de maladies auto-immunes spontanées chez l’être humain, et le fait que des souris auxquelles on a enlevé le thymus développent néanmoins des maladies auto-immunes.
Via une nouvelle expérience, Shimon Sakaguchi a tenté d’empêcher l’emballement du système immunitaire de souris dépourvues de thymus. Pour cela, il a prélevé des lymphocytes T sur des souris génétiquement identiques aux souris opérées, et les a réinjectées à ces dernières. Ainsi traitées, les souris sans thymus ne développaient plus de maladie auto-immune. Conclusion du chercheur : « Cela suggérait qu’il devait exister une population de lymphocytes T capable d’empêcher le développement de ces maladies ».
Mais, dans les années 1980, obtenir des fonds pour mener de telles recherches n’était pas chose aisée. Ainsi, « la communauté des spécialistes en immunologie était très sceptique quant à l’existence de telles cellules », explique Shimon Sakaguchi. Parti pour plusieurs années aux États-Unis, le chercheur reconnaît avoir eu « beaucoup de chance » lorsqu’une fondation privée a accepté de soutenir ses travaux.
Dix ans de recherche supplémentaires ont été nécessaires avant qu’il puisse publier, en 1995, un article scientifique relatant sa découverte des lymphocytes T régulateurs. On sait aujourd’hui que ceux-ci sont les agents de sécurité de l’organisme. Ils contrôlent les réactions indésirables et maintiennent l’équilibre du système immunitaire via un processus appelé tolérance périphérique. Leur dysfonctionnement peut être à l’origine de maladies auto-immunes. Les travaux ultérieurs de Shimon Sakaguchi et de ses co-récipiendaires du prix Nobel, Mary Brankow et Fred Ramsdell, ont permis de découvrir le gène Foxp3, qui contrôle spécifiquement les lymphocytes Treg.
Des maladies auto-immunes aux cancers, un fort potentiel
Au début de sa carrière,Shimon Sakaguchi s’intéressait aux maladies auto-immunes et à leurs origines. « Mais au fil de mes recherches, nous avons progressivement compris que les lymphocytes Treg constituaient un sujet plus important », souligne-t-il. On sait désormais que ces cellules sont impliquées dans la manière dont se développent les cancers, ainsi que dans la tolérance du greffon, en cas de transplantation d’organe.
Shimon Sakaguchi et ses collaborateurs travaillent également sur de nouvelles façons d’exploiter les lymphocytes Treg à des fins thérapeutiques, ainsi que sur la mise au point de protocoles permettant de convertir les lymphocytes T « auto-agressifs » en lymphocytes Treg, ce qui permettrait, espèrent-ils, de cibler spécifiquement les maladies auto-immunes dont ils sont responsables.
Son espoir est que, parmi les nombreux essais cliniques actuellement en cours dans le domaine de l’immunothérapie anticancéreuse en lien avec ces travaux, certains aboutissent à des solutions concrètes pour améliorer la prise en charge des patients. Il est également fasciné par de récents résultats de recherche qui suggèrent que les lymphocytes Treg seraient aussi impliqués dans les maladies liées à l’inflammation. Pour influer sur le potentiel de réparation des tissus endommagés, il pourrait être intéressant d’agir sur eux : « Les maladies neurodégénératives telles que la maladie d’Alzheimer ou la maladie de Parkinson sont associées à une inflammation. En ciblant uniquement ce type d’inflammation, nous pourrions peut-être [parvenir à] arrêter la progression de la maladie ou la retarder. Nous espérons que cette piste s’avérera réelle », conclut-il.
Cet épisode de The Conversation Weekly a été produit par Mend Mariwany et Katie Flood et est animé par Gemma Ware. Le mixage et la conception sonore ont été réalisés par Michelle Macklem et la musique du générique par Neeta Sarl.
TC : Notre système immunitaire est une merveilleuse mécanique.
Il est composé de nombreuses composantes qui interagissent, en particulier les anticorps et les lymphocytes T (des cellules immunitaires de type « globules blancs » qui interviennent à la fois dans la destruction des cellules infectées, la coordination de la réponse immunitaire et la mémorisation des infections). Ils nous protègent lorsque nous contractons une infection virale comme le Covid-19 ou la grippe, ou lorsque la consommation d’un curry douteux déclenche une intoxication alimentaire.
Mais, chez certaines personnes, le système immunitaire dysfonctionne et s’emballe. Au lieu de cibler les bactéries ou les virus qui les menacent, il s’attaque à leur organisme, s’en prenant à leurs propres cellules. Quand cela arrive, des maladies auto-immunes peuvent se développer, telles que la polyarthrite rhumatoïde ou le diabète de type 1.
Comment notre système immunitaire sait-il contre quoi se battre, et à quel moment le faire ? Dans les années 1980, les scientifiques pensaient avoir trouvé la réponse. Ils avaient découvert que, lorsque de nouveaux lymphocytes T sont créés dans notre thymus (un petit organe situé à l’arrière de la partie supérieure du sternum), ceux qui risquent d’attaquer nos propres tissus sont éliminés. Les lymphocytes T survivants sont ensuite relâchés dans notre corps, où ils n’attaquent que les intrus. Ce concept est appelé la « tolérance au soi ».
Mais, un jeune scientifique japonais, Shimon Sakaguchi, ne s’est pas satisfait de cette explication.
Il a décidé de creuser davantage. Il soupçonnait que des lymphocytes T « auto-agressifs » pouvaient parvenir à s’échapper du thymus et se répandre dans l’organisme. Selon lui, un autre mécanisme existait pour faire face à ce cas de figure et contrôler lesdits lymphocytes T. Ce mécanisme fondamental aurait aussi expliqué la survenue de maladies auto-immunes spontanées chez l’être humain.
Il s’avère que Sakaguchi avait raison. En début de semaine, il a été l’un des trois scientifiques récompensés par le prix Nobel de médecine ou physiologie 2025 pour leur découverte des lymphocytes T régulateurs, appelés Treglymphocytes Treg.
Ces cellules immunitaires d’un type particulier sont en quelque sorte des gardes du corps de l’organisme ; leur rôle est d’aider à maintenir le système immunitaire en équilibre. Désormais, ces recherches alimentent des essais cliniques destinés à mettre au point des traitements pour lutter contre le cancer, le diabète, ou pour prévenir le rejet de greffes d’organes.
Je suis Gemma Ware, de The Conversation, un site d’actualité et d’analyse indépendant qui associe journalistes et universitaires. Bienvenue dans The Conversation Weekly, le podcast où des experts vous expliquent comment nous en sommes arrivés là.
TC : Shimon Sakaguchi, vous êtes professeur émérite à l’Immunology Frontier Research Centre de l’université d’Osaka au Japon et corécipiendaire du prix Nobel de physiologie ou médecine de cette année. Félicitations et bienvenue à The Conversation.
SS : Merci beaucoup.
TC : Je crois comprendre que vous étiez dans votre laboratoire lorsque vous avez reçu l’appel vous annonçant que vous aviez remporté le prix. Comment se sont passés les jours qui ont suivi ?
SK : C’était une merveilleuse surprise. J’ai ensuite reçu énormément de messages de félicitations du monde entier. C’est vraiment incroyable, et enthousiasmant.
TC : Revenons au début des années 1980. Vous travailliez alors à l’Institut de recherche sur le cancer d’Aichi, à Nagoya, au Japon. Comment en êtes-vous venu à vous intéresser au fonctionnement du système immunitaire ?
SK : J’étais très intéressé par la tolérance immunologique. Le système immunitaire nous protège des microbes qui tentent de nous envahir. Mais, cependant, parfois, il se retourne contre nous et provoque des maladies auto-immunes. Ainsi, le système immunitaire est à la fois bon et mauvais. Le fait qu’il ne s’en prenne pas à nous, c’est ce que l’on appelle la tolérance au soi. Comprendre comment cette tolérance immunitaire est établie et maintenue, constitue un des thèmes clés de la recherche en immunologie.
TC : Vous vous intéressiez à une expérience menée auparavant par certains de vos collègues sur des souris nouveau-nées. Ils avaient retiré le thymus de ces souris trois jours après leur naissance. Comme le thymus est essentiel au développement de la tolérance immunitaire (c’est d’ailleurs de là que vient le nom des « lymphocytes T », le T étant pour « thymus »), ils pensaient que leur système immunitaire aurait été affaibli. Mais, en réalité, ce qui s’est produit, c’est que leur système immunitaire s’est emballé et que les souris ont développé des maladies auto-immunes. Qu’est-ce qui vous intriguait tant dans cette expérience ?
SS : L’expérimentation qu’ils ont menée était très intéressante. En effet, si vous enlevez le thymus de souris normales pendant la période néonatale, vous vous attendriez à ce qu’elles présentent une déficience immunitaire, puisqu’elles n’ont alors plus de lymphocytes. Mais il s’est passé tout le contraire : elles ont développé des maladies auto-immunes. Des maladies très semblables à celles que l’on observe chez l’être humain. Il se passait donc maintenant quelque chose d’intéressant. Évidemment, chez les patients humains [qui développent des maladies auto-immunes], le thymus n’a pas été retiré. Il devait donc exister un mécanisme commun capable d’expliquer [le résultat observé chez les souris ayant subi une ablation du thymus] et les maladies auto-immunes spontanées chez l’humain.
TC : Vous avez alors décidé d’une autre approche, pour voir si vous pouviez empêcher le système immunitaire des souris sans thymus de s’emballer. Vous avez prélevé des lymphocytes T sur des souris génétiquement identiques et les avez introduits dans l’organisme de celles auxquelles on avait enlevé le thymus. Qu’avez-vous découvert ?
SS : C’est tout à fait cela, et de cette façon, la survenue de maladies a pu être prévenue. Cela suggérait donc qu’il devait exister une population de lymphocytes T capable d’empêcher le développement des maladies [auto-immunes]. Une sorte de population « suppressive ».
TC : Racontez-nous ce moment où vous avez réalisé que les souris allaient bien et que vous aviez réussi à les protéger des maladies auto-immunes. Qu’avez-vous ressenti ?
SS : De l’excitation, et le sentiment qu’il s’agissait de quelque chose d’important. Puis que si nous analysions plus en profondeur ce phénomène, il pourrait peut-être nous apprendre un principe immunologique fondamental à propos de la tolérance. Je me disais que si je pouvais découvrir cela, disons, dans les dix ans, ce serait formidable. C’est là tout ce que j’espérais à cette époque.
TC : Aviez-vous conscience à ce moment-là d’avoir fait une découverte majeure ?
SS : Une découverte majeure ? Disons que dans le domaine de l’immunologie, c’était certainement quelque chose, car c’était essentiel pour comprendre les maladies immunologiques. Quant à savoir si c’était une « grande découverte » ou non… Cela allait dépendre de notre capacité à démontrer que nous pouvions guérir de telles maladies ou en empêcher le développement. À cette époque, il restait encore à savoir comment nous allions pouvoir généraliser ce que nous avions trouvé.
TC : Avez-vous rencontré des difficultés, dans les années 1980, pour poursuivre ces travaux de recherche ?
SS : Il n’a pas été facile d’obtenir des financements, car la communauté des spécialistes en immunologie était très sceptique quant à l’existence de tels lymphocytes. Mais à cette période, j’ai passé près de dix ans aux États-Unis, où j’ai eu beaucoup de chance, car une fondation privée, la Lucille P. Markey Foundation, a soutenu mes recherches pendant huit ans. Le soutien de jeunes chercheurs par des fondations privées était bien plus courant aux États-Unis qu’au Japon. J’espère que ce type de pratique ou de système se poursuivra, à la fois aux États-Unis, et au Japon.
TC : Vous aviez donc mené cette expérience sur des souris et réalisé qu’il existait un type particulier de lymphocyte T. Mais, comprendre plus précisément de quoi il retournait vous a pris environ une décennie. Une fois que vous y êtes parvenu, vous avez baptisé ces lymphocytes T des lymphocytes T régulateurs, ou lymphocytes Treg. Il s’agit donc d’un type particulier de lymphocytes T, qui empêchent notre système immunitaire de surréagir et d’attaquer notre corps. Vous avez publié votre article sur les lymphocytes T régulateurs en 1995. Comment a-t-il été reçu à l’époque ?
SS : Avant cette date, les personnes considéraient qu’il s’agissait d’un phénomène intéressant. Mais, ce n’est que lorsque nous sommes parvenus à définir cette population grâce à un marqueur spécifique que tout le monde a pu observer les mêmes cellules que nous. Avant cela, les autres chercheurs ne pouvaient pas vérifier que ce que nous affirmions était vrai. Nous avons démontré que ces lymphocytes étaient exprimés fortement, et de façon constitutive. Chacun a ensuite pu reproduire nos expériences et le confirmer.
TC : Rapidement, ces lymphocytes T régulateurs que vous aviez identifiés circulent et empêchent tout lymphocyte T agressif qui se serait échappé du thymus d’attaquer notre corps. Si nous n’en possédons pas, nous risquons de développer une maladie auto-immune. Mais aujourd’hui, nous savons aussi que le rôle joué par les lymphocytes Treg est beaucoup plus large que cela. Pourquoi est-ce si important ?
SS : J’avais un intérêt pour les maladies auto-immunes, et leurs origines. C’était ce qui motivait mes recherches, ce qui en constituait la force directrice. Mais au fil de mes travaux, j’ai compris que les lymphocytes Treg étaient importants à la fois en matière de maladies auto-immunes, et pour l’immunité tumorale, la tolérance vis-à-vis des greffons, et plus récemment, la réparation des tissus. Ils ont donc de multiples fonctions. Tout ça est aujourd’hui très enthousiasmant.
TC : Revenons à l’époque où vous identifiiez ces lymphocytes T régulateurs. Vos collègues et corécipiendaires du Nobel, Mary Bruncko et Fred Ramsdell, travaillaient aux États-Unis à comprendre les gènes derrière une maladie auto-immune rare et invalidante. Dans le cadre de ces travaux, ils ont découvert le gène qui contrôle le fonctionnement des lymphocytes T régulateurs. Vous souvenez-vous de la publication de leur article, en 2001 ? Quelle a été votre réaction ?
SS : Nous avions remarqué cet article. Un gène avait été identifié et une anomalie ou mutation de ce gène provoquait à la fois des maladies auto-immunes, et des allergies et des maladies inflammatoires chroniques de l’intestin. Ainsi un seul gène était responsable de multiples pathologies immunologiques. Ledit gène avait été découvert, mais les auteurs n’avaient pas montré comment cette anomalie génétique entraînait ces maladies immunologiques.
Nous avons immédiatement commencé nos recherches sur ce gène, appelé FoxP3. Nous avons postulé qu’il devait être lié à la fonction ou au développement des Treg. Nous avons donc commencé diverses expérimentations, et publié nos résultats deux ans plus tard : nous avons démontré que ce gène était spécifique des lymphocytes T régulateurs.
TC : Les connaissiez-vous personnellement ? Étiez-vous en contact avec eux, scientifiquement parlant ?
SS : Non, je ne les connaissais pas à l’époque. Mais, bien sûr, nous nous sommes rencontrés lors de congrès scientifiques, notamment avec Fred Ramsdell. Ils avaient publié leurs découvertes et les présentaient également dans des colloques.
TC : Nous commençons seulement à comprendre ce que vos découvertes pourraient apporter en matière d’amélioration de la santé. Quelles sont, selon vous, les pistes de recherche les plus prometteuses et sur quoi travaillez-vous actuellement ?
SS : Les Treg sont spécialisées dans la suppression immunitaire. Cela signifie qu’en les renforçant ou en les multipliant, elles pourraient être utilisées pour traiter des maladies immunologiques, notamment les maladies auto-immunes, les allergies ou le syndrome de l’intestin irritable.
Ce qui est enthousiasmant, c’est que plus de 200 essais cliniques sont en cours : on prélève chez les patients des Treg naturellement présents dans leur organisme, on les multiplie puis on les leur réinjecte.
Mais, nous menons aussi des projets plus ambitieux : nous essayons de convertir des lymphocytes T effecteurs ou mémoires spécifiques d’une maladie — donc des « mauvais » lymphocytes – en Treg. Nous espérons de cette façon aboutir à une suppression spécifique d’un antigène ou d’une maladie (le terme « antigène » désigne tout élément étranger à l’organisme capable de déclencher une réponse immunitaire, ndlr).
TC : Ces « mauvais » lymphocytes T qui attaquent l’organisme, vous voulez les transformer en Treg pour qu’ils deviennent des gardes du corps ?
SS : Exactement. C’est ce que nous poursuivons actuellement.
TC : Quelles maladies ciblez-vous ?
SS : Diverses maladies auto-immunes, par exemple des maladies auto-immunes du foie, dont l’hépatite auto-immune, pour laquelle le seul traitement actuellement disponible est l’administration de corticostéroïdes (corticothérapie, ndlr).
TC : D’autres équipes s’intéressent aussi au cancer. Pouvez-vous expliquer comment cela fonctionnerait ?
SS : C’est un autre espoir en matière de recherche sur les lymphocytes Treg. Ces derniers sont abondants et très fortement activés dans les tissus cancéreux. La réponse immunitaire dirigée contre les cellules cancéreuses est de ce fait inhibée.
L’idée est de trouver une façon de réduire la quantité de Treg et ainsi améliorer la réponse immunitaire antitumorale. Nous espérons à terme parvenir à développer une petite molécule administrable par voie orale qui serait capable de renforcer ladite réponse en faisant diminuer le nombre de lymphocytes Treg présents dans les tissus tumoraux. Nous sommes encore loin de l’objectif, mais ce type de recherche nous intéresse au plus haut point.
TC : En lisant vos travaux, on se rend compte à quel point ils s’appuient sur les recherches de ceux qui vous ont précédé, non seulement au sein de votre propre laboratoire, mais aussi ceux qui ont œuvré durant les décennies précédentes, et qui pour certains ont aussi obtenu un prix Nobel. Qu’aimeriez-vous que l’on fasse de vos découvertes à l’avenir ?
SS : Eh bien, mon espoir immédiat est que les Treg deviennent un outil efficace pour traiter diverses maladies immunologiques, ou que l’on parvienne à les cibler dans le cadre d’immunothérapies anticancéreuses. J’espère que cela deviendra très prochainement une réalité clinique. Dans le même temps, des recherches récentes ont montré que ces lymphocytes ont aussi d’autres fonctions, en plus de leur rôle immunosuppresseur.
Concrètement, cela signifie qu’ils pourraient présenter un intérêt au-delà des maladies immunologiques, notamment dans le traitement de maladies neurodégénératives telles que les maladies d’Alzheimer ou de Parkinson, dans lesquelles l’inflammation joue un rôle. En ciblant cette inflammation, nous pourrions peut-être ralentir leur progression.
C’est une piste captivante, nous espérons qu’elle se confirmera, et que cette approche pourra fonctionner pour ce type de pathologies.
Copyright : Dr Jean-Pierre Laroche / 2025

