Ménopause : ELINZANETANT, une bouffée d'espoir
https://jamanetwork.com/journals/jama/fullarticle/2822766
Article libre d'accès
Importance
Des traitements non hormonaux sûrs et efficaces pour les symptômes vasomoteurs de la ménopause (VMS) sont nécessaires.
Objectif
Évaluer l’efficacité et l’innocuité de l’élinzanetant, un antagoniste sélectif des récepteurs de la neurokinine-1,3, pour le traitement des symptômes vasomoteurs ménopausiques modérés à sévères.
Conception, cadre et participants
Deux essais randomisés en double aveugle de phase 3 (OASIS 1 et 2) incluaient des participantes ménopausées âgées de 40 à 65 ans présentant des symptômes vasomoteurs modérés à sévères (OASIS 1 : 77 sites aux États-Unis, en Europe et en Israël du 27 août 2021 au 27 novembre 2023, et OASIS 2 : 77 sites aux États-Unis, au Canada et en Europe du 29 octobre 2021 au 10 octobre 2023).
Intervention
Une fois par jour, élinzanetant par voie orale, 120 mg, pendant 26 semaines ou placebo correspondant pendant 12 semaines, suivi d'élinzanetant, 120 mg, pendant 14 semaines.
Principaux critères d'évaluation et mesures
Les principaux critères d'évaluation comprenaient la variation moyenne de la fréquence et de la gravité des symptômes vasomoteurs modérés à sévères entre le début de l'étude et les semaines 4 et 12, mesurée par le journal électronique quotidien des bouffées de chaleur. Les critères d'évaluation secondaires comprenaient le score T total du Patient-Reported Outcomes Measurement Information System (PSIMS), le score T total du questionnaire sur les troubles du sommeil (formule abrégée 8b) et le score total du questionnaire sur la qualité de vie spécifique à la ménopause entre le début de l'étude et la semaine 12.
Résultats
Les participants éligibles (âge moyen [ET], OASIS 1 : 54,6 [4,9] ans ; OASIS 2 : 54,6 [4,8] ans) ont été randomisés pour recevoir de l'élinzanétant (OASIS 1 : n = 199 ; OASIS 2 : n = 200) ou un placebo (OASIS 1 : n = 197 ; OASIS 2 : n = 200). Au total, 309 (78,0 %) et 324 (81,0 %) ont terminé OASIS 1 et 2, respectivement. Pour les groupes élinzanétant et placebo, la moyenne initiale (ET) des VMS par 24 heures était de 13,4 (6,6) contre 14,3 (13,9) (OASIS 1) et 14,7 (11,1) contre 16,2 (11,2) (OASIS 2). La gravité initiale du VMS était de 2,6 (0,2) contre 2,5 (0,2) (OASIS 1) et de 2,5 (0,2) contre 2,5 (0,2) (OASIS 2). Français L'élinzanétant a réduit significativement la fréquence des VMS à la semaine 4 (OASIS 1 : −3,3 [IC à 95 %, −4,5 à −2,1], P < 0,001 ; OASIS 2 : −3,0 [IC à 95 %, −4,4 à −1,7], P < 0,001) et à la semaine 12 (OASIS 1 : −3,2 [IC à 95 %, −4,8 à −1,6], P < 0,001 ; OASIS 2 : −3,2 [IC à 95 %, −4,6 à −1,9], P < 0,001). Français L'élinzanétant a également amélioré la gravité des VMS à la semaine 4 (OASIS 1 : −0,3 [IC à 95 %, −0,4 à −0,2], P < 0,001 ; OASIS 2 : −0,2 [IC à 95 %, −0,3 à −0,1], P < 0,001) et à la semaine 12 (OASIS 1 : −0,4 [IC à 95 %, −0,5 à −0,3], P < 0,001 ; OASIS 2 : −0,3 [IC à 95 %, −0,4 à −0,1], P < 0,001). L'élinzanétant a amélioré les troubles du sommeil et la qualité de vie liée à la ménopause à la semaine 12, et le profil de sécurité était favorable.
Conclusions et pertinence
L’élinzanétant a été bien toléré et efficace dans le traitement des VMS ménopausiques modérés à sévères
Points clés
Question Quelle est l’efficacité et la sécurité de l’élinzanetant, 120 mg, chez les personnes ménopausées présentant des symptômes vasomoteurs (VMS) modérés à sévères ?
Résultats Dans 2 essais cliniques pivots de phase 3, l'élinzanetant a démontré des réductions statistiquement significatives de la fréquence et de la gravité des VMS par rapport au placebo. L'élinzanetant a également amélioré de manière significative les troubles du sommeil et la qualité de vie liée à la ménopause par rapport au placebo ; le profil de sécurité était favorable.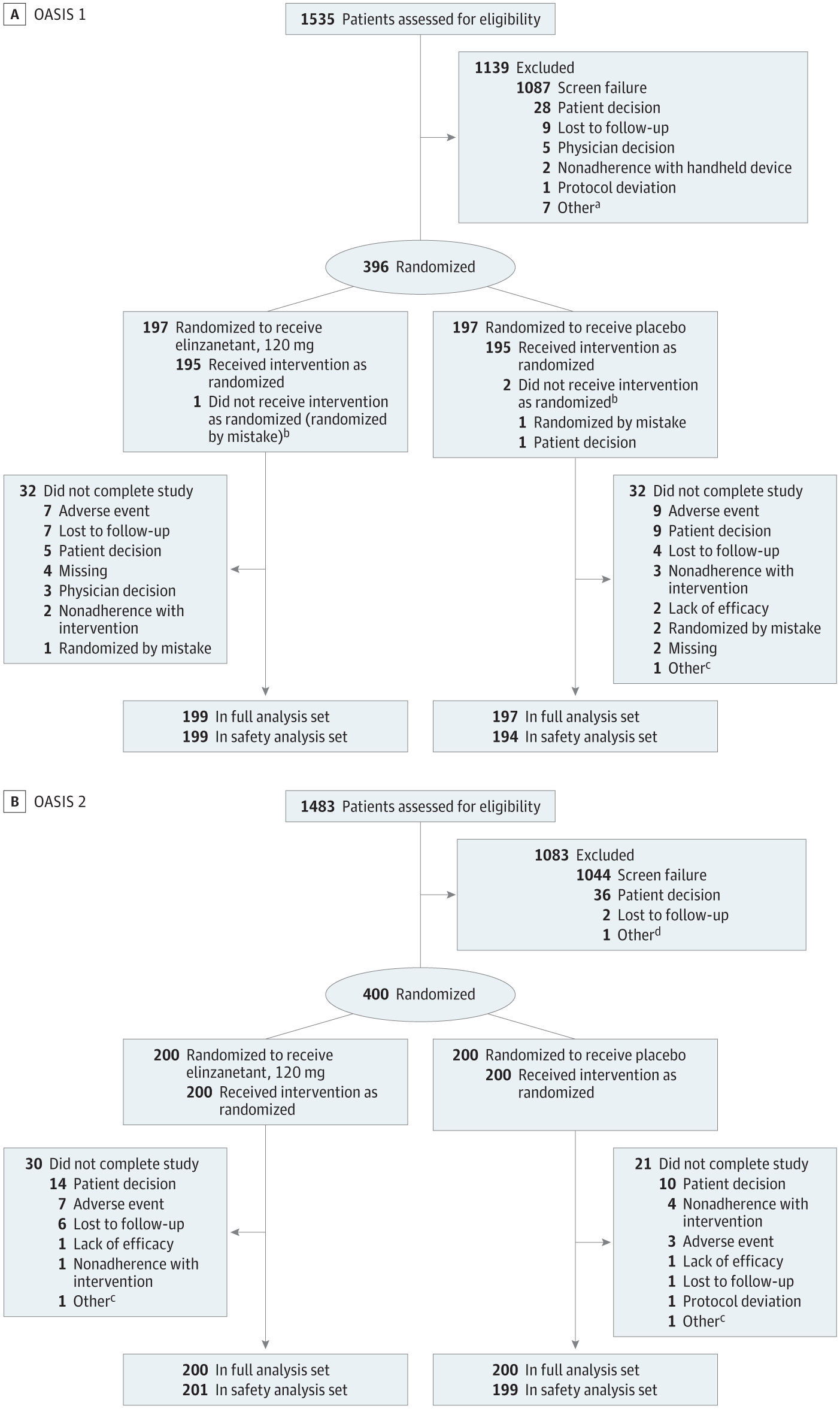
Recrutement, randomisation et flux de participants dans les essais OASIS 1 et OASIS 2
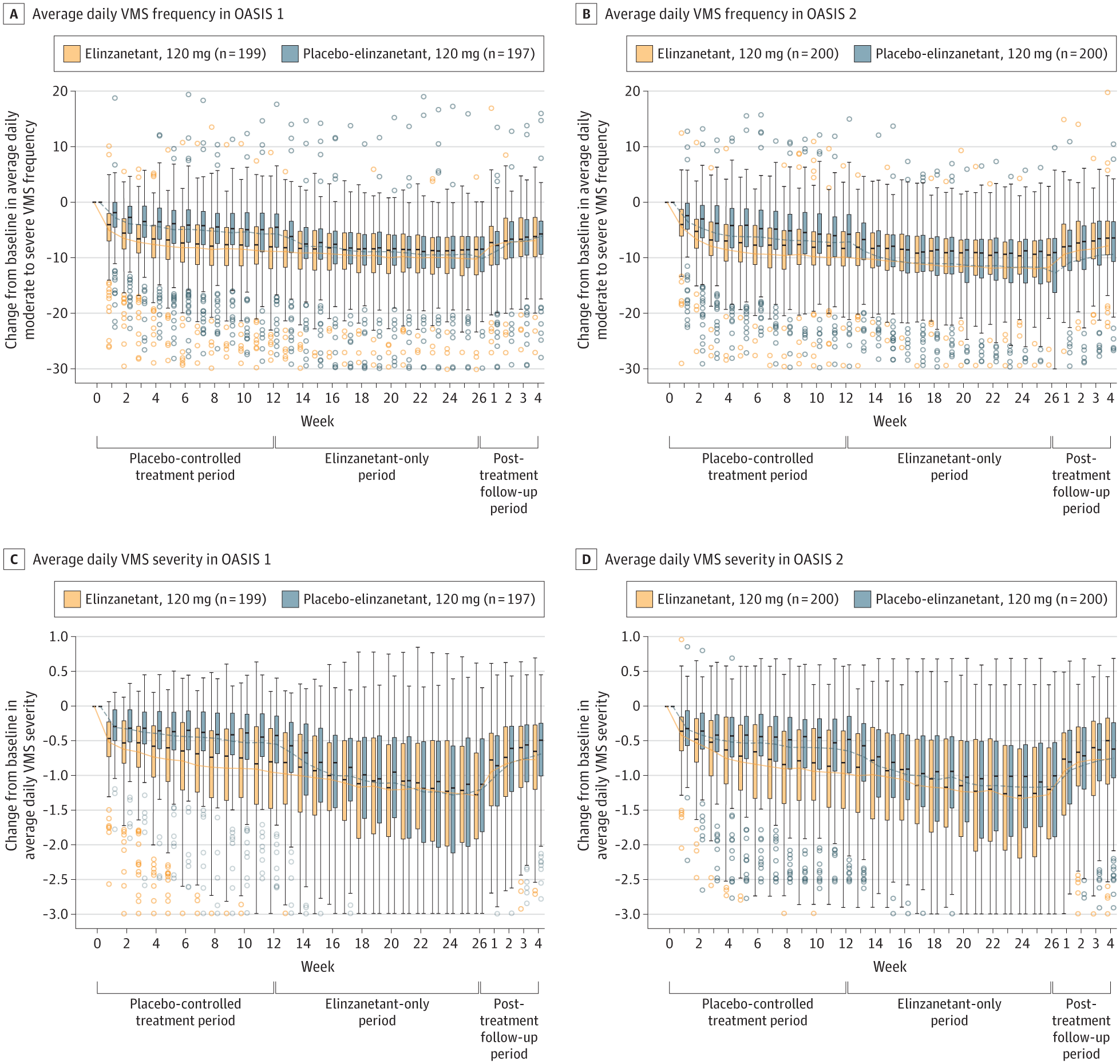
Changement par rapport à la valeur initiale de la fréquence et de la gravité des symptômes vasomoteurs quotidiens moyens (VMS) par groupe de traitement et par étude
Signification
L'élinzanétant est un antagoniste sélectif des récepteurs de la neurokinine 1,3 efficace et bien toléré pour le traitement des symptômes vasomoteurs modérés à sévères associés à la ménopause. L 'élinzanétant améliore également les troubles du sommeil et la qualité de vie liée à la ménopause.
Dans l'étude OASIS 1, des événements indésirables liés au traitement (EILT) ont été signalés chez 51,3 % des participants du groupe elinzanetant et 48,5 % du groupe placebo au cours de la période de traitement contrôlée par placebo de 12 semaines . Dans l'étude OASIS 2, 44,3 % et 38,2 % des participants ont signalé des EILT dans les groupes elinzanetant et placebo, respectivement. Dans les deux essais, la plupart des EILT étaient d'intensité légère ou modérée, et il y a eu peu d'EI graves
Dans les deux essais, les céphalées et la fatigue (terme privilégié du Medical Dictionary for Regulatory Activities) sont survenues plus fréquemment dans les groupes elinzanetant au cours de la période de traitement contrôlée par placebo de 12 semaines (7,0 % à 9,0 % contre 2,5 % à 2,6 % pour les céphalées et 5,5 % à 7,0 % contre 1,5 % pour la fatigue) . La fatigue et les céphalées ont été signalées moins fréquemment par les participants du groupe placebo après le passage à l'elinzanetant par rapport à ceux initialement randomisés pour recevoir l'elinzanetant (2,2 % à 3,6 % pour les céphalées et 0,6 % à 1,7 % pour la fatigue au cours des semaines 13 à 26) .La plupart des événements étaient d'intensité légère et aucun n'était grave.
D'après une analyse post hoc, pour la fatigue, la fréquence relative quotidienne la plus élevée (jusqu'à 5 %) a été observée au cours des premières semaines, puis a été réduite à moins de 3 % après la semaine 13. Pour les maux de tête, la fréquence relative quotidienne la plus élevée (jusqu'à 5,5 %) a été signalée vers la semaine 7 à 8 et a été réduite à moins de 2 % vers la fin de la période de traitement.
Aucun cas d'élévation des enzymes hépatiques répondant aux critères d'une lésion hépatique n'a été observé, comme l'a évalué le comité de surveillance de la sécurité hépatique.
Aucun cas d'hyperplasie endométriale ou de néoplasie maligne n'a été observé dans les deux essais, comme l'ont évalué trois pathologistes indépendants.
Aucun changement cliniquement pertinent des signes vitaux ou des paramètres de laboratoire n'a été observé tout au long de l'étude, et aucun nouveau signal de sécurité n'a été observé tout au long des deux essais.
OASIS 1 et 2 étaient deux essais pivots de phase 3 similaires réalisés sur différents sites et pays qui ont démontré séparément l'efficacité de l'élinzanetant pour le traitement des VMS associés à la ménopause.
L'élinzanetant a démontré une amélioration rapide de la fréquence des VMS à 1 semaine et des améliorations robustes de la gravité des VMS, des troubles du sommeil et de la qualité de vie liée à la ménopause, et présente un profil de sécurité favorable.
L'élinzanetant a le potentiel de fournir une option de traitement non hormonal bien tolérée et efficace pour répondre aux besoins de santé non satisfaits de nombreuses personnes ménopausées atteintes de VMS modérés à sévères.
Commentaire
Une avancée thérapeutique très significative pour une pathologie qui retentit qur la qualité de vie des patientes
Ce traitement n'est pas hormonal ,il présente à priori peu d'effets secondaires....une très bonne chose , enfin !
.

