iconograpghie : traité de Médecine Vasculaire Ed Elevier Masson 2021, JP Laroche JP Galanaud
"Exclusivité en français"
"Nous avons toujours la foi. Mais ce que nous attendions de Dieu, nous l'attendons aujourd'hui de la science médicale." George Bernard Shaw
The Post-thrombotic Syndrome - Prevention and Treatment: VAS-European Independent Foundation in Angiology/Vascular Medicine Position Paper. Cosmi B, Stanek A, Kozak M, Wennberg PW, Kolluri R, Righini M, Poredos P, Lichtenberg M, Catalano M, et al. Frontiers in Cardiovascular Medicine. 2022 Feb 24 / Vol.9 / Article 762443 (Impact factor 6.05).

Traduction et iconographie François Becker , Chamonix MD, PhD, HDR, PU Médecine Vasculaire, (notes FB à la fin : *n)
Abréviations
CC : Contention-Compression, Compression Veineuse Elastique dégressive par chaussettes ou bas
EBM : Evidence Based Medicine, Médecine fondée sur les preuves, Médecine factuelle
IVC : Insuffisance Veineuse Chronique
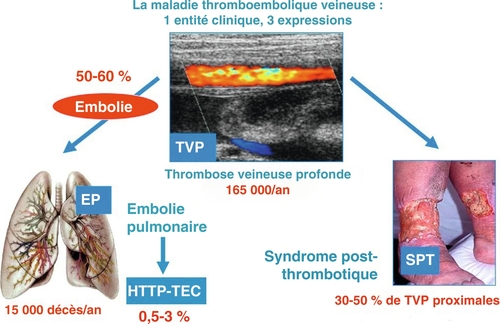
MTEV : Maladie Thrombo-Embolique Veineuse (TVP et/ou EP)
SPT : Syndrome Post-Thrombotique
TVP : Thrombose Veineuse Profonde
Résumé.
Importance. Le syndrome post-thrombotique (SPT) est la principale complication à long terme de la TVP affectant jusqu'à 40-50 % des patients. Sa gestion clinique ne repose que sur des données EBM limitées.
Objectif. Fournir un consensus d’experts pour le diagnostic, la prévention et le traitement du SPT.
Recherche de données EBM. Recherche sur Medline, Cochrane database review, Google Scholar utilisant les termes « post-thrombotic syndrome » et « post-phlebitic syndrome » dans le titre ou l’abstract, jusqu’à septembre 2020.
Filtres. Anglais, Essai clinique contrôlé, Revue systématique, Méta-analyse, Recommandations.
La littérature pertinente concernant le diagnostic, la prévention et le traitement du SPT a été évaluée et résumée par un premier groupe d’experts (Evidence synthesis team). A partir de ces données, un groupe de 15 cliniciens experts en angiologie/médecine vasculaire a examiné la justesse de différents items concernant le management du SPT en utilisant une échelle Likert-9 lors de deux rounds Delphi.
Résultats. Les panélistes ont retenu comme appropriés les items suivants
- Pour le diagnostic du SPT : le score de Villata, l’évaluation d’une insuffisance veineuse pré-existante, un délai de 3 à 6 mois après le diagnostic de TVP, un suivi régulier personnalisé en fonction de la présence ou de l’absence d’un SPT cliniquement pertinent.
- Pour le soulagement des symptômes et la prévention du SPT : 1-bandage, chaussette/bas de compression 30-40 mmHg à la cheville en phase aigüe, quelle que soit l’extension de la TVP, 2-bas de compression 30-40 mmHg après TVP fémoro-iliaque, 3-chaussette de compression 30-40 mmHg après TVP poplitée, 4-durée du traitement compressif fonction de la sévérité du SPT régulièrement réévaluée, 5-thrombolyse dirigée par cathéter, avec ou sans thrombectomie mécanique, seulement en cas de TVP fémoro-iliaque chez des patients avec symptomatologie sévère et faible risque hémorragique.
- Pour le traitement du SPT : 1-bas-cuisse 30-40 mmHg à la cheville pour SPT après TVP fémoro-iliaque, 2-chausssette 30-40 mmHg pour SPT après TVP poplitée, 3-exercice physique. La place du traitement endovasculaire a été jugée incertaine, en tout cas discutable seulement en cas de SPT sévère avec sténose/occlusion sus-inguinale et suivie par un traitement anticoagulant.
Introduction.
Le syndrome post-thrombotique est la principale complication à long terme de la TVP affectant jusqu'à 40-50 % des patients, principalement du fait d'un défaut de résolution du thrombus avec obstruction persistante à l'écoulement veineux et incompétence valvulaire secondaire*1. Le SPT n'a pas été systématiquement pris en compte dans les critères d’évaluation des nombreux essais cliniques ayant étudié des stratégies pharmacologiques de prévention et de traitement de la MTEV au cours des 30 dernières années, seules des analyses post hoc secondaires sont disponibles. Malheureusement, il existe très peu de preuves concernant nombre de problèmes dans la gestion du SPT, et les preuves existantes sont de faible qualité*2.
Les preuves limitées disponibles et les nombreuses zones d'incertitude impliquent aussi un large éventail de variations et d'hétérogénéité dans la prise en charge clinique du SPT dans les différents pays.
Cela a incité la VAS-European Independent Foundation in Angiology/Vascular Medicine à lancer un projet de prise de position sur la pertinence des interventions pour le SPT impliquant des cliniciens experts de différents pays.
Le concept de pertinence fait référence au poids relatif des avantages et des inconvénients d'une intervention médicale ou chirurgicale. Une procédure appropriée est une procédure pour laquelle « le bénéfice attendu pour la santé dépasse les conséquences négatives possibles, avec une marge suffisamment large pour que la procédure en vaille la peine, hors coût ».
VAS est un groupe de travail européen créé en 1991 par Dr Mariella Catalano de Milan, devenu une fondation à but non-lucratif en partenariat avec une 50aine d’organisations scientifiques et d’universités en Europe. VAS est présent dans 40 pays. VAS est très axé sur l’éducation, la formation, la santé publique dans un souci de pratique quotidienne
https://www.vas-int.net/vas-for-angiology-vascular-medicine/brief-history-of-vas/
Méthode.
La méthode RAND/UCLA et une méthode Delphi à deux tours ont été utilisées (Fitch K. Rand/UCLA Appropriateness Method User’s Manual - http://www.rand.org).
Un groupe de praticiens cliniciens experts a été recruté pour effectuer une revue de la littérature (équipe de synthèse des preuves) composé de huit spécialistes en angiologie/médecine vasculaire de sept pays européens et des États-Unis. Les bases MEDLINE, Cochrane et Google scholar ont été explorées jusqu'en septembre 2020. Seuls les essais cliniques prospectifs portant sur le diagnostic du SPT, les essais cliniques randomisés et les revues systématiques portant sur la prévention et le traitement du SPT, publiés en anglais, ont été inclus. Les résumés, actes de conférence, articles de synthèse, études de cohorte observationnelles ou rétrospectives, éditoriaux et commentaires ont été exclus. Les doublons ont été supprimés.
Trois études prospectives pour le diagnostic, cinq revues systématiques et quatre essais cliniques randomisés non inclus dans les revues systématiques ont été sélectionnés.
L'évaluation méthodologique a été menée selon les American College of Cardiology/American Heart Association Task Force on Practice Guidelines. L’évaluation méthodologique a été complétée pour les revues systématiques et les études primaires non incluses dans les revues systématiques.
L’annexe 1 présente les résultats de cette revue critique (https://www.frontiersin.org/articles/10.3389/fcvm.2022.762443/full#supplementary-material)
Au total, 29 items ont été retenus concernant le diagnostic (10), la prévention (8) et le traitement (11) du SPT. Une échelle de Likert 9 points a été construite pour chacun d’eux. Les formulaires ont été adressés à un panel de 15 membres (13 spécialistes en angiologie/médecine vasculaire, 2 internistes).
Les indications ont été classées en trois niveaux de pertinence, sur la base suivante :
- Approprié : médiane du panel de 7 à 9, sans désaccord sur l'échelle de pertinence finale. Il serait inapproprié de ne pas offrir ce service, il y a une chance raisonnable que cette procédure soit bénéfique pour le patient et ce bénéfice n’est pas négligeable.
- Incertain : médiane du panel de 4 à 6 ou toute position avec désaccord.
- Inapproprié : médiane du panel de 1 à 3, sans désaccord.
Le deuxième tour impliquait un face-à-face virtuel en web-réunion des panélistes avec modérateur pour débattre de la note médiane et des désaccords entre panélistes. Sur les 29 items initiaux, 15 ont été acceptés sans changement, 2 ont été modifiés puis retenus, 9 ont été supprimés de même que 3 items pour lesquels il y avait désaccord. Au total, 17 items ont été retenus (Cf tableau 1).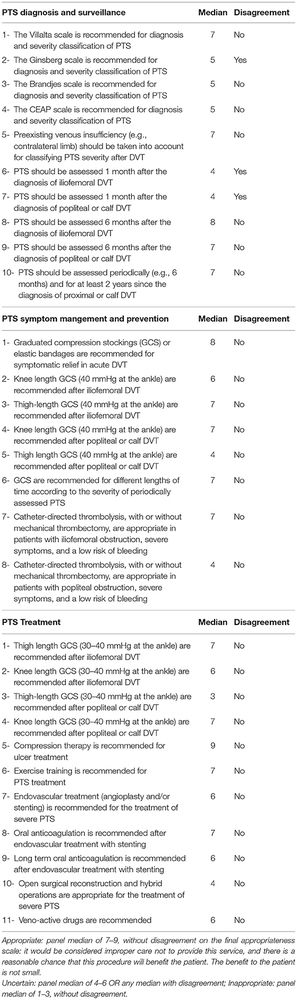
Résultats.
Diagnostic et Surveillance.
1-Le score de Villalta est approprié pour le diagnostic et la gradation du SPT
2-Il convient d’évaluer une insuffisance veineuse pré-existante (via le membre controlatéral par ex.) pour juger de la sévérité d’un SPT après TVP.
3-Il convient de juger d’un SPT au moins 3 à 6 mois après le diagnostic de la TVP fémoro-iliaque ou poplitéo-fémorale et ensuite selon un calendrier personnalisé en fonction de la présence ou de l’absence de SPT cliniquement pertinent à ces instants*3.
Il n'y a pas de limite de temps recommandée pour diagnostiquer le SPT et des études ont suivi des patients pendant deux 2 ans ou bien plus. Les symptômes et les signes de la phase aiguë peuvent nécessiter du temps pour s'atténuer. En conséquence, le diagnostic de SPT doit être différé jusqu'à 3 à 6 mois. Par la suite, le rythme de surveillance est aussi lié à la gravité du SPT et aux facteurs de risque et aux caractéristiques des patients (extension initiale de la TVP, IMC, mode de vie, …).
Gestion en phase aigüe.
1-Chaussettes ou bas de compression ou Bandes élastiques sont appropriés pour soulager les symptômes et signes que la TVP soit fémoro-iliaque, poplitée ou distale.
La CC réduit douleur et grosse jambe des TVP proximales ou distales. En cas de grosse jambe prononcée, le bandage est plus approprié dans les premiers jours. Après réduction de la grosse jambe une CC par chaussette ou bas peut être utilisée ; la taille du dispositif est jugé sur le membre controlatéral de manière à éviter qu’il ne devienne trop large après réduction de l’œdème.
2-La thrombolyse dirigée par cathéter, avec ou sans thrombectomie mécanique, est appropriée pour les patients avec obstruction fémoro-iliaque sévèrement symptomatique et à faible risque de saignement.
La thrombolyse dirigée par cathéter est appropriée en particulier chez les sujets jeunes dans le cadre d’un syndrome de compression iliaque. L’étude CaVent montre une réduction significative de l’incidence du SPT à long terme, mais avec un risque accru de saignement.
Prévention.
1- Les bas-cuisse de CC 30-40 mmHg à la cheville sont appropriés pour la prévention du SPT après TVP fémoro-iliaque.
Les études sur l’utilisation de la CC pour la prévention du SPT ont donné des résultats contradictoires. Une méta-analyse Cochrane a conclu que l’utilisation de la CC entraine une réduction cliniquement significative bien que statistiquement non-significative (?) de l’incidence du SPT mais sans réduction de l’incidence de SPT sévère et sans différence claire sur la récidive de MTEV.
Des études ont montré que la chaussette est plus confortable et plus facile à poser que le bas. Le bas est préférable pour les 6 à 12 premiers mois, une chaussette peut être portée ensuite. Un choix personnalisé peut être envisagé en fonction de l’extension de la TVP, de la symptomatologie initiale et du développement du SPT.
2-Les chaussettes de CC 30-40 mmHg à la cheville sont appropriées pour la prévention du SPT après TVP poplitée*4.
Les chaussettes sont plus confortables et elles accroissent la compliance du patient.
L’information correcte et l’ajustement des conseils donnés au patient sont primordiaux pour sa compliance au traitement. Une réduction du degré de compression*5, temporaire ou définitive, peut être envisagée pour améliorer la compliance. Les TVP du mollet ne nécessitent pas de CC en prévention du SPT sauf si elles sont symptomatiques*4.
3- La CC est appropriée pour une durée variable avec la sévérité du SPT évaluée périodiquement.
La durée d’utilisation de la CC doit être individualisée en fonction de la sévérité du SPT telle qu’elle est jugée au fil du temps *6. Un bas cuisse peut être utilisé chez certains patients (en cas de TVP extensive fémoro-iliaque, induration cutanée, lymphoédème secondaire ou phlébolymphoédème).
Traitement.
1-Les bas-cuisse de CC 30-40 mmHg à la cheville sont appropriés pour le traitement du SPT après TVP fémoro-iliaque.
2-Les chaussettes de CC 30-40 mmHg à la cheville sont appropriées pour le traitement du SPT après TVP poplitée.
3-Le traitement compressif est approprié pour le traitement des ulcères veineux
Le traitement compressif des ulcères post-thrombotiques et les différents types de dispositifs utilisables, est un vaste sujet à discuter à part.
4-L’exercice physique est approprié pour le traitement du SPT.
L’exercice physique comme la marche est évalué dans un petit nombre d’études, comme l’adaptation du style de vie et la réduction pondérale en cas d’obésité.
5-Le rôle du traitement endovasculaire (angioplastie et/ou stenting sus-inguinal) est de bénéfice incertain dans le traitement du SPT sévère. Il ne peut être envisagé qu’en cas de sténose ou occlusion sus-inguinale sans reflux veineux profond marqué associé.
6-Un traitement anticoagulant oral est approprié après traitement endovasculaire avec stenting.
Toutefois le type et la durée optimale de ce traitement sont encore l’objet de débat.
Discussion.
Ce document de consensus fournit un cadre pour le clinicien de terrain. Toutefois l'évaluation méthodologique des études existantes sur le SPT a classé la plupart d'entre elles en qualité faible ou très faible et de nombreuses incertitudes demeurent concernant le diagnostic, la prévention et le traitement du SPT.
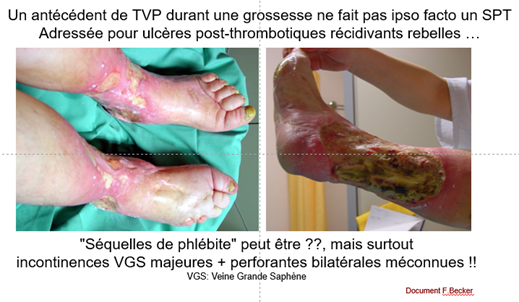
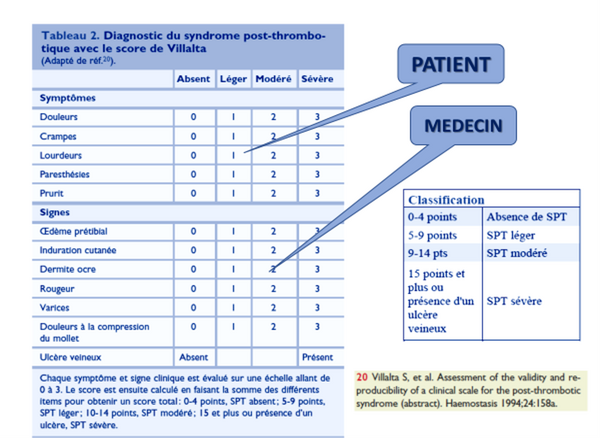
Le diagnostic du SPT lui-même doit être réévalué car des études récentes remettent en questions le score de Villalta (SV)*7 pourtant validé en externe et approuvé par des sociétés savantes. Ses principales limitations sont -le caractère subjectif ou d’interprétation plus ou moins subjective de ses composants, -le fait que tous ses items peuvent être aussi le fait d’une IVC par insuffisance veineuse superficielle ou d’un reflux primaire sans rapport avec une TVP, le manque de précision quant à l’item ulcère. La prévalence de l’IVC essentielle étant plus élevée que celle de la TVP dans la population générale, une proportion significative de patients-TVP a une IVC primaire préexistante qui peut aggraver la symptomatologie du SPT et conduire à une surestimation de sa sévérité au cours du suivi. Le SV a le potentiel de classer à tort ou de surestimer une maladie veineuse préexistante en tant que SPT (Strijkers RH, Phlebology 2012). Une étude a conclu que les plaintes courantes des patients et l'impact du SPT ne sont pas bien reflétés dans le SV (Engeseth M., JTH 2019), une autre a montré que le SV a classé à tort les personnes atteintes d'IVC primaire et d'antécédents de TVP comme ayant un SPT dans 42% des cas (Ning J., JVS VLD 2020). Cependant, l'IVC n’est pas ou ne peut pas être correctement évaluée au moment du diagnostic de TVP bien que l'examen du membre controlatéral puisse aider, il n'y a pas de méthode formelle pour tenir compte de l'insuffisance veineuse préexistante dans le score de Villalta. L’association SV plus CEAP révisé pourrait être étudiée pour intégrer une insuffisance veineuse antérieure*8.
Le timing de surveillance d’un SPT n’est pas non plus bien codifié. En règle générale, dans les études un SPT était évalué tous les 6 mois après le diagnostic et sur 2 ans. L’évaluation a 1 mois après le diagnostic de TVP est trop précoce car on peut être encore dans la séméiologie de la TVP ; une étude a toutefois montré que la persistance des symptômes à 1 mois de la TVP était associée à un plus haut risque de SPT.
Une autre option est le développement de score de prédiction qui peut aider à identifier, dès le moment de la TVP, les patients à plus haut risque de survenue d’un PTS comme le SOX-PTS score qui combine le BMI (IMC), le degré d’extension de la TVP et le score de Villalta initial. Les données de l’exploration écho-Doppler pourraient aussi être utilisées mais -les données ED peuvent ne pas correspondre à la sévérité du SPT, -la Society of Vascular Medicine s’est prononcée contre la répétition des examens ED en l’absence de dégradation clinique, -les modalités de l’examen ED pour évaluer recanalisation et reflux veineux ont besoin d’être standardisées.*9
La surveillance des patients en télémedecine est aussi discutée.
Une minorité de la totalité des patients avec TVP fémoro-iliaque a été enrôlée dans les études de prévention du SPT par thrombectomie pharmacomécanique (< 2.5% de la population incluable). Les études ATTRACT, CaVenT, CAVA n’ont pas montré de résultats probants notamment au plan du bénéfice clinique. Il y a encore beaucoup d’hétérogénéité dans la sélection des patients, le délai d’intervention, les méthodes utilisées, les matériaux utilisés, les indications de stenting, traitement antithrombotique optimal post-stenting …, c’est un sujet encore en évolution, en recherche de preuves d’efficacité clinique.
Le rôle des AOD dans la prévention du SPT émerge dans des études récentes et des analyses post-hoc évaluant le SPT dans des essais de traitement de la TVP avec AOD vs AVK (Palareti G. et al 2020)*10. Malgré des limites, dans les études sur les AOD, plus de 60-70 % des patients étaient exempts de SPT et des manifestations sévères telles qu'un ulcère cutané n'ont été observées que dans une minorité (<5 à 6%) des patients après un suivi moyen de 30 mois. Ces taux de SPT à long terme sont similaires à ceux des études dans lesquelles un traitement thrombolytique a été utilisé et sont peut-être liés à une activité anticoagulante moins variable dans la phase aiguë de la TVP, favorisant ainsi la recanalisation veineuse.
Conclusion.
Le SPT est la complication à long terme la plus courante de la TVP. Une surveillance régulière et une prise en charge médicale conservatrice avec anticoagulation standard et chaussettes/bas de compression graduée sont indiqués pour la prévention du SPT chez la majorité des patients. Une approche interventionnelles, endovasculaire, pour la prévention et le traitement du SPT ne repose que sur des preuves limitées et ne doit être envisagée que dans des cas particuliers.
Les propos de ce « position paper » reflètent l'opinion consensuelle d’experts vasculaires basée sur des preuves de faible qualité dans la plupart des cas.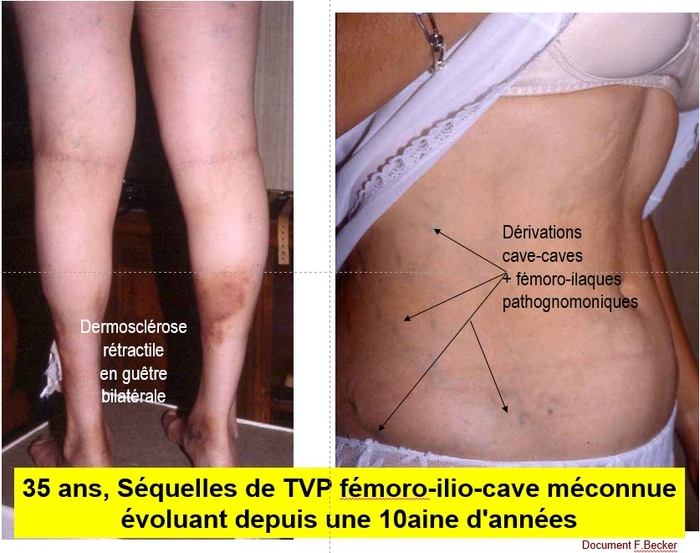
Notes F.Becker.
*1. Présentation schématique.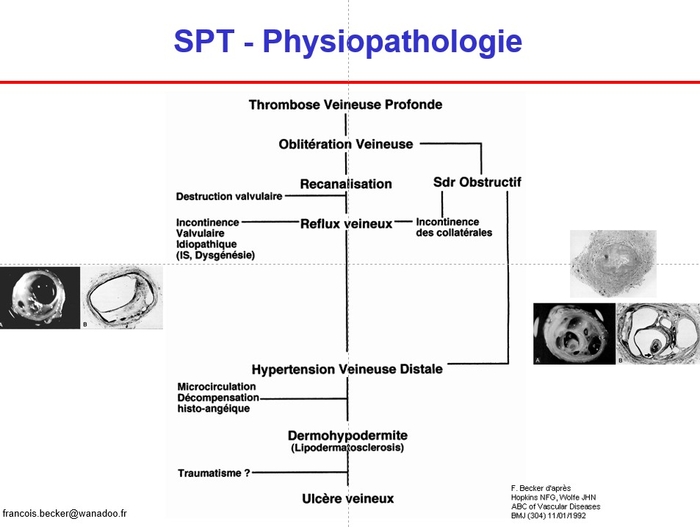
-- Le thrombus veineux n’est pas nécessairement obstructif au sens hydraulique du terme (entrave à l’écoulement). Outre le fait que le thrombus peut être mobile, l’occlusion thrombotique d’un segment veineux peut n’être que très temporairement obstructive si le segment thrombosé a un fort potentiel de suppléance (cas le plus fréquent : TVP distale isolée, TVP distale étendue à l’axe poplitéo-fémorale, TVP fémorale isolée, voire TVP iliaque commune isolée). A l’inverse la thrombose d’une confluence (thrombose isolée de l’axe poplité, thrombose de la veine fémorale commune ± veine iliaque externe) engendrera une obstruction qui peut passer à la chronicité.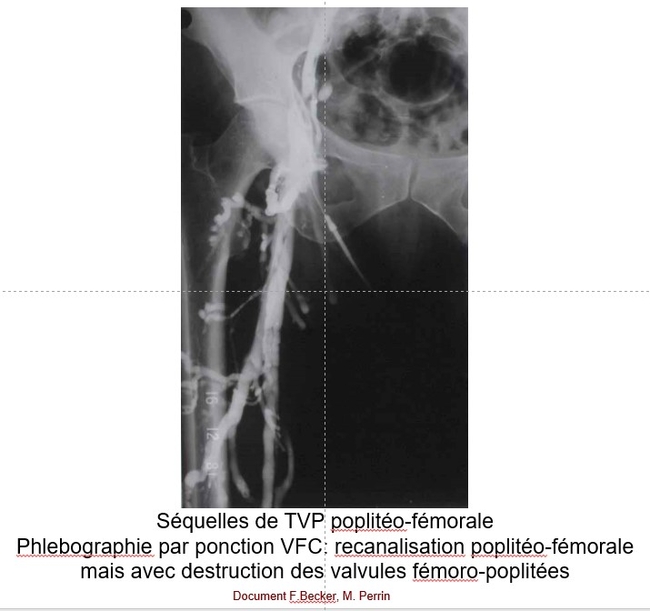
-- Le reflux veineux procède de deux mécanismes. Une obstruction segmentaire proximale isolée, surtout si elle devient chronique mettra sous tension les valvules veineuses en amont de la thrombose et les conduira à perdre leur fonction anti-reflux (floppy valve). Plus fréquemment les valvules sont détruites avec la résorption du thrombus et l’inflammation pariétale rétractile : plus la thrombose intéresse de valvules, plus la résorption du thrombus sera lente plus il y aura de valvules détruites. Les valvules sont très nombreuses mais peu puissantes au niveau jambier, plus espacées mais puissantes au niveau poplitéo-fémorale ; la valvule la plus puissante est la valvule fémoro-iliaque ; l’axe iliaque n’est pas valvulé. Le reflux veineux s’auto-aggrave en engendrant la dégradation des valvules saines d’amont.
-- Le terrain veineux et l’activité physique du patient interfèrent, une insuffisance veineuse pré-existante ou la sédentarité du patient aggravent la symptomatologie.
*2. La phrase est sévère. Il faut remettre tout cela dans le contexte historique.
L’histoire des séquelles de TVP nait avec la publication de Gunnar Bauer portant sur 300 séquelles de phlegmasia alba dolens dans Acta Chirurgica Scandinavia en 1942. Au moins 4 points sont à prendre en considération ; à l’époque : 1-la TVP c’était essentiellement la phlegmasia alba dolens, la TVP a- ou paucisymptomatique était inconnue, 2-on était surtout préoccupé par les troubles trophiques veineux secondaires, difficiles à traiter (et restant actuellement encore difficiles à traiter), pour lesquels on n’avait pas d’autre traitement que la compression, 3-Bauer a utilisé le terme maladie post-thrombotique (impliquant une évolution dans le temps de l’asymptomatique à l’ulcère) et non syndrome post-thrombotique (ensemble de symptômes et signes à un moment donné), 4-le traitement héparinique était balbutiant et Bauer souligna que son introduction allait probablement tout changer.
On ne s’est intéressé au syndrome post-thrombotique que bien plus tard avec le suivi des patients inclus dans les essais sur les anticoagulants mais faire des essais thérapeutiques pour prévenir ces séquelles de TVP posaient au moins 5 problèmes : 1-le temps d’apparition des ulcères est long (2-3 ans à 10-15 ans) ce qui implique un taux de perdus de vue important (d’autant qu’il faut ajouter la léthalité liée à la MTEV), 2-le terme de syndrome post-thrombotique apparu insidieusement brouille les cartes car il ne repose sur aucune définition précise et les scores développés pour les études ne sont pas spécifiques, 3-l’objectif a surtout été de valider ou de critiquer la compression dans des séries contrôlées mais la chaussette de compression placebo est très discutable (il faut bien une certaine pression pour qu’elle tienne et donne l’impression de comprimer ; « en off » les ingénieurs textiles disent que la chaussette placebo n’existe pas), il est logique que la plupart des études aient été menées sans groupe contrôle avec une chaussette placebo, 4-on ne sait pas bien d’où vient le dogme des 30-40 voire 50 mmHg à la cheville pour la CC, peut être que l’on a appliqué la force de CC pour le traitement de l’ulcère à sa prévention, 5- imposer un traitement contraignant en prévention pose le problème de la compliance du patient et implique que l’information du patient devrait être prise en compte dans les résultats.
Il faut aussi reconnaitre que la méthodologique des essais cliniques a considérablement évolué et que l’on pourrait tenir ce propos pour de nombreux secteurs de la médecine et de la chirurgie.
*3. Juger d’un SPT à quelques semaines d’une TVP est un non-sens, le problème n’est pas dans les symptômes et signes mineurs d’IVC mais dans le développement d’ulcère post-thrombotique dont l’incidence est croissante sur des années de manière exponentielle comme le montre très bien l’étude DURAC (Schulman, JTH 2006).
*4. On ne dit pas s’il s’agit de TVP poplitée isolée ou de TVP jambière(s) à extension poplitée. Il est regrettable que les TVP distales ne soient pas discutées dans ce document, n’oublions que les veines les veines jambières sont très richement valvulées, que le reflux des veines Ti.Post. voire Fib. et des perforantes distales joue un rôle majeur dans la genèse des ulcères. Que l’on néglige les TVP distales segmentaires se conçoit, mais que l’on néglige les TVP jambières multiples étendues est très discutable.
Même asymptomatique les reflux profonds jambiers sont importants à connaitre, il suffit quelques fois d’un coup sur la région sus-malléolaire pour passer en quelques jours d’asymptomatique à symptomatique …
*5. Depuis la rédaction de ce « position paper », les résultats de l’étude CELEST ont été publiés. Cette étude française montre les chaussettes de compression dégressive délivrant 25 mmHg à la cheville ne sont pas inférieures aux chaussettes 35 mmHg.
*6. Il est regrettable que l’étude Ideal DVT (Lancet Haematol 2018) n’ait pas été discutée ici. Elle montre que, au-delà de 6 mois post-TVP, un suivi régulier avec une durée de CC adaptée à la symptomatologie (poursuite, arrêt, reprise en fonction) est aussi efficace que la même compression portée à titre systématique durant 2 ans (chaussette 30-40 mmHg à la cheville tricotée sur métier à plat donc assez rigides). A noter un niveau d’information et d’éducation important permettant d’obtenir une adhérence au traitement très élevée (93% à 6 mois, 78% à 2 ans).
*7. Le score de Villata me laisse perplexe. D’accord on n’en a pas d’autre mais quand même ! Le poids des symptômes, par définition subjectifs, est important. La description des critères objectifs est plus que sommaire et la corona phlebectatica n’y figure pas, les troubles trophiques se limitent à l’induration cutanée (dermohypodermite, lipodermatosclérose). L’ulcère veineux ouvert a été rajouté par la suite, il ne figurait pas dans la description initiale. L’ulcère cicatrisé et l’ulcère récidivant n’y figurent toujours pas. Enfin, énorme oubli, la claudication veineuse n’y figure pas non plus (plus que regrettable quand on va aborder les gestes endovasculaires …). Le score de Ginsberg est encore plus succinct (Symptômes fonctionnels + œdème).
Le score de Brandjes qui a été développé pour l’une des études considérées de médiocre qualité (Lancet 1997) était autrement plus complet …
Par ailleurs il faut rappeler que ces scores ne sont pas spécifiques du SPT (hors peut être la grosse jambe et la claudication veineuse) mais reflètent seulement une insuffisance veineuse quelle qu’en soit la nature.
*8. Surpris qu’un truc simple n’ait pas été discuté à l’ère du smartphone. On prend des photos pour un oui un non, je trouve très pratique de prendre une photo de référence des faces médiales de cheville en position Charlot debout à la phase initiale de TVP et à chaque consultation et de suivre ainsi le développement de signes cutanés objectifs d’IVC. Dans le cadre d’étude on pourrait utiliser des outils de numérisation qui ont été développées.
*9. La qualité et le degré d’information des examens ED de suivi laisse effectivement parfois pantois. Il est urgent de normaliser les examens de suivi en exigeant un minimum de paramètres morphologiquement et hémodynamiquement déterminants. Il est par exemple navrant que l’existence ou non d’un reflux profond dans la gouttière tibiale postérieure (veines Ti.Post + perforantes) soient rarement mentionné alors que c’est un facteur clef du développement d’un ulcère.
Depuis la rédaction de ce document quelques articles sont parus mentionnant l’intérêt de prendre en compte quelques items ED simples dans l’évaluation du risque de SPT, comme l’existence d’un thrombus résiduel ou d’un reflux en poplité (Prandoni, Haematologica 2022).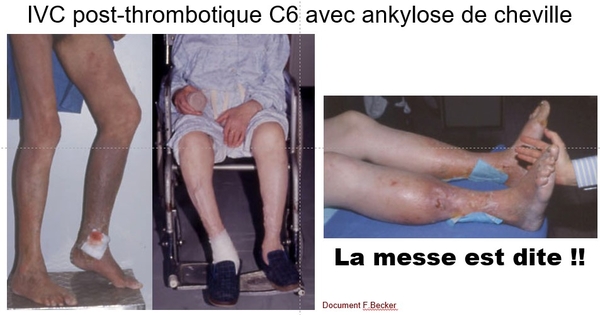
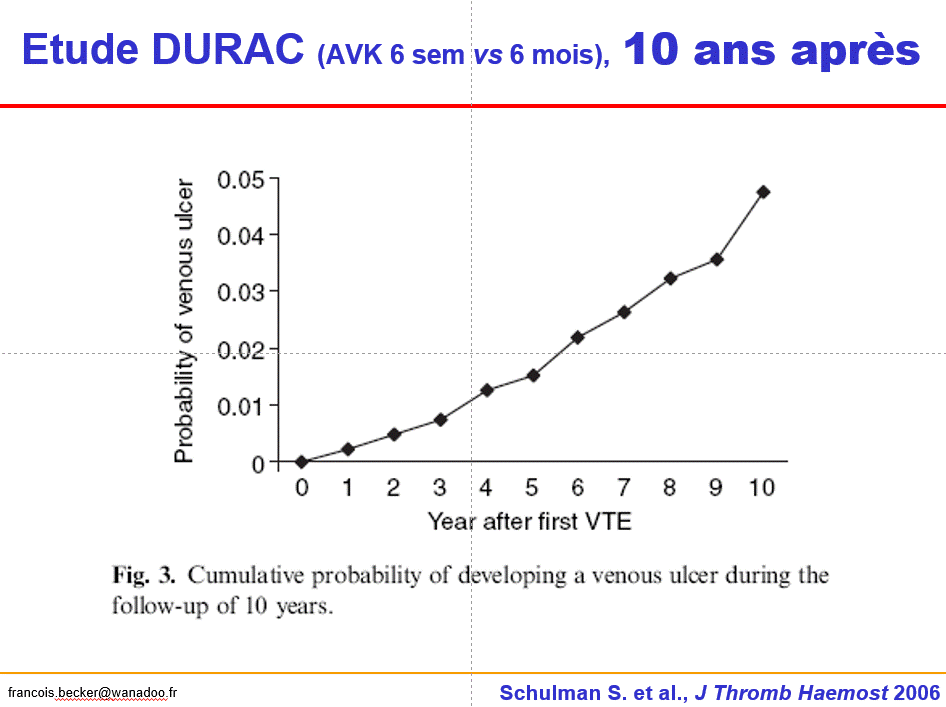
*10. Pour boucler la boucle, il est important de rappeler que l’impact du traitement anticoagulant initial avait été mentionné par G. Bauer qui soulignait que le traitement héparinique initial allait changer la donne. Outre la qualité du traitement anticoagulant initial, il est maintenant possible que les AODs fassent mieux que les AVK pour la résolution du thrombus et donc la prévention du SPT.
F. Becker 17/04/22