“Le progrès nait de la diversité des cultures et de l'affirmation des personnalités.” Pierre Joliot
"La liberté de la presse est entière ; il suffit d'avoir les milliards nécessaires." Alfred Sauvy
"Si vous ne lisez pas le journal, vous êtes mal informé. Si vous lisez le journal, vous êtes mal informé." Mark Twain
ARTICLE 1
Outcomes and Readmission in Patients With Retinal Artery Occlusion (from the Nationwide Readmission Database)
Résultats et réadmission chez les patients présentant une occlusion de l' artère rétinienne (à partir de la base de données nationale sur la réadmission )
Kunal Suri, MDa, Monil Majmundar, MDb, Ashish Kumar, MDc, Kunal N. Patel, MD, MPHd, Xioa Yi Zhou, MDa, Harshvardhan Zala, MDe, and Ankur Kalra, MDfAm J Cardiol 2022;183:105−108
L' occlusion de l' artère rétinienne (RAO) est une urgence ophtalmologique, entraînant une perte de vision soudaine. La compréhension de ses facteurs de risque et la collecte d'informations sur l'incidence des événements indésirables peuvent fournir des informations utiles sur l'évaluation rentable des patients et la prévention secondaire.
Dans cette étude de cohorte rétrospective, nous avons utilisé la base de données nationale sur les réadmissions de 2016 à 2018 et interrogé la base de données pour identifier les patients atteints de RAO.
Les résultats cliniques étaient l'incidence cumulée d'infarctus du myocarde (IM), d'accident vasculaire cérébral, de décès (à l'hôpital et 6 mois après la sortie), l'utilisation des ressources, la réadmission toutes causes confondues à 6 mois et motifs de réadmission toutes causes confondues .
Nous avons identifié un total de 14 527 patients atteints de RAO. L'âge moyen des patients avec RAO était de 69 ± 13 ans. L'hypertension (11 839, 82 %), l'hyperlipidémie (8 868, 61 %), la cardiomyopathie ischémique (4 826, 33 %), le tabagisme (4 772, 33 %) et le diabète (4 588, 32 %) étaient des comorbidités courantes chez les patients atteints d'ORA . Sur 14 527 patients atteints de RAO, 308 patients (2,1 %) sont décédés, 1 577 (10,9 %) ont développé un AVC et 615 (4,2 %) ont développé un IM dans les 6 mois. Au total, 2 841 patients (24,9 %) ont été réadmis dans les 6 mois suivant leur sortie. La sténose de l'artère carotide (386 ; 10,8 %) était la cause la plus fréquente deréadmission . Les antécédents d'accident vasculaire cérébral ou d'accident ischémique transitoire et l'indice de comorbidité d'Elixhauser ≥ 3 étaient des facteurs prédictifs d'accident vasculaire cérébral. Le sexe féminin, la cardiomyopathie ischémique, la maladie de l' artère carotide , l'insuffisance cardiaque, la maladie rénale chronique et le cancer étaient des facteurs prédictifs d'IM. Le cancer, l'insuffisance rénale chronique, l'indice de comorbidité d'Elixhauser ≥ 3, le statut de payeur Medicare/Medicaid, l'admission index non élective, la fibrillation auriculaire et la maladie de l' artère carotide étaient des facteurs prédictifs de réadmission toutes causes confondues à 6 mois .
En conclusion, les patients atteints de RAO ont un risque important de comorbidités, de décès, d'AVC, d'IM et de réadmission. Le RAO peut être utilisé comme marqueur clinique d'un futur AVC et IM, et devrait déclencher le dépistage des événements ischémiques vasculaires aigus
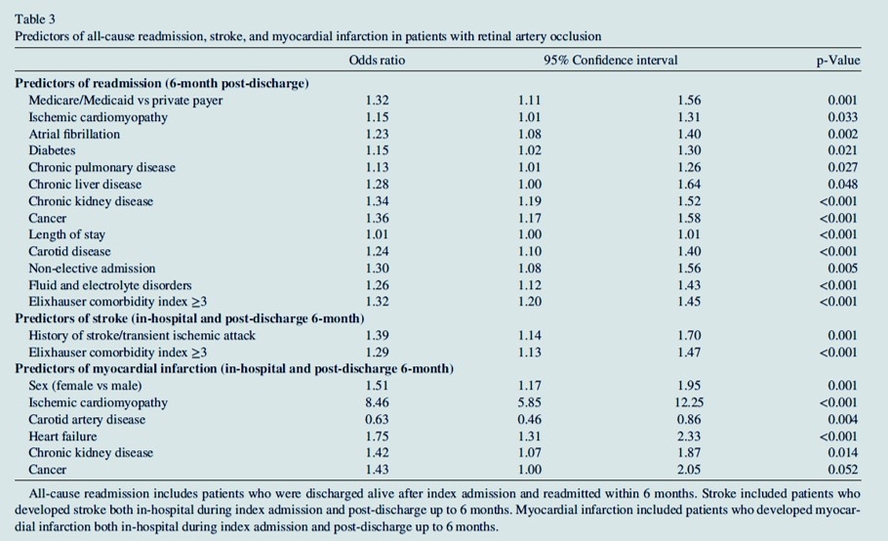
L' occlusion de l' artère rétinienne (RAO), un marqueur clinique majeur du risque d'infactus,d'AVC et de décés. En cas de RAO ré évaluation du risque CV, et des conséquences sur le traitement médical et de la correction des FDRCV.
ARTICLE 2
What Went Wrong with VEGF-A in Peripheral Arterial Disease? A Systematic Review and
Biological Insights on Future Therapeutics
Dans cette étude de cohorte rétrospective, nous avons utilisé la base de données nationale sur les réadmissions de 2016 à 2018 et interrogé la base de données pour identifier les patients atteints de RAO.
Les résultats cliniques étaient l'incidence cumulée d'infarctus du myocarde (IM), d'accident vasculaire cérébral, de décès (à l'hôpital et 6 mois après la sortie), l'utilisation des ressources, la réadmission toutes causes confondues à 6 mois et motifs de réadmission toutes causes confondues .
Nous avons identifié un total de 14 527 patients atteints de RAO. L'âge moyen des patients avec RAO était de 69 ± 13 ans. L'hypertension (11 839, 82 %), l'hyperlipidémie (8 868, 61 %), la cardiomyopathie ischémique (4 826, 33 %), le tabagisme (4 772, 33 %) et le diabète (4 588, 32 %) étaient des comorbidités courantes chez les patients atteints d'ORA . Sur 14 527 patients atteints de RAO, 308 patients (2,1 %) sont décédés, 1 577 (10,9 %) ont développé un AVC et 615 (4,2 %) ont développé un IM dans les 6 mois. Au total, 2 841 patients (24,9 %) ont été réadmis dans les 6 mois suivant leur sortie. La sténose de l'artère carotide (386 ; 10,8 %) était la cause la plus fréquente deréadmission . Les antécédents d'accident vasculaire cérébral ou d'accident ischémique transitoire et l'indice de comorbidité d'Elixhauser ≥ 3 étaient des facteurs prédictifs d'accident vasculaire cérébral. Le sexe féminin, la cardiomyopathie ischémique, la maladie de l' artère carotide , l'insuffisance cardiaque, la maladie rénale chronique et le cancer étaient des facteurs prédictifs d'IM. Le cancer, l'insuffisance rénale chronique, l'indice de comorbidité d'Elixhauser ≥ 3, le statut de payeur Medicare/Medicaid, l'admission index non élective, la fibrillation auriculaire et la maladie de l' artère carotide étaient des facteurs prédictifs de réadmission toutes causes confondues à 6 mois .
En conclusion, les patients atteints de RAO ont un risque important de comorbidités, de décès, d'AVC, d'IM et de réadmission. Le RAO peut être utilisé comme marqueur clinique d'un futur AVC et IM, et devrait déclencher le dépistage des événements ischémiques vasculaires aigus

L' occlusion de l' artère rétinienne (RAO), un marqueur clinique majeur du risque d'infactus,d'AVC et de décés. En cas de RAO ré évaluation du risque CV, et des conséquences sur le traitement médical et de la correction des FDRCV.
ARTICLE 2
What Went Wrong with VEGF-A in Peripheral Arterial Disease? A Systematic Review and
Biological Insights on Future Therapeutics
Qu'est-ce qui a mal tourné avec le VEGF-A dans la maladie artérielle périphérique ? Une revue systématique et des aperçus biologiques sur les thérapies futures
Stavroula L. Kastora , Jonathan Eley, Martin Gannon , Ross Melvin, Euan Munro Sotirios A. Makris
Journal of Vascular Research 2022, 15 Novembre
https://www.karger.com/Article/Pdf/527079
Article libre d'accés
Contexte :
Sur les 200 millions de patients dans le monde touchés par la maladie artérielle périphérique (MAP), 4 % nécessiteront inévitablement une amputation majeure d'un membre. Les revues systématiques précédentes ont présenté un ensemble de preuves contradictoires en termes d'effets des membres de la famille du facteur de croissance endothélial vasculaire (VEGF) sur la progression naturelle de la MAP. Malgré cela, la modulation des mécanismes intrinsèques de l'angiogenèse ciblant les membres de la famille VEGF confère toujours une cible thérapeutique attractive.
Le but de la présente étude était d'évaluer les preuves actuelles de la modulation du VEGF dans le contexte de la PAD.
Méthodes
Il s'agit d'une revue systématique de la littérature réalisée selon les directives PRISMA et enregistrée dans la base de données PROSPERO [CRD42021285988]. Une recherche documentaire indépendante a été effectuée jusqu'au 1er avril 2022 dans six bases de données. Un total de 22 études éligibles ont été identifiées [N : 3, études interventionnelles de patients ; N : 19, études animales]. Les études animales ont été évaluées par l'outil de risque de biais SYRCLE, tandis que les études sur les participants humains ont été évaluées par l'échelle Newcastle Ottawa. Dans l'ensemble, la qualité des preuves a été jugée acceptable pour les études animales et humaines. Les principaux résultats de l'étude étaient la variation en pourcentage de la sténose de la lumière du vaisseau lésé et de la formation de la zone néointimale lors de la modulation du VEGF (inhibition ou activation) par rapport au groupe témoin.
Résultats
Dix-neuf modèles animaux et trois études sur des participants humains ont été inclus dans l'examen systématique et évalués séparément. La modulation positive du VEGF-A dans les modèles animaux a entraîné une diminution médiane de 65,58 % [IC à 95 % 45,2 ; 71,87] dans la sténose de la lumière [14 études]. En outre, une modulation positive du VEGF-A s'est avérée réduire la prolifération de la zone néointimale par une diminution médiane de 63,41 % [IC à 95 % 41,6 ; 79,59] [14 études]. La durée médiane à la fin de l'étude était de 28 jours [intervalle : 14–84 jours]. Les données étaient insuffisantes pour évaluer ces résultats en ce qui concerne la modulation du VEGF-B ou du VEGF-C. Le nombre limité d'études humaines disponibles a présenté une évaluation des résultats inadéquate malgré leur classement global NOS correct.
Interprétation:
La modulation positive au VEGF-A diminue la sténose de la lumière et l'hyperplasie néointimale dans les modèles animaux de simulation PAD. La variabilité précédemment identifiée parmi les résultats s'est avérée fortement liée à la variabilité des conceptions expérimentales. L'applicabilité clinique et le profil d'innocuité du VEGF-A dans le contexte de la MAP restent à définir par un ensemble robuste et uniformément conçu d'autres expériences basées sur des modèles animaux
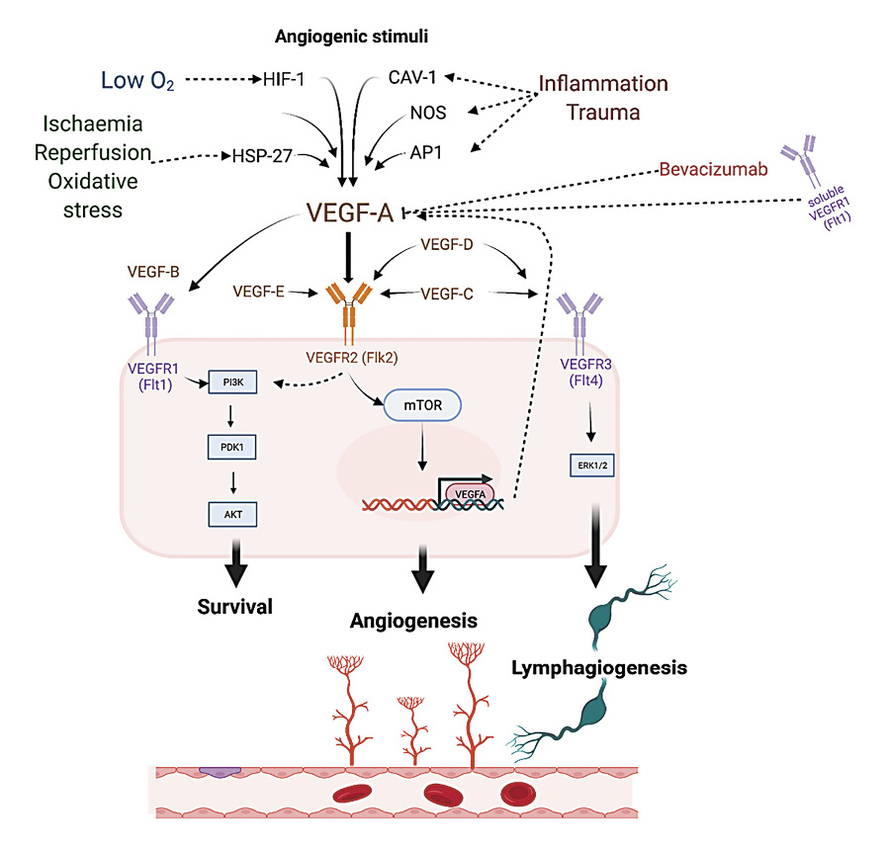
Stimuli angiogéniques tels que l'hypoxie par le facteur 1 inductible par l'hypoxie (HIF-1); ischémie de reperfusion et stress oxydatif par la protéine de choc thermique 27 (HSP27); un traumatisme tissulaire et une inflammation par la protéine activatrice 1 (AP-1), la cavéoline-1 (Cav-1) ou l'oxyde nitrique synthase (NOS) favorisent l'activation du VEGF-A. Le bevacizumab et le VEGFR1 soluble exercent des effets inhibiteurs sur le VEGF-A .La liaison du VEGF-A au VEGFR2 active les cascades proangiogéniques en aval . Le VEGF-B est le principal substrat du VEGFR-1 lié à la membrane, dont l'activation conduit à la promotion de la survie cellulaire via la voie de transformation de la souche phosphatidylinositol 3-kinase/Ak (PI3K/AKT) avec peu d'effet sur l'angiogenèse [ 68 , 69 ]. Le VEGF-C et le VEGF-D sont des substrats primaires du récepteur VEGFR3, dont l'activation conduit à la promotion lymphangiogénique via la voie des kinases régulées par le signal extracellulaire 1 et 2 (ERK1/2). L'activation croisée des récepteurs du VEGF est possible par plusieurs membres de la famille du VEGF avec des effets variables encore à élucider .
Le facteur de croissance endothélial vasculaire (VEGF) a un impact sur la progression naturelle de la MAP. Malgré cela, la modulation des mécanismes intrinsèques de l'angiogenèse ciblant les membres de la famille VEGF confère toujours une cible thérapeutique attractive. Article prospectif pour le futur, un future proche ou éloigné , il faut passer de l'animal à l'homme maintenant.
ARTICLE 3
Saeed K, Áinle FN. Standardizing definitions for bleeding events in studies including pregnant women: A call to action. Res Pract Thromb Haemost. 2022 Oct 25;6(7):e12822. doi: 10.1002/rth2.12822. PMID: 36313985; PMCID: PMC9596607.
Normaliser les définitions des événements hémorragiques dans les études incluant des femmes enceintes : un appel à l'action
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9596607/
Contexte :
Sur les 200 millions de patients dans le monde touchés par la maladie artérielle périphérique (MAP), 4 % nécessiteront inévitablement une amputation majeure d'un membre. Les revues systématiques précédentes ont présenté un ensemble de preuves contradictoires en termes d'effets des membres de la famille du facteur de croissance endothélial vasculaire (VEGF) sur la progression naturelle de la MAP. Malgré cela, la modulation des mécanismes intrinsèques de l'angiogenèse ciblant les membres de la famille VEGF confère toujours une cible thérapeutique attractive.
Le but de la présente étude était d'évaluer les preuves actuelles de la modulation du VEGF dans le contexte de la PAD.
Méthodes
Il s'agit d'une revue systématique de la littérature réalisée selon les directives PRISMA et enregistrée dans la base de données PROSPERO [CRD42021285988]. Une recherche documentaire indépendante a été effectuée jusqu'au 1er avril 2022 dans six bases de données. Un total de 22 études éligibles ont été identifiées [N : 3, études interventionnelles de patients ; N : 19, études animales]. Les études animales ont été évaluées par l'outil de risque de biais SYRCLE, tandis que les études sur les participants humains ont été évaluées par l'échelle Newcastle Ottawa. Dans l'ensemble, la qualité des preuves a été jugée acceptable pour les études animales et humaines. Les principaux résultats de l'étude étaient la variation en pourcentage de la sténose de la lumière du vaisseau lésé et de la formation de la zone néointimale lors de la modulation du VEGF (inhibition ou activation) par rapport au groupe témoin.
Résultats
Dix-neuf modèles animaux et trois études sur des participants humains ont été inclus dans l'examen systématique et évalués séparément. La modulation positive du VEGF-A dans les modèles animaux a entraîné une diminution médiane de 65,58 % [IC à 95 % 45,2 ; 71,87] dans la sténose de la lumière [14 études]. En outre, une modulation positive du VEGF-A s'est avérée réduire la prolifération de la zone néointimale par une diminution médiane de 63,41 % [IC à 95 % 41,6 ; 79,59] [14 études]. La durée médiane à la fin de l'étude était de 28 jours [intervalle : 14–84 jours]. Les données étaient insuffisantes pour évaluer ces résultats en ce qui concerne la modulation du VEGF-B ou du VEGF-C. Le nombre limité d'études humaines disponibles a présenté une évaluation des résultats inadéquate malgré leur classement global NOS correct.
Interprétation:
La modulation positive au VEGF-A diminue la sténose de la lumière et l'hyperplasie néointimale dans les modèles animaux de simulation PAD. La variabilité précédemment identifiée parmi les résultats s'est avérée fortement liée à la variabilité des conceptions expérimentales. L'applicabilité clinique et le profil d'innocuité du VEGF-A dans le contexte de la MAP restent à définir par un ensemble robuste et uniformément conçu d'autres expériences basées sur des modèles animaux

Stimuli angiogéniques tels que l'hypoxie par le facteur 1 inductible par l'hypoxie (HIF-1); ischémie de reperfusion et stress oxydatif par la protéine de choc thermique 27 (HSP27); un traumatisme tissulaire et une inflammation par la protéine activatrice 1 (AP-1), la cavéoline-1 (Cav-1) ou l'oxyde nitrique synthase (NOS) favorisent l'activation du VEGF-A. Le bevacizumab et le VEGFR1 soluble exercent des effets inhibiteurs sur le VEGF-A .La liaison du VEGF-A au VEGFR2 active les cascades proangiogéniques en aval . Le VEGF-B est le principal substrat du VEGFR-1 lié à la membrane, dont l'activation conduit à la promotion de la survie cellulaire via la voie de transformation de la souche phosphatidylinositol 3-kinase/Ak (PI3K/AKT) avec peu d'effet sur l'angiogenèse [ 68 , 69 ]. Le VEGF-C et le VEGF-D sont des substrats primaires du récepteur VEGFR3, dont l'activation conduit à la promotion lymphangiogénique via la voie des kinases régulées par le signal extracellulaire 1 et 2 (ERK1/2). L'activation croisée des récepteurs du VEGF est possible par plusieurs membres de la famille du VEGF avec des effets variables encore à élucider .
Le facteur de croissance endothélial vasculaire (VEGF) a un impact sur la progression naturelle de la MAP. Malgré cela, la modulation des mécanismes intrinsèques de l'angiogenèse ciblant les membres de la famille VEGF confère toujours une cible thérapeutique attractive. Article prospectif pour le futur, un future proche ou éloigné , il faut passer de l'animal à l'homme maintenant.
ARTICLE 3
Saeed K, Áinle FN. Standardizing definitions for bleeding events in studies including pregnant women: A call to action. Res Pract Thromb Haemost. 2022 Oct 25;6(7):e12822. doi: 10.1002/rth2.12822. PMID: 36313985; PMCID: PMC9596607.
Normaliser les définitions des événements hémorragiques dans les études incluant des femmes enceintes : un appel à l'action
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9596607/
Libre d'accés
Monard, C., Meersch-Dini, M. & Joannidis, M. When the kidneys hurt, the other organs suffer.
Quand les reins "souffrent ", les autres organes aussi
La thromboembolie veineuse (TEV) est l'une des principales causes de décès pendant la grossesse et pendant la période post-partum. L'héparine de bas poids moléculaire ajustée en fonction du poids (HBPM) est utilisée pour prévenir et traiter la TEV pendant la grossesse.
Les enjeux sont très importants : un décès maternel dû à une embolie pulmonaire (EP) est un événement dévastateur aux conséquences considérables pour la famille, les amis et la société de la femme. La TEV peut également imposer une invalidité à vie.
Le risque de TEV augmente pendant la grossesse et culmine pendant la période post‐partum, avec des taux d'incidence combinés rapportés de 1,2 (intervalle de confiance [IC] à 95 % : 1,0–1,4) et 4,2 (IC à 95 % : 2,4–7,6) pour 1 000 années-personnes au cours de la respectivement les périodes prénatale et post-partum. 2 Par conséquent, la prévention et le traitement optimaux de la TEV sont d'une importance cruciale.
Les enjeux sont très importants : un décès maternel dû à une embolie pulmonaire (EP) est un événement dévastateur aux conséquences considérables pour la famille, les amis et la société de la femme. La TEV peut également imposer une invalidité à vie.
Le risque de TEV augmente pendant la grossesse et culmine pendant la période post‐partum, avec des taux d'incidence combinés rapportés de 1,2 (intervalle de confiance [IC] à 95 % : 1,0–1,4) et 4,2 (IC à 95 % : 2,4–7,6) pour 1 000 années-personnes au cours de la respectivement les périodes prénatale et post-partum. 2 Par conséquent, la prévention et le traitement optimaux de la TEV sont d'une importance cruciale.
L'hémorragie du post-partum (HPP) est également l'une des principales causes de décès maternels dans le monde : dans une revue systématique de l'Organisation mondiale de la santé de 2014 analysant les estimations mondiales, régionales et sous-régionales des causes de décès maternels entre 2003 et 2009, les hémorragies représentaient 27,1 % (19,9 % –36,2 %) des décès maternels dans le monde.
L'anticoagulation administrée pour le traitement de la TEV est connue pour être associée à un risque hémorragique, qui peut être pertinent pendant la grossesse, pendant la période péripartum et post-partum.
Malgré ces risques concurrents élevés, l'effet précis de l'anticoagulation thérapeutique sur le risque de saignement pendant la grossesse est mal caractérisé
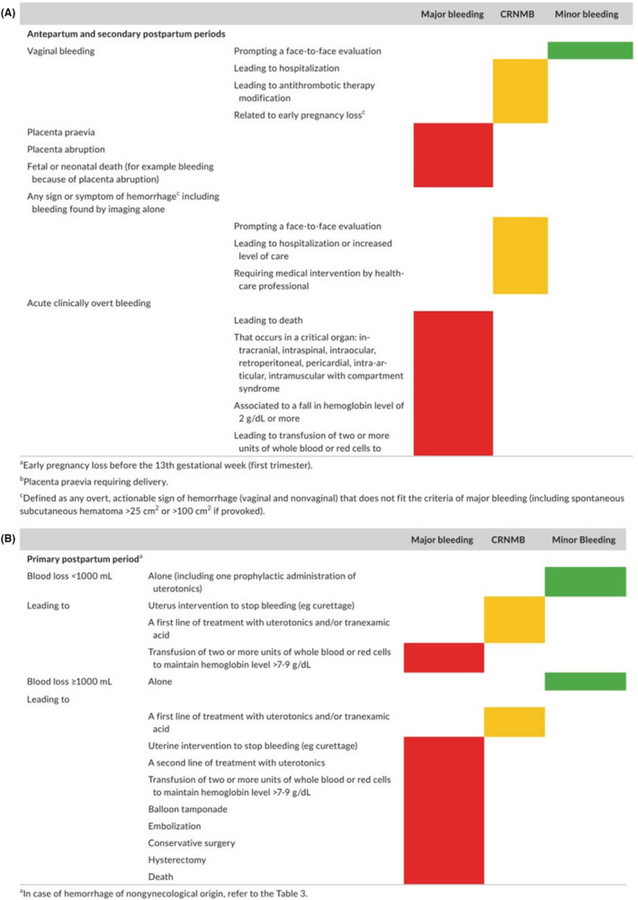
Définition proposée des événements hémorragiques dans les études évaluant le traitement antithrombotique chez les femmes enceintes de l'ISTH SSC sur le contrôle de l'anticoagulation (reproduit avec autorisation). Les couleurs correspondent aux critères sélectionnés pour chaque classe d'hémorragies : rouge pour les hémorragies majeures, orange pour les hémorragies non majeures cliniquement pertinentes et vert pour les hémorragies mineures, respectivement. (A) Classification proposée pour les périodes antepartum et postpartum secondaire (24 h à 6 semaines après l'accouchement). (B) Classification proposée pour la période post-partum primaire (premières 24 h de l'accouchement).
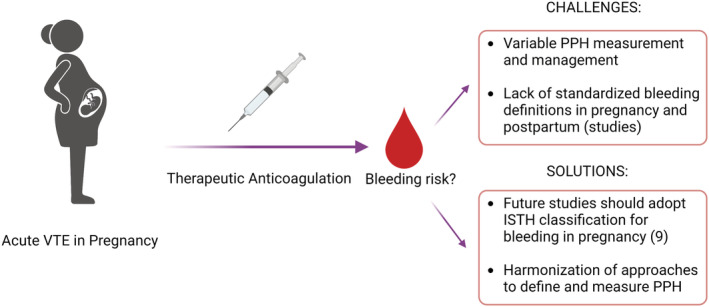
Les complications hémorragiques résultant de l'utilisation de l'anticoagulation thérapeutique pour la prise en charge de la TEV pendant la grossesse sont mal caractérisées. Les défis et les lacunes dans les connaissances qui contribuent à ce phénomène doivent être abordés, y compris l'absence d'une définition normalisée des événements hémorragiques dans les études incluant les femmes enceintes.
Les solutions incluent l'adoption de la classification ISTH pour les saignements pendant la grossesse et le post-partum dans les études futures.
Grossesse + anticoagulation = grossesse à risque HEMORRAGIQUE. Il est alors très important au moment de la prescription de l'anticoagulant d'évaluer ce risque.La classification de l'ISTH est donc utile et très importante.
ARTICLE 4

Définition proposée des événements hémorragiques dans les études évaluant le traitement antithrombotique chez les femmes enceintes de l'ISTH SSC sur le contrôle de l'anticoagulation (reproduit avec autorisation). Les couleurs correspondent aux critères sélectionnés pour chaque classe d'hémorragies : rouge pour les hémorragies majeures, orange pour les hémorragies non majeures cliniquement pertinentes et vert pour les hémorragies mineures, respectivement. (A) Classification proposée pour les périodes antepartum et postpartum secondaire (24 h à 6 semaines après l'accouchement). (B) Classification proposée pour la période post-partum primaire (premières 24 h de l'accouchement).

Les complications hémorragiques résultant de l'utilisation de l'anticoagulation thérapeutique pour la prise en charge de la TEV pendant la grossesse sont mal caractérisées. Les défis et les lacunes dans les connaissances qui contribuent à ce phénomène doivent être abordés, y compris l'absence d'une définition normalisée des événements hémorragiques dans les études incluant les femmes enceintes.
Les solutions incluent l'adoption de la classification ISTH pour les saignements pendant la grossesse et le post-partum dans les études futures.
Grossesse + anticoagulation = grossesse à risque HEMORRAGIQUE. Il est alors très important au moment de la prescription de l'anticoagulant d'évaluer ce risque.La classification de l'ISTH est donc utile et très importante.
ARTICLE 4
Monard, C., Meersch-Dini, M. & Joannidis, M. When the kidneys hurt, the other organs suffer.
Quand les reins "souffrent ", les autres organes aussi
Intensive Care Med (2022). https://doi.org/10.1007/s00134-022-06925-5
https://link.springer.com/article/10.1007/s00134-022-06925-5
https://link.springer.com/article/10.1007/s00134-022-06925-5
En raison de l'inter-connexion inter-organes, qui est une partie essentielle de la biologie humaine, un organe endommagé compromet généralement d'autres organes chez les patients gravement malades.
L'insuffisance rénale aiguë (IRA) est caractérisée par une chute aiguë du débit de filtration glomérulaire, diagnostiquée soit par une augmentation de la créatinine sérique et/ou par le développement d'une oligurie, reflétée dans les critères diagnostiques des directives KDIGO (Kinney Disease Improving Global Outcomes).
L'IRA entraîne une rétention hydrique, une perturbation électrolytique, une acidose métabolique et une altération de la pharmacocinétique des médicaments. La clairance des médiateurs inflammatoires est également réduite, ce qui entraîne une augmentation significative de la charge pro-inflammatoire . Ceci, combiné à l'accumulation de toxines urémiques, contribue aux lésions endothéliales et à l'augmentation de la perméabilité vasculaire . En plus de la perte de fonction rénale, le stress et/ou les dommages rénaux, qui peuvent précéder le diagnostic d'IRA (IRA subclinique), peuvent également induire une inflammation et avoir des conséquences à distance . Ces conséquences peuvent varier en fonction de la cause sous-jacente de l'IRA.
L'insuffisance rénale aiguë (IRA) est caractérisée par une chute aiguë du débit de filtration glomérulaire, diagnostiquée soit par une augmentation de la créatinine sérique et/ou par le développement d'une oligurie, reflétée dans les critères diagnostiques des directives KDIGO (Kinney Disease Improving Global Outcomes).
L'IRA entraîne une rétention hydrique, une perturbation électrolytique, une acidose métabolique et une altération de la pharmacocinétique des médicaments. La clairance des médiateurs inflammatoires est également réduite, ce qui entraîne une augmentation significative de la charge pro-inflammatoire . Ceci, combiné à l'accumulation de toxines urémiques, contribue aux lésions endothéliales et à l'augmentation de la perméabilité vasculaire . En plus de la perte de fonction rénale, le stress et/ou les dommages rénaux, qui peuvent précéder le diagnostic d'IRA (IRA subclinique), peuvent également induire une inflammation et avoir des conséquences à distance . Ces conséquences peuvent varier en fonction de la cause sous-jacente de l'IRA.
Le présent article propose une vision néphrocentrique concernant l'impact de l'IRA sur la fonction des organes essentiels .
Bien que l'IRA puisse affecter presque tous les organes du corps, cette revue se concentrera sur les interactions les plus documentées et les organes cliniquement pertinents.
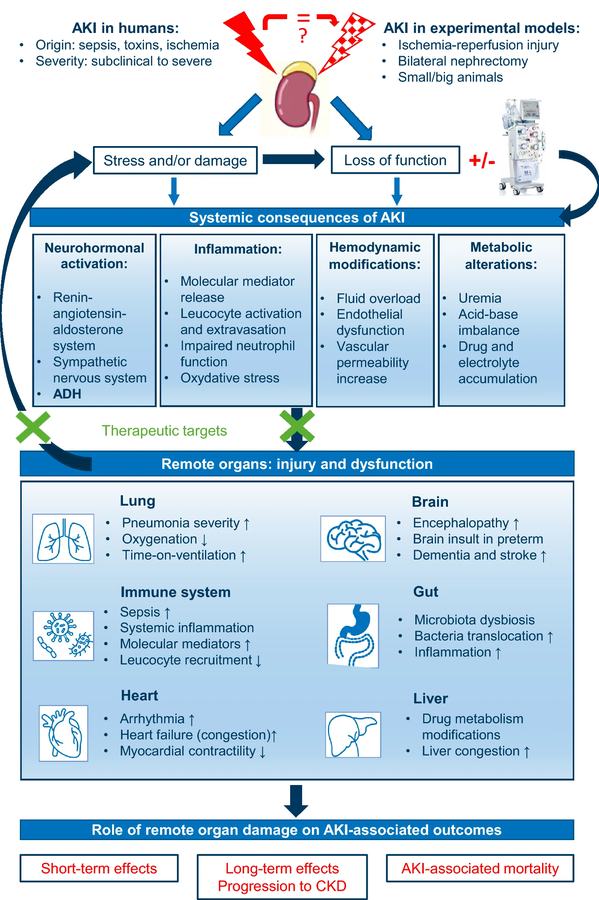 L'IRA affecte les organes distants par diverses voies telles que l'inflammation médiée par les effecteurs cellulaires et moléculaires, les altérations métaboliques et hémodynamiques et le système neurohormonal.
L'IRA affecte les organes distants par diverses voies telles que l'inflammation médiée par les effecteurs cellulaires et moléculaires, les altérations métaboliques et hémodynamiques et le système neurohormonal. Lorsque le rein souffre, les organes distants souffrent également, contribuant probablement à la mortalité et à la morbidité associées à l'IRA.
Des interventions visant à atténuer les diaphonies entre les reins et les organes pourraient être envisagées pour améliorer les résultats pour les patients. Cela nécessite cependant une meilleure compréhension des interactions entre les organes, qui à ce jour reposent principalement sur des modèles animaux ou des patients atteints d'IRC, et ne tiennent pas compte des causes et de la gravité de l'IRA.
Les dommages causés par la perte de fonction rénale ou l'atteinte rénale elle-même doivent également être distingués.
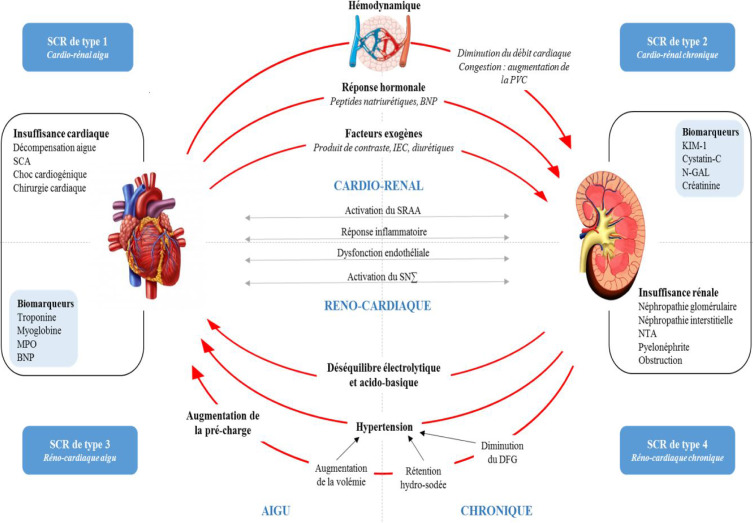
Un exemple IRA et Coeur
Des interventions visant à atténuer les diaphonies entre les reins et les organes pourraient être envisagées pour améliorer les résultats pour les patients. Cela nécessite cependant une meilleure compréhension des interactions entre les organes, qui à ce jour reposent principalement sur des modèles animaux ou des patients atteints d'IRC, et ne tiennent pas compte des causes et de la gravité de l'IRA.
Les dommages causés par la perte de fonction rénale ou l'atteinte rénale elle-même doivent également être distingués.
Un exemple IRA et Coeur
Le syndrome cardio-rénal (SRC) définit les interactions bidirectionnelles complexes entre le cœur et les rein et le SRC de type 3 définit le dysfonctionnement cardiaque résultant de l'IRA . Les mécanismes physiopathologiques par lesquels l'IRA contribue au dysfonctionnement cardiaque aigu ne sont pas bien connus. Certaines données expérimentales suggèrent que les lésions cardiaques peuvent être directement déclenchées par des médiateurs inflammatoires, le stress oxydatif et la régulation à la hausse des systèmes neuroendocriniens tôt après l'IRA. Parmi les perturbations physiologiques associées à la perte de la fonction rénale, la surcharge liquidienne revêt une importance particulière car elle augmente la précharge et étire les cardiomyocytes, diminuant ainsi la contractilité et augmentant la demande de travail. Chez les patients souffrant d'acidémie, l'acide accumulé peut altérer la structure des protéines et altérer la fonction normale, entraînant une diminution de la contractilité myocardique par une expression altérée des récepteurs β et une mauvaise gestion du calcium intracellulaire. Les troubles électrolytiques à base d'IRA peuvent provoquer des arythmies cardiaques, diminuant ainsi le débit cardiaque et exposant les patients à un risque d'événements thrombotiques. De plus, les systèmes rénine-angiotensine-aldostérone et le système nerveux central sont activés dans l'IRA, ce qui entraîne une augmentation de la rétention d'eau, une augmentation de la précharge et de la postcharge. En termes d'urémie, bien que l'effet des toxines urémiques sur la fonction cardiaque dans l'IRA soit peu connu, une association avec une toxicité cardiovasculaire a été démontrée dans l'IRC . De plus, l'IRA contribue aux altérations de la pharmacocinétique et de la pharmacodynamique des médicaments cardiovasculaires.
https://www.sciencedirect.com/science/article/abs/pii/S2352580018301151
Quand le rein souffre, c'est tous les organes qui souffrent. Rappellons que l'IRCT entraine un sur risque CV . L'IRA entraine aussi des altérations de la pharmacocinétique et de la pharmacodynamie des médicaments cardiovasculaires. Il est donc important chez tous les patients quelque soit leur pathologie de surveiller régulièrement la fonction rénale (albuminurie comprise). Rappelons que les situations qui déclenchent l'IRA sont un sepsis, une toxémie, une ischémie sévère myocardique ou autre. Coeur et Rein deux organes connectés !