iconographie : dyslipidémie
"Je ne suis pas un prophète ni un homme des cavernes, juste un mortel avec le potentiel d'un superman." David Bowie
Inhibition de PCSK9 : des progrès actuels à l'avenir en évolution,Chunping Liu et coll, Cells 2022 , 11 (19), 2972; https://doi.org/10.3390/cells11192972
"Je ne suis pas un prophète ni un homme des cavernes, juste un mortel avec le potentiel d'un superman." David Bowie
Inhibition de PCSK9 : des progrès actuels à l'avenir en évolution,Chunping Liu et coll, Cells 2022 , 11 (19), 2972; https://doi.org/10.3390/cells11192972
Article libre d'accès
La proprotéine convertase subtilisine/kexine de type 9 (PCSK9) est une sérine protéase sécrétoire synthétisée principalement par le foie. Il favorise principalement la dégradation du récepteur des lipoprotéines de basse densité (LDL-R) en se liant au LDL-R, réduisant ainsi la clairance du cholestérol des lipoprotéines de basse densité (LDL-C).
En plus de réguler le LDL-R, les inhibiteurs de PCSK9 peuvent également se lier aux récepteurs de type Toll (TLR), au récepteur de récupération B (SR-B/CD36), à la protéine 1 liée au récepteur des lipoprotéines de basse densité (LRP1), au récepteur de l'apolipoprotéine E-2 (ApoER2) et le récepteur des lipoprotéines de très basse densité (VLDL-R) réduisant la concentration de lipoprotéines et ralentissant la thrombose.
En plus des maladies cardiovasculaires, PCSK9 est également utilisé dans le cancer du pancréas, la septicémie et la maladie de Parkinson.
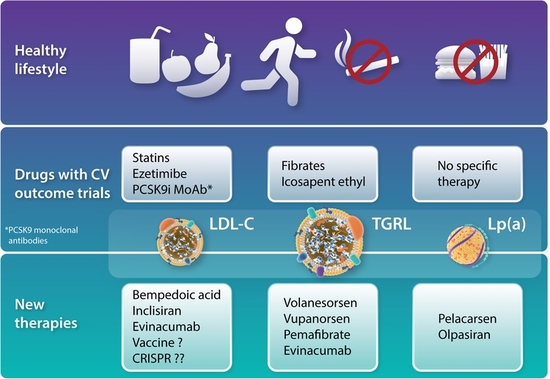
Les inhibiteurs de PCSK9 actuellement commercialisés comprennent l'alirocumab, l'evolocumab et l'inclisiran, ainsi que de petites molécules, les médicaments à base d'acide nucléique et les vaccins en cours de développement.
Cette revue a systématiquement résumé l'application, les études précliniques, la sécurité, le mécanisme d'action et les derniers progrès de la recherche sur les inhibiteurs de PCSK9, dans le but de fournir des idées pour la recherche et le développement de médicaments et l'application clinique de PCSK9 dans les maladies cardiovasculaires et d'étendre son application à d'autres maladies.
En plus de réguler le LDL-R, les inhibiteurs de PCSK9 peuvent également se lier aux récepteurs de type Toll (TLR), au récepteur de récupération B (SR-B/CD36), à la protéine 1 liée au récepteur des lipoprotéines de basse densité (LRP1), au récepteur de l'apolipoprotéine E-2 (ApoER2) et le récepteur des lipoprotéines de très basse densité (VLDL-R) réduisant la concentration de lipoprotéines et ralentissant la thrombose.
En plus des maladies cardiovasculaires, PCSK9 est également utilisé dans le cancer du pancréas, la septicémie et la maladie de Parkinson.
Les inhibiteurs de PCSK9 actuellement commercialisés comprennent l'alirocumab, l'evolocumab et l'inclisiran, ainsi que de petites molécules, les médicaments à base d'acide nucléique et les vaccins en cours de développement.
Cette revue a systématiquement résumé l'application, les études précliniques, la sécurité, le mécanisme d'action et les derniers progrès de la recherche sur les inhibiteurs de PCSK9, dans le but de fournir des idées pour la recherche et le développement de médicaments et l'application clinique de PCSK9 dans les maladies cardiovasculaires et d'étendre son application à d'autres maladies.
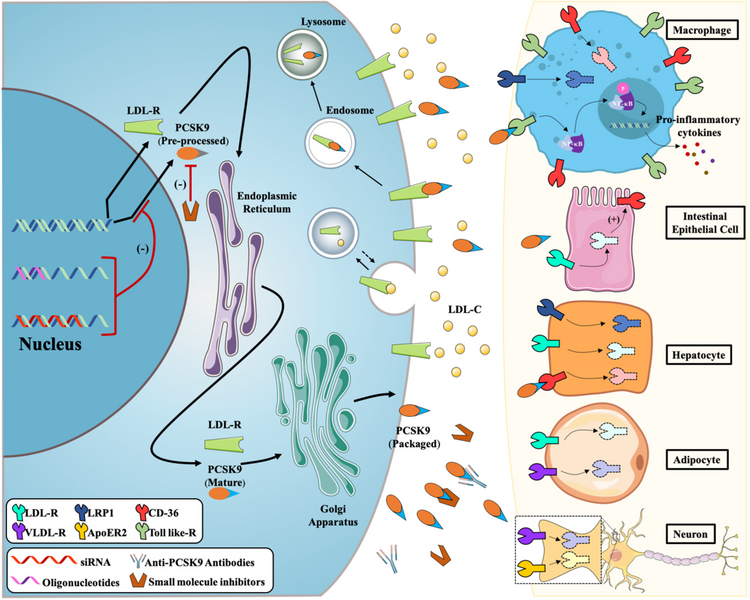
Mécanismes moléculaires des inhibiteurs de PCSK9 avec différentes stratégies.
Résumé et perspectives
En réduisant la teneur en LDL-C, en inhibant l'AP et la thrombose et en réduisant la production de substances inflammatoires, PCSK9 peut traiter l'hyperlipidémie , l'As , la lipoprotéine(a), le risque de thromboembolie veineuse (MTEV) , la sténose aortique et d'autres maladies cardiovasculaires.
De plus, les inhibiteurs de PCSK9 ont été utilisés pour améliorer le traitement du sepsis et de certaines tumeurs malignes . Les inhibiteurs de PCSK9 existants comprennent les anticorps monoclonaux, les petits ARN interférents ou ASO, les médicaments à petites molécules, les imitations de polypeptides, les techniques d'édition de gènes et les vaccins.
Actuellement, les inhibiteurs utilisés en clinique comprennent des anticorps monoclonaux et des siRNA.
Les anticorps monoclonaux entièrement humains, l'alirocumab (Regeneron et Sanofi) et l'évocumab (Amgen), approuvés par la FDA, sont principalement utilisés pour l'HeFH et la prévention des événements CV chez les patients atteints d'une maladie cardiovasculaire confirmée . L'évocumab a une efficacité significative et une bonne tolérance pour l'HFHo , mais n'a pas d'efficacité évidente pour les patients homozygotes atteints d'HF avec des gènes de défaut du récepteur LDL-R négatifs qui nécessitent des stratégies de traitement supplémentaires .
Les effets indésirables des anticorps n'étaient pas significativement différents du placebo, sauf que le taux de réponse au site d'injection était légèrement supérieur à celui du placebo .
Les inhibiteurs de PCSK9 actuellement disponibles comprennent l'alirocumab et l'evolocumab, ainsi que l'inclisiran, un médicament à base d'ARNsi. L'anticorps monoclonal PCSK9 n'a pas le même effet biologique que le variant PCSK9 qui réduit les taux de LDL-C en se liant à la protéine PCSK9 libre. De plus, la production de mAb recombinant est compliquée, le coût est élevé et les conditions de conservation sont strictes. Les patients doivent passer beaucoup de temps en thérapie et supporter des coûts économiques élevés, ce qui limite considérablement l'utilisation clinique.
Les effets indésirables des anticorps n'étaient pas significativement différents du placebo, sauf que le taux de réponse au site d'injection était légèrement supérieur à celui du placebo .
Les inhibiteurs de PCSK9 actuellement disponibles comprennent l'alirocumab et l'evolocumab, ainsi que l'inclisiran, un médicament à base d'ARNsi. L'anticorps monoclonal PCSK9 n'a pas le même effet biologique que le variant PCSK9 qui réduit les taux de LDL-C en se liant à la protéine PCSK9 libre. De plus, la production de mAb recombinant est compliquée, le coût est élevé et les conditions de conservation sont strictes. Les patients doivent passer beaucoup de temps en thérapie et supporter des coûts économiques élevés, ce qui limite considérablement l'utilisation clinique.
La N-acétylgalactosamine et les ASO à modification éthyle restreinte sont de nouvelles thérapies pour inhiber PCSK9. En plus de l'injection, des chercheurs américains ont également développé un médicament ASO (AZD8233) à potentiel oral. Des études ont montré que l'injection sous-cutanée et l'administration orale peuvent réduire considérablement le niveau de PCSK9 et, par rapport à l'injection sous-cutanée, les médicaments oraux sont plus pratiques à utiliser pour les patients, évitent les risques potentiels et l'inconfort de l'injection sous-cutanée et améliorent l'observance du patient .
Cependant, les données cliniques actuelles de ce médicament ne sont pas suffisantes et l'efficacité et l'innocuité ultérieures doivent être confirmées dans d'autres études cliniques.
Les médicaments à base d'ARNsi ou les ASO ont réduit la fréquence d'administration ou d'injection mais nécessitent toujours un traitement répété. Les vaccins sont un moyen efficace de réduire ces limitations. Le vaccin PCSK9 a des effets thérapeutiques en déclenchant la production d'anticorps anti-PCSK9 hôtes et en neutralisant de manière appropriée les interactions PCSK9 et LDL-R . Certaines études ont modifié les constructions peptidiques immunogènes de l'IFPT en L-IFPT, puis les ont mélangées à un adjuvant à l'alun, en les nommant L-IFPTA + vaccin . Des études ont montré que les anticorps induits par cette méthode sont durables et ont le potentiel d'être un vaccin candidat efficace pour le traitement de la dyslipidémie et des maladies cardiovasculaires athérosclérotiques, mais les données cliniques sur le L-IFPTA font encore défaut.
Pendant ce temps, l'innocuité immunitaire et l'efficacité du vaccin pour induire des réponses d'anticorps anti-PCSK9 chez les primates non humains sont à l'étude.
Bien que la voie de développement du vaccin PCSK9 nécessite encore des études cliniques approfondies, les preuves d'innocuité et d'efficacité disponibles sont encourageantes.
En plus de la vaccination contre PCSK9, la technologie d'édition de gènes est également une nouvelle technique pour inhiber la fonction de PCSK9. L'éditeur de base d'adénine CRISPR est fourni par les LNP, qui peuvent modifier efficacement et avec précision les gènes pertinents in vivo et réduire efficacement les niveaux de protéine PCSK9 et de LDL-C, mais il est encore au stade des essais cliniques de phase I .
En résumé, les inhibiteurs de PCSK9 réduisent considérablement le niveau de LDL-C, et le développement de médicaments apparentés est d'une grande importance pour le traitement des maladies cardiovasculaires
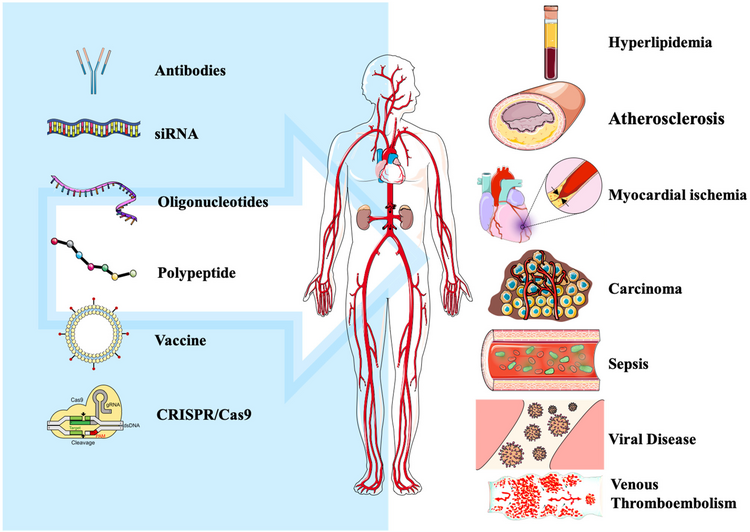 Application des inhibiteurs de PCSK9 avec différentes stratégies dans la maladie.
Application des inhibiteurs de PCSK9 avec différentes stratégies dans la maladie.Complément d'enquête : anti PCSK9 et MTEV
L'effet de l'inhibition de PCSK9 (protéine convertase subtilisine/Kexine de type 9) sur le risque de thromboembolie veineuse Marston, Nicholas A. MD et coll, Circulation. 2020;141(20):1600-1607. doi:10.1161/CIRCULATIONAHA.120.046397.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7469753/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7469753/
Contexte :
La relation entre les taux de cholestérol et le risque de thromboembolie veineuse (MTEV) est incertaine. Nous avons entrepris de déterminer l'effet de l'inhibition de PCSK9 (proprotéine convertase subtilisine/kexine de type 9) sur le risque de MTEV, d'explorer les mécanismes potentiels et d'examiner l'efficacité dans des sous-groupes à risque cliniquement et génétiquement défini.
La relation entre les taux de cholestérol et le risque de thromboembolie veineuse (MTEV) est incertaine. Nous avons entrepris de déterminer l'effet de l'inhibition de PCSK9 (proprotéine convertase subtilisine/kexine de type 9) sur le risque de MTEV, d'explorer les mécanismes potentiels et d'examiner l'efficacité dans des sous-groupes à risque cliniquement et génétiquement défini.
Méthodes :
Nous avons effectué une analyse post hoc de l'essai FOURIER (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk) testant si l'evolocumab réduit le risque d'événements TEV (thrombose veineuse profonde ou embolie pulmonaire). Les données de FOURIER et ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome during Treatment with Alirocumab) ont ensuite été combinées dans une méta-analyse pour évaluer l'effet de classe de l'inhibition de PCSK9 sur le risque de MTEV. Nous avons également analysé les lipides de base dans FOURIER pour étudier les mécanismes potentiels expliquant la réduction de la TEV avec l'evolocumab. Enfin, une analyse génétique exploratoire a été réalisée dans FOURIER pour déterminer si un score de risque polygénique de TEV pouvait identifier les patients à haut risque qui tireraient la plus grande réduction de TEV de l'evolocumab.
Nous avons effectué une analyse post hoc de l'essai FOURIER (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk) testant si l'evolocumab réduit le risque d'événements TEV (thrombose veineuse profonde ou embolie pulmonaire). Les données de FOURIER et ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome during Treatment with Alirocumab) ont ensuite été combinées dans une méta-analyse pour évaluer l'effet de classe de l'inhibition de PCSK9 sur le risque de MTEV. Nous avons également analysé les lipides de base dans FOURIER pour étudier les mécanismes potentiels expliquant la réduction de la TEV avec l'evolocumab. Enfin, une analyse génétique exploratoire a été réalisée dans FOURIER pour déterminer si un score de risque polygénique de TEV pouvait identifier les patients à haut risque qui tireraient la plus grande réduction de TEV de l'evolocumab.
Résultats :
Dans FOURIER, le hazard ratio (HR) de MTEV avec evolocumab était de 0,71 (IC 95%, 0,50-1,00 ; P =0,05), sans effet la 1ère année (HR, 0,96 [IC 95%, 0,57-1,62 ]) mais une réduction de 46 % (HR, 0,54 [IC 95 %, 0,33-0,88] ; P = 0,014) au-delà de 1 an. Une méta-analyse de FOURIER et ODYSSEY OUTCOMES a démontré une réduction de 31 % du risque relatif de TEV avec l'inhibition de PCSK9 (HR, 0,69 [IC à 95 %, 0,53-0,90] ; P = 0,007). Il n'y avait aucune relation entre les taux de cholestérol à lipoprotéines de basse densité de base et l'ampleur de la réduction du risque de TEV. En revanche, chez les patients dont les taux initiaux de lipoprotéine(a) (Lp[a]) étaient plus élevés, l'evolocumab a réduit la Lp(a) de 33 nmol/L et le risque de MTEV de 48 % (HR, 0,52 [IC 95 %, 0,30-0,89 ] ; P= 0,017), alors que chez les patients dont les taux de Lp(a) initiaux étaient inférieurs, l'évolocumab n'a réduit la Lp(a) que de 7 nmol/L et n'a eu aucun effet sur le risque de MTEV ( interaction P 0,087 pour la RH ; hétérogénéité P 0,037 pour la réduction du risque absolu ). Modélisé comme une variable continue, il y avait une interaction significative entre la concentration initiale de Lp(a) et l'ampleur de la réduction du risque de MTEV ( interaction P = 0,04). Un score de risque polygénique a identifié les patients qui présentaient un risque > 2 fois plus élevé de MTEV et qui ont obtenu une plus grande réduction relative ( interaction P = 0,04) et absolue de la MTEV ( hétérogénéité P = 0,009) par rapport à ceux sans risque génétique élevé.
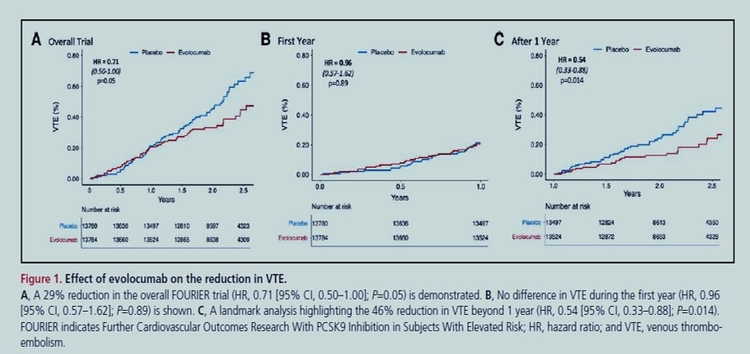
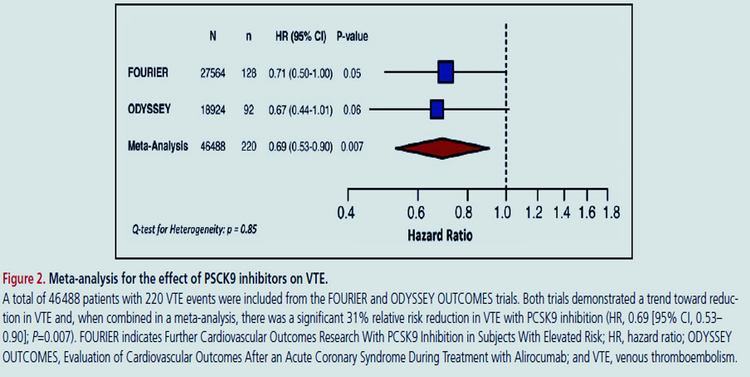
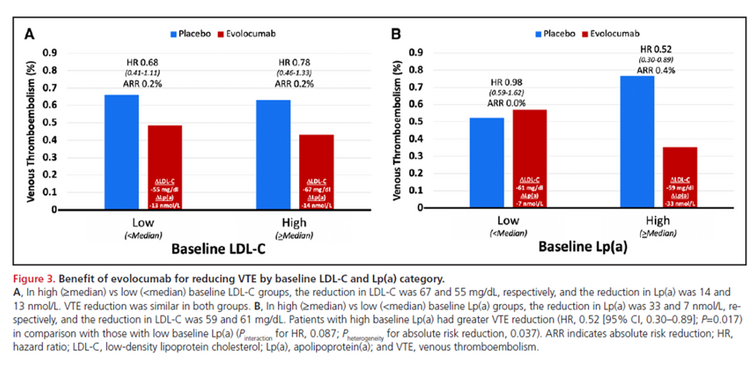
Dans FOURIER, le hazard ratio (HR) de MTEV avec evolocumab était de 0,71 (IC 95%, 0,50-1,00 ; P =0,05), sans effet la 1ère année (HR, 0,96 [IC 95%, 0,57-1,62 ]) mais une réduction de 46 % (HR, 0,54 [IC 95 %, 0,33-0,88] ; P = 0,014) au-delà de 1 an. Une méta-analyse de FOURIER et ODYSSEY OUTCOMES a démontré une réduction de 31 % du risque relatif de TEV avec l'inhibition de PCSK9 (HR, 0,69 [IC à 95 %, 0,53-0,90] ; P = 0,007). Il n'y avait aucune relation entre les taux de cholestérol à lipoprotéines de basse densité de base et l'ampleur de la réduction du risque de TEV. En revanche, chez les patients dont les taux initiaux de lipoprotéine(a) (Lp[a]) étaient plus élevés, l'evolocumab a réduit la Lp(a) de 33 nmol/L et le risque de MTEV de 48 % (HR, 0,52 [IC 95 %, 0,30-0,89 ] ; P= 0,017), alors que chez les patients dont les taux de Lp(a) initiaux étaient inférieurs, l'évolocumab n'a réduit la Lp(a) que de 7 nmol/L et n'a eu aucun effet sur le risque de MTEV ( interaction P 0,087 pour la RH ; hétérogénéité P 0,037 pour la réduction du risque absolu ). Modélisé comme une variable continue, il y avait une interaction significative entre la concentration initiale de Lp(a) et l'ampleur de la réduction du risque de MTEV ( interaction P = 0,04). Un score de risque polygénique a identifié les patients qui présentaient un risque > 2 fois plus élevé de MTEV et qui ont obtenu une plus grande réduction relative ( interaction P = 0,04) et absolue de la MTEV ( hétérogénéité P = 0,009) par rapport à ceux sans risque génétique élevé.



Conclusions :
L'inhibition de PCSK9 réduit significativement le risque de MTEV. La réduction de la Lp(a) peut être un médiateur important de cet effet, une découverte particulièrement intéressante étant donné le développement en cours de puissants inhibiteurs de la Lp(a).
L'inhibition de PCSK9 réduit significativement le risque de MTEV. La réduction de la Lp(a) peut être un médiateur important de cet effet, une découverte particulièrement intéressante étant donné le développement en cours de puissants inhibiteurs de la Lp(a).
Commentaires
Anti PCSK9 et effet pléiotropique, nouvelle piste des effets thérapeutiques de ces molécules. On a l'impression, que les Anti PCSK9 comme les inhibiteurs du cotransporteur SGLT2 nous livrent "leurs secrets" progressivement. Anti PCSK9 et MTEV, c'est par le biais de la réduction de la Lp(a) que leur action anti MTEV se ferait.
Si n on poursuit le raisonnment ne faudrait-il pas "demain" doser la Lp(a) chre les patients qui présentent une MTEV non provoquée ou pour évaluer le risque de récidive ?
La question mérite d'être posée, quant à la réponse, nous avaons devant nous un chemin à explorer puis à valider.
Si n on poursuit le raisonnment ne faudrait-il pas "demain" doser la Lp(a) chre les patients qui présentent une MTEV non provoquée ou pour évaluer le risque de récidive ?
La question mérite d'être posée, quant à la réponse, nous avaons devant nous un chemin à explorer puis à valider.