"Le savoir est à l'esprit ce que l'oxygène est aux poumons." Souleymane Boel
"Le corps humain comprend le thorax au nord et l'abdomen au sud. C'est dans le thorax que les poumonsfont leur nid." Jean Charles
L'embolie pulmonaire, l'HTP-TEC sont deux entités cliniques en pleine évolutivité. Il était donc logique de demander à Laurent Bertoletti, "es spécialite EP" sont point de vue actuel sur cette thématique qui évolue sans cesse.
Merci à Laurent de s'être prêté au jeu des questions de MedVasc.info.
Entretien Laurent Bertoletti : de l’EP à l’HTP-TEC
Professeur des universités-praticien hospitalier à la Faculté de Médecine,spécialiste en pneumologie, chef du service de Médecine Vasculaire et Thérapeutique du CHU de Saint-Etienne
Laurent Bertolietti est coordonnateur pour la France du registre international RIETE depuis 2011, et est maintenant co-coordonnateur du réseau F-CRIN INNOVTE (réseau d’excellence Français, financé via le PIA et travaillant sur le diagnostic et la Thérapeutique de la maladie thromboembolique veineuse). Il est membre du laboratoire SAINBIOSE où il participe aux activités de recherche fondamentales et translationnelles. La reconnaissance internationale de ses activités s’est récemment matérialisée dans son élection au poste de « Chairman » de l’assemblée « Pulmonary Embolism » de l’European Respiratory Society, société savante recouvrant 160 pays, dont l’objectif est de promouvoir la santé respiratoire en donnant la priorité à la science, à l’éducation et à la défense des droits.
L’EP est une affection grave, potentiellement mortelle. Quels sont les signes cliniques les plus pertinents et les signes de gravité
La question des signes cliniques est difficile !
Classiquement, les signes cliniques qui doivent faire penser à l’embolie pulmonaire sont la douleur thoracique et la dyspnée. Si la douleur thoracique est un signe d’alerte fréquent en population générale, souvent aiguë, la dyspnée est plus délicate à évaluer, pouvant apparaitre isolément et/ou progressivement. Beaucoup de patients parleront d’ailleurs de fatigue pour exprimer une limitation respiratoire à des actes de la vie quotidienne. L’interrogatoire est alors crucial. Plus rarement, les patients pourront consulter du fait d’hémoptysie ou dans les suites d’une syncope. Concernant l’hémoptysie, c’est relativement rare (moins de 10% des embolies pulmonaires), mais si vous suspectez une embolie, c’est un signe qui doit vous décider à aller au bout de votre hypothèse. Pour la syncope, des collègues Italiens (Prandoni et al NEJM 2016) ont retrouvé une prévalence forte de l’embolie pulmonaire (17%), mais je ne crois pas que cela ait été confirmé par d’autres équipes.
A côté de ces signes d’interrogatoire, l’examen physique peut être tout à fait normal ! Le signe physique le plus fréquemment retrouvé dans l’embolie pulmonaire est la tachycardie, habituellement sinusale.
La clinique est donc “traitre” dans l’embolie pulmonaire, tellement difficile que des embolies pulmonaires peuvent être diagnostiquées chez des patients sans aucun symptôme respiratoire. C’est bien connu chez les patients avec thrombose veineuse profonde proximale (jusqu’à 30% d’embolie pulmonaire asymptomatique) et chez les patients passant un scanner thoracique pour une autre raison (classiquement le cancer, vecteur d’embolie dite de découverte “fortuite”).
C’est finalement le message clé. Il faut savoir penser à l’embolie devant des symptômes thoraciques, en particulier chez des patients avec des facteurs de risque (TVP, cancer, immobilisation récente, etc). Et savoir que la caractéristique sera le contraste entre un interrogatoire pouvant être riche (dyspnée, douleur thoracique, voire hémoptysie ou syncope) contrastant avec un examen clinique pauvre (à l’échelle thoracique). Ce contraste pose d'ailleurs question à toutes les promotions d’étudiants en médecine venant dans mon service, et découvrant l’imagerie d’embolie pulmonaire d’un patient dont ils viennent de réaliser un examen clinique complet (et souvent presque normal).
Pour les signes de gravité, ils sont plus simples à préciser. C’est l’hypoxémie (évaluée par une mesure de la saturation transcutanée en oxygène réalisée en air ambiant) et surtout le statu hémodynamique. L’existence d’une tension artérielle inférieure à 90 mmHg ou des signes cliniques de choc (marbrures) signe une urgence thérapeutique.
Le parcours de soins de l’EP est aujourd’hui bien codifié. Quels sont les étapes « obligatoires » ?
Le parcours de soins a été précisé lors du travail du groupe de travail multisociétés savantes sur la prise en charge de la MTEV. (Sanchez Ol et al Rev Mal Respir 2019).
Concernant l’embolie pulmonaire, la prise en charge initiale repose sur une stratification du risque. En cas de risque faible de décès (<1%), la possibilité d’un traitement ambulatoire (ou après une hospitalisation de courte durée) est maintenant ouverte. Cela nécessite une sélection des patients (selon un score validé comme le sPESI ou la règle d’HESTIA), mais aussi un circuit organisé permettant de revoir les patients à 72h. Cette évaluation rapprochée est décisive pour confirmer le diagnostic, adapter la thérapeutique et programmer le plan de soins. Un moment dédié de “débriefing” sera nécessaire avec le patient, la prise en charge initiale (comme le retour au domicile) pouvant parfois être relativement anxiogène. Une nouvelle consultation sera organisée à un mois, pour réévaluer ces paramètres, et commencer la synthèse étiologique.
Pour la majeure partie des patients avec embolie pulmonaire, l’hospitalisation initiale reste la règle, permettant de confirmer le diagnostic, évaluer le retentissement, s’assurer d’une évolution favorable sous anticoagulant, et programmer le plan de soins. Une fois le patient stabilisé et la prise en charge encadrée, une nouvelle consultation sera possible 3 à 6 mois après.
Après 3 à 6 mois de traitement, le rapport bénéfices/risques du traitement anticoagulant sera réévalué, afin de produire une décision thérapeutique argumentée (arrêt ou poursuite du traitement anticoagulant, modalité de prévention secondaire, etc). En cas de poursuite du traitement anticoagulant, le patient devra être revu une fois par an, pour réévaluation clinique, et de la décision thérapeutique, à l’aulne des données disponibles de la science.
Pendant le suivi, la question de l'évaluation des séquelles sera majeure. Cette évaluation sera d’abord clinique, via l’interrogatoire et l’examen physique.
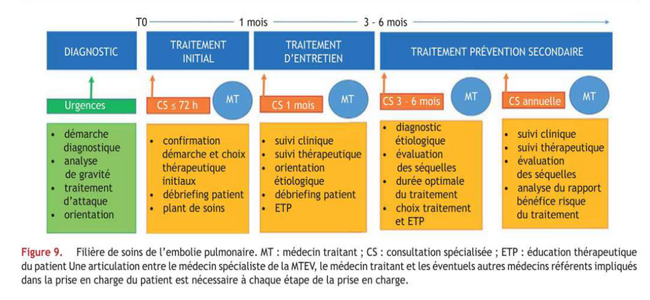
D’après Bertoletti L et al “Quel parcours de soins proposer aux patients atteints d’une embolie
pulmonaire ? Quels malades traiter en ambulatoire ?” Rev Mal Respir 2021
Deux problèmes actuellement : le traitement de l’EP à domicile et les EP sous segmentaires symptomatiques et asymptomatiques. Quels sont pour ces deux questions les points forts à retenir
Tu as raison, ce sont vraiment deux sujets problématiques.
Concernant le traitement de l’EP à domicile, il a été clairement démontré que sous réserve de bien sélectionner les patients, et de mettre à disposition un parcours de soins structuré, cette prise en charge était possible et sûre pour certains patients. Cependant, si l’on dispose maintenant de scores solides pour sélectionner ces patients, les structures capables de mettre en place une évaluation spécialisée à moins de 72h, puis une consultation rapprochée, tout en maintenant le reste des activités, sont rares. Il se pose aussi la question de la valorisation financière de ces activités. Les expériences récentes ont démontré que le “tout ambulatoire” ne pouvait marcher qu’en cas d'un encadrement suffisant au domicile, et d’amélioration (cruciale) des moyens de communications entre professionnels de santé.
Concernant les EP sous-segmentaires, c’est l’illustration d’un progrès qui ne peut ne pas en être un. Un des livres que je recommande fréquemment à mes étudiants s’intitule “L'enfer de la médecine... est pavé de bonnes intentions” (Patrick Lemoine, chez Robert Laffont, 2005). Le progrès technologique a permis d’améliorer la résolution des angioscanners thoraciques, et la proportion de patients diagnostiqués avec une EP sous-segmentaire (au scanner) a augmenté au fur et à mesure des années, dans les essais diagnostiques. Or, cette augmentation du nombre de cas diagnostiqués ne s’est pas traduite dans les faits par une diminution du nombre de décès par embolie, tout en augmentant le nombre de patients exposés aux anticoagulants. Il est donc apparu le risque nous -médecins- ayons succombé à un de nos vices préférés : le “Disease Mongering”, cher à mon ami Paul Frappé. C’est en fait notre capacité à accepter la fabrication de maladies (qui n’existaient pas jusqu’alors), maladies répondants à la possibilité de prescrire des thérapeutiques mises à dispositions. Dis autrement, on aime diagnostiquer des maladies que l’on peut traiter par des médicaments. Or, une étude (difficile, qui a pris une dizaine d’années) vient de montrer que si l'on arrive à obtenir l’accord d’un patient diagnostiqué avec une EP sous-segmentaire isolée (c’est-àdire sans thrombose veineuse associée), le risque d’évènement thromboembolique pendant le suivi est de 3.1%, avec un intervalle de confiance montant jusqu’à 6%. Le débat n’est pas encore réglé, mais il est possible à l’avenir que l’on fera avec certaines EP sous-segmentaires la même chose que ce que certains font déjà avec les TVP distales : une surveillance rapprochée sans traitement anticoagulant.
L’HTP-TEC- est aussi une affection grave. Chez un patient qui a fait une EP quels sont les signes prédictifs d’HTP- TEC et quels sont les examens les plus pertinents pour quantifier cette affection.
Alors que le syndrome post-thrombotique est LA complication à long terme connue de tous après TVP, l’hypertension pulmonaire thromboembolique chronique (HTP-TEC) est encore trop mal connue des médecins impliqués dans la prise en charge des patients souffrant d’EP.
Lors du diagnostic d’EP, plusieurs signes doivent faire évoquer l’hypothèse d’une HTP-TEC déjà existante au clinicien. Tout d’abord, certains signes radiologiques sont associés à une HTP-TEC, et pas à une EP : c’est la forme du caillot (avec des angles de raccordement à la paroi différents), l’existence d’une perfusion mosaïque sur le parenchyme ou de collatérales médiastinales, un retentissement sur le ventricule droit disproportionné de l’atteinte embolique. Nous devons savoir challenger nos radiologues. Pour les patients bénéficiant d’une échographie cardiaque, l’existence d’une HTP (PAPs>=45 mmHg) doit faire suspecter le diagnostic.
Dans le suivi, l’existence d’une dyspnée ou l'apparition de signes d’insuffisance cardiaque droite doit faire évoquer le diagnostic. Et à cet instant, l’imagerie thoracique à réaliser (en complément de l’échographie cardiaque) est la SCINTIGRAPHIE PULMONAIRE. Plusieurs études ont montré que les angioscanners étaient encore insuffisamment sensibles pour rejeter le diagnostic, alors qu’une perfusion normale à la scintigraphie permet de rejeter à 100% l’hypothèse de séquelles d’EP !
Dans tous les cas, nous devons traquer la dyspnée post-EP, trop souvent minimisée par les patients, pour qui il est “normal” d’avoir des symptômes persistants à distance d’un évènement que nous savons (nous) aigu. Et en cas de dyspnée, il faut réaliser la combinaison gagnante scintigraphie/échocardiographie, qui permet déjà de bien avancer le diagnostic.
Quels sont les différents traitements en 2022 de l’HTP-TEC et leurs indications ?
Des progrès extraordinaires ont été réalisés dans cette maladie qui était mortelle dans la plus part des cas, et que l’on arrive de plus en plus souvent à guérir grâce aux interventions thérapeutiques !
Le traitement le plus efficace est la thromboendartériectomie. C’est une chirurgie lourde, mais nous avons la chance en France d’avoir un centre expert. C’est le traitement de référence qui doit être proposé à tous les patients éligibles. Il n’est par contre possible que si l’obstruction mécanique est accessible chirurgicalement, et explique l’atteinte hémodynamique (évalué au cathétérisme cardiaque droit, nous n’avons pas d’outil aussi bon et non-invasif que l’écho-Doppler pour cette atteinte “artérielle” pulmonaire). En cas d’obstruction mécanique non accessible (que ce soit pour des problématiques techniques ou de comorbidités), le développement de l’angioplastie (arrivée en France grâce à Hélène BOUVAIST du CHU de Grenoble) est en train de révolutionner le traitement mécanique de l’HTP-TEC.
Enfin, l’amélioration de nos connaissances a permis de démontrer l’intervention d’une vasculopathie distale dans la physiopathologie de cette pathologie. Cette vasculopathie peut être prise en charge médicalement. Le seul médicament autorisé actuellement en France est le Riociguat (ADEMPAS°). Des essais sont en cours avec d’autres molécules. Le Riociguat a démontré son efficacité sur les capacités fonctionnelles. Il ouvre aussi la possibilité de combinaisons thérapeutiques, association traitement mécanique et traitement médicamenteux.
En fait, nous suivons ce qui a été réalisé dans certaines pathologies artérielles pendant les dernières décennies : éviter les récidives graves (poursuite d’un traitement anticoagulant au long cours, en privilégiant pour l’instant les AVK), améliorer l’hémodynamique en ciblant mécaniquement les lésions macroscopiques (angioplasties ou thromboendartériectomie) et l’atteinte vasculaire microscopique (Riociguat aujourd’hui, Macitentan demain ?).
La communauté vasculaire a donc un rôle CLE à jouer dans le diagnostic et la prise en charge de ces pathologies !
Un grand Merci Laurent pour ces réponses claires "partout; toujours !".....


