Entretien
-
Entretien Marc Righini : EP SOUS SEGMENTAIRES

“L'impossible recule devant celui qui avance.” Proverbe Suisse
"La vraie grandeur mystique du Karaté se trouve dans la profondeur, l'ampleur et l'immensité des philosophies orientales qui sont derrière lui".Masutatsu Oyama
Les embolies pulmonaires sous segmentaires font la une depuis quelques années . Elles alimentent les discussions et même, la controverse. Il était donc utile de faire le point sur cette entité avec le Pr Marc Righini qui connaît parfaitement ce sujet et qui a accepté cet entretien avec https://medvasc.info/
Marc Righini effectue ses études de médecine à Genève. Il obtient son diplôme en 1994, complété par des spécialisations en médecine interne (FMH en 2000) et en angiologie-hémostase (FMH en 2001).
Il effectue ensuite un stage aux CHU de Montpellier et Nîmes dans le but d’acquérir des compétences en échographie vasculaire. Responsable de l’unité d’angiologie des HUG depuis 2012, il prend la tête du Service d’angiologie et hémostase en 2015. Ses recherches concernent essentiellement les maladies thromboemboliques veineuses, notamment le diagnostic et le traitement de l’embolie pulmonaire et de la thrombose veineuse profonde. Membre de plusieurs sociétés savantes nationales et internationales, il anime également de nombreuses collaborations scientifiques en Europe et au Canada. Privat-docent au Département de médecine interne des spécialités de la Faculté de médecine de l’UNIGE en 2006, il est promu à la fonction de professeur assistant en 2014, avant d’être nommé professeur ordinaire en novembre 2015.
L’embolie pulmonaire est une entité clinique de mieux en mieux connue, par contre il existe une littérature de plus en plus abondante sur les EP sous segmentaires, ce tableau clinique a intégré notre pratique. Peux-tu Marc nous en donner une définition précise ?C’est une bonne question. Mais à part la définition radiologique, je devrais dire scannographique, qui fait maintenant l’objet d’un consensus (1 SSPE visible sur deux coupes de CT etc.), il n’y a pas de tableau clinique spécifique. La plupart des patients vont se présenter avec une douleur thoracique et/ou une dyspnée qui ne les différencient en rien d’une EP plus proximale. Par contre, certains critères de gravité tels que l’hypoxémie ou l’instabilité hémodynamique sont bien sûr moins fréquents. La présence concomitante d’une TVP proximale est aussi plus rare lors d’une EP sous-segmentaire que lors d’une TVP plus proximale.
Quelle est la symptomatologie clinique d’une EP sous segmentaire ? Existe-t-elle ?
Comme discuté ci-dessus, il n’y a pas forcément de symptomatologie spécifique. Mais si on considère le spectre de présentation de l’EP qui va de la douleur thoracique au décès, on est bien sûr plutôt du côté de la douleur thoracique, associée ou non à une dyspnée,que du côté de l’arrêt cardiaque.
L’angio scanner est l’examen référence en matière d’EP sous segmentaires mais qu’en est-il des scores de probabilité, des scores de gravité, des D Dimères ?
Le scanner multi-barrettes est en effet devenu le gold standard moderne pour le diagnostic d’embolie pulmonaire, remplaçant ainsi l’angiographie pulmonaire.
Il est important de rappeler que les EP sous segmentaires n’étaient pas visualisées avec les CT mono-barrettes et la scintigraphie de V/P. Malgré cela, l’avènement du CT multi-barrettes n’a pas réduit le taux d’événement thromboembolique à trois mois, ce qui qui suggère que le fait de ne pas diagnostiquer ces « EP » ne portait à conséquence pour les patients. Par ailleurs, les données épidémiologiques aux Etats-Unis montrent que l’avènement du CT multi-barrette a augmenté l’incidence de l’EP (en particulier en augmentant la fréquence des EP sous segmentaires diagnostiquée, et donc traitées) alors que la mortalité de l’EP n’a pas changé. Ceci suggère que le fait de traiter ces EP sous segmentaires, ne change pas réellement le pronostic des patients.
Un autre point important est que la valeur prédictive positive du scanner au niveau sous-segmentaire (comparé à l’angiographie pulmonaire) est mauvaise, environ de 25%. Ce qui veut dire que la plupart des images de défects intraluminaux rapportés au niveau sous segmentaire au CT ne seraient pas diagnostiquées comme étant des embolies pulmonaires sous-segmentaires si on faisait une angiographie pulmonaire. Ceci complique passablement la prise en charge et nécessite à chaque fois une relecture par un radiologue expérimenté avant de retenir le diagnostic. En ce qui concerne les scores de gravité, ils restent utiles pour identifier les patients qui peuvent rentrer à domicile (PESI, sPESI, Hestia).
Les D-dimères gardent un rôle fondamental dans ce contexte. En effet, le fait d’avoir un D-dimère négatif, même en présence d’une EP sous segmentaire isolée, identifie des patients qui ont un taux d’événement thromboembolique à trois mois inférieur à 0.2% sans anticoagulation (pour rappel : risque de récidive après un CT négatif : 1%). C’est une bonne façon d’identifier des patients avec une EP sous segmentaire isolé chez qui un traitement anticoagulant n’est probablement pas indispensable.
Au-delà du raisonnement concernant les D-dimères, une étude de cohorte récente a montré que le risque de récidive en cas d’embolie pulmonaire sous segmentaire non traitéeétait de l’ordre de 2%. Ceci correspond au risque de récidive thrombo-embolique pour des EP plus proximales traitéesdans les études EINSTEIN ou HOKUSAI, par exemple. La dangerosité des EP sous segmentaires isolées est donc bien moindre que celle des EP plus proximales. Par contre, la même étude suggère un risque plus élevé de récidive pour les EP sous segmentaires multiples non traitées. Celles-ci nécessitent probablement un traitement anticoagulant.
Une question importante, quelle est la différence pronostique entre les EP sous segmentaires de découverte fortuite asymptomatique et celles qui sont symptomatiques dans le cancer et hors cancer. Quel est taux de récidive et sous quelle forme ?Malheureusement, les données de la littérature sont très limitées. Il y a déjà un doute quant à une différence de pronostic entre les EP sous segmentaires par rapport aux EP plus proximales. Certaines études rapportent un pronostic tout à fait semblable, d’autre un meilleur pronostic pour les EP sous-segmentaires.
En ce qui concerne les EP sous segmentaires de découverte fortuite dans un contexte oncologique, leur taux varie de 1-5% selon les études et la plupart des recommandations suggèrent de traiter les EP symptomatiques ou de découverte fortuite de la même manière. On n’a pas de données très solides sur leur pronostic.
Faut il traiter TOUTES les EP sous segmentaires et comment et pendant combien de temps ?
Je pense qu’il faut proposer une démarche radiologique et clinique avant de se poser la question de l’anticoagulation. Voici quelques étapes :
1. Vérifier avec un radiologue expérimenté qu’il s’agit bien d’une EP sous-segmentaire isolée.
2. Réaliser un écho-Doppler des MI à la recherche d’une TVP proximale. Si une TVP est retrouvée, il faudra traiter le patient.
3. Effectuer un dosage des D-dimères pour les patients ambulatoires, car un test D-dimères négatif garantit un taux d’événement thromboembolique quasi nul à trois en l’absence d’anticoagulation.
4. Intégrer la clinique car une EP sous-segmentaire du lobe inférieur droit alors que le patient présente une douleur thoracique haute à gauche rend la probabilité d’un faux positif du CT plus élevée.
5. Evaluer le risque hémorragique car s’il est élevé le rapport bénéfice-risque de l’anticoagulation pour une EP sous segmentaire n’est pas favorable.
6. Prendre en compte le contexte du patient. Un contexte néoplasique va nous pousser vers un traitement anticoagulant, sauf si le risque hémorragique est élevé.
7. Discuter avec le patient des doutes quant à la nécessité de traitement et de ses préférences éventuelles.
8. Si possible, l’inclure dans l’étude randomisée SAFE-SSPE qui apportera, je l’espère, des données plus robustes quant à la prise en charge de ces patients.
Donc en résumé : Il y a certainement une proportion non négligeable d’EP sous segmentaires isolées qui ne nécessitent pas de traitement, en particulier chez des patients qui ont une bonne réserve cardio-pulmonaire. Si on les traite par anticoagulant, il faut viser 3 mois, mais il n’y a aucune donnée de comparaison de durée de traitement en cas d’EP sous-segmentaire isolée.
EP sous segmentaires et HTP-TEC, ça existe ?
Je pense que personne ne le sait. On peut imaginer que des récidives d’embolies sous-segmentaires répétées et asymptomatiques puissent favoriser une CTEPH mais je pense que le rôle de la thrombose in situ est sous-estimé dans cette pathologie.
Merci Marc pour ces réponses claires et argumentées, directement applicables à la "vie réelle" qui fait notre quotidien. -
Entretien avec François BECKER : Sténose carotidienne asymptomatique

iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
"Ce qu'on appelle stratégie consiste essentiellement à passer les rivières sur les ponts et à franchir les montagnes par les cols." Anatole France
Entretien avec F. Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire La question de la sténose carotidienne asymptomatique est une question toujours complexe avec des réponses trop souvent discordantes. C'est pourquoi j'ai demandé à François Becker son avis éclairé . En le lisant vous allez découvrir l'essence même de cette question . Vous allez aller, à la rencontre de la sténose carotidienne asymptomatique et in fine à une connaissance optimale. Le partage du savoir est toujours enrichissant.
La question de la sténose carotidienne asymptomatique est une question toujours complexe avec des réponses trop souvent discordantes. C'est pourquoi j'ai demandé à François Becker son avis éclairé . En le lisant vous allez découvrir l'essence même de cette question . Vous allez aller, à la rencontre de la sténose carotidienne asymptomatique et in fine à une connaissance optimale. Le partage du savoir est toujours enrichissant.
Question 1 : Peux-tu définir avec précision ce qu’est une sténose carotidienne asymptomatique ?Avant de répondre à ta question, il me parait bon de rappeler 4 points importants :
1- D’abord ce qu’on entend par sténose carotide* car dans les documents d’ordre épidémiologique on mélange parfois lésions extra- et intracrâniennes, ce qui surestime l’évaluation de la responsabilité des sténoses carotides extra-crâniennes dans les AVC ischémiques. Sans autre précision, on entend par sténose carotide les sténoses intéressant la bifurcation carotide proprement dite et/ou les 1ers cms de l’artère carotide interne cervicale : bifurcation carotide, origine de l’ACI ou bulbe carotide, ACI post-bulbaire immédiate. Sont exclues les sténoses de la carotide commune thoracique et cervicale, de l’ACI cervicale haute sous la base du crâne, les sténoses intra-crâniennes (siphon carotidien, sylvienne) et les sténoses limitées au tronc de la carotide externe.
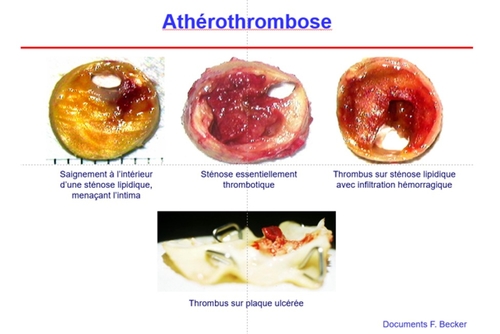
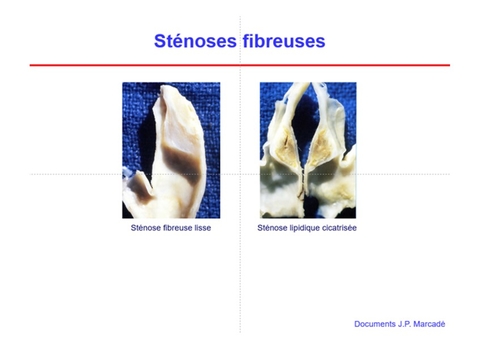
2- Sans précision, on parle de sténose par athérosclérose, les lésions d’artériopathie non-athéroscléreuse sont exclues du propos (bien que nettement moins fréquentes que les sténoses athéroscléreuses, il faut savoir les évoquer ,car leur gestion est spécifique).
3- Plaque, sténose les deux mots sont souvent utilisés l’un pour l’autre alors que du point de vue étymologique et hémodynamique les deux termes sont différents (parler d’une plaque à 80% ou d’une sténose à 20% a quelque chose d’incongru). Probablement pour pallier ces aléas de langage est apparu le terme de sténose significative qui n’est pas plus précis. S’il existe quelques variantes dans la définition du mot plaque, toutes agréent qu’une plaque est un élément plutôt rigide, plutôt plat et en tout cas peu épais. Une sténose est non seulement un rétrécissement mais un rétrécissement anormal. Il est communément admis en hydraulique qu’une sténose régulière ne perturbe pas le flux jusqu’à atteindre au moins 70% section. On peut appliquer aux carotides la méthode de Bollinger pour les membres inférieurs en distinguant sténoses ≥ 50% diam., sténoses 25-50% diam., plaques ≤ 25% diam.
4- Une cause majeure de discordance dans l’appréciation du degré de sténose des lésions carotides est que les uns parlent de sténose en réduction de diamètre quand les autres parlent en réduction de section. Ce n’est pas supportable ! Il faut toujours préciser X%-diam ou X%-section.
Pour répondre à ta question, il faut encore faire un brin d’histoire. Jusqu’en 1950 et les travaux de C.M. Fisher les lésions carotides extra-crâniennes ont été négligées. Il faut peut-être rappeler que l’artériographie a été développée pour l’étude des tumeurs cérébrales (E. Moniz 1927), que l’apoplexie était considérée comme liée à la thrombose d’artère intra-crânienne (XVIIème-XVIIIème siècle) et que les premiers liens entre lésions carotides extra-crâniennes et AVC ischémique homolatérale ont été établis pour des plaques ulcérées avec matériel thrombotique extra-crâniennes (Chiari 1905).
La définition du caractère symptomatique ou asymptomatique des sténoses carotides (SC) est liée aux études sur la chirurgie carotidienne.
Initialement une sténose carotide était définie comme asymptomatique si sans aucun antécédent de séméiologie neurologique ou oculaire attribuable (étude VA) ou aucun antécédent de séméiologie neurologique ou oculaire attribuable dans le territoire carotide concerné (études Casanova et ACAS).
Puis l’étude ECST (1981-94) a défini une sténose carotide symptomatique comme avec AIT, infarctus rétinien ou AVC non-invalidant dans le territoire carotidien homolatéral dans les 6 mois précédents l’inclusion et l’étude NASCET (1987-1997) comme AIT, CMOT (Cécité Monoculare Transitoire) AVC non-invalidant dans le territoire carotidien homolatéral dans les 4 mois précédents l’inclusion.
Il est important de noter qu’il ne s’agit que de déficit focalisé : vertige isolé, malaise, syncope, toute séméiologie non-hemisphérique ne sont pas pris en compte, il en est de même des infarctus silencieux en imagerie cérébrale.
Suite à l’étude ACST (1993-2003), une sténose carotide asymptomatique a été définie par opposition à une sténose symptomatique.
Une sténose carotide asymptomatique est donc définie comme sans aucun antécédent neurologique déficitaire focalisé, hémisphérique ou oculaire, dans le territoire homolatéral à la sténose dans les 4 à 6 mois précédents.
Le délai de 4 à 6 mois pourrait actuellement être réduit à 6 sem.*Carotide est à la fois adjectif qualificatif et nom commun.
Question 2 : Dans quelles circonstances doit-on rechercher une sténose carotidienne asymptomatique ?
Sujet polémique ! L’USPSTF (US Preventive Services Task Force Recommendation Statement) a réitéré en 2021 son opposition de 2014 au dépistage de sténose carotide en se prononçant against. L’American Heart Association (AHA) et l’American Stroke Association (ASA) ont fait de même.
Certes,il s’agit de dépistage en population générale mais les trois raisons majeures de cette opposition sont- La cascade d’examens lorsque le 1er examen n’est pas jugé suffisamment crédible (problème de l’écho-Doppler « opérateur-dépendant ») ou lorsque le 1er examen (en général l’écho-Doppler) est systématiquement vérifié par une artériographie dès lors qu’il n’est pas normal ou lorsqu’il est seulement demandé à l’écho-Doppler des critères de vitesse systolique de sténose « ≥ 50% » auquel cas une artériographie est réalisée pour décider de la suite (position radiologique).
- La iatrogènie liée aux actes inutiles etsurtout le fait que dans la vraie vie le taux de complications opératoires est assez souvent supérieur au maximum de 3% requis pour pratiquer la chirurgie ou le stenting pour sténose carotide asymptomatique (et encore ces 3% datent d’études anciennes, maintenant ce devrait être < 1.5%).
- Le fait qu’il n’y a pas de bénéfice prouvé à la chirurgie ou au stenting préventif pour les sténoses carotides asymptomatiques (tout particulièrement chez la femme).Les dernières données sont celles de l’étude SPACE-2 interrompue prématurément à 513 patients pour recrutement trop lent. Dans cette étude le taux d’AVC et décès post-opératoires (chirurgie ou stenting) était de 2.5%, et à 1 an il n’y avait pas de différence dans le critère d’évaluation principal (tout AVC et décès à 30 j. + AVC ischémique ipsilatéral à 5 ans) : 2.5% pour l’endartériectomie, 3% pour le stenting, 0.9% pour le traitement médical optimal (Chaturverdi, jama neurol. Fev. 2021).

Il faut se poser la question du pourquoi intervenir préventivement par chirurgie ou stenting sur une sténose carotide asymptomatique : pour prévenir un AVC ischémique fatal ou invalidant !
Les AIT ont pu être inclus dans certaines études, mais si l’AIT est un très bon signe d’alerte, la prévention par chirurgie ou stenting des AIT n’a pas d’intérêt puisque par définition la durée de la séméiologie est < 24h.Prévenir par chirurgie ou stenting un AVC ischémique fatal ou invalidant n’est pas évident. En effet la sténose carotide est marqueur de risque cardio-vasculaire, marqueur de risque d’AVC toute cause, marqueur de risque d’AVC ischémique homo ou bilatéral, facteur d’AVC ischémique homolatéral. Même en cas de sténose carotide 70-99%, 20% des AVC dans le territoire d’une sténose dite symptomatique et 45% des AVC dans le territoire d’une sténose asymptomatique sont sans rapport avec la sténose carotide en question.
Au total, les sténoses > 50% diamètre et oblitérations ACI sont jugées responsables d’environ 10% des AVC ischémiques(ESVS Guidelines, Naylor AR et al. Eur J Vasc Endovasc Surg 2018 Jan; Mas JL Académie Médecine 2019 Oct; Chatuverdi S. et al. F1000Research 2020 Aug)
Le patient avec sténose carotide est souvent polyvasculaire (connu ou non). Il existe une corrélation positive entre sévérité des sténoses carotides et sévérité des lésions coronaires (que la sténose carotide soit symptomatique ou non). L’HTA est facteur de risque de sténose carotide, d’infarctus lacunaire, d’AVC cardio-embolique, d’AVC hémorragique. Le tabagisme est facteur de risque d’AVC ischémique et d’AVC hémorragique … 10% des patients avec sténose carotide ont une FA, 10% des patients avec FA ont une sténose carotide (Noubiap et al, Am J Cardiol2020).
Ainsi pour prévenir les AVC il est bien plus rentable d’agir sur les facteurs de risque !
Un exemple avec le tabagisme est particulièrement impressionnant. Si la prévalence du tabagisme de l’adulte USA était réduite de 1%, dès la première année seraient épargnées 924 hospitalisations pour infarctus du myocarde, 538 hospitalisations pour AVC (Stroke), 190 décès pre-hospitaliers, 44 millions US$ 1995. Pour parvenir au même résultat pour les seuls AVC, sur base ACAS-ACST, il faudrait opérer 46.000 sténoses carotides asymptomatiques … après avoir dépisté environ 1.000.000 de sujets/patients haut risque ! (Hankey GJ. Journal of Cardiovascular Risk 1999. Lightwood JM, Glantz SA. Circulation 1997).
Enfin n’oublions pas que passé un certain âge, l’âge lui-même est le facteur de risque principal, d’où l’intérêt du maintien d’une bonne hygiène de vie et d’une activité physique.
Le dépistage des sténoses carotides asymptomatiques ne se discute que si les règles du traitement médical optimal sont appliquées et respectées. Chercher à dépister une sténose carotide asymptomatique chez un patient tabagique actif hypertendu non-contrôlé n’a pas de sens.
Si la prévention médicale de l’athérosclérose est bien conduite, si on maitrise la qualité des examens et de la suite qui leur est donnée, il peut être raisonnable de dépister des lésions carotides chez le patient asymptomatique présentant un souffle carotidien (Guidelines communs à 22 sociétés de Cardiologie et Neurologie) ou chez les patients avec facteurs de risque multiples ou avec une artériopathie des membres inférieurs connue ou toute affection cardio-vasculaire (Society for Vascular Surgery) dans l’idée d’affiner la quantification du risque cardio-vasculaire et d’identifier les sténoses carotides asymptomatiques à haut risque neuro-vasculaire ischémique homolatéral, on y reviendra plus loin.
Pour ceux qui aiment encore l’examen clinique, le souffle cervical systolique strident ou le souffle continu systolo-diastolique fin, feutré sont en règle le fait d’une sténose très serrée sous-jacente.
Tu peux me dire que j’ai oublié le classique dépistage pré-opératoire des sténoses carotides (chirurgie cardiaque, chirurgie lourde non-cardiaque) : les études récentes montrent que -la majorité des AVC post-op surviennent en l’absence de sténose carotide ou ne peuvent pas être attribués à une sténose carotide asymptomatique préalable, -en cas de sténose carotide unilatérale les AVC sont autant ipsilatéraux que controlatéraux à la sténose. Au total ce dépistage pré-op ne semble plus justifié.
Pour mémoire la prévalence des sténoses carotides ≥ 50% diamètre en population générale augmente de façon exponentielle avec l’âge : de l’ordre de 1% dans la tranche 50-59 ans, de l’ordre de 8% pour les 80 ans et plus.
En France cela donne environ 750.000 personnes avec une sténose ≥ 50% et 220.000 avec une sténose ≥ 70% (J.L. Mas).Question 3 : Le traitement médical complet ou BMT joue un rôle important dans la gestion thérapeutique des sténoses carotidiennes en général et notamment en cas de sténose asymptomatique, jusqu’à quel degré de sténose ?
Réponse courte, le traitement médical optimal (TMO) ou Best Medical Treatment (BMT) joue un rôle majeur dans la gestion, dans le traitement des sténoses carotides, qu’elles soient asymptomatiques ou symptomatiques, et ce quel que soit le degré de sténose.
Les études princeps sont en partie périmées parce que le traitement médical a fait un bond avec l’arrivée des statines, la prise en compte plus rigoureuse de l’HTA et la « découverte » du rôle majeur de l’hygiène de vie. Le traitement médical peut réduire une sténose mais ne la fait pas disparaitre. Son rôle est dans la prévention des complications de la plaque ou de la sténose carotide, dans la lutte contre le passage de l’athérosclérose à l’athérothrombose et ce quel que soit le siège des lésions (c’est là un atout majeur, la prévention primo-secondaire des accidents liés à la sténose carotide,c’est aussi la prévention des AVC dans leur ensemble, la prévention des accidents coronaires, la prévention des complications de l’artériopathie des membres inférieurs, …).
Le TMO ne se limite pas à une ordonnance standardisée délivrée à la va vite en fin d’examen. Il faut expliquer en détail les enjeux et les modalités au patient, bien lui préciser qu’il s’agit d’un traitement au long cours, au besoin on complètera en demandant au patient de revenir pour un entretien spécifique.
Outre l’arrêt définitif du tabagisme, une activité physique régulière, une alimentation de type méditerranéen et la lutte contre le surpoids ou l’obésité, ce traitement inclue une statine au long cours (en ciblant LDL < 1 voire < 0.7 g/L, voire < 0.5 g/L, un antiplaquettaire au long cours (en général aspirine 75-325 mg), le contrôle strict de la pression artérielle (PA < 140/90 mm Hg), et le traitement d’un diabète éventuel (HbA1c < 7%). L’adhérence au traitement doit être testée à chaque consultation.
Il importe aussi d’expliquer au patient les symptômes et signes d’AIT ou de CMOT pour qu’il consulte rapidement en cas de survenue.
Question 4 : A partir de quel degré de sténose asymptomatique doit-on envisager un traitement chirurgical
A la suite de l’étude ACAS (1987-1993), le seuil d’indication opératoire était sténose > 60% (plus petit diamètre luminal vs diamètre luminal de l’ACI distale où les parois sont parallèles). Il est monté à 70% avec l’étude ACST (1993-2003).
Actuellement le degré de sténose n’est plus que la 1ère étape du diagnostic. Il faut ensuite préciser les caractères de la sténose tant au point de vue du risque thrombo-embolique que du risque hémodynamique.
En effet, l’ensemble des études suggère que, sous traitement médical optimal (TMO), le risque annuel d’AVC ischémique homolatéral à une sténose carotide asymptomatique se situe actuellement entre 0,5 et 1 % / an. Si le TMO est appliqué et si on est logique, la place pour une indication opératoire est restreinte.
Il faut aussi prendre en compte l’espérance de vie du patient, une espérance de vie > 5 ans est un critère dans l’indication opératoire pour sténose carotide asymptomatique et ce quel que soit l’âge du patient (ESVS guidelines 2018).
Maintenant je ne suis pas naïf, des guidelines à la vraie vie, d’autres critères sur lesquels je ne m’étendrai pas interviennent dans les indications opératoires. Les taux d’interventions pour sténose carotide asymptomatique parmi l’ensemble des interventions pour sténose carotide laissent perplexe : 90% aux USA, 65-70% en Italie et en France, 40-45% en Hongrie et en Suisse, 33% en Australie, 15-25% en Finlande, Norvège, Suède et Royaume-Uni, 0% au Danemark ! (données 2004-2010).
Question 5 : Quels sont les paramètres de vulnérabilité de la sténose dont on dispose. Est-ce que la vulnérabilité de la plaque est aujourd’hui un paramètre important décisionnel ?
Je n’aime pas trop ce terme de vulnérabilité de la plaque ou de la sténose. Vulnérable « qui est exposé à recevoir des coups, qui est exposé aux atteintes de la maladie, … », alors que là ,c’est l’inverse , c’est la plaque ou la sténose qui est l’agresseur pour le cerveau. Tu veux parler de l’identification des lésions carotides probablement à plus haut risque d’être responsable d’un AVC ischémique. Cinq pistes ont été retenues (toutefois sur des études portant sur de faibles effectifs) :
1- Patients avec infarctus cérébral silencieux,
2- Progression sténosante de la lésion,
3- Risque thrombo-embolique,
4- Risque hémodynamique et.....peut-être
5- Marqueurs biologiques ?La présence d’un infarctus cérébral non-lacunaire asymptomatique dans le territoire de l’ACI sténosée est retenue in ESVS Guidelines 2018 (RR 3 - IC95% 1.46-6.29, p 0,002).
L’évolution sténosante de la lésion (plaque, sténose) est lente, une progression « rapide » est a priori le fait d’un hématome intra-plaque ou d’un thrombus. Pour les sténoses 50-99% stables le taux annuel d’AVCi, le risque, double avec la progression de la sténose dans une étude multicentrique observationnelle, l’augmentation du risque est plus net si la sténose progresse franchement rapidement RR 4,7 (95%IC: 2,3-9,6) dans un RCT multicentrique. Mais tout cela dépend de par qui et comment est fait le suivi, c’est surtout valable si c’est le même examinateur et si la rapidité d’évolution est appréciée sur un graphique.
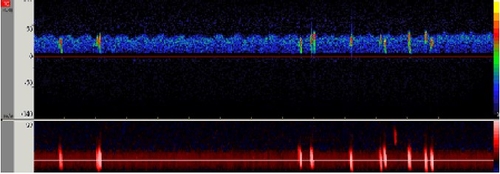 L’évaluation du risque thrombo-embolique repose sur plusieurs paramètres : l’échostructure de la lésion (an-hypoéchogène, hypoéchogène-hétérogène) d’autant plus précise que l’on dispose d’un support informatique, la vascularisation de la lésion en écho de contraste, la détection de micro-embols ou HITS du côté de la lésion (monitoring Doppler trans-crânien). En imagerie radiologique, analyse de la lésion en IRM de haute définition (la référence actuelle), le volume de la lésion en CT (risque proportionnel à la surface et au volume). Dans une méta-analyse le risque annuel d’AVCi pour les sténoses 50-99% diam est de 4.2% lorsque la sténose est à dominante anéchogène/hypoéchogène versus 1.6% lorsque la sténose est à dominante échogène. Dans une autre méta-analyse la détection de HITS augmente le risque annuel d’AVCi avec un OR à 2,61 (p 0,001). Dans une étude multicentrique, le risque annuel d’AVCi des sténoses 70-99% uniformément anéchogène/hypoéchogène avec détection de HITS du côté de la sténose est de 8.9% vs 0.8% dans le cas contraire.
L’évaluation du risque thrombo-embolique repose sur plusieurs paramètres : l’échostructure de la lésion (an-hypoéchogène, hypoéchogène-hétérogène) d’autant plus précise que l’on dispose d’un support informatique, la vascularisation de la lésion en écho de contraste, la détection de micro-embols ou HITS du côté de la lésion (monitoring Doppler trans-crânien). En imagerie radiologique, analyse de la lésion en IRM de haute définition (la référence actuelle), le volume de la lésion en CT (risque proportionnel à la surface et au volume). Dans une méta-analyse le risque annuel d’AVCi pour les sténoses 50-99% diam est de 4.2% lorsque la sténose est à dominante anéchogène/hypoéchogène versus 1.6% lorsque la sténose est à dominante échogène. Dans une autre méta-analyse la détection de HITS augmente le risque annuel d’AVCi avec un OR à 2,61 (p 0,001). Dans une étude multicentrique, le risque annuel d’AVCi des sténoses 70-99% uniformément anéchogène/hypoéchogène avec détection de HITS du côté de la sténose est de 8.9% vs 0.8% dans le cas contraire.L’évaluation du risque hémodynamique est assez facile en écho-Doppler si on veut bien s’en donner la peine avec la combinaison des critères suivants :
- mesure comparative des index de résistance au niveau des carotides communes (I.Vi),
- mesure comparative des débits carotidiens (en TAMV sur les ACC),
- évaluation comparative des signaux sylviens (amplitude et temps de montée),
- évaluation de la vasoréactivité cérébrale (par blocpnée-hyperpnée en 1ère intention, par test au CO2 en 2ème intention).
Le maintien du débit ACC malgré une sténose très serrée indique a priori une vasodilatation cérébrale pour compenser un défaut de suppléance par le polygone de Willis ; l’augmentation du temps de montée des signaux ACM et l’abolition unilatérale de la vasoréactivité cérébrale indique que la sténose ACI est mal suppléée. L’écho-Doppler cervical et transcrânien fait à mon sens mieux plus facilement et mieux le diagnostic de sténoses pseudo-occlusives de l’ACI que l’angio-MR ou l’angio-CT (la référence était l’artériographie conventionnelle numérisée avec les critères NASCET-Rothwell). Il est important de savoir faire ce diagnostic de sténose pseudo-occlusive (c’est-à-dire qui se comporte comme une occlusion complète) car c’est la sténose hyper-serrée de l’origine de l’ACI pour laquelle le bénéfice de la chirurgie est marginal à 2 ans et nul à 5 ans.Des marqueurs biologiques sont en cours d’évaluation, l’hs-CRP apparait en bonne place.
Question 6 : Sténose asymptomatique de la carotide et occlusion controlatérale de la carotide : quelle est la conduite à tenir et en fonction de quel degré de sténose
Le sujet est en pleine révision, les études récentes (Patel P.B. et al, J Vasc Surg 2018 juin ; Turley R.S. et al, J Vasc Surg 2019 sept ; Schneider J.R. et al ,J Vasc Surg 2020 mars) montrent que le patient avec sténose carotide asymptomatique et occlusion de l’ACI controlatérale asymptomatique n’est pas très différent du patient sans occlusion ACI tant au plan de son risque spontané d’AVCi que de son risque opératoire. En fait on retombe dans les éléments discutés dans la question précédente. Ici il est probable que celui qui a oblitéré une ACI de façon asymptomatique a un bon polygone de Willis.
Question 7 : Où en est l’étude ACTRIS (sténose carotide asymptomatique vs traitement médical) ? Que penses-tu de l’étude récente ACST-2 trail (sténose carotide asymptomatique, chirurgie vs stenting) ?
Toutes les études avec un bras TMO ont du mal à inclure. Avant de parler d’ACST-2 et d’ACTRIS, il faut parler de SPACE-2.
SPACE-2 est une étude Allemagne-Autriche-Suisse avec 3 bras parallèles randomisés à égalité (TMO seul vs Endartériectomie carotidienne + TMO vs Stenting carotidien + TMO). Il était prévu d’inclure 3.000 patients, le critère principal d’évaluation était « taux cumulé de décès et tout AVC à 30j. post-op + taux d’AVC ischémique homolatéral à 5 ans ». Puis devant la difficulté à inclure, il a été décidé de faire 2 études « TMO seul vs EAC + TMO » et « TMO seul vs Stenting + TMO ». Malgré cela, l’étude a été arrêtée au bout de 5 ans pour défaut de recrutement alors qu’il n’était pas encore noté de différence significative entre les groupes. Les raisons de la difficulté à inclure interpellent : « SPACE-2 a conclu que le recrutement a largement échoué parce que (1) de nombreux cliniciens non expérimentés pensaient que les interventions étaient justifiées chez la majorité des patients asymptomatiques, (2) les patients initialement référés pour intervention ne voulaient pas être randomisés dans le bras TMO seul ; (3) le stenting était déjà remboursé dans les pays recruteurs pour le traitement de patients asymptomatiques en dehors de l'essai ; et (4) la randomisation TMO seul signifiait une perte de revenu pour les hôpitaux, les chirurgiens et les interventionnistes.». L’amertume des auteurs et les commentaires de Naylor (in EJVES juin 2016) font peine, difficile d’occulter le fait que la sténose carotide asymptomatique est aussi un business !!
L’étude ACTRIS est une étude française comparant TMO seul vs Endartériectomie + TMOchez 700 patients ayant une espérance de vie > 5 ans et jugés à haut risque sur les critères décrits plus haut (Sténose > 70% NASCET avec au moins 1 des facteurs de risque suivant : Progression rapide de la sténose, Sténose hypoéchogène, Détection de HITS, Hématome intra-plaque en IRM, Infarctus cérébral silencieux de type embolique du côté de la sténose, Antécédent d’infarctus cérébral ou d’AIT du côté opposé). Des collègues nous disent inclure des patients, mais on n’a pas d’information et sur le site ClinicalTrials.gov l’étude est donné comme « Not recruiting » alors qu’elle a débuté en 2019. Personnellement je n’aurais pas considéré avec sténose carotide asymptomatique jugée à haut-risque mais au contraire les patients avec sténose jugée à bas risque neuro-vasculaire ipsilatéral.
L’étude ACST-2 est une étude multicentrique européenne2008-2020 dont les résultats viennent d’être publiés dans le Lancet . Elle a inclus 3.625 patients avec sténose carotide asymptomatique > 60% randomisés, endartériectomie carotidienne vs stenting carotidien. Le traitement médical n’a pas été investigué, il était supposé optimal pour la majorité des patients.
A J30, l’item « tout AVC ou décès » était de 2.7% dans le groupe endartériectomie vs 3.8% dans le groupe stenting, l’item « AVC invalidant ou décès » était de 0.9% dans le groupe endartériectomie vs1% dans le groupe stenting ; le risque d’infarctus du myocarde était un peu plus élevé dans le groupe endartériectomie.
A 5 ans, l’item « tout AVC ou décès » était de 7% dans le groupe endartériectomie vs8.6% dans le groupe stenting, l’item « AVC invalidant ou décès » était de 4.5% dans le groupe endartériectomie vs5.3% dans le groupe stenting.
Au congrès ESC les résultats ont été présentés : morbidité-moralité à j30 1% dans les deux groupes, à 5 ans AVC invalidant ou fatal non-liés à la procédure 2.5% dans les deux groupes, tout AVC non-lié à la procédure 4.5% dans le bras chirurgie et 5.2% dans le bras stenting.
Il a été conclu que les deux procédures affichaient les mêmes résultats.
Il est probable qu’on aille vers des résultats identiques entre endartériectomie et stenting (sauf peut-être chez la femme et le sujet très âgé) mais tout semble fait pour privilégier le stenting.
Dernière question : carte blanche vers le futur.
Je crois avoir déjà laissé transpirer mes sentiments. Comme titrait R. Naylor dans le J Vasc Surg de juin 2009 « Who benefits most from intervention for asymptomatic carotid stenosis: patients or professionals? »
Les études princeps ont été menées pour défendre la chirurgie et valider un degré de sténose seuil d’indication opératoire. Le patient avec sténose carotide asymptomatique, comme le patient avec un petit anévrisme de l’aorte asymptomatique, est victime de la notion de seuil d’indication opératoire. La chirurgie, comme le stenting maintenant, étant perçu comme le traitement le patient dont la lésion carotide est dite non-chirurgicale est renvoyé au suivi en imagerie jusqu’à ce que la sténose soit déclarée « chirurgicale », dans ce schéma le traitement médical passe souvent aux oubliettes.
Pourtant le TMO actuel, s’il est bien appliqué et suivi, est la clef de voute de toute la prise en charge de ces patients avec sténose carotide asymptomatique. Un faible pourcentage de ces patients relèvent de la chirurgie ou du stenting carotidien. Cela veut dire qu’il faut identifier ces patients avec une bonne fiabilité ; non seulement une bonne fiabilité mais, compte-tenu de la prévalence élevée de ces lésions, avec des moyens et des praticiens faciles d’accès.
L’écho-Doppler cervical et transcrânien a un rôle majeur à jouermais à condition qu’on arrête de dire «ah mais, c’est opérateur-dépendant ! », à condition que le but de cet examen aille bien au-delà de sténose < ou > 50%, à condition qu’on sache utiliser toutes les possibilités de l’EDC et de l’EDTC pour dire risque standard ou haut-risque neurovasculaire ipsilatéral.
Dans le cas contraire je crois que l’EDC n’aura bientôt, n’a peut-être déjà, plus d’intérêt dans les sténoses carotides asymptomatiques.
Enfin si demain on se met véritablement à vouloir faire des économies de santé, peut-être qu’on misera tout sur le TMO chez les patients avec des facteurs de risque vasculaires, avec un traitement gradué en fonction du risque, sans chercher à savoir si les patients ont telles ou telle lésions ou sténoses.
F. Becker 21/10/2021
Merci François d'avoir abordé cette question importante de manière détaillée et documentée, as usual....
- La cascade d’examens lorsque le 1er examen n’est pas jugé suffisamment crédible (problème de l’écho-Doppler « opérateur-dépendant ») ou lorsque le 1er examen (en général l’écho-Doppler) est systématiquement vérifié par une artériographie dès lors qu’il n’est pas normal ou lorsqu’il est seulement demandé à l’écho-Doppler des critères de vitesse systolique de sténose « ≥ 50% » auquel cas une artériographie est réalisée pour décider de la suite (position radiologique).
-
Entretien : les TVP distales

Nouvelle rubrique :" les entretiens de #MedVascInfo", avec......
"La connaissance, c'est partager le savoir qui nous fait grandir." Olivier Lockert
"Savoir, c’est pouvoir ! C’est l’action qui détermine si la connaissance est certaine." Swâmi Prâjnanpad
"Le savoir que l’on ne complète pas chaque jour diminue tous les jours." Proverbe ChinoisIl s'agira d'entretiens sur des questions sur la THROMBOSE (Veineuse et Artérielle), sur la PANDEMIE, avec des experts, dont l'expertise est unanimement reconnue.Le but est d'avoir leur vision sur des sujets qui font débat, voire qui sont à l'origine de controverses.Ces entretiens s'inscrivent dans le "PARTAGE du SAVOIR" , si important et si utile, avec le respect de la SCIENCE. Il s'agira d'interviews écrites, tout en laissant à l'expert la liberté totale de ses propos. L'interview classique orale sera pour un peu plus tard quand les problèmes techniques seront résolus
C'est le Dr Jean Philippe Galanaud , Médecin Vasculaire, qui inaugure cette nouvelle rubrique.
Entretien Thrombose veineuse distale avec le Dr. Jean Philippe Galanaud, Département de Médecine Sunnybrook Health Sciences Centre, Université de Toronto, Toronto, Canada
Rappelons que le Dr Jean Philippe Galanaud a beaucoup travaillé et publié sur les TV Distales, il est donc le mieux placé pour répondre aux questions de #MedVascInfo . Crette thématique a été à l'origine de controverses, mais aujourd'hui cette question est consensuelle.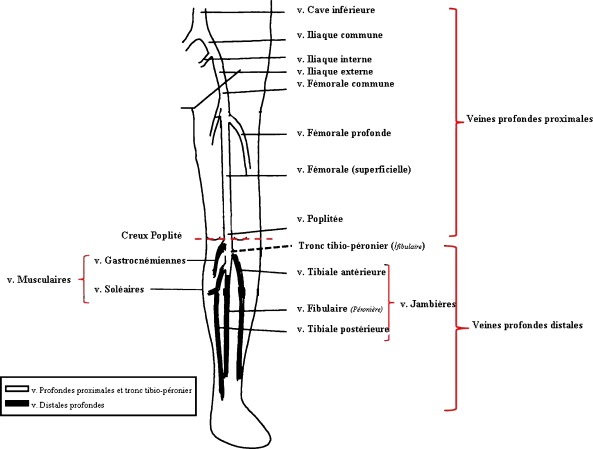
Question 1
Jean Philippe peux-tu nous définir sur le plan anatomique les thromboses veineuses distales des membres inférieurs, de plus pourcentage entre TVP distale vs proximale
D'un point de vue strictement anatomique, les veines distales englobent les veines jambières (tibiale postérieure, péronière, tibiale antérieure (Les thrombose tibiales antérieures sont exceptionnelles) et musculaires (soléaires et gastrocnémiennes) ainsi que le tronc tibio péronier. D'un point de vue pratique, les TVP du tronc tibio péronier sont généralement considérées comme des TVP poplitées. Un peu plus de 50% des TVP isolées (sans embolie pulmonaire) des membres inférieurs sont des TVP distales
Question 2
Existe t il une différence quant à l histoire naturelle des TV musculaires et des TV jambières (hors cancer) , sexe, facteur déclenchant ou non, survenue d'une embolie pulmonaire
Voilà une question à laquelle il est difficile de répondre. Des études cliniques, ont retrouvé un taux d’extension proximal très faible à trois mois (inférieur à 3 %) des TVP musculaires (vs. un taux généralement admis de 10% en cas de tvp distale tout venant), suggérant que le potentiel thrombo-embolique de celles-ci était inférieur à celui des thromboses jambières. Un essai thérapeutique publié par Schwartz en 2010 ne retrouvait pas de bénéfice à un traitement anticoagulant par HBPM pendant 10 jours, par rapport à une compression élastique seule en cas de TVP musculaire. Dans l’étude Cactus, en revanche, il n’y avait pas de différence significative entre le taux d’extension des thromboses jambières et musculaires, même si les thromboses jambières semblaient s’étendre un peu plus. Dans l’étude Optimev, le risque de récidive thrombo-embolique à l’arrêt du traitement ac était similaire entre thromboses jambières et musculaires. En pratique, dans les recommandations Inter sociétés, il n’est pas fait de distinction entre thromboses jambières et musculaires en terme de nécessité de traiter et de durée de traitement.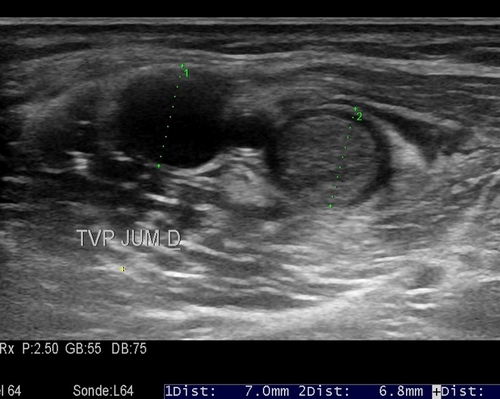 Question 3
Question 3
Le traitement anticoagulant des TVP distales symptomatiques (en dehors du cancer) est il différent selon leur localisation anatomique : molécule, dose, duréeComme mentionné précédemment, il n’est pas fait de distinguo entre les thromboses jambières et musculaire en terme de traitement dans les recommandations Inter sociétés. En revanche, le nombre de segments veineux thrombosés semble influencer le risque de récidive, et, en cas de thrombose multiples, il est suggéré de traiter trois mois plutôt que six semaines par anticoagulants. Les thromboses du tronc tibio-péronier, devraient quant à elle être traitées comme des thromboses poplités en raison de leur risque de récidive similaire à celui des thromboses poplités.Concernant le choix de la molécule, les anticoagulants oraux direct, à dose curative, même s’ils n’ont pas fait encore l’objet d’une évaluation par le biais d’un essai thérapeutique dédié, constituent le traitement de première intention.Question 4
Le traitement anticoagulant des TVP distales symptomatiques au décours d'un cancer actif est il différent selon leur localisation anatomique : molécule, dose, durée
L’étude Optimev a mis en évidence qu'en l absence de cancer le risque de récidive des thromboses distales était deux fois moindre qu’en cas de thrombose proximale et la majorité des récidives etaient de thromboses distales. En revanche, lorsque la thrombose distale survient au décours d’un cancer, le pronostic, en terme de récidive, de type de récidive et de mortalité est comparable à celui des TVP proximales chez les patients cancéreux. Aussi, en cas de thrombose distale chez un patient cancéreux, lorsque la thrombose survient en dehors de tout facteur transitoire surajouté, un traitement anticoagulant prolongé peut/doit être proposé si le risque hémorragique le permet et si c’est en accord avec le choix du patient. Le choix de la molécule est identique à celui que l’on prescrirait chez le même patient présentant une thrombose proximale. En cas de risque hémorragique, l’intensité du traitement anticoagulant peut et doit être adaptée de façon plus souple qu’en cas de TVP proximale.Question 5
Quelle est la prise en charge des TVP distales asymptomatiques ?
Dans la pratique clinique, en cas de découverte d’une thrombose distale asymptomatique, en l’absence de risque hémorragique, les patients sont généralement traités de la même manière que pour une thrombose symptomatique. L’élément modulateur principal du traitement des thromboses distales est le risque hémorragique. En cas de risque hémorragique élevé, une surveillance par écho-Doppler à une semaine plus ou mois 2 semaines doit être proposée. Un traitement à dose prophylactique, peut aussi être proposé, si le risque hémorragique le permet. Enfin, il ne faut pas déployer de filtre cave en cas de thrombose veineuse profonde distale et proposer une surveillance écho-Doppler
Merci Jean Philippe pour avoir accepté de participé à ce premier entretien sur #MedVascinfo avec des réponses claires et précises.Bibliographie
Galanaud JP, Quenet S, Rivron-Guillot K, Quere I, Sanchez Muñoz-Torrero JF, Tolosa C, Monreal M; RIETE INVESTIGATORS.
Comparison of the clinical history of symptomatic isolated distal deep-vein thrombosis vs. proximal deep vein thrombosis in 11 086 patients J Thromb Haemost . 2009 Dec;7(12):2028-34.
JP Galanaud ,MA Sevestre, C Genty, JP Laroche, V Zizka, I Quéré, JL Bosson, OPTIMEV SFMV investigators, Comparison of the clinical history of symptomatic isolated muscular calf vein thrombosis versus deep calf vein thrombosis, J Vasc Surg 2010;52:932-8.
JP Galanaud, JL Bosson, I Quéré, Risk factors and early outcomes of patients with symptomatic distal vs. proximal deep-vein thrombosis,Curr Opin Pulm Med, 2011 Sep;17(5):387-91.
J-P Galanaud, S R Kahn, A Khau Van Kien, J-P Laroche, I Quéré, Epidemiology and management of isolated distal deep venous thrombosis, Rev Med Interne,2012 Dec;33(12):678-85.
Righini M, Galanaud JP, Guenneguez H, Brisot D, Diard A, Faisse P, Barrellier MT, Hamel-Desnos C, Jurus C, Pichot O, Martin M, Mazzolai L, Choquenet C, Accassat S, Robert-Ebadi H, Carrier M, Le Gal G, Mermilllod B, Laroche JP, Bounameaux H, Perrier A, Kahn SR, Quere I, Anticoagulant therapy for symptomatic calf deep vein thrombosis (CACTUS): a randomised, double
blind, placebo-controlled trial, Lancet Haematol . 2016 Dec;3(12):e556-e562.
Robert-Ebadi H, Righini M.Should we diagnose and treat distal deep vein thrombosis?Hematology Am Soc Hematol Educ Program
2017 Dec 8;2017(1):231-236.
Kirkilesis G, Kakkos SK, Bicknell C, Salim S, Kakavia K Treatment of distal deep vein thrombosis, Cochrane Database Syst Rev2020 Apr 9;4(4):CD013422.
Quéré I, Glanaud JP, Sanchez O, Quelle est la prise en charge des thromboses veineuses profondes sous-poplitées ? Revue des Maladies Respiratoires 2021,38, e164-e170
-
Entretien avec Christophe Bonnin : la dysfonction érectile (DE)
"Nos vertus, nous les devons à l'impuissance où nous sommes d'avoir des vices."
Jules Renard"Il y a beaucoup de gens dont la facilité de parler ne vient que de l'impuissance de se taire."Savinien Cyrano De Bergerac
"Comme le coeur et comme le sexe, le rire procède par érection. Rien ne l'enfle qui ne l'excite. Il ne se dresse pas à volonté." Jean CocteauUn motif de consultation en médecine vasculaire, on peut assurer la partie technique, mais nous ne sommes pas toutes et tous des sexologues.
J’ai donc demandé à Christophe Bonnin de délimiternotre champ d’investigation « vasculaire »
Christophe Bonnin
Médecin Vasculaire libéral Nice
Praticien attaché au CHU Nice, sercive Médecine Vasculaire
Membre du bureau de la SFMV
Expert dysfonction érectile pour la SFMV
Définition de la DELa dysfonction érectile (DE) est définie comme « l’incapacité d’obtenir et/ou de maintenir une érection suffisante pour permette une activité sexuelle satisfaisante." C’est la définition retenue par le DSM-V (5ème édition du Manuel diagnostique et statistique des troubles mentaux, et des troubles psychiatrique). Cette incapacité doit être installée depuis plus de 6 mois – auparavant c’était 3 mois – et éprouvée dans 75 à 100% des occasions d’activités sexuelles et associée à une détresse cliniquement significative. Le délai de 6 mois peut néanmoins être raccourci en cas de traumatisme ou de DE post-chirurgicale.
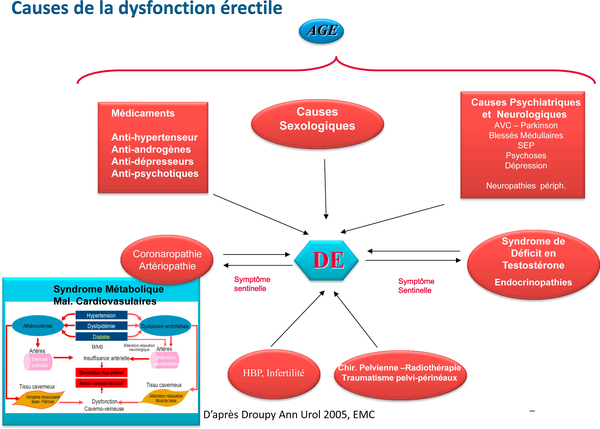
Peux-tu définir la population vasculaire chez laquelle la DE fait partie des signes cliniques à rechercher ?Je dirai, à l’instar des recommandations sur l’évaluation du risque cardiovasculaire, tous les patients de plus de 40 ans, qu’ils aient ou non des facteurs de risque cardiovasculaire connus, car la DE est un marqueur précoce du risque cardiovasculaire et peut être annonciatrice notamment d’une coronaropathie dans les 3 à 5 ans suivant son apparition.
A quoi va servir la réalisation d’un écho Doppler ?
L’écho-Doppler pénien avec stimulation pharmacologique, car on ne conçoit pas actuellement de réaliser un écho-Doppler pénien sans stimulation pharmacologique en dehors de rares contre-indications, sert à mettre en évidence deux causes vasculaires isolées ou associées de DE : l’insuffisance artérielle érectile et la dysfonction veino-occlusive, même si pour cette dernière le diagnostic en est relativement complexe. Outre cet objectif, il constitue bien souvent la première occasion de réaliser une injection intra-caverneuse et de montrer au patient la simplicité du geste et l’absence de douleur associée. L’érection complète parfois obtenue peut également constituer une réassurance pour le patient.

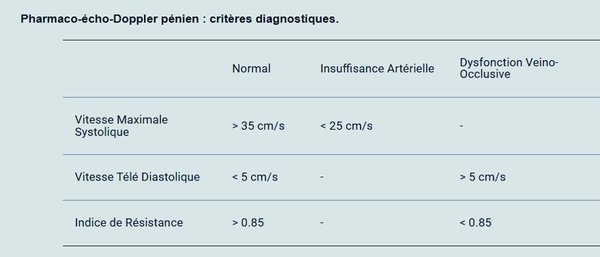
Intérêt de la réalisation d’un test pharmacologique intra caverneux et comment l’interpréterLe test pharmacologique intra-caverneux comme test diagnostique est proposé en deuxième intention, après le bilan consensuel et le traitement par IPDE5. Un test positif constitue en une érection rigide apparaissant dans les 10 mn suivant l’injection et durant au moins 30 minutes. Il donne des informations sur le statut vasculaire, mais qui sont limitées car s’il élimine l’insuffisance artérielle ou la DVO sévère, il n’élimine pas complètement l’insuffisance artérielle érectile ni la dysfonction veino-occlusive. Il peut par ailleurs être négatif en cas de DE d’origine purement psychogène.
La fuite veineuse mythe ou réalité et comment la mettre en évidence ?La dysfonction veino-occlusive ou « fuite veineuse » n’est pas un mythe. Elle peut être d’origines diverses. Elle peut tout d’abord être liée à l’absence de pression intra-caverneuse suffisante pour assurer la compression des veines sous-albuginéales, soit par lésions artérielles d’amont, soir par dysfonction endothéliale, et on peut parler dans ce cas de fuite « fonctionnelle ». Elle peut être également liée à des anomalies congénitales du retour veineux (DE primaire), à des modifications de structure du tissu conjonctif des travées caverneuses ou encore de l’albuginée (ex : maladie de Lapeyronie). S’il est relativement aisé de pouvoir dire qu’il n’existe pas de dysfonction veino-occlusive, il est beaucoup plus problématique de l’affirmer. Le pharmaco-écho-Doppler permet de la suspecter, le cavernoscanner proposé par Ronald Virag montre les voies de drainage lors d’une fuite veineuse et les anomalies congénitales de drainage. Le problème est que ces examens précisent rarement le mécanisme en cause.
Prise en charge de la DE thérapeutique : indications, contre-indications
Selon les recommandations actuelles, la première ligne de traitement est représentée par les IPDE5, en dehors de très rares contre-indications, et sous réserve que l’état cardiovasculaire du patient permette une activité sexuelle. Ils peuvent être donnés à la demande ou en prise quotidienne pour une meilleure efficacité. La prostaglandine E1 par voie locale ou injectable vient en deuxième ligne, de même que le vacuum. La PgE1 peut être associée aux IPDE5. L’implant pénien vient en 3ème ligne.
Quelle place pour un traitement chirurgical en 2022
Le traitement chirurgical n’est pas recommandé par les sociétés savantes. Il existe néanmoins des publications concernant à la fois la revascularisation artérielle, par exemple l’angioplastie pudendale chez des patients très sélectionnés, ou encore le traitement des fuites veineuses par la chirurgie ou embolisation / sclérose des voies de drainage, là encore pour des patients très sélectionnés. E Allaire (Paris) a par exemple récemment proposé l’association stripping de la veine dorsale profonde de la verge – sclérose à la mousse des voies de drainage avec un résultat satisfaisant à 1 an.
Merci Christophe de cette mise au point claireet didactique.
Tablau et Illustrations :
Chapitre 148: Dysfonction érectile, Christophe Bonnin; Patrick Bouilly, in Traité de Médecine Vasculaire, Ed Elsevier Masson , 2021. -
Entretien avec Francis Couturaud : MTEV , durée du traitement
 “Quand les mouettes ont pied, il est temps de virer.” Proverbe Breton
“Quand les mouettes ont pied, il est temps de virer.” Proverbe Breton
“C'était la Bretagne et seule cette province leur semblait capable de rivaliser avec la beauté sauvage de leurs îles.” Hervé Jaouen
"L'essentiel est l'emploi de la vie, non sa durée." Sénèque
Thème : MTEV et durée du traitement anticoagulantLa durée du traitement après un épisode de MTEV (EP/TVP) est un problème quotidien en médecine vasculaire. Nous devons l'envisager en évaluant la balance bénéfice-risque, le risque de récidive et le risque hémorragique. Mais aussi on doit tenir compte des souhaits du patient. Il fallait donc avoir l'avis d'un expert sur cette question. Un grand merci à Francis Couturaud d'avoir accepté cet entretien afin de "baliser" cette décision.
Pr Francis Couturaud
Département de Médecine Interne et Pneumologie, Centre Hospitalo-Universitaire de Brest, Brest, France
EA 3878, INSERM CIC 1412, Université de Bretagne Occidentale, Brest, France
FCRIN INNOVTE, France
Question 1
La durée du traitement anticoagulant en cas de MTEV (TVP et ou EP), est toujours une question difficile. De plus les patients sont soit pressés de stopper ou au contraire de poursuivre l’anticoagulation. Quels sont les circonstances où le traitement peut être stoppé rapidement de 6 semaines à 3/ 6 mois.
Il s’agit des circonstances dans lesquelles le facteur déclenchant est majeur et transitoire : transitoire veut dire réversible, et majeur signifie que la « disparition » du facteur de risque dans le temps est associée à un risque de récidive si faible qu’il justifie un arrêt du traitement anticoagulant (maximum 6 mois). Ces facteurs sont : la chirurgie (avec anesthésie générale > 30 minutes), les traumatismes avec fracture ou plâtre, les alitements de plus de 3 jours pour affection médicale aiguë, le tout dans les 3 mois précédent la MTEV. En outre, en France, dans nos recommandations, nous avons aussi classé les facteurs hormonaux (pilule oestro-progestative, grossesse et post-partum, et traitement hormonal de la ménopause, dans les 3 mois précédent la MTEV) comme facteurs majeurs transitoires : en effet, si le risque d’un premier épisode de MTEV est modéré, en revanche, en termes de récidives, les conséquences sont MAJEURES. Les études sont abondantes sur le très faible risque de récidive dans ces contextes une fois l’exposition hormonale stoppée. Nos recommandations diffèrent ainsi du consensus européen (ESC/ERS).
Question 2
En cas de TVP proximale avec facteur déclenchant, en dehors des circonstances cliniques qui expliquent la TVP, dispose-t'on d’autres d’arguments pour prolonger la durée des anticoagulants : obstruction résiduelle, grosse jambe, D Dimères, thrombophilie, pathologie inflammatoire ?
Ces facteurs ne sont pas associés à un risque indépendant accru de récidive et ils ne sauraient supplanter l’information déterminante apportée par la présence d’un facteur majeur transitoire ; ils ne peuvent donc pas conduire à prolonger le traitement au-delà de 3 ou 6 mois dans le contexte d’une TVP proximale provoquée par un facteur majeur transitoire. Pour mémoire, la recherche d’une thrombophilie n’est pas indiquée dans le cadre d’une TVP provoquée.
Question 3En cas d’EP proximale avec facteur déclenchant, en dehors des circonstances cliniques qui expliquent l’EP, dispose-t-on d’autres d’arguments pour prolonger la durée des anticoagulants obstruction résiduelle, D Dimères, thrombophilie, pathologie inflammatoire, HTAP ou autres ?
Excepté l’hypertension pulmonaire thrombo-embolique chronique, qui justifie formellement un traitement anticoagulant par AVK pour une durée non limitée (en plus de la prise en charge médicale ou chirurgicale spécifique), les autres facteurs (obstruction résiduelle, D-dimères, pathologie inflammatoire) ne sont pas associés à un risque suffisamment élevé pour justifier de prolonger le traitement dans le cadre d’une EP provoquée par un facteur majeur transitoire. Pour mémoire, la recherche d’une thrombophilie n’est pas indiquée dans le cadre d’une EP provoquée.
Question 4
La tentation de l’extension de l’anticoagulation par un AOD en cas de MTEV « idiopathique » ou « plus ou moins idiopathique » est une réalité. Bientôt les « LOW DOSE » vont supplanter les « FULL DOSE ». Peux tu préciser à la fois les indications possibles et les contre-indications de cette « LOW attitude thérapeutique »
L’essai « RENOVE » (randomisation low- versus full-dose d’AOD), dont le recrutement est presque achevé (2500 patients inclus) adresse directement cette question majeure d’une LOW-DOSE chez des patients à haut risque de récidive. Dans l’attente de ces résultats, il faut bien se rappeler des critères d’inclusion dans les études EINSTEIN-CHOICE et AMPLIFY-extension : patients pour lesquels l’indication à prolonger le traitement au-delà de 6 mois est incertaine (en gros, 50/50 en faveur ou défaveur). Il ne s’agit donc pas de patients à très haut risque de récidive dans ces essais. En pratique, les patients éligibles à un traitement LOW-DOSE pour une durée non limitée sont ceux ayant un premier épisode de MTEV non provoquée par un facteur majeur transitoire, en l’absence de cancer, et sans critères de sévérité (EP à risque faible ou intermédiaire faible, TVP proximale jusqu’en fémorale) sont éligibles. Par contre, ne sont pas éligibles, car non inclus dans ces essais industriels, les patients avec EP à haut risque de décès, les MTEV non provoquées récidivantes ni les MTEV avec thrombophilie majeure (antithrombine, et encore moins les antiphospholipides où le recours aux AVK est à discuter notamment pour les triples positifs); de même, les patients avec EP à risque intermédiaire élevé ou thromboses ilio-caves sont sous représentés dans ces essais, dans ma pratique (hors essai thérapeutique), je ne leur propose pas la demi-dose.
Question 5
Quelles est la durée de l’anticoagulation en cas de CANCER et MTEV ?
Sur la base des recommandations françaises, on poursuit le traitement tant que le cancer est actif (non en rémission ou cancer évolutif) et/ou tant qu’un traitement anticancéreux est nécessaire.
Question 6
En cas d’EP asymptomatique découverte sur un scanner au décours d’un cancer doit-on traiter ? Quel est le risque ? En cas de TVP de site inhabituelle (splanchnique, VS, VC…) découverte sur un scanner au décours d’un cancer adopte-t-on les mêmes recommandations pour l’anticoagulation. Enfin quelle anticoagulation pour les mêmes découvertes de MTEV asymptomatique mais en dehors du cancer
Les EP fortuites (= EP non suspectées, qu’elles soient asymptomatiques ou non) dans le cancer sont traités de la même manière qu’une EP suspectée symptomatique dans le contexte du cancer ou hors cancer. Pour les thromboses veineuses profondes de localisation atypique, on traite selon les mêmes modalités qu’une thrombose de localisation « classique » (TVP membres inférieurs ou EP). Ceci dit, nous ne disposons d’aucune bonne étude sur le sujet. Dans ces situations, il est plus que jamais crucial de peser le risque thrombotique au regard du risque hémorragique (ex : thrombose ovarienne : il faut se concerter). Maître mot : décider à plusieurs !
Enfin une MTEV asymptomatique hors cancer est traitée de la même façon qu’une MTEV symptomatique hors cancer.
Question 7
La durée de l’anticoagulation en termes de bénéfice risque tient compte du risque hémorragique et du risque de récidive. Ces deux risques sont différents selon les localisations de la MTEV, selon l’existence d’un cancer ou non. Selon toi peux-tu résumer les caractéristiques des patients à risque hémorragique majeur et ceux à risque de récidives majeurs ?
Point crucial et difficile car certains facteurs sont à la fois des facteurs de récidive de MTEV et aussi des facteurs hémorragiques (ex : cancer, sujet âgé)
Les patients à risque majeur de récidivesont les patients avec MTEV non provoquée récidivante, les EP non provoquées à haut risque de décès (on craint surtout le risque de décès par récidive ici), les MTEV non provoquées avec thrombophilie majeure (antiphospholipides et déficit en antithrombine) et les MTEV dans le contexte d’un cancer actif ou sous traitement anticancéreux.
Les patients à très haut risque hémorragique sont les patients avec anémie (facteur majeur), les insuffisants rénaux, le cancer, les antécédents d’hémorragie sous traitement anticoagulant, l’âge (>75 ans notamment). D’autres paramètres sont à risque hémorragique grave comme l’hypertension artérielle non contrôlée. Dans le cancer, qui est aussi une circonstance à très haut risque de récidive de MTEV, certaines localisations saignent plus, quel que soit le type d’anticoagulant d’ailleurs (HBPM ou AOD) : cancer digestif haut (oeso-gastrique) et urologique (vessie), métastases cérébrales. Enfin certaines associations médicamenteuses augmentent le risque hémorragique : les antiagrégants, certaines chimiothérapies (anti-angiogéniques, anti-tyrosine kinase notamment).
Merci Francis de tes réponses, toujours fondées sur les preuves. Merci aussi article après article, congrès après congrès d'accompagner la Médecine Vasculaire et de toujours répondre présent. -
Entretien avec François Becker : AOMI
 iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
"Toute subversion commence par celle du vocabulaire " Confucius (551-479 av. J.-C.)
"La science est un outil puissant. L’usage qu’on en fait dépend de l’homme, pas de l’outil." Albert Einstein
"Ce qu'on appelle stratégie consiste essentiellement à passer les rivières sur les ponts et à franchir les montagnes par les cols." Anatole France
Entretien avec F. Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire
Un Maître "és Médecine Vasculaire", Maître Yoda de la Médecine VasculaireAOMI, état des lieux
Question 1
Pourquoi l’AOMI est la localisation plus grave de l’athérothrombose ?FB- Je ne crois qu’on puisse dire les choses comme ça. L’AOMI n’est pas en elle-même la localisation la plus grave de l’athérothrombose, ce sont le contexte et nos comportements qui en font la gravité.
Pour ce qui est de l’AOMI athéromateuse elle-même, la majorité des patients porteurs d’une AOMI sont asymptomatiques ou ne rapportent aucun symptôme durant la vie courante. Parmi les patients-AOMI avec claudication intermittente on estime que, dans les 5 ans suivant le diagnostic, 70-80% s’améliorent ou restent stables, 10 à 20% voient leur claudication s’aggraver, 5 à 10% développent une ischémie critique. Par ailleurs 1% des patients-AOMI se présentent d’emblée en ischémie critique. Parmi ces patients en ischémie critique 40 à 50% auront une amputation majeure (jambe ou cuisse) ou décéderont dans l’année suivant le diagnostic. Il faudrait ajouter le risque d’oblitération artérielle aigue thrombotique, d’ischémie aigüe, (environ 1% par an dans les études), mais il est assez rare qu’une thrombose aigüe survienne sans cofacteur. Au total pour ce qui est strictement du risque de l’AOMI, le risque annuel d’amputation majeure est inférieur à 1%.
Pour ce qui est du risque cardio-vasculaire (CV) général il en va différemment. Le risque annuel d’événements CV graves (infarctus du myocarde, AVC, décès CV) est de 4 à 5% chez le claudicant. La mortalité CV à 10 ans est multipliée par 4 à 6 chez le patient avec AOMI par rapport au patient sans AOMI. La morbi-mortalité CV du patient-AOMI est du même ordre, voire un peu plus élevée, que celle du patient coronarien ou du patient ayant fait un AVC.
Deux facteurs me semblent devoir être pris en compte :
1-le fait que dans l’histoire naturelle de l’athérosclérose les coronaires sont touchées en premier, puis les artères des membres inférieurs, puis les carotides (extra- et intracrâniennes),
2-le fait que la prévalence de l’AOMI augmente de façon exponentielle avec l’âge.
Ainsi le patient-AOMI jeune a souvent aussi des lésions coronaires (connues ou non), le patient-AOMI âgé a souvent des lésions coronaires et des lésions carotides (connues ou non). Deux fois sur 3 le patient-AOMI est un polyvasculaireLa mortalité générale est également augmentée à peu près dans les mêmes proportions car le tabagisme est le facteur de risque majeur de l’AOMI athéromateuse. Il faut donc ajouter la mortalité liée au tabac (cancers, BPCO).
Le diabète est également un facteur de risque à prendre en compte dans l’excès de morbi-mortalité, mais il est plus difficile à mesurer car il faudrait distinguer deux cas de figures : le patient-AOMI dont la glycémie est un peu augmentée et le patient-AOMI ayant clairement une artériopathie diabétique touchant électivement les artères distales. Le second est à plus haut risque d’amputation et d’accidents CV que le premier.
Plus rare, mais peut-être plus grave, est l’AOMI chez l’insuffisant rénal chronique au stade terminal.
Le patient avec AOMI athéromateuse a une autre caractéristique peu flatteuse : toutes les études, sans exception, montrent que c’est le patient vasculaire le plus mal pris en charge ; celui pour lequel les recommandations sont les plus mal appliquées, les plus mal observées (et il y en a eu depuis 25 ans !).
« Mal appréciée, sous-diagnostiquée, sous-traitée » est un leitmotiv dans les articles de synthèse. Et ça n’est pas nouveau, déjà Charcot se plaignait du peu de considération pour « sa claudication » !
Les patients sont d’accord pour une pléthore d’examens et d’angioplasties pas toujours utiles, mais la lutte contre le tabagisme et l’incitation à l’entrainement à la marche passent souvent au second plan (soit que le patient renâcle, soit que le médecin ne prenne pas le temps d’expliquer, de convaincre), mais les règles d’hygiène de vie et le traitement médicamenteux de l’athéro-thrombose laissent à désirer (tant au niveau de l’observance que de la prescription). Ces fondamentaux ne sont pas considérés comme pour le patient avec lésions coronaires ou cervico-encéphaliques alors que le niveau de risque CV du patient-AOMI est le même voire supérieur, alors que la fréquence et la sévérité de lésions coronaires, le risque d’AVC, la mortalité toutes causes sont inversement proportionnelles à l’index de pression à la cheville (IPSch). Au-delà du risque loco-régional, l’AOMI est un puissant marqueur de risque CV que l’AOMI soit symptomatique ou asymptomatique (même niveau de risque à même niveau d’IPSch).
Autre point majeur, l’AOMI est encore souvent considérée comme une affection masculine alors que la prévalence de l’AOMI définie sur la mesure d’IPSch est identique chez l’homme et chez la femme pour chaque tranche d’âge (Rotterdam study 1998). Conséquence le « Mal appréciée, sous-diagnostiquée, sous-traitée » est encore plus criant chez la femme !
Enfin il y a également un problème de terminologie qui ajoute à la confusion. En France on parle volontiers d’artérite alors que le terme désigne partout ailleurs les artériopathies inflammatoires, dans les pays anglo-saxons on parle d’artériopathie périphérique (PAD, peripheral arterial disease) en précisant rarement de quelle artériopathie périphérique il s’agit (artères des membres inférieurs ou toute artériopathie non-coronaire). On précise rarement que l’on parle d’artériopathie oblitérante, alors qu’il y a aussi des artériopathies ectasiantes (artériomégalie, dolicho-méga-artères, anévrysmes). De même on précise rarement artériopathie athéromateuse (ou athérosclérose ou athéro-thrombose) alors qu’il y a aussi des artériopathies non-athéromateuses (compression, dysplasie fibro-musculaire, artérites, ..). On précise rarement artériopathie chronique (les formes aigues sont souvent multifactorielles). Récemment un groupe d’experts sous l’égide de Bauersachs a « tapé du poing sur la table » en demandant un terme unique et précis (Vasa juillet 2021 + l’éditorial de Qanadli).
L’artériopathie dont on parle ici est l’artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse,c’est un peu long j’en conviens mais c’est plus précis et plus juste qu’artérite ou PAD !
Je suis un peu long, mais ça fait pas mal de facteurs qui expliquent la gravité de l’ACOMI et tous ne sont pas liés à l’ACOMI …
Et puis n’oublions pas qu’il s’agit d’une affection très fréquente (3 à 7% de la population adulte, 20% des plus de 70 ans) !
Question 2
L’examen clinique est toujours si important dans le diagnostic et la prise en charge de l’AOMI. Quels sont ses passages obligés ?
FB. Bien sûr que l’examen clinique reste important. Au terme d’une carrière on a des tas d’histoires à raconter, parfois dramatiques, sur des cas où l’étape clinique a été négligée.
Certes ça prend un peu plus de temps que de faire un « bon pour écho-Doppler », pourtant en 20 min on peut obtenir pas mal d’informations pour peu qu’on ait le sens de l’anamnèse et que l’on fasse dévêtir le patient.
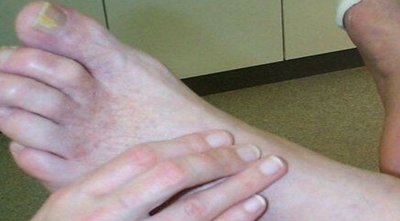 A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
https://www.medicinus.net/examen-peripherique/ (pouls pédieux)
Puis on passe à la palpation des pouls fémoraux au Scarpa membre en rotation externe. Le pouls poplité est parfois plus difficile à percevoir (le rechercher genou fléchi en abduction). L’examen est complété par l’auscultation ilio-fémorale et au niveau de la gouttière fémorale, par la palpation abdominale à la recherche d’un AAA, la palpation simultanée des pouls radiaux et l’auscultation cervicale. Petit détail qui a son importance, attention si un pouls fémoral ou poplité est trop facilement perçu, trop ample, il peut s’agir d’un anévrysme ou d’un pouls de butée.Si les pouls périphériques ne sont pas perçus, et a fortiori s’il existe des lésions cutanées du pied, il faut savoir « lire le pied » à la recherche de signe d’insuffisance artérielle en testant le remplissage de veines du pied (normalement quasi instantané, anormal si on voit la veine se remplir lentement), en appréciant l’état des pulpes digitales et de la coque talonnière (normalement pleines, anormale si flétries « vides » avec contact osseux facile), en évaluant la pression distale par l’angle de décoloration de la semelle plantaire en surélevant lentement les deux pieds membre en extension (alerte si une semelle plantaire reste colorée alors que l’autre se décolore, si la semelle plantaire coté symptomatique se décolore à moins de 40-50°). Ce temps de l’examen ne prend que 2 ou 3 min et peut rapporter gros.
L’analyse des signes et symptômes cardinaux (claudication intermittente, douleurs de décubitus, troubles trophiques) nécessite d’être à la fois ferme sur certains point-clefs et sensible à la nuance sur d’autres.
Avant de qualifier un patient-AOMI d’asymptomatique, il faut prendre en compte l’activité du patient et distinguer l’asymptomatique sédentaire et le symptomatique actif. Le premier peut être asymptomatique avec une occlusion iliaque, le second peut être symptomatique avec une sténose fémorale à 50% au canal de Hunter. Le premier peut être asymptomatique avec un examen du pied montrant des signes d’insuffisance artérielle prononcée, le second peut avoir un examen du pied parfaitement normal. Le premier est à risque CV bien supérieur à celui du second.
La claudication intermittente artérielle dans sa forme typique (la plus fréquente) est une douleur du mollet survenant à la marche, d’abord sous forme de gêne autorisant la poursuite de la marche (distance initiale de claudication) puis sous forme de crampe obligeant à l’arrêt (distance absolue de claudication). La douleur cède assez rapidement à l’arrêt de l’effort en position debout et se reproduit à l’identique pour une quantité d’effort similaire. Ces caractères distinguent la claudication artérielle de la claudication veineuse (douleur sourde puis constrictive du muscle et ne cèdant pas rapidement à l’arrêt de l’effort mais lentement en position de vidange veineuse allongé ou allongé jambe en l’air), des claudications rhumatologiques (mécaniques apparaissant rapidement et ne concernant pas un groupe musculaire donné), de la claudication neurologique (qui n’est pas une douleur musculaire mais une sensation de faiblesse ou d’engourdissement des membres inférieurs cédant en fléchissant le tronc en avant ou en s’asseyant). Il est très important de demander au patient de montrer du doigt là où il a mal et comment la douleur se calme.
Toutefois le tableau n’est pas toujours aussi simple, il existe des claudications artérielles touchant d’autres territoires que le mollet (fesse, cuisse, muscles de la semelle plantaire et parfois même muscles lombaires) et surtout il existe des douleurs combinées (une sténose de l’iliaque commune ou de l’hypogastrique peut s’exprimer sous forme de coxalgie d’effort, une sténose de la fémorale commune et de la fémorale profonde peut s’exprimer sous forme de gonalgie d’effort, une oblitération de l’aorte sous-rénale peut prendre un masque neurologique).
L’item clef est toujours -déclenché par une certaine quantité d’effort de marche, -cédant rapidement à l’arrêt de l’effort, -se reproduisant à l’identique à la reprise de la marche.Les douleurs de décubitus d’origine artérielle sont assez typiques pour peu que l’on demande au patient de montrer où il a mal et comment il calme la douleur. Elles intéressent d’abord l’avant-pied, les orteils (le patient les décrit volontiers en coiffant l’avant-pied de sa main). Le patient trouve à les calmer en verticalisant plus ou moins sa jambe (à ce degré d’insuffisance artérielle le réflexe vasoconstricteur postural est aboli et la pression hydrostatique augmente la pression de perfusion).
Elles évoluent en 3 degrés :
1-douleurs de primo-décubitus s’estompant en mettant le talon au bord du lit,
2-le patient doit laisser pendre la jambe hors du lit pour trouver le sommeil,
3-le patient est obligé de passer la nuit assis au fauteuil, à ce stade un œdème du pied et de la cheville s’installe.Les limites de ce symptôme sont le seuil individuel de sensibilité à la douleur et l’existence éventuelle d’une neuropathie sensitive (fréquente chez le diabétique, non-rare chez le sujet âgé longiligne) ou d’une neuropathie sensitive induite par l’ischémie.
Au total symptôme très précis mais inconstant.
Les troubles trophiques posent plus de problèmes car il n’est pas facile par la seule clinique d’établir le lien de causalité avec l’artériopathie.
Comme les douleurs de décubitus ischémiques, les ulcérations et gangrènes sont aussi acrales, elles siègent aux orteils et sur les zones de frottement du pied (malléole externe, hallux valgus, quintus varus, toute angulation de déformation d’orteil, tout orteil irrité par un ongle adjacent déformé). Elles sont en général douloureuses, plus ou moins sèches ou plus ou moins humides et nécrotiques ; les gangrènes sèches momifiées ne sont pas douloureuses.
Mais AOMI + Trouble trophique du pied n’est pas ipso facto égal à AOMI stade IV :
--le trouble trophique peut être totalement indépendant de l’AOMI, l’AOMI est contingente
--le trouble trophique peut être le fait d’une lésion emboligène plus ou moins sténosante sur l’arbre artériel du membre inférieur.
--l’insuffisance artérielle peut être modeste mais suffisante pour entraver la cicatrisation d’une plaie quelconque (facteur aggravant mais non causal),
--l’insuffisance artérielle peut être directement responsable du trouble trophique que ce dernier soit accidentel ou de survenue spontanée au stade ultime de l’AOMI.
Il est souvent utile d’avoir recours à des examens comme la mesure de pression digitale et la mesure de pression transcutanée d’oxygène à l’avant-pied pour préciser le lien de causalité.
Ces problèmes de qualification des troubles trophiques et leur impact sur l’évaluation des résultats thérapeutiques ont conduit un groupe d’experts à établir la notion d’ischémie critique chronique de membre inférieur (Circulation 1991).
L’ensemble de ces éléments fait que la classification dite de Leriche et Fontaine de 1952-1954 en 4 stades (I asymptomatique, II claudication intermittente, III douleurs de repos et IV troubles trophiques) n’est plus adaptée aux patients tels que nous les voyons aujourd’hui. En termes hémodynamico-cliniques, il n’y a que deux stades : le stade d’ischémie d’effort (regroupant « stades » I et II) et l’ischémie permanente (regroupant stades III et IV et ischémie critique chronique).
Question 3
L’écho-Doppler complète les données cliniques, quel est son apport le plus important ?
Le Doppler puis l’écho-Doppler ont été un tournant dans le diagnostic et la prise en charge de l’AOMI, on peut juste regretter que ça ait pu conduire chez certains à l’abandon de l’examen clinique et à la multiplication d’actes inutiles.
Il est aussi regrettable qu’en France un examen complémentaire soit coté en tant que tel et non pas en fonction de la complexité de l’examen réalisé. Celui qui passe 5 min à faire un écho-Doppler de débrouillage et celui qui passe 45 min à faire un examen complet détaillé cotent le même acte …
 Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.
Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.Mais faire le même examen pour tout le monde n’est pas logique. Il faut distinguer l’examen de 1ère intention qui peut être très simplifié s’il s’agit simplement de répondre à la question « ACOMI ? oui/non », le premier examen définissant la stratégie qui doit être assez complet, l’examen de surveillance qui peut se focaliser sur les points essentiels (par ex. surveillance post-opératoire), l’examen pré-opératoire qui doit pouvoir se confronter à l’artériographie ou être le seul examen décisionnel pré-opératoire.
Quelle que soit l’étendue de l’examen il doit toujours comprendre une mesure de pression distale, indice de pression systolique à la cheville et mesure de pression digitale (au moins chez les patients à haute probabilité de médiacalcose jambière : diabétique, insuffisant rénal chronique, âge > 75 ans).
Deux autres points sont à mettre à l’actif de l’écho-Doppler
--parfois on est surpris du peu de lésions athéromateuses sur l’arbre artériel et il faut savoir se poser la question d’une artériopathie non-athéromateuse (artérite inflammatoire, dysplasie fibro-musculaire, compression, …) ou d’une thrombophilie en cas d’accident aigu.
--l’écho-Doppler est probablement le meilleur examen pour le diagnostic d’artériomégalie et de dystrophie polyanévrysmale qui sont des variétés assez sévères d’artériopathie des M.I.
Question 4
Plutôt que faire des angioscanners en cas d’AOMI, ne vaudrait-il pas mieux réaliser une angiographie diagnostique et thérapeutique du côté du membre atteint ?
FB. Je ne comprends pas très bien ta question. Il y a 25-30 ans que l’on a démontré qu’un examen écho-Doppler méthodique complet avec un compte-rendu précis fait aussi bien qu’une angiographie (et il s’agissait à l’époque d’artériographie intra-artérielle numérisée), le test de Skinner-Strandness (1967) est très utile dans l’évaluation des claudications douteuses, les appareils écho-Doppler actuels permettent une évaluation très précise des artères de jambe et du pied dans l’ischémie critique. Je crois que sauf question très précise à laquelle on n’a pas pu répondre en écho-Doppler et en exploration fonctionnelle, il n’y a en règle pas de place pour l’angiographie de 1ère intention quelle qu’elle soit.
Si telle est ta question, je ne comprends pas l’utilisation l’angio-scanner ou de l’angio-IRM en 1ère intention, je ne comprends pas ces angio-CT/angio-IRM réalisés de façon systématique « pour vérifier un écho-Doppler », je ne comprends pas les angio-CT/angio-IRM réalisées alors que l’indication thérapeutique est clairement d’ordre médical.
A mon sens dans la très très grande majorité des cas l’angiographie est un examen à titre préopératoire et lorsque l’indication est celle d’une angioplastie ça peut être le 1er temps de l’intervention.
Le manque d’argent en Médecine est un fait et une rengaine, mais si on commençait par supprimer tout ce qui ne sert à rien, tous les actes diagnostiques et thérapeutiques inutiles, et on comblerait une partie du manque.
Question 5
Le traitement médical de l’AOMI est très important après la correction des FDRCV, l’activité physique. Quelles sont les molécules à privilégier ?
De plus quelle est la place de l’association rivaroxaban 2.5 mg X 2 plus aspirine 100 mg et la place de la double anti agrégation plaquettaire ?FB. Je ne dirai pas les choses tout à fait comme ça.
Le traitement de l’ACOMI est celui de la prévention cardio-vasculaire, primo-secondaire si le patient est asymptomatique, secondaire si le patient est symptomatique. Mais ce distinguo est ici à mon sens de peu d’intérêt, voire flou, car comme déjà dit le risque CV est inversement proportionnel à l’IPSch que le patient soit symptomatique ou symptomatique. Comme discuté à la question 2, considéré comme asymptomatique un patient sédentaire avec un IPSch à 0.50 et partant ne pas lui prescrire d’antiagrégant selon certaines recommandations n’est pas logique.
L’arrêt du tabagisme est peut-être plus fondamental encore que pour les autres localisations d’athérosclérose.
L’entrainement à la marche pour le claudicant c’est un peu plus que les « au moins 30 min de marche ou autre activité physique par jour » recommandés en prévention CV.
Au plan médicamenteux, le traitement comprend au moins un antiagrégant plaquettaire (aspirine à 75 mg/100 mg/j. ou clopidogrel 75 mg. Le clopidogrel est peut-être préférable tant que le tabagisme n’est pas stoppé, le ticagrelor n’est pas supérieur au clopidogrel) et une statine (en allant progressivement à la dose optimale, en étant d’autant plus exigeant sur le seuil de LDLc que l’IPSch est plus bas). A cela s’ajoute le traitement d’une HTA ou d’un diabète si présent(s) en ciblant la normalité. De même si une dyslipidémie n’est pas suffisamment corrigée par le régime et les statines, l’adjonction d’une nouvelle classe de normolipémiant se discute (ézétimibe, anti-PCSK9)
L’adjonction systématique d’un IEC est recommandée mais ne fait pas l’unanimité.
Quant à la double anti-agrégation plaquettaire ou à l’association AAP-AOD vs monothérapie classique les résultats des essais randomisés peuvent se résumer ainsi : double AAP ou AAP-AOD plus efficace mais plus d’accident hémorragique (assez logique). La question tourne donc autour de la balance bénéfice-risque, pour qui ou quand ? Pour qui ?, logiquement les patients à très haut risque d’accident thrombotique. Quand ? : pour couvrir une période à haut risque, en général post-procédure ou au décours d’un accident thrombotique.
Mais les résultats de l’étude COMPASS à laquelle tu fais allusion vont probablement faire évoluer les pratiques avec extension des indications de l’association aspirine-AOD (dans COMPASS aspirine 100 mg et rivaroxaban 2.5 mg x 2). Personnellement je suis assez nuancé, association Aspirine-AOD pour un patient restant à haut risque malgré un TMO basique bien appliqué oui, Aspirine-AOD ou double antiagrégation plaquettaire chez un sédentaire qui continue à fumer son paquet de cigarettes, non (n’oublions pas que le tabac est aussi facteur d’AVC hémorragique).
Question 6
Comme synthétiser les problèmes de l’AOMI ?
FB. Je crois que l’on n’a jamais fait plus synthétique que E. Housley auquel l’éditeur du BMJ demandait « un article bref, clair, précis sur le traitement du patient-ACOMI claudicant destiné aux MG, pas plus de 800 mots ! » Housley commence son article en disant qu’il a été tenté de répondre « je peux le faire en 5 mots : stop smoking and keep walking »(BMJ may 1988).
 En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!
En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!Le traitement de fond du patient-ACOMI est le traitement médical optimal de la prévention cardio-vasculaire globale (prévention primo-secondaire et secondaire)
La reconstruction artérielle (angioplastie, chirurgie) est un traitement de seconde intention chez le claudicant (claudication invalidante et restant invalidante après un traitement médical optimal de 3 mois bien conduit) et de première intention chez le patient en ischémie permanente (mais le TMO reprend sa place dès cette phase critique passée).
J’ajouterai qu’il faut arrêter de limiter l’ACOMI au mâle claudicant ou avec gangrène du pied,
il faut être conscient que
- à même niveau d’index de pression systolique à la cheville le risque CV est similaire chez le patient-ACOMI asymptomatique et chez le symptomatique.
- l’ACOMI diagnostiquée par IPSch est aussi fréquente chez la femme que chez l’homme.
Abréviations
ACOMI : artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse
CV : cardiovasculaire
IPSch : index de pression systolique à la cheville
TMO : traitement médical optimal
Références.
Polonsky T.S., McDermott M.M. Lower extremity peripheral artery disease without chronic limb-threatening ischemia. A Review. JAMA. 2021;325(21):2188-2198.
Aday A.W., Matsushita K. Epidemiology of peripheral artery disease and polyvascular Disease. Circulation Research. 2021;128:1818–1832.
Becker F., Robert-Ebadi H. Diagnostic clinique de l’ischémie critique chronique de membre inférieur. Rev Med Suisse 2013 ; 9 : 302-5
Becker F., Robert-Ebadi H., Ricco J.B. et al. Chapter I: Definitions, Epidemiology, Clinical Presentation and Prognosis. European Journal of Vascular and Endovascular Surgery (2011) 42(S2), S4–S12
HAS. Prise en charge de l’artériopathie chronique oblitérante athéroscléreuse des membres inférieurs. RPC. Avril 2006
Becker F. Histoire de la claudication intermittente d’origine artérielle, Syndrome de Bouley-Charcot. J Mal Vasc2005, 30, 2, 114-117
Second European Consensus Document on Chronic Critical Leg Ischemia. Circulation 1991 ; 84(4) suppl Nov
Becker F. Classification clinique et hémodynamique des artériopathies chroniques oblitérantes des membres inférieurs. Thèse d’Université 1989.
F. Becker 16/07/21

Merci François pour ce tour d'horizon sur l'AOMI qui est clair, complet, didactique , tout simplement parfait. Tout cela a le mérite de ne pas oublier les fondamentaux en médecine vasculaire comme en médecine en général. La clinique "primum movens" que rien ne remplace et ne remplacera jamais.
-
Entretien avec Grégoire Le Gal : la MTEV veineuse fait découvrir le cancer

“Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire.” A Kirwan
“Si il n'y avait pas la Science, combien d'entre nous pourraient profiter de leur cancer pendant plus de cinq ans ?” Pierre Desproges
Thème : la MTEV veineuse fait découvrir le cancer
Dans la pratique, la recherche d'un cancer en cas de MTEV sans facteur déclenchant pose toujours de nombreux problèmes.
Doit-on,trop en faire ou pas assez ?Quel est le juste milieux ?
J'ai donc demandé à Grégoire Le Gal , "un de nos cousins canadiens" de nous éclairer sur ce sujet.
Merci d'avoir accepté Grégoire. Dr. Grégoire Le Gal MD PHD
Dr. Grégoire Le Gal MD PHD
ProfessorDepartment of Medicine, University of Ottawa
Physician, Thrombosis Unit, Division of Hematology
The Ottawa Hospital - General Campus
Senior Scientist, Clinical Epidemiology Program
Ottawa Hospital Research InstituteQUESTION 1
Grégoire pourrais-tu définir ce qu’est exactement une MTEV sans facteur déclenchant ?
Malheureusement non, pas ‘exactement’. Certaines situations sont faciles à identifier. Une fracture de hanche récente traitée chirurgicalement est un facteur déclenchant évident, mais quid d’une arthroscopie en ambulatoire par exemple ? Par ailleurs, certains facteurs déclenchants telle que la période post-opératoire sont transitoires et réversibles, mais d’autres peuvent être persistants, comme un cancer ou une maladie inflammatoire chronique de l’intestin (MICI).
L’ISTH propose de classer les évènements thrombotiques en trois catégories :
1) provoqués par un facteur déclenchant transitoire « majeur » (chirurgie avec anesthésie générale de plus de 30 minutes, hospitalisation avec alitement d’au moins trois jours, césarienne), « mineur bien qu’important »(chirurgie avec anesthésie de moins de 30 minutes, hospitalisation courte, estrogénothérapie, grossesse ou post-partum, alitement à domicile, traumatisme des membres inférieurs avec mobilité réduite) ;
2) provoqués par un facteur déclenchant persistant : cancer, MICI, anticorps antiphospholipides ; 3) les évènements non provoqués, sans facteur déclenchant.
Mais comme vous le voyez, tout n’est pas noir ou blanc, et si certaines thromboses sont clairement non provoquées (« le coup de tonnerre dans un ciel bleu »), un jugement au cas par cas est indispensable.QUESTION 2
Quel est le % de cancer retrouvé en cas de MTEV sans aucun facteur déclenchant ?
On a longtemps pensé que le risque était de 10% à un an. Les essais randomisés récents ont rapporté des chiffres plus bas, de l’ordre de 5% de cancers occultes. Il est probable que dans les études de cohorte anciennes étaient comptabilisés des cancers qui étaient d’emblée apparents au moment du diagnostic de la thrombose.
QUESTION 3
La recherche d’un cancer dans le contexte de MTEV sans facteur déclenchant crée sas cesse la polémique. Il existe une grande distorsion entre les recommandations et la réalité du terrain. La tentation du scanner Thoraco Abdomino Pelvien est grande. Alors chez qui proposer cette recherche de cancer et comment ?
L’essai randomisé canadien SOME (https://www.nejm.org/doi/full/10.1056/NEJMoa1506623) n’a pas montré de bénéfice du scanner abdomino-pelvien par rapport à un dépistage limité (examen clinique, biologie de routine, mise à jour des examens de dépistage recommandés pour l’âge et le sexe), ni sur le nombre de cancers diagnostiqués au moment du diagnostic, ni sur le risque de cancer au suivi. L’essai français MVTEP (https://clinicaltrials.gov/ct2/show/NCT04304651) a montré qu’un PET-scanner augmentait, mais de façon non statistiquement significative, le nombre de cancers diagnostiqués initialement. En revanche, le risque de cancer au cours du suivi était significativement plus faible dans le groupe des patients ayant eu un PET-scanner par rapport à ceux du groupe ayant eu un dépistage limité. Nous avons entrepris un nouvel essai clinique de plus grande ampleur pour évaluer l’intérêt du PET-scanner dans cette indication.
Dans l’attente des résultats, les guides de pratique français et internationaux préconisent de réaliser un interrogatoire et un examen clinique complets, une biologie de routine et une analyse d’urine, une radiographie pulmonaire, et de mettre à jour les examens de dépistage habituels pour les cancers du sein, du col, de la prostate ou du colon.
Un message important pour finir sur cette question : en pratique, nous sommes souvent très inquiets du risque de cancer chez les patients jeunes présentant une thrombose non provoquée (« pourquoi lui, sportif, en santé etc… »), alors que dans les études récentes, nous avons pu montrer que le risque de cancer était très faible chez les patients jeunes atteints de thrombose (moins de 1%), augmentait de façon assez nette à partir de 50 ans pour atteindre 9% chez les patients de plus de 80 ans. Nous devons donc être particulièrement vigilants chez les patients de plus de 50 ans.
QUESTION 4
En cas de cancer à l’origine d’une MTEV, ce cancer est-il évolué ou au stade occulte, en dehors des tableaux cliniques évolués de cancer.
Dans les essais cités plus hauts, un tiers des cancers solides étaient diagnostiqués à un stage précoce (stade I/II) et deux tiers à un stade plus avancé (III/IV) sans différence significative entre les bras dépistage limité ou intensif. Il faut toutefois noter que quand bien même un dépistage intensif permettrait de diagnostiquer les cancers à un stade plus précoce, le bénéfice sur le pronostic resterait à démontrer. En effet, les études épidémiologiques montrent que la maladie thromboembolique est associée à une mortalité accrue chez les patients avec cancer, et que ceci est particulièrement vrai chez les patients avec un cancer localisé. Même en cas de cancer localisé, la thrombose est probablement la manifestation d’une maladie plus agressive.
QUESTION 5
Existe-t-il une valeur prédictive de cancer en fonction de la localisation initiale de la MTEV : TVP distale versus TVP proximale, EP proximale versus EP distale voire sous segmentaire
Des études antérieures ont montré une association entre thrombose distale bilatérale et diagnostic ultérieur de cancer. Dans les essais de dépistage cités plus haut, le risque de cancer occulte était le même chez les patients avec TVP isolée, TVP et EP ou EP isolée. A noter toutefois que la plupart de ces études avaient exclu les patients avec thromboses distales isolées, et que l’information sur le caractère unilatéral ou bilatéral de la TVP, le caractère sous-segmentaire ou plus proximal de l’EP, n’était pas collectée. Ces points précis n’ont donc pas pu être analysés.
QUESTION 6
Une fois le cancer découvert, le patient est anticoagulé pour sa MTEV. Doit-on envisager alors une modification de ce traitement anticoagulant, selon le type de cancer, selon son évolution ?
Oui. Sans rentrer dans les détails, car cela pourrait faire l’objet d’un entretien complet, la prise en charge de la maladie thromboembolique est bien sûr différente chez les patients avec cancer.
Même si de plus en plus de patients peuvent être traités par AOD, le traitement par héparine de bas poids moléculaire au long cours est toujours indiqué dans certaines situations. Il existe aussi une indication à la poursuite du traitement anticoagulant tant que le cancer est actif et/ou que des traitements sont poursuivis (hormonothérapie…).
Dans l’attente des résultats de l’essai français APICAT,nous manquons de données sur la réduction de la dose d’AOD après 6 mois chez les patients avec cancer.
Etude APICAT : https://clinicaltrials.gov/ct2/show/NCT03692065?cond=API-CAT&draw=2&rank=1
Etude MVPT : https://www.em-consulte.com/article/1029759Merci Grégoire pour la clarté ,la justesse de ton analyse et la pertinence de tes réponses.
-
Entretien avec Isabelle Mahé : Thrombose et cancer
 "L'esprit humain est plus fort que tout ce qui peut lui arriver." C.C. Scott
"L'esprit humain est plus fort que tout ce qui peut lui arriver." C.C. Scott
« Trois idéaux ont éclairé ma route et m'ont souvent redonné le courage d'affronter la vie avec optimisme : la bonté, la beauté et la vérité. » Albert Einstein
Thrombose et cancer : c'est au quotidien que nous sommes de plus en plus concernés par cette association, une liaison dangereuse, dont il faut écarter tous les pièges. Qui est le mieux placé aujourd'hui pour décrypter cette thématique ? Isabelle Mahé a bien voulu répondre à https://medvasc.info/. Merci Isabelle d'avoir accepté cet entretien.
Isabelle Mahé , Professeur des Universités, Praticien Hospitalier en Médecine Interne
Chef du service de Médecine Interne, Hôpital Louis Mourier, APHP, Université Paris Cité
INNOVTE-FCRIN, Cedex2 ,Saint EtienneEpidémiologie de la MTEV au cours du cancer actif et typologie (localisation, récurrence, risque hémorragique)
Avec les progrès notables des traitements anticancéreux ces dernières années, l’espérance de vie des patients avec cancer s’allonge. Dans le même temps, et dans le contexte des progrès réalisés en imagerie, l’incidence des événements thromboemboliques veineux associés au cancer progresse, quel que soit le site du cancer. Dans une étude récente, le risque thromboembolique chez les patients avec cancer a été estimé à 9 fois celui des patients sans cancer.Le risque thromboembolique veineux dépend du site et du stade du cancer, mais aussi des caractéristiques du patient et des traitements du cancer. Ainsi, les cancers du pancréas, gastrique, du poumon et les tumeurs cérébrales sont les plus à risque thromboembolique en risque relatif ; mais en terme d’effectifs, les patients avec cancers du sein, de la prostate et colorectal, en raison de leur prévalence élevée et bien qu’à moindre risque relatif de thrombose, sont les plus nombreux des patients avec thrombose et cancer.
Quel que soit le type de tumeur, la survenue d’un événement thromboembolique veineux est associée à un mauvais pronostic. Par ailleurs, après un premier épisode, sous traitement anticoagulant bien conduit, les patients avec cancer ont un risque majoré de développer une récidive veineuse thromboembolique et d’avoir des complications hémorragiques par rapport aux patients sans cancer.
Pendant longtemps les HBPM ont été le traitement référence de la MTEV au cours du cancer depuis l’étude CLOT. Aujourd’hui les choses changent, les AOD ont le vent en poupe. Qu’apportent les AOD par rapport aux HBPM dans ce contexte ?Par rapport aux HBPM administrés au long cours par voie injectable, les AOD ont l’avantage de la voie orale. Les HBPM sont longtemps restées la seule alternative thérapeutique recommandée chez les patients atteints de thrombose et cancer. Désormais, 2 alternatives s’offrent au prescripteur et au patient, HBPM et AOD, qui ne sont pas exclusives, puisque l’une ou l’autre des options peut être privilégiée au cours du suivi du patient selon le contexte et les préférences, ce qui est très positif.
Que reste-t-il des indications des HBPM en 2022 ?Les HBPM sont et restent une alternative de premier choix dans la prise en charge thérapeutique de la thrombose associée au cancer, comme cela a été rappelé dans la mise à jour des Recommandations Françaises en 2021 (https://doi.org/10.1016/j.
rmr.2021.03.001). De plus, chez les patients avec une insuffisance rénale sévère, situation où les AOD sont contre-indiqués, les HBPM sont privilégiées (Recommandations Françaises 2021).
La prévention de la MTEV au décours d’un cancer actif se pose régulièrement. Quelle est ta pratique à ce sujet ?Les patients avec cancer sont à risque thromboembolique veineux, à l’origine d’un surcroît de morbidité, de mortalité et de coûts de santé. Dans ce contexte, la thromboprophylaxie semble attractive.
Bien que les HBPM aient démontré une efficacité par rapport au placebo dans la prévention du risque thromboembolique veineux chez les patients avec cancer recevant une chimiothérapie en ambulatoire, leur prescription systématique n’est pas recommandée compte tenu de la réduction modeste du risque de survenue d’événement thromboembolique veineux, du risque hémorragique et de la contrainte de la voie injectable.
Plus récemment, les AOD ont été évalués prospectivement chez les patients avec cancer les plus à risque thromboembolique veineux (score de Khorana ≥2), mettant en évidence une réduction du risque thromboembolique veineux à 6 mois, au prix d’une augmentation significative du risque de saignements majeurs.
En pratique, en dehors du cas du myélome qui justifie une prophylaxie, la thromboprophylaxie doit être discutée au cas par cas devant les cancers les plus thrombogènes, en l’absence de facteur de risque hémorragique.
L’étude APICAT qui tu diriges est très attendue, peux-tu nous en rappeler la philosophie ?
Mahé I, et al. Thromb Haemost 2021. doi: 10.1055/a-1647-9896Les essais thérapeutiques évaluant les différents schémas thérapeutiques d’anticoagulants chez des patients avec un cancer ont pour la plupart été menés avec une évaluation à 6 mois de l’événement index.
Avec les progrès des traitements anticancéreux et des soins de support, près de 60% des patients pris en charge pour un événement thromboembolique veineux associé à un cancer sont encore vivants 6 mois plus tard. La question de leur traitement se pose alors.
Après un épisode thromboembolique veineux dans un contexte de cancer, le risque de récidive est élevé, surtout dans les premières semaines suivant l’événement. Après 6 mois, ce risque persiste, même s’il est moins élevé que dans les 6 premiers mois alors que le risque hémorragique est significatif. Dans ce contexte, l'option d’une dose réduite d’anticoagulant semble attractive et justifie d'être évaluée prospectivement.
L’objectif principal de l’étude API-CAT (étude prospective randomisée en double aveugle) est d’évaluer la non infériorité sur le risque de récidive thrombo-embolique veineux d’une dose réduite d’anticoagulant (apixaban 2.5 mg X2/j) par rapport à la dose pleine (5 mg X2/j) chez des patients avec cancer actif ayant reçu au moins 6 mois d’anticoagulant pour un événement thrombo-embolique veineux ; si cet objectif est atteint, la supériorité de la dose réduite sur le risque hémorragique sera recherchée. L’analyse sera stratifiée selon le site de cancer.
A ce jour, plus de 1100 patients sur les 1722 patients attendus ont été inclus dans les 11 pays participant à l’étude.
Les AOD présentent des interactions avec les traitements du cancer. Peux-tu nous rappeler les interactions les plus dangereuses. Existe-t-il un ou des sites qui permettent en consultation lorsque que la prescription d’un AOD est possible d’éviter des associations à risqueLa question des interactions médicamenteuses entre AOD et anticancéreux est souvent évoquée. Elle peut s’envisager sous 2 angles ; le premier : peut-on attendre un effet de l’AOD sur l’effet antitumoral ? La réponse est non, il y a peu ou pas d’effet attendu de l’AOD sur l’effet du traitement antitumoral ; le deuxième : peut-on attendre un effet de l'anti tumoral sur l’effet de l’AOD ? La question se pose pour les traitements dont le métabolisme passe par le CYP3A4 et qui sont substrats de la P-gp. Dans la plupart des cas, l’intervalle thérapeutique large des AOD permet de ne pas anticiper d’impact clinique. La question reste posée pour les inhibiteurs/inducteurs puissants du 3A4 et de la P-gp, qui étaient des critères de non inclusion des essais thérapeutiques évaluant les AOD dans la thrombose associée au cancer. Il faut rappeler que pour ces situations, les données disponibles concernant les interactions n’ont pas été obtenues chez des patients.
https://cancer-<wbr< a=""> />druginteractions.org</wbr<>
https://www.afsos.org/fiche-
referentiel/prise-charge-de- maladie-thromboembolique- veineuse-cancerologie/
Les nouveaux AOD arrivent. Est-ce que les Anti XI par exemple ont été testés pour traiter la MTEV dans le cancer ou la prévenir ?Les anti XI semblent avoir un profil intéressant : en agissant au niveau du facteur XI, ces traitements permettent de prévenir le risque thromboembolique tout en minimisant le risque hémorragique.
A ce jour des données sont disponibles dans la prévention du risque thromboembolique dans la chirurgie du genou et la prévention du risque cardio-embolique dans la fibrillation auriculaire.
Un tel profil semble particulièrement attractif dans la prise en charge de la maladie veineuse thromboembolique associée au cancer. Des études prospectives randomisées sont sur le point de débuter en France dans la prise en charge initiale de la thrombose associée au cancer, avec un suivi à 6 mois.
Merci à Isabelle Mahé, des réponses claires, pour une meilleure connaissance sur THROMBOSE et CANCER, avec des retombées pratiques précieuses. -
Entretien avec l'auteur : Grégoire Détriché (AOMI/FEMME)
 "C'est par l'expérience que la science et l'art font leur progrès chez les hommes." Aristote
"C'est par l'expérience que la science et l'art font leur progrès chez les hommes." Aristote
Entretien avec le Dr Grégoire Détriché :au sujet de son article "Women Specific Characteristics and 1-Year Outcome Among Patients Hospitalized for Peripheral Artery Disease: A Monocentric Cohort Analysis in a Tertiary Center," Caractéristiques spécifiques aux femmes et résultat à 1 an chez les patientes hospitalisées pour une maladie artérielle périphérique : une analyse de cohorte monocentrique dans un centre tertiaire" in Front. Cardiovasc. Med., 07 February 2022 | https://doi.org/10.3389/fcvm.2022.824466, Co Auteurs : Alexis Guédon, Nassim Mohamedi, Olfa Sellami, Charles Cheng, Alexandre Galloula, Guillaume Goudot, Lina Khider Hélène Mortelette, Jonas Sitruk, Nicolas Gendron, Marc Sapoval, Pierre Julia, David M. Smadja,Tristan Mirault and Emmanuel Messas, "Team HEGP"
le principe de cet entretien est d'aller au delà d'un article Grégoire Détriché est Spécialiste en Médecine Vasculaire, MD PhD
Grégoire Détriché est Spécialiste en Médecine Vasculaire, MD PhD
Ancien interne des hôpitaux de Paris, Chef de Clinique des Universités - Assistant des hôpitaux de Paris
Service de médecine vasculaire, Hôpital Européen Georges-Pompidou, Assistance Publique Hôpitaux de Paris, Université de Paris (APHP-CUP), Paris, FranceUniversité de Paris, Thérapies Innovantes en Hémostase, INSERM, Paris, France
Laboratoire de recherche en biochirurgie (Fondation Carpentier), Assistance Publique Hôpitaux de Paris, Centre-Université de Paris (APHP-CUP), Paris, France
Merci Grégoire de ta réactivité et bravo pour l'article qui montre que les femmes comme les hommes présentent des atteintes cardio vasculaires qui ne sont pas à minimiser, bien au contraire.
Résumé de l'article :Bien que les femmes aient des taux d'incidence, de prévalence et de décès liés aux maladies cardiovasculaires normalisés selon l'âge inférieurs à ceux des hommes, il existe également des rapports indiquant que les femmes atteintes de maladies cardiovasculaires reçoivent moins de soins, moins d'examens et ont de moins bons résultats après un événement coronarien. Les objectifs de cette étude étaient de comparer les caractéristiques des hommes et des femmes hospitalisés pour une maladie artérielle périphérique (MAP), leurs résultats cardiovasculaires et des membres, et leur mortalité à 1 an. L'étude est un registre prospectif recueillant des données sur tous les patients consécutifs hospitalisés pour MAP au sein du service vasculaire du centre tertiaire Hôpital Européen Georges-Pompidou (Paris, France). Les patients devaient répondre à l'un des trois critères d'inclusion : revascularisation antérieure du membre inférieur ou toute occlusion artérielle du membre inférieur due à une maladie vasculaire athérosclérotique ou à des signes hémodynamiques de MAP. Les critères d'exclusion étaient les patients présentant une occlusion artérielle des membres inférieurs due à une autre cause. Tous les patients ont été suivis pendant au moins 12 mois après l'hospitalisation initiale. Parmi les 235 patients inclus, il y avait 61 femmes (26%), plus âgées que les hommes avec un âge médian de 75,6 et 68,3 ans respectivement. Les principaux facteurs de risque cardiovasculaire et les comorbidités étaient similaires pour les hommes et les femmes sauf plus d'anciens ou d'actuels fumeurs [145 (83,4 %) vs 33 (54,1 %)] et plus d'antécédents de maladie coronarienne [42 (24,1 %) vs 7 (11,5 %)] chez les hommes. La plupart des patients [138 (58,8 %)] avaient une ischémie critique des membres et 97 (41,3 %) avaient une claudication, sans différence selon le sexe. Après décharge, 218 patients ont reçu un traitement antithrombotique (93,2 %), 195 un hypolipémiant (83,3 %), 185 un inhibiteur de l'enzyme de conversion ou un antagoniste des récepteurs de l'angiotensine (78,9 %), de même entre les sexes. A 1 an, la mortalité globale, les événements indésirables cardiovasculaires majeurs, les événements indésirables majeurs des membres ne différaient pas avec 23 (13,2 %), 11 (6,3 %) et 32 (18,4 %) chez les hommes, et 8 (13,1 %), 3 ( 4,9%), 15 (24,6%) chez les femmes, respectivement, malgré la différence d'âge. La mortalité globale, les résultats cardiovasculaires, la revascularisation d'un membre ou l'amputation ne différaient pas entre les hommes et les femmes, 1 an après l'hospitalisation pour MAP bien que ces dernières soient plus âgées, moins fumeuses et moins coronariennes.
L'entretien
Aujourd'hui la mortalité chez les femmes et liée aux accidents cardiovasculaires, est largement sous-estimés. Quels sont les facteurs de RCV prédominants chez les femmes par rapport aux hommes ?En effet, pendant longtemps, la pathologie cardiovasculaire féminine a été reléguée au second plan, considérant que cette pathologie atteignait principalement les hommes.
En dehors des facteurs de risque cardiovasculaire modifiables ou non, commun aux deux sexes que nous connaissons tous, des facteurs de risque sont spécifiques aux femmes.
Mes travaux de thèse de sciences m’ont permis, entre autres, de m’y intéresser, et ils sont de deux types : je les qualifierai d’une part d’intrinsèques liés au sexe féminin et d’autre part d’extrinsèque liés à l’environnement féminin. Ces derniers ne sont hélas, pas tout le temps reconnu et recherché.
Les facteurs de risque intrinsèques sont représentés notamment par une ménopause précoce, un diabète gestationnel, des troubles hypertensifs durant la grossesse, un accouchement prématuré et des maladies telles que le syndrome des ovaires polykystiques.
Concernant les facteurs de risque extrinsèques,il s’agit principalement de facteurs de risque psychosociaux tels que les abus et violences sexuelles, les difficultés socio-économiques, l’environnement et le stress au travail etc.
Désormais, lors de nos consultations, notre interrogatoire doit également se tourner vers la recherche de ces facteurs de risque et nous devons notamment retracer avec rigueur l’historique des grossesses de nos patientes.
L'artériopathie chronique oblitérante des membres inférieurs (AOMI) présente-t-elle chez les femmes des spécificités particulières, sur le plan clinique et sur la topographie des atteintes retrouvées https://www.frontiersin.org/articles/10.3389/fcvm.2022.824466/fullL’artériopathie oblitérante des membres inférieurs (AOMI) chez les femmes semble avoir un début plus tardif que chez les hommes. En effet, nous montrons dans notre étude que les patients tout sexe confondus hospitalisés pour AOMI ont un âge médian de 70 ans. Les femmes, à l’admission, ont en moyenne 76 ans alors que les hommes en ont 68, soit 8 ans d’écart ! Cependant, nous avons inclus que des artéritiques hospitalisés, donc très majoritairement des ischémies critiques.
https://www.frontiersin.org/articles/10.3389/fcvm.2022.824466/fullL’artériopathie oblitérante des membres inférieurs (AOMI) chez les femmes semble avoir un début plus tardif que chez les hommes. En effet, nous montrons dans notre étude que les patients tout sexe confondus hospitalisés pour AOMI ont un âge médian de 70 ans. Les femmes, à l’admission, ont en moyenne 76 ans alors que les hommes en ont 68, soit 8 ans d’écart ! Cependant, nous avons inclus que des artéritiques hospitalisés, donc très majoritairement des ischémies critiques.
Nous sous-estimons par conséquent la part de claudicants et d’asymptomatiques chez les femmes dans la population générale !
Cependant, nous devons être alertés par le fait que les symptômes chez les femmes sont volontiers atypiques et moins fréquents que chez les hommes, pouvant expliquer en partie cette sous-estimation diagnostique et la prise en charge tardive de cette pathologie, alors déjà à un stade assez avancé. Pour preuve, nous soulignons dans notre étude, qu’avec moins de facteurs de risque cardiovasculaire que les hommes, les femmes avaient une survie globale, des événements cardiovasculaires majeurs ou des événements majeurs indésirables sur les membres inférieurs définis par des amputations ou des revascularisations, similaires aux hommes !
Pour ce qui est de la topographie des atteintes, nous pensons que le sexe n’influe pas cela mais que c’est plutôt les facteurs de risque cardiovasculaire associé au sexe qui influencent la topographie des atteintes. En effet, les diabétiques ont des atteintes plutôt distales alors que chez les tabagiques, les atteintes sont plutôt proximales.
Quelles sont les atteintes cardio-vasculaires associées chez les femmes qui présentent une AOMILes autres atteintes cardiovasculaires chez les femmes sont comme chez les hommes d’où la nécessité impérative d’un bilan d’extension artériel de l’AOMI, au niveau de l’aorte abdominale (recherche d’anévrisme), au niveau cardiaque et au niveau des troncs supra-aortiques. Je souligne également que la recherche d’une bronchopneumopathie chronique obstructive (BPCO) est aussi pertinente.
En effet dans notre étude, à l’inclusion, notre population présente de manière similaire une insuffisance cardiaque, une BPCO, un anévrisme de l’aorte abdominale et des antécédents d’accidents vasculaires cérébraux, qu’ils soient ischémiques ou transitoires. Seuls les antécédents de cardiopathie ischémique semblent être plus fréquents chez les hommes à l’inclusion.
Rappelons enfin qu’à la lumière des recommandations de la Société Européenne de Cardiologie datant de 2017 et toujours d’actualité, les patients présentant une AOMI ont une probabilité associée de présenter une cardiopathie ischémique dans 25 à 70% des cas, une atteinte carotidienne significative dans 14 à 19% des cas et une sténose de plus de 70% des artères rénales dans 10 à 23% des cas.
Quelles sont tes constatations sur le traitement de cette AOMI chez les femmes ?Certaines études internationales ont mis en exergue le fait que les femmes sont moins bien traitées que les hommes. Ceci doit nous faire vivement réagir !
Nous apprenons qu’in fine, la pathologie cardiovasculaire n’a pas de sexe si j’ose dire. Le traitement vasculo-protecteur, cette fameuse triplette composée d’un inhibiteur de l’enzyme de conversion (IEC) ou d’un antagoniste du récepteur de l’angiotensine II (ARA2), d’un antiplaquettaire (sauf en cas d’AOMI asymptomatique isolée sans autre atteinte artérielle) et d’un traitement hypolipémiant optimal avec un objectif de LDL cholestérol inférieur à 1,4 mmol/l (0,55 g/L) doit être prescrit et appliqué chez tous nos patients ! Après sortie d’hospitalisation dans notre étude, nous constatons l’égalité de prescriptions de ces traitements quel que soit le sexe, et dans des proportions similaires aux grands essais thérapeutiques récents tels que COMPASS et EUCLID.
Les premiers signes de l'AOMI chez la femme sont-ils en rapport avec leur statut hormonal ?Quand on parle de pathologie cardiovasculaire féminine, immanquablement nous pensons bien sûr aux estrogènes. Cependant, je vous propose d’aller un peu plus loin dans la physiopathologie féminine.
Les premières constatations ont été relevées avec les études publiées à partir de la cohorte de Framingham il y a quelques décennies. En effet, il a été montré que les femmes en pré ménopause développaient moins de maladies coronariennes que les femmes ménopausées ou que les femmes du même âge ayant eu une ménopause précoce.
Depuis, les effets cardiovasculaires protecteurs des estrogènes ont été démontrés. Ils favorisent en effet la vasodilatation artérielle, diminuent l’action des cytokines pro-inflammatoires, abaissent les lipoprotéines de basse densité et augmentent les lipoprotéines de haute densité. A la ménopause, de manière schématique, un switch hormonal a lieu : les estrogènes chutent et la concentration plasmatique d’une des gonadotrophines, par boucle de rétrocontrôle, augmente : il s’agit de l’hormone folliculostimulante (FSH). Des études ont même rapporté la corrélation entre taux plasmatique de FSH et épaisseur intima-média carotidienne et score calcique coronaire chez la femme.
Mais concernant le taux de FSH, un autre paramètre est intéressant à regarder : la cinétique d’augmentation du taux plasmatique de cette hormone pendant la période péri-ménopausique. En effet, des auteurs ont souligné que les femmes ayant une cinétique d’augmentation plus faible de la FSH pendant leur transition vers la ménopause pouvaient être moins à risque de développer une athérosclérose symptomatique que celles avec une cinétique d’augmentation moyenne ou élevée de FSH durant cette même période.
Il est ainsi possible que durant leur vie pré-ménopausique, l’athérome reste asymptomatique et que le trigger des manifestations cliniques chez les femmes soit l’augmentation des taux plasmatiques de FSH et leur niveau d’augmentation durant leur période de transition péri-ménopausique.
A la lumière des données de cet article doit-on proposer un dépistage de l'AOMI chez les femmes ? Quand ? Comment ? Périodicité ? Ce dépistage doit-il être global sur le plan CVJe pense bien sûr qu’il faut proposer un dépistage de l’AOMI chez les femmesMerci Grégoire pour ces réponses claires, précises et d'une grande qualité scientifique.
Tout d’abord il s’agit de cibler ce dépistage à la lumière des facteurs de risque cardiovasculaire classique : les femmes de plus de 60 ans.
Après, il nous faut cibler les femmes plus à risque et leur proposer un dépistage plus précoce, en les interrogeant sur leurs facteurs de risque spécifiques. La collaboration avec nos confrères gynécologues et sage-femme prend alors tout son sens, pour une prise en charge globale et pluridisciplinaire des femmes à tous les moments de leur vie.
Nous devons en plus avoir toujours en tête l’atypie des symptômes chez les femmes, et qu’à chaque consultation, même pour un motif totalement différent, prendre des pouls ou enregistrer des flux aux chevilles permettrait de dépister ce « silent killer » qu’est l’AOMI asymptomatique, trop souvent sous diagnostiquée…
Par ailleurs, prendre l’initiative de réaliser des dosages des taux FSH plasmatique durant la période péri-ménopausique afin d’en établir une cinétique permettrait sans doute de stratifier le risque cardiovasculaire chez les femmes à cette période de leur vie et de planifier un suivi cardiovasculaire personnalisé pour chaque patiente.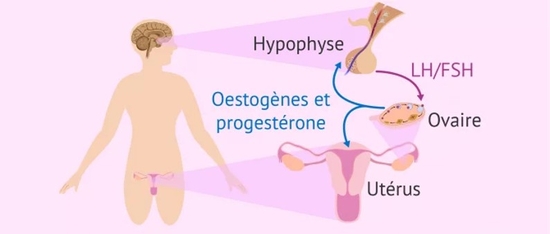
Enfin, devant l’association non négligeable des lésions artérielles athéromateuses, je pense qu’un dépistage global cardiovasculaire par écho-Doppler de l’aorte abdominale, des membres inférieurs et des troncs supra-aortique pour dépistage des plaques (et de l’anévrisme de l’aorte abdominale), associé avec l’échocardiographie trans-thoracique et le scanner coronaire est nécessaire afin de limiter le plus possible l’entrée dans une athérosclérose symptomatique. Je reste persuadé que la prévention cardiovasculaire associé à l’éducation thérapeutique pour toutes et tous permettra, à terme, de réduire de manière significative la morbi-mortalité cardiovasculaire. J'ajouterai que Grégoire fait partie des jeunes médecins vasculaires regroupés au sein du Club du même nom (CJMV) , il sont TOUTES et TOUS l'avenir de la Médecine Vasculaire.
J'ajouterai que Grégoire fait partie des jeunes médecins vasculaires regroupés au sein du Club du même nom (CJMV) , il sont TOUTES et TOUS l'avenir de la Médecine Vasculaire. -
Entretien avec l'auteur : Simon Soudet (JAK2V617F)
 " Le monde est plein de choses claires que personne ne remarque jamais. "Le Chien des Baskerville (1902) de Arthur Conan Doyle
" Le monde est plein de choses claires que personne ne remarque jamais. "Le Chien des Baskerville (1902) de Arthur Conan Doyle
“En science, la phrase la plus excitante que l'on peut entendre, celle qui annonce des nouvelles découvertes, ce n'est pas "Eureka" mais c'est "drôle".” Isaac AsimovNouvelle rubrique avec Simon Soudet , Médecin Vasculaire, Department of Vascular Medicine, CHU Amiens Picardie et EA7516 CHIMERE, Universite Jules Vernes Picardie, Amiens, France à propos de cet article : JAK2 allele burden is correlated with a risk of venous but not arterial thrombosis,Simon Soudet , Gaelle Le Roy , Estelle Cadet , Audrey Michaud , Pierre Morel , Jean Pierre Marolleau , Marie Antoinette Sevestre ,Thrombosis Research 211 (2022) 1–5
https://www.sciencedirect.com/science/article/abs/pii/S0049384822000111
La charge allélique JAK2 est corrélée à un risque de thrombose veineuse mais pas artérielleCette rubrique "ENTRETIEN AVEC L'AUTEUR" a pour but d'interviewé l'auteur d'un article récent afin qu'il nous fasse partager ce qui a motivé cet article et d'aller plus loins que sa simple lecture.
Simon Soudet , Chef de Cliniquue Assistant, Service de Médecine Vasculaire au CHU Amiens Picardie
Merci à Simon Soudet "d'essuyer les plâtres" avec brio
Votre objectif était d'étudier le rôle de la charge allélique de la mutation JAK2V617F dans le risque d'événements cardiovasculaires (EVC) et/ou de thrombose veineuse (TEV) dans une cohorte de patients atteints de : Philadelphia chromosome, negative chronic myeloproliferative neoplasms (MPN) include polycythemia vera (PV), essential thrombosis(ET) and primary myelofibrosis (PM)confirmés ainsi que chez les patients sans MPN confirmé. Pourquoi cette démarche ?L'idée peut paraître effectivement surprenante : pourquoi s'intéresser à une mutation responsable d'une maladie plutôt que de s'intéresser aux patients avec une pathologie donnée?
Deux raisons à cela :
- En tant que médecins vasculaires nous prescrivons parfois la recherche de la mutation JAK2V617F dans le cadre du bilan étiologique d'une thrombose (le plus souvent atypique ou splanchnique) alors que le patient n'a pas (encore) de diagnostic de syndrome myéloprolifératif. Parfois la mutation est positive avant de pouvoir réunir l'ensemble des critères pour classer le patient dans un cadre nosologique donné. Notamment si la numération formule sanguine est normale. Notre question était donc d'interroger l'évolution des ces patients.
- Il existe des arguments physiopathologiques pour penser que la mutation JAK2V617F en elle même a rôle dans le processus de la thrombose. Dans notre étude, nous montrons que plus la charge allélique est élevée, plus le risque est important, cependant, le risque persiste même en cas de mutation à faible taux, ce qui vient confirmer d'autres études précédentes. Cette démarche est à rapprocher de la recherche de Clonalité Hématoipoiétique de Signification Indéterminée (CHIP), qui est définie par la présence d'une mutation acquise à faible taux en l'absence d'anomalie de la numération formule sanguine. Des preuves s'accumulent pour penser que cette CHIP pourrait etre un facteur de risque thrombotique veineux et artériel. La mutation JAK2V617F fait partie des gènes définissant cette CHIP, et notre étude va dans le sens d'un impact propre de cette mutation en termes de thrombose, quel que soit le cadre nosologique.
Évidemment, la stratification du risque thrombotique d'un patient ne repose pas sur la seule présence d'une mutation génétique mais nécessite une approche globale du patient (expertise notamment du médecin vasculaire), nous montrons tout de même une différence de risque selon le diagnostic de syndrome myéloprolifératif.
Pour cette mutation JAK2V617F , pouvez-nous nous expliquer ce qu'est la charge alléliqueLa charge allélique est également appelée ratio allélique.
C'est le pourcentage ou le rapport des allèles mutées sur les allèles non mutées. L'intérêt est de comprendre que ce taux est dynamique dans le temps et que la charge allélique augmente au cours du temps, meme si son histoire naturelle n'est pas connue précisément. Aujourd'hui, le suivi dans le temps de cette charge allélique n'est pas recommandée ni même faite en routine. Notre étude ne permet pas de proposer un suivi régulier de ce taux, mais ces résultats interrogent sur l'intérêt de mesurer ce taux dans l'évolution d'un patient.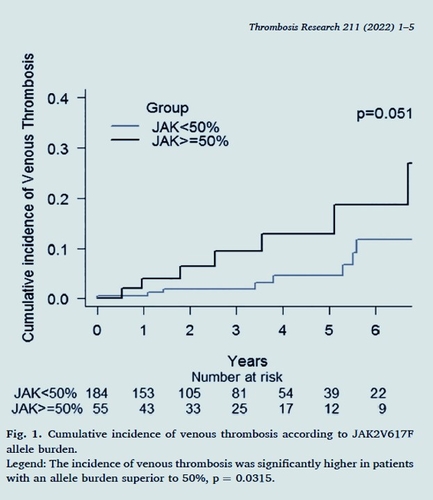 Si cette charge est < ou > 50% , quelles sont les conséquences pratiques en terme d'anticoagulation en cas de THROMBOSE VEINEUSEEn cas de syndrome myéloprolifératif, notre attitude est aidée par plusieurs publications montrant que la première cause de mortalité de ces patients est d'origine thrombotique. En cas de thrombose veineuse associée la prolongation du traitement semble justifiée et fait basculer le patient dans les groupes à haut risque. C'est dans ce groupe que la charge allélique est le plus souvent supérieure à 50%.
Si cette charge est < ou > 50% , quelles sont les conséquences pratiques en terme d'anticoagulation en cas de THROMBOSE VEINEUSEEn cas de syndrome myéloprolifératif, notre attitude est aidée par plusieurs publications montrant que la première cause de mortalité de ces patients est d'origine thrombotique. En cas de thrombose veineuse associée la prolongation du traitement semble justifiée et fait basculer le patient dans les groupes à haut risque. C'est dans ce groupe que la charge allélique est le plus souvent supérieure à 50%.
Si l'on considère les patients avec charge allélique faible (inférieure à 50% et notamment ceux à quelques %) et sans maladie hématologique, la durée d'anticoagulation doit probablement etre conditionnée par les facteurs de risque transitoires ou non, notamment le caractère provoqué ou non et bien sur la clinique intiale (TVP/EP/splanchnique). Nous avons besoin de plus de données et d'essais mais il semble raisonnable de considérer que la présence d'une mutation JAK2V617F est un facteur de risque additionnel persistant. Sa présence incite donc à prolonger le traitement mais au terme d'une évaluation rigoureuse de la situation de chaque patient, c'est toujours une prise en charge personnalisée.
Beaucoup de questions restent en suspens, notamment si l'on considère que JAK2V617F n'est qu'une mutation parmi d'autres. Les liens entre anomalie de l'hématopoièse et le risque de thrombose veineuse et artérielle sont un sujet en développement, notamment grâce au développement de techniques de séquençage de plus en plus sensibles. Les années à venir devraient permettre de mieux cerner l'attitude thérapeutique.Pensez-vous que le recherche de la mutation JAK2V617F hors Sd myéloprolifératif soit utile dans le bilan de thrombophilie soit intéressante, voire utile ou inutile , à titre systématique ou à titre ponctuelTout d'abord, la prescription d'une analyse génétique, même acquise, n'est jamais anodine et les conséquences du résultat doivent pouvoir etre expliquées au patient. La découverte d'une mutation avec charge allélique faible peut etre anxiogène ("attendre" l'apparition d'une possible maladie hématologique) chez certains patients et le suivi / évolution de telles mutations n'est actuellement pas consensuel.
La fréquence de positivité de la recherche de JAK2V617F chez le patient avec thrombose "tout venant" est faible et ne se justifie pas. Par contre en cas d'atypie, de maladie récidivante ou en cas d'anomalie de la numération formule sanguine cette recherche a tout son sens. C'est un outil permettant parfois d'avoir une explications à des histoires thrombotiques complexes et/ ou récidivantes et nous montrons sont potentiel impact pronostic.
En tant que médecin vasculaire, nous sommes fréquemment confrontés à l'absence d'explication de la survenue d'une thrombose. La recherche de la mutation JAK2V617F est un outil de deuxième ligne après discussion de l'intéret de la recherche avec le patient
Merci Simon, je conseille à toutes et à tous de lire cet article très intéressant.
Une remarque la recherche de la mutation JAK2V617F fait l'objet d'un remboursement à l'hôpital mais pas en ville, où eel est très couteuse. - En tant que médecins vasculaires nous prescrivons parfois la recherche de la mutation JAK2V617F dans le cadre du bilan étiologique d'une thrombose (le plus souvent atypique ou splanchnique) alors que le patient n'a pas (encore) de diagnostic de syndrome myéloprolifératif. Parfois la mutation est positive avant de pouvoir réunir l'ensemble des critères pour classer le patient dans un cadre nosologique donné. Notamment si la numération formule sanguine est normale. Notre question était donc d'interroger l'évolution des ces patients.
-
Entretien avec l'autrice Géraldine Poénou (Hgie/Cancer/MTEV)
 "Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire." A Kirwan
"Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire." A Kirwan
« Presque tous les hommes meurent de leurs remèdes et non pas de leurs maladies. » MOLIÈRE (1622-1673), Le Malade imaginaire
Entretien ave Géraldine Poénou à propos de l'article
( inCancers 2022, 14, 1937. https://doi.org/10.3390/cancers14081937 Le point de départ :Les patients présentant des événements thromboemboliques veineux dans le cadre d'un cancer relèvent d’un traitement anticoagulant (quand il est possible) tant que le cancer est actif. De plus, malheureusement le cancer actif est autant un facteur de risque de récurrence d’événements thromboemboliques veineux qu’un facteur de risque hémorragique sous anticoagulant. Par conséquent, une stratégie d'anticoagulation sur mesure doit reposer sur une évaluation individualisée des risques de récidive thromboembolique veineuse et d'hémorragie associée aux anticoagulants. Aucun modèle d'évaluation des risques existant pour le risque de saignement associé aux anticoagulants n'a été validé pour la thrombose associée au cancer.
Le point de départ :Les patients présentant des événements thromboemboliques veineux dans le cadre d'un cancer relèvent d’un traitement anticoagulant (quand il est possible) tant que le cancer est actif. De plus, malheureusement le cancer actif est autant un facteur de risque de récurrence d’événements thromboemboliques veineux qu’un facteur de risque hémorragique sous anticoagulant. Par conséquent, une stratégie d'anticoagulation sur mesure doit reposer sur une évaluation individualisée des risques de récidive thromboembolique veineuse et d'hémorragie associée aux anticoagulants. Aucun modèle d'évaluation des risques existant pour le risque de saignement associé aux anticoagulants n'a été validé pour la thrombose associée au cancer.
Pour obtenir un meilleur modèle d'évaluation des risques, il semble nécessaire de se poser plusieurs questions que l'on a directement posé à Géraldine
Dr Géraldine Poénou@zudenstein
Assistante spécialiste en médecine vasculaire et thérapeutique
(Pr Laurent Bertoletti)
Service de Médecine Interne, Hôpital Louis Mourier, APHP Paris, Colombes
(Pr Isabelle Mahé)
Tout d’abord félicitations à toute l’équipe du Pr Isabelle Mahé pour cet article passionnant et très utile car il met en évidence des points majeurs sur l’anticoagulation de la MTEV au cours du cancer et notamment sur le risque hémorragique.
Le résumé graphique de l'article est hautement pertinent et didactique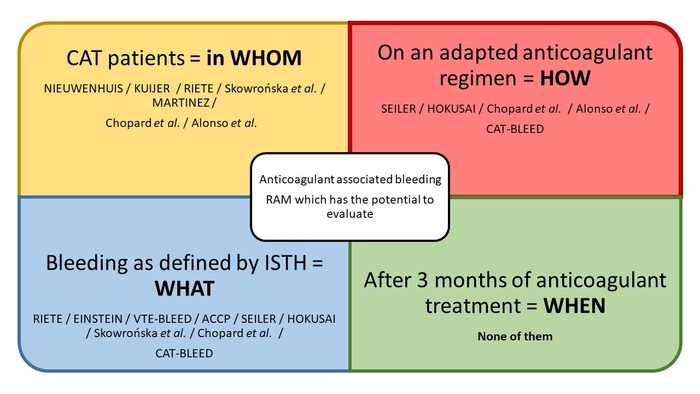
Alors première question : quelles sont les particularités du risque hémorragique, durant l’anticoagulation d’une MTEV au décours d’un cancer actif ?
Merci pour les félicitations, nous sommes tous très heureux des retours positifs que nous avons pour l’article ! Je pense que le plus important dans notre approche est que nous avons tenu à recentrer la question autours du patient : « Qu’est qui rend un patient souffrant de cancer ayant une MVTE sous anticoagulant plus à risque hémorragiquequ’un autre patient ? ». En se posant la question de cette façon cela force à se pencher, tout d’abord sur les caractéristiques intrinsèques du patient puis sa relation avec son environnement notamment thérapeutique.
Les caractéristiques intrinsèques du patient regroupent sa balance risque thrombotique/ risque hémorragique constitutionnelle propre à ce dernier (âge, situation à risques hémorragiques, insuffisance d’organe…) ainsi que les caractéristiques liées à son cancer (site, type, métastase…). Ces facteurs de risques sont immuables et doivent être recherché de manière systématique.
En association aux deux caractéristiques sus citées, il est important d’ajouter l’influence des traitements anticoagulant d’une part et des traitements anti cancéreux d’autre part. En effet, la sensibilité à certains traitements, ses propriétés pharmacologiques, sa toxicité et ses interactions médicamenteuses influent sur le risque hémorragique.
Si deux aspects sont systématiquement à évaluer chez tout patient ayant une MVTE (sa balance hémorragie/thrombose et son type de traitement anticoagulant) les particularités de notre patient dans cette situation est qu’il est nécessaire de prendre en compte aussi de manière de manière simultanée les caractéristiques liées à son cancer et l’impact de son traitement anticancéreux.
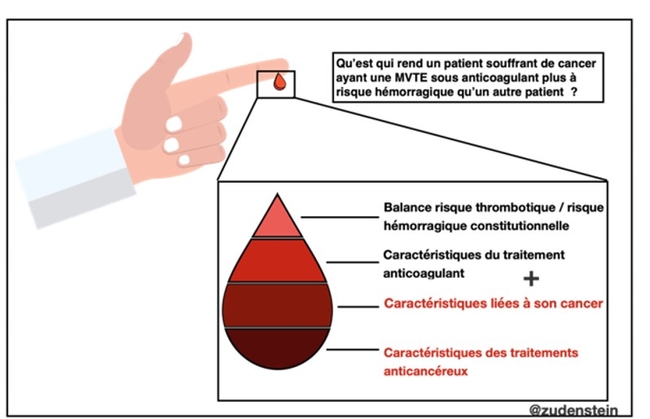
Le risque hémorragique dans ce contexte est il supérieur ou inférieur au risque de récidive de la MTEV ?Cette question à une réponse variable au cours du temps. D’après la littérature, chez un patient ayant une MTEV ce que l’on sait c’est qu’au moment du diagnostic risque de récidive et risque hémorragique sont égaux. Mais là où le risque de récidive diminue au fil des mois, le risque hémorragique reste constant sous anticoagulant et devient donc supérieur. C’est sur ce raisonnement qu’après la phase initiale de traitement, il est proposé une demi-dose en prévention des récidives de MVTE en population général. La même cinétique est observée chez les patients atteints de cancer. D’où l’idée de l’essai randomisé contrôlé international APICAT du Professeur Isabelle MAHÉ qui j’espère avec la participation active de tous permettra une limitation des expositions évitables à un surrisque hémorragique.
Dans cet article les différents scores de risque hémorragiques sont passés en revue. Pour mémoire il n’existe qu’un score de risque hémorragique Cancer et MTEV associé le score CAT-BLEED. Nous savons toutes et tous que les scores ont des limités ce que souligne la littérature et que le score parfait n’existe pas. Les items des scores sont plus pertinents. Alors quels seraient les paramètres les plus utiles dans la pratique quotidienne pour évaluer le risque hémorragique, en cas de MTEV/Cancer actif ?
Question difficile !La liste des facteurs influençant le risque hémorragique est longue voir fastidieuse pour une pratique en routine. Dans un monde idéal, il faudrait arriver à développer pour la pratique quotidienne une évaluation de la balance risque thrombotique/ risque hémorragiquerespectant la balance bénéficie/risque.
Cela passera potentiellement par l’intégration de nouveaux outils faciles d’emploi comme des biomarqueurs pour évaluer l’ensemble des éléments de l’équation « à quel risque hémorragique nous exposons les patients ? ».
Ce risque hémorragique est différent selon le type de cancer, sa localisation, les traitements du cancer et le traitement anticoagulant. Cette notion est très importante. Sans caricaturer le sujet quels sont les directions majeures à retenir des quatre questions : WHOM ? HOW ? WHAT ? WHEN ?WHOM ? => Comprendre qu’un patient cancéreux est à plus haut risque hémorragique et thrombotique que la population générale et donc doit être traité à part.
HOW? => Se rappeler qu’il est plus complexe dans sa prise en charge. Nous nous devons de trouver un moyen d’évaluer de manière globale l’addition des facteurs à prendre en compte.
WHAT? => Parler et mesurer la même chose. Nous nous devons de nous appuyer sur les critères tel que défini par l’ISTH pour parler d’hémorragie majeure, ou non majeure mais cliniquement pertinente.
WHEN? => Après 6 mois pour être plus bénéfique qu’à risque. La chose que nous souhaitons le plus en tant que médecin c’est d’abord le primum non nocere, il ne faut pas évaluer le traitement alors que ça non-prescription entrainerait une forte probabilité de décès. C’est après 6 mois de traitement, lorsque le risque de récidive est au plus bas, que l’évaluation prend tout son intérêt.
Compte tenu des bases de données sur cette thématique majeure, est ce que l’Intelligence Artificielle (Machine Learning) pourrait être d’une aide efficace ?
OUI ! L’individualisation ou personnalisation d’un traitement ne peut être que plus efficace via l’Intelligence Artificielle
Merci à toi Géraldine de nous avoir éclairé sur un sujet "délicat" auquel les médecins vasculaires sont confrontrés au quotidien.
Merci pour cet article qui pose les bonnes questions. Le réponses ne sont pas toutes au rendez-vous, la question du traitement anticoagulant devrait avancer avec les résultats de l’étude APICAT et d’autres.
Les RCP ONCO-THROMBOSE pour ces cas difficiles sont d'un grande aide. -
Entretien avec Laurent Bertoletti : de l’EP à l’HTP-TEC

"Le savoir est à l'esprit ce que l'oxygène est aux poumons." Souleymane Boel
"Le corps humain comprend le thorax au nord et l'abdomen au sud. C'est dans le thorax que les poumonsfont leur nid." Jean Charles
L'embolie pulmonaire, l'HTP-TEC sont deux entités cliniques en pleine évolutivité. Il était donc logique de demander à Laurent Bertoletti, "es spécialite EP" sont point de vue actuel sur cette thématique qui évolue sans cesse.
Merci à Laurent de s'être prêté au jeu des questions de MedVasc.info.
Entretien Laurent Bertoletti : de l’EP à l’HTP-TEC
Professeur des universités-praticien hospitalier à la Faculté de Médecine,spécialiste en pneumologie, chef du service de Médecine Vasculaire et Thérapeutique du CHU de Saint-Etienne
Laurent Bertolietti est coordonnateur pour la France du registre international RIETE depuis 2011, et est maintenant co-coordonnateur du réseau F-CRIN INNOVTE (réseau d’excellence Français, financé via le PIA et travaillant sur le diagnostic et la Thérapeutique de la maladie thromboembolique veineuse). Il est membre du laboratoire SAINBIOSE où il participe aux activités de recherche fondamentales et translationnelles. La reconnaissance internationale de ses activités s’est récemment matérialisée dans son élection au poste de « Chairman » de l’assemblée « Pulmonary Embolism » de l’European Respiratory Society, société savante recouvrant 160 pays, dont l’objectif est de promouvoir la santé respiratoire en donnant la priorité à la science, à l’éducation et à la défense des droits.
L’EP est une affection grave, potentiellement mortelle. Quels sont les signes cliniques les plus pertinents et les signes de gravitéLa question des signes cliniques est difficile !
Classiquement, les signes cliniques qui doivent faire penser à l’embolie pulmonaire sont la douleur thoracique et la dyspnée. Si la douleur thoracique est un signe d’alerte fréquent en population générale, souvent aiguë, la dyspnée est plus délicate à évaluer, pouvant apparaitre isolément et/ou progressivement. Beaucoup de patients parleront d’ailleurs de fatigue pour exprimer une limitation respiratoire à des actes de la vie quotidienne. L’interrogatoire est alors crucial. Plus rarement, les patients pourront consulter du fait d’hémoptysie ou dans les suites d’une syncope. Concernant l’hémoptysie, c’est relativement rare (moins de 10% des embolies pulmonaires), mais si vous suspectez une embolie, c’est un signe qui doit vous décider à aller au bout de votre hypothèse. Pour la syncope, des collègues Italiens (Prandoni et al NEJM 2016) ont retrouvé une prévalence forte de l’embolie pulmonaire (17%), mais je ne crois pas que cela ait été confirmé par d’autres équipes.
A côté de ces signes d’interrogatoire, l’examen physique peut être tout à fait normal ! Le signe physique le plus fréquemment retrouvé dans l’embolie pulmonaire est la tachycardie, habituellement sinusale.
La clinique est donc “traitre” dans l’embolie pulmonaire, tellement difficile que des embolies pulmonaires peuvent être diagnostiquées chez des patients sans aucun symptôme respiratoire. C’est bien connu chez les patients avec thrombose veineuse profonde proximale (jusqu’à 30% d’embolie pulmonaire asymptomatique) et chez les patients passant un scanner thoracique pour une autre raison (classiquement le cancer, vecteur d’embolie dite de découverte “fortuite”).
C’est finalement le message clé. Il faut savoir penser à l’embolie devant des symptômes thoraciques, en particulier chez des patients avec des facteurs de risque (TVP, cancer, immobilisation récente, etc). Et savoir que la caractéristique sera le contraste entre un interrogatoire pouvant être riche (dyspnée, douleur thoracique, voire hémoptysie ou syncope) contrastant avec un examen clinique pauvre (à l’échelle thoracique). Ce contraste pose d'ailleurs question à toutes les promotions d’étudiants en médecine venant dans mon service, et découvrant l’imagerie d’embolie pulmonaire d’un patient dont ils viennent de réaliser un examen clinique complet (et souvent presque normal).
Pour les signes de gravité, ils sont plus simples à préciser. C’est l’hypoxémie (évaluée par une mesure de la saturation transcutanée en oxygène réalisée en air ambiant) et surtout le statu hémodynamique. L’existence d’une tension artérielle inférieure à 90 mmHg ou des signes cliniques de choc(marbrures) signe une urgence thérapeutique.
Le parcours de soins de l’EP est aujourd’hui bien codifié. Quels sont les étapes « obligatoires » ?
Le parcours de soins a été précisé lors du travail du groupe de travail multisociétés savantes sur la prise en charge de la MTEV. (Sanchez Ol et al Rev Mal Respir 2019).
Concernant l’embolie pulmonaire, la prise en charge initiale repose sur une stratification du risque. En cas de risque faible de décès (<1%), la possibilité d’un traitement ambulatoire (ou après une hospitalisation de courte durée) est maintenant ouverte. Cela nécessite une sélection des patients (selon un score validé comme le sPESI ou la règle d’HESTIA), mais aussi un circuit organisé permettant de revoir les patients à 72h. Cette évaluation rapprochée est décisive pour confirmer le diagnostic, adapter la thérapeutique et programmer le plan de soins. Un moment dédié de “débriefing” sera nécessaire avec le patient, la prise en charge initiale (comme le retour au domicile) pouvant parfois être relativement anxiogène. Une nouvelle consultation sera organisée à un mois, pour réévaluer ces paramètres, et commencer la synthèse étiologique.
Pour la majeure partie des patients avec embolie pulmonaire, l’hospitalisation initiale reste la règle, permettant de confirmer le diagnostic, évaluer le retentissement, s’assurer d’une évolution favorable sous anticoagulant, et programmer le plan de soins. Une fois le patient stabilisé et la prise en charge encadrée, une nouvelle consultation sera possible 3 à 6 mois après.
Après 3 à 6 mois de traitement, le rapport bénéfices/risques du traitement anticoagulant sera réévalué, afin de produire une décision thérapeutique argumentée (arrêt ou poursuite du traitement anticoagulant, modalité de prévention secondaire, etc). En cas de poursuite du traitement anticoagulant, le patient devra être revu une fois par an, pour réévaluation clinique, et de la décision thérapeutique, à l’aulne des données disponibles de la science.
Pendant le suivi, la question de l'évaluation des séquelles sera majeure. Cette évaluation sera d’abord clinique, via l’interrogatoire et l’examen physique.
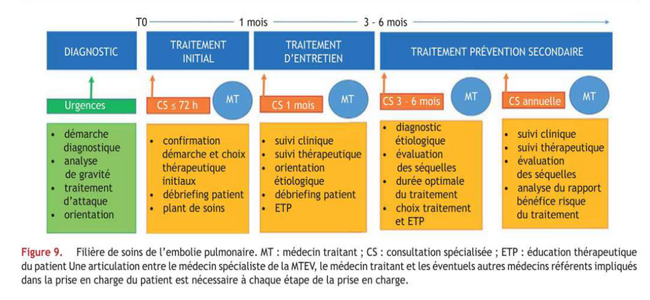
D’après Bertoletti L et al “Quel parcours de soins proposer aux patients atteints d’une embolie
pulmonaire ? Quels malades traiter en ambulatoire ?” Rev Mal Respir 2021
Deux problèmes actuellement : le traitement de l’EP à domicile et les EP sous segmentaires symptomatiques et asymptomatiques. Quels sont pour ces deux questions les points forts à retenirTu as raison, ce sont vraiment deux sujets problématiques.
Concernant le traitement de l’EP à domicile, il a été clairement démontré que sous réserve de bien sélectionner les patients, et de mettre à disposition un parcours de soins structuré, cette prise en charge était possible et sûre pour certains patients. Cependant, si l’on dispose maintenant de scores solides pour sélectionner ces patients, les structures capables de mettre en place une évaluation spécialisée à moins de 72h, puis une consultation rapprochée, tout en maintenant le reste des activités, sont rares. Il se pose aussi la question de la valorisation financière de ces activités. Les expériences récentes ont démontré que le “tout ambulatoire” ne pouvait marcher qu’en cas d'un encadrement suffisant au domicile, et d’amélioration (cruciale) des moyens de communications entre professionnels de santé.
Concernant les EP sous-segmentaires, c’est l’illustration d’un progrès qui ne peut ne pas en être un. Un des livres que je recommande fréquemment à mes étudiants s’intitule “L'enfer de la médecine... est pavé de bonnes intentions” (Patrick Lemoine, chez Robert Laffont, 2005). Le progrès technologique a permis d’améliorer la résolution des angioscanners thoraciques, et la proportion de patients diagnostiqués avec une EP sous-segmentaire (au scanner) a augmenté au fur et à mesure des années, dans les essais diagnostiques. Or, cette augmentation du nombre de cas diagnostiqués ne s’est pas traduite dans les faits par une diminution du nombre de décès par embolie, tout en augmentant le nombre de patients exposés aux anticoagulants. Il est donc apparu le risque nous -médecins- ayons succombé à un de nos vices préférés : le “Disease Mongering”, cher à mon ami Paul Frappé. C’est en fait notre capacité à accepter la fabrication de maladies (qui n’existaient pas jusqu’alors), maladies répondants à la possibilité de prescrire des thérapeutiques mises à dispositions. Dis autrement, on aime diagnostiquer des maladies que l’on peut traiter par des médicaments. Or, une étude (difficile, qui a pris une dizaine d’années) vient de montrer que si l'on arrive à obtenir l’accord d’un patient diagnostiqué avec une EP sous-segmentaire isolée (c’est-àdire sans thrombose veineuse associée), le risque d’évènement thromboembolique pendant le suivi est de 3.1%, avec un intervalle de confiance montant jusqu’à 6%. Le débat n’est pas encore réglé, mais il est possible à l’avenir que l’on fera avec certaines EP sous-segmentaires la même chose que ce que certains font déjà avec les TVP distales : une surveillance rapprochée sans traitement anticoagulant.
L’HTP-TEC- est aussi une affection grave. Chez un patient qui a fait une EP quels sont les signes prédictifs d’HTP- TEC et quels sont les examens les plus pertinents pour quantifier cette affection.Alors que le syndrome post-thrombotique est LA complication à long terme connue de tous après TVP, l’hypertension pulmonaire thromboembolique chronique (HTP-TEC) est encore trop mal connue des médecins impliqués dans la prise en charge des patients souffrant d’EP.
Lors du diagnostic d’EP, plusieurs signes doivent faire évoquer l’hypothèse d’une HTP-TEC déjà existante au clinicien. Tout d’abord, certains signes radiologiques sont associés à une HTP-TEC, et pas à une EP : c’est la forme du caillot (avec des angles de raccordement à la paroi différents), l’existence d’une perfusion mosaïque sur le parenchyme ou de collatérales médiastinales, un retentissement sur le ventricule droit disproportionné de l’atteinte embolique. Nous devons savoir challenger nos radiologues. Pour les patients bénéficiant d’une échographie cardiaque, l’existence d’une HTP (PAPs>=45 mmHg) doit faire suspecter le diagnostic.
Dans le suivi, l’existence d’une dyspnée ou l'apparition de signes d’insuffisance cardiaque droite doit faire évoquer le diagnostic. Et à cet instant, l’imagerie thoracique à réaliser (en complément de l’échographie cardiaque) est la SCINTIGRAPHIE PULMONAIRE. Plusieurs études ont montré que les angioscanners étaient encore insuffisamment sensibles pour rejeter le diagnostic, alors qu’une perfusion normale à la scintigraphie permet de rejeter à 100% l’hypothèse de séquelles d’EP !
Dans tous les cas, nous devons traquer la dyspnée post-EP, trop souvent minimisée par les patients, pour qui il est “normal” d’avoir des symptômes persistants à distance d’un évènement que nous savons (nous) aigu. Et en cas de dyspnée, il faut réaliser la combinaison gagnante scintigraphie/échocardiographie, qui permet déjà de bien avancer le diagnostic.
Quels sont les différents traitements en 2022 de l’HTP-TEC et leurs indications ?
Des progrès extraordinaires ont été réalisés dans cette maladie qui était mortelle dans la plus part des cas, et que l’on arrive de plus en plus souvent à guérir grâce aux interventions thérapeutiques !
Le traitement le plus efficace est la thromboendartériectomie. C’est une chirurgie lourde, mais nous avons la chance en France d’avoir un centre expert. C’est le traitement de référence qui doit être proposé à tous les patients éligibles. Il n’est par contre possible que si l’obstruction mécanique est accessible chirurgicalement, et explique l’atteinte hémodynamique (évalué au cathétérisme cardiaque droit, nous n’avons pas d’outil aussi bon et non-invasif que l’écho-Doppler pour cette atteinte “artérielle” pulmonaire). En cas d’obstruction mécanique non accessible (que ce soit pour des problématiques techniques ou de comorbidités), le développement de l’angioplastie (arrivée en France grâce à Hélène BOUVAIST du CHU de Grenoble) est en train de révolutionner le traitement mécanique de l’HTP-TEC.
Enfin, l’amélioration de nos connaissances a permis de démontrer l’intervention d’une vasculopathie distale dans la physiopathologie de cette pathologie. Cette vasculopathie peut être prise en charge médicalement. Le seul médicament autorisé actuellement en France est le Riociguat (ADEMPAS°). Des essais sont en cours avec d’autres molécules. Le Riociguat a démontré son efficacité sur les capacités fonctionnelles. Il ouvre aussi la possibilité de combinaisons thérapeutiques, association traitement mécanique et traitement médicamenteux.
En fait, nous suivons ce qui a été réalisé dans certaines pathologies artérielles pendant les dernières décennies : éviter les récidives graves (poursuite d’un traitement anticoagulant au long cours, en privilégiant pour l’instant les AVK), améliorer l’hémodynamique en ciblant mécaniquement les lésions macroscopiques (angioplasties ou thromboendartériectomie) et l’atteinte vasculaire microscopique (Riociguat aujourd’hui, Macitentan demain ?).
La communauté vasculaire a donc un rôle CLE à jouer dans le diagnostic et la prise en charge de ces pathologies !
Un grand Merci Laurent pour ces réponses claires "partout; toujours !".....
-
Entretien avec le Pr Claire Mounier Vehier "le Cœur des Femmes"
 "Le coeur de la femme est aussi instable qu'une goutte d'eau sur une fleur de lotus" Confucius"Un coeur n'est juste que s'il bat au rythme des autres coeurs." Paul Eluard
"Le coeur de la femme est aussi instable qu'une goutte d'eau sur une fleur de lotus" Confucius"Un coeur n'est juste que s'il bat au rythme des autres coeurs." Paul Eluard
Merci au Professeur Claire Mounier-Vehier d'avoir répondu présent pour https://medvasc.info/ . Claire Mounier-Vehier est cardiologue. Diplômée en 1991 de la faculté de médecine de l'université de Lille 2, elle découvre les maladies cardio-vasculaires chez les femmes au CHU de Lille, et cette thématique ne la quittera pas. Nommée Professeur des Universités - Praticien Hospitalier en médecine vasculaire en 2003, elle est depuis 2005 chef du Service de médecine vasculaire et hypertension artérielle à l’Institut Cœur Poumon du CHU de Lille. Son engagement bénévole à la tête de la Fédération Française de Cardiologie Nord-Pas de Calais lui permet de mener des expériences pilotes en faveur de la santé cardio-vasculaire des femmes, en particulier celles en situation de précarité. Présidente de la Fédération Française de Cardiologie de 2015 à 2019, elle œuvre désormais pour faire partager à toutes les femmes qu’elles sont des actrices essentielles de leur santé.
Claire Mounier-Vehier est cardiologue. Diplômée en 1991 de la faculté de médecine de l'université de Lille 2, elle découvre les maladies cardio-vasculaires chez les femmes au CHU de Lille, et cette thématique ne la quittera pas. Nommée Professeur des Universités - Praticien Hospitalier en médecine vasculaire en 2003, elle est depuis 2005 chef du Service de médecine vasculaire et hypertension artérielle à l’Institut Cœur Poumon du CHU de Lille. Son engagement bénévole à la tête de la Fédération Française de Cardiologie Nord-Pas de Calais lui permet de mener des expériences pilotes en faveur de la santé cardio-vasculaire des femmes, en particulier celles en situation de précarité. Présidente de la Fédération Française de Cardiologie de 2015 à 2019, elle œuvre désormais pour faire partager à toutes les femmes qu’elles sont des actrices essentielles de leur santé.
La santé cardio vasculaire des femmes est sous estimée à toutes les phases clés de leur vie hormonale, c’est ce que l’on peut lire dans les missions du fond de dotation Agir pour le Cœur des Femmes (https://www.agirpourlecoeurdesfemmes.com/). Est-ce que vous pouvez nous en dire plus ?
Les maladies cardio-vasculaires ne sont plus réservées aux hommes. Maladies de l’environnement et du mode de vie, elles sont même devenues en 30 ans la première cause de mortalité chez les femmes, avec plus de 75 000 décès par an en France, ce qui reste encore trop méconnu. A âge égal, les femmes ont davantage de facteurs de risque traditionnels que les hommes, avec des artères plus fines et plus fragiles. Elles sont également soumises à des situations à risque cardio-vasculaires spécifiques, liées à leur vie hormonale dont: contraception, endométriose, âge des première règles, syndrome des ovaires polykystiques, grossesse et ménopause….
La maladie cardio-cérébro-vasculaire est la première cause de mortalité féminine et les femmes meurent plus de maladies vasculaires que les hommes ?
Sur le plan des maladies cardio-cérébro-vasculaires, il y a un réel déficit en termes de connaissances et de sensibilisation du grand public. Étant une maladie que l’on attribuait par le passé plutôt aux hommes, on ne s’imagine pas aujourd’hui qu’elles représentent la première cause de mortalité chez les femmes. Les raisons sont multiples : les femmes adoptent depuis de nombreuses années des comportements à risque avec en chef de file des malfaiteurs le tabac suivi de l’excès de cholestérol, du stress, de la sédentarité….. Elles ont parallèlement de moins en moins de temps pour s’occuper d’elles. Ce sont des maladies de l’environnement ! on ne le souligne pas assez. La prévention est essentielle, car 8 décès sur 10 pourraient être évités avec un meilleur repérage des facteurs de risque et la mise en place d’un parcours de soins cardio vasculaire & gynécologique.
Y a-t-il des signes particuliers de l’infarctus du myocarde chez la femme ?
Près de la moitié des femmes de moins de 55 ans victimes d’un infarctus du myocarde n’ont pas ressenti le symptôme classique des hommes, la douleur brutale en étau dans la poitrine irradiant le bras gauche et la mâchoire.
Les femmes doivent s’alerter face à d’autres symptômes, plus atypiques, encore méconnus et souvent associés surtout quand ils se répètent ou se prolongent :
- une sensation d’épuisement ou de grande fatigue,
- un essoufflement progressif à l’effort,
- une oppression brutale dans la poitrine
- une douleur aigue dans le haut du dos, entre les omoplates ou dans le cou
- des palpitations,
- des sueurs froides,
- des symptômes digestifs récurrents : nausées, gêne ou brûlure gastrique…
Ces symptômes peuvent survenir lors des activités quotidiennes ou d’un stress psychologique. Ils peuvent aussi réveiller la nuit et être associés à une sensation d’angoisse, qui est souvent un bon signal d’alarme.
Les femmes doivent être particulièrement vigilantes lorsqu’elles cumulent plusieurs facteurs de risque cardio-vasculaire: tabac, inactivité physique, surpoids-obésité, stress, hypertension artérielle, diabète, cholestérol, contraception avec oestrogènes de synthèse…et doivent absolument se faire dépister.
Le fond de de dotation Agir pour le Cœur des Femmes, dont vous êtes une des fondatrices a pour devise Alerter, Anticiper et Agir. Quelle est la vocation du Bus du Cœur des Femmes ?
Le Bus du Cœur des Femmes offre une prise en charge médicale gratuite aux femmes en situation de vulnérabilité. Il se positionne dans des lieux stratégiques de plusieurs villes de France pour aller à la rencontre de ces femmes. Ce bus équipé permet aux professionnels de santé de repérer les facteurs de risque cardio-vasculaire, les symptômes d’alerte quand ils sont présents, de faire un état des lieux sur le suivi gynécologique. Il donne aussi des conseils de prévention, de gestion du stress, d’alimentation, de sommeil, d’activité physique et aussi de proposer à ces femmes un suivi coordonné cardio-vasculaire &gynécologique, en partenariat avec les acteurs locaux. Si besoin, les femmes sont réinsérées dans un parcours de soin pour suivre certains facteurs de risques qui pourraient engendrer un accident cardio-vasculaire.
Au-delà du dépistage en lui-même, l’objectif de l’opération Bus du cœur des Femmes est de faire prendre conscience aux femmes qu’elles doivent prendre du temps pour elles et pour leur santé, apprendre à s’écouter et à écouter leur corps.Les étapes dans chaque ville sont aussi une formidable opportunité de décloisonner le soin entre la ville et l’hôpital, de fédérer des professionnels de santé ensemble sur le sujet de la santé des femmes tout en impliquant les villes et le tissu associatif
Quelles recommandations pour prendre soin de soi tout au long de sa vie de femme ?
Six consultations clés vont se succéder dans un parcours cardio-vasculaire & gynécologique jalonnant la vie d’une femme, le médecin traitant étant le chef d’orchestre de la prise en charge.
La consultation longue de la première contraception
La consultation de renouvellement de la contraception
La consultation pré conceptionnelle
La consultation du post-partum, à distance de l’accouchement
La consultation à la péri-ménopause
La consultation de suivi de la ménopause
A la préménopause, à la ménopause, quelles sont les recommandations actuelles quant à la prévention cardio vasculaire hormonale ? comment et quand proposer un traitement hormonal ?
Parmi les traitements symptomatiques de la ménopause, le traitement hormonal transdermique à base d’estrogènes naturels et de progestérone naturelle (en l’absence d’hystérectomie) est le plus efficace,avec une action démontrée sur la prévention de l’ostéoporose mais aussi sur les bouffées vasomotrices, les troubles de l’humeur et du sommeil, les douleurs articulaires. Prescrit moins de 10 ans après le début de la ménopause, chez des femmes de moins de 60 ans, symptomatiques sur le plan du climatère, il est également associé à une réduction de la mortalité cardio-vasculaire sur les études de cohortes prospectives. Néanmoins, il ne peut être prescrit à une femme ayant des antécédents d’accident cardiaque, cérébral, artériel ou veineux, ou d’antécédents néoplasiques gynécologiques d’où la nécessité de faire un bilan cardio-vasculaire et gynécologique avec la prescription.
Pour en savoir plus télécharger les recommandations « HTA, Hormones et femmes » de la Société Française d’HTA sur https://www.agirpourlecoeurdesfemmes.com/fonds-de-dotation/media/Consensus-d-experts-HTA-HORMONES-ET-FEMME
L’HTA chez la femme est elle aussi sous diagnostiquée. C’est aussi une maladie de l’environnement. Quels sont les facteurs de risque et les situations à risque de l’HTA chez la femme ?
Le tabac : il est l’ennemi n°1 de la femme.
La sédentarité : les femmes ne sont que 53% à atteindre les recommandations de l'OMS en matière d'activité physique 30 minutes d’activité physique par jour.
Le surpoids et l’obésité : en France, 44% des femmes de 18 à 74 ans sont en surpoids ou obèses (Etude Esteban, Santé Publique France, 2019).
Le stress psychosocial
La contraception avec oestrogènes de synthèse
La grossesse lorsque le placenta ne se développe pas correctement
La ménopause
Quelles sont les complications de l’HTA au décours de la grossesse ?
L’hypertension artérielle gravidique est une élévation anormale de la pression artérielle au cours de la grossesse.Elle apparaît après la 20ème semaine d’aménorrhée. Son diagnostic précoce et son traitement préviennent la survenue d'une pré-éclampsie. Présente dans 5 à 10 % des grossesses, elle doit être prise en charge rapidement après avoir été diagnostiquée, pour en limiter les conséquences.
L'hypertension artérielle survenant lors d'une grossesse est source de complications maternelles mais aussi fœtal pouvant mettre en jeu le pronostic vital de la mère et du foetus. Elle est aujourd’hui considérée comme un facteur de risque indépendant chez la femme.
Quels sont pour vous les recommandations que vous feriez à toutes les femmes pour prévenir les pathologies cardio-cérébro-vasculaires ?
L’hygiène de vie est très efficace pour se protéger : activité physique régulière, pas de tabac, alimentation saine riche en légumes-fruits et appauvrie en sel (5à 6 grammes par jour), gestion du stress, peu d’alcool (moins de 7 UI par semaine), sommeil réparateur (au moins 6 heures par nuit), pratique d’une sieste de 20 minutes si possible quotidienne… Il faut également savoir écouter son corps et reconnaître certains symptômes avant-coureurs et se faire dépister en présence de facteurs de risque, de symptômes d’alerte sans attendre et à l’entrée dans la ménopause.
Merci Claire d'avoir décrypté le "Coeur des Femmes" avec passion. Plus d’info : www.agirpourlecoeurdesfemmes.com www.sfhta.eu.www.sfmv.fr et sur le site de la SFMV https://www.portailvasculaire.fr/ ,
Plus d’info : www.agirpourlecoeurdesfemmes.com www.sfhta.eu.www.sfmv.fr et sur le site de la SFMV https://www.portailvasculaire.fr/ ,
le WEBINAR https://vimeo.com/showcase/7482226/video/645828787 -
Entretien avec Manuel Monreal : le Registre RIETE
 Iconographie : Barcelone, le Camp Nou"En culture tous les progrès pour le pays sont des bienfaits." Proverbe Catalan
Iconographie : Barcelone, le Camp Nou"En culture tous les progrès pour le pays sont des bienfaits." Proverbe Catalan
« Apprendre à douter, c'est apprendre à penser. » Octavio Paz
"L'architecte du futur se basera sur l'imitation de la nature parce que c'est la méthode la plus rationnelle, durable et économique de toutes." Antoni Gaudi
Entretien avec le Pr Manuel Monreal Bosch, à propos de RIETE Servicio de Medicina Interna, Hospital Germans Trias i Pujol, Badalona (Barcelona), España;
Servicio de Medicina Interna, Hospital Germans Trias i Pujol, Badalona (Barcelona), España;
Universidad Católica de Murcia, Murcia, España.
Son principal axe de recherche porte sur l'étude de la maladie thromboembolique veineuse et des facteurs de risque et de la maladie artérielle. En 2001, il a lancé le Registre RIETE (Registre informatisé des patients atteints de maladie thromboembolique), qui est un projet international auquel participent des pays de toute l'Europe, d'Amérique latine, des États-Unis, du Canada et du Moyen-Orient
Muchas gracias Manuel por responder a mis preguntas.
C'est un honneur !
Question 1
Comment avez-vous eu l'idée de créer REGISTRE RIETE ? Quand ? et combien d’ articles ont été publiés et combien de médecins sont impliqués ?
Je me rappelle encore le jour (il y a 21 ans) où j'ai été appelé en urgence (j'étais de garde) pour assister une dame de 72 ans qui a été admise dans le service de neurologie de l'hôpital pour une hémorragie cérébrale spontanée. Dix jours après l'accident vasculaire cérébral, elle a soudainement développé une dyspnée des douleurs thoraciques, il s’agissait d’une embolie pulmonaire aiguë.Que pouvais-je faire pour la soigner ? Puis-je prescrire en toute sécurité des anticoagulants à une femme qui 10 jours plus tôt avait présenté ne hémorragie cérébrale ? Les recommandations actuelles sur les traitements antithrombotiques (basé sur les résultats d'essais cliniques randomisés) ne fournissent pas de recommandations sur la prise en charge de ces patients. Il y a peu de données dans la littérature pour connaître l'histoire naturelle des patients développant une MTEV peu de temps après une hémorragie. La plupart des cliniciens se sentent concernés par le risque de récidive hémorragique si nous prescrivons des anticoagulants et le risque d'EP mortelle si nous ne le faisons pas.
C'est alors que j'ai pensé que si nous (mes collègues et moi-même) pouvions mettre le données de nombreux patients souffrant d'affections similaires dans une base de données unique, nous pourrions probablement pouvoir dans un proche avenir mieux connaitre leur histoire naturelle et comparer les résultats selon différentes décisions thérapeutiques. Ainsi, j'ai convaincu 25 de mes collègues en Espagne (les experts en MTEV issus de 25 hôpitaux espagnols) pour partager une base de données que nous mettrons sur Internet. Nous avons commencé à rassembler des informations sur de plus en plus de patients, nous avons commencé à diffuser nos expériences en réunions scientifiques et de convaincre plus de collègues de nous rejoindre. En 2006, nous avons traduit la base de données en anglais et essayé d'étendre le registre à d'autres pays. Nous avons actuellement 99 052 patients validés dans RIETE, suivis pendant au moins 3 mois, avec plus de 1 000 variables par patient. Nous avons 240 hôpitaux actifs dans 25 pays et avons publié 228 articles scientifiques.
Pour en savoir plus : https://rieteregistry.com/
Question 2
Quelles sont pour vous les principales connaissances que Riete a apportées pour la MTEV au cours des 10 dernières années grâce au registre, quels sont les progrès importants qui en découlent ?
Nous avons réalisé de nombreuses études chez des patients qui sont souvent exclus des études randomisées essais cliniques, tels que les patientes enceintes ou celles ayant récemment subi un saignement majeur, un cancer disséminé, une insuffisance rénale ou hépatique, entre autres. Dans notre expérience, un patient sur 5 atteint de MTEV (19 %) avait au moins un de ces critères d'exclusion pour être recrutés dans les essais pivots randomisés avec des anticoagulants oraux directs. De plus, contre toute attente, ils avaient un taux de saignement majeur 4 fois plus élevé (et un taux 6 fois plus élevé taux d'hémorragie fatale) que les patients sans critères d'exclusion. De plus Ils avaient un taux 3 fois plus élevé de récidives de MTEV (et un taux 4 fois plus élevé d'EP fatale) que les patients sans critères d'exclusion.
Parmi 39 257 patients atteints d'EP aiguë, nous avons constaté que l'admission dans un hôpital qui reçoit plus de 40 EP par an a été associée à des réductions significatives de mortalité liée à l'EP à 30 jours. Dans une autre étude, nous avons constaté que les patients atteints d'EP avaient de meilleurs résultats s'ils étaient gérés en accord avec les directives internationales.
On s'attend à ce qu'à l'avenir RIETE continue à fournir des preuves cliniques pour des sous-groupes peu étudiés avec une MTEV, et qui auront un rôle plus important pour la facilitation d'études multicentriques (et multinationales) qui pourraient être utilisées pour l'évaluation de variations et disparités dans les soins, l'amélioration de la qualité et la conduite de recherche d'efficacité. L'objectif global est d'améliorer la gestion de la MTEV grâce à une meilleure compréhension de la démographie, des comorbidités, des facteurs de risque et l'utilisation de thérapies appropriées pour les patients atteints de MTEV.
Question 3
Le cancer associé à la MTEV est un sujet très important et nos connaissances ont évolué mois après mois. Pour vous, quels sont les développements les plus importants pour le les patients ?
Dans une étude portant sur 10 962 patients atteints d'un cancer actif et d'une MTEV, 2,2 % sont décédés d'EP et 1,6 % sont morts d'hémorragie au cours des 12 premiers mois. Fait intéressant les patients présentant initialement une EP mortelle, l’EP était 3 fois plus fréquente que l'hémorragie mortelle.A contrario chez ceux qui ne présentaient qu'une TVP, l'EP fatale était 3 fois moins fréquente qu’une hémorragie. Il y a donc des raisons de croire que les patients cancéreux atteints de TVP bénéficient probablement d'un traitement différent de celui des patients cancéreux atteints d'EP. Des doses plus faibles, des anticoagulants plus sûrs, des durées de traitement plus courtes ? Seuls des essais randomisés pourraient apporter une réponse à ces questions.
Dans une autre étude, le taux de récidives de MTEV pendant l'anticoagulation était similaire au taux d'hémorragie majeure chez les patientes atteintes d'un cancer du sein ou colorectal. Cependant, chez les patients atteints d'un cancer de la prostate, le taux de récidive était la moitié du taux d’hémorragie, alors que chez les patients atteints de cancer du poumon, le taux de récidive était supérieur à 2 fois plus élevé que le taux de saignement majeur. Encore une fois, il y a des raisons de suggérer que les patients cancéreux atteints de MTEV pourraient probablement bénéficier de thérapies adaptées en fonction du siège du cancer. Les oncologues ont appris il y a plus de 20 ans que l'adaptation du traitement oncologique selon un certain nombre de variables chez leurs patients atteints de cancer a été associée à de meilleurs résultats. En attendant, nous continuons à traiter nos patients avec cancer et MEV avec les mêmes médicaments, mêmes doses et mêmes durées.
Question 4Les AOD sont utilisées partout dans le monde (quand c'est possible sur le plan économique) comme anticoagulation de référence. Qu’est-ce que le registre Riete nous a appris sur leur utilisation ?
Dans les essais cliniques randomisés, les AOD ont démontré une efficacité et une plus grande sécurité que le traitement anticoagulant standard. Le registre RIETE a constaté cependant qu’un patient sur 5 recevant des AOD dans la vie réelle a reçu une prescription inférieure à doses recommandées et que l'utilisation de doses inférieures à celles recommandées a été la cause de complications : récidive de MTEV, par contre aucun avantage des AOD low dose en ce qui concerne le risque hémorragique.
Question 5
La récidive de MTEV et le risque hémorragique sont les principaux paramètres importants dans la gestion de la MTEV Avec votre expérience ,quel est le paramètre le plus important et pourquoi ?C'est une question importante mais qui a une réponse difficile parce que les récidives et les complications hémorragiques sont multifactorielles. Nous avons récemment publié notre première étude sur l'utilisation des outils de machine learning (intelligence artificielle) pour mieux identifier les patients à risque, et nous avons constaté que dans certains scénarios, que ces méthodes ont une très grande précision (courbes ROC autour de 98%) tandis les méthodes de régression classiques statistiques n’étaient que d'environ 65%.
Question 6
Quelle est votre conception sur la durée de l'anticoagulation ?
Nous devons mieux identifier les patients à risque accru de récidive de MTEV (en particulier les récidives d'EP) après l'arrêt de l'anticoagulation. Nous devons également mieux identifier quels patients atteints de MTEV présentent un risque accru d'hémorragie majeure au-delà des 3 premiers mois de traitement. Ce n'est qu'alors que nous serons en mesure de fournir quelques recommandations (peut-être seulement suggestions) sur la durée optimale du traitement anticoagulant pour chaque patient. Mais la quantité de variables qui peuvent influencer chacun de ces résultats est importante. Mon sentiment est que nous avons actuellement des recommandations trop simples (3 mois de thérapeutique si facteurs de risque transitoires, indéterminée si cancer ou événement secondaire), et que nous avons besoin de scores pronostiques plus précis (et sophistiqués), accessibles via internet, pour ajuster la durée du traitement anticoagulant aux nombreuses variables : âge, poids corporel, fonction rénale, traitements concomitants, troubles sous-jacents, MTEV initiale , mode de présentation de la MTEV qui peuvent influencer les résultats.
Encore Merci ManuelLe Registre Riete est pour moi la "bible", car toutes les situations décrites, articles après articles se retrouvent dans la vraie vie et nous aident dans nos décisions. Avec les 99 502 patients à ce jour et 1000 paramètres par patients, seul l'Intelligence Artificielle permettra d'en extraire la "substantifique moelle" ......selon Rabelais.
Et déjà un article avec l'IA: Machine learning to predict outcomes in patients with acute pulmonary embolism who prematurely discontinued anticoagulant therapy,Damian Mora , José Antonio Nieto , Jorge Mateo , Behnood Bikdeli , Stefano Barco , Javier Trujillo Santos , Silvia Soler , Llorenç Font , Marijan Bosevski , Manuel Monreal, Thrombosis Haemostasis , 2021 Jun 9(https://www.thieme-connect.com/products/ejournals/abstract/10.1055/a-1525-7220) -
Entretien avec Marc Carrier : COVID-19 et MTEV
 "Le Canada est délimité au nord par l'or, à l'ouest par l'orient, à l'est par l'histoire et au sud par des amis" Frances Shelley Wees
"Le Canada est délimité au nord par l'or, à l'ouest par l'orient, à l'est par l'histoire et au sud par des amis" Frances Shelley Wees
« Advance - Ottawa - en Avant ». Devise de la ville d'Ottawa
Entretien avec Marc Carrier :Senior Scientist, Clinical Epidemiology Program
Ottawa Hospital Research Institute
Chief, Division of Hematology, Department of Medicine
The Ottawa Hospital
Professor, Department of Medicine
University of Ottawa
Marc Carrier est un éminenent spécialiste sur le maladie Vieneuse thrombo Embolique.
Il a publié entre 2011 et 2021 , 210 articles sur cette thématique dans les revues les plus prestigieuse.Cet entretien est centré sur la MTEV et la Covid-19Merci Marc , un grand Merci d'avoir répondu à mes questions et en francais
L’orage cytokinique qui est présent chez les patients Covid-19 en réanimation, comment est-il un activateur des phénomènes thrombotiques ?Excellente question. Je crois que l’entrée du virus dans la cellule endothéliale (exposition de facteur tissulaire), la cascade inflammatoire (relâche de cytokines) et l’orage cytokinique (activation du complément) sont tous des activateurs inter-reliés qui contribuent à la formation de thrombine, le dépôt de fibrine et les phénomènes thrombotiques.
A votre avis si la prévention par héparine de bas poids moléculaire est le médicament de la prévention de la maladie thrombo embolique en réanimation au décours de la Covid-19, à quelle dose ? Préventive ? Intermédiaire ? Ou curative ?
Pour l’instant, les données probantes semblent suggérer que les HBPM à dose préventive devraient être utilisées chez les patients en réanimation pour Covid-19. L’essai multi-plateforme randomisé (mRCT) qui a randomisé les patients avec Covid-19 en réanimation entre une dose d’héparine (majorité HBPM) thérapeutique et une dose standard (intermédiaire et préventive) n’a pas démontré de bénéfices sur le critère de jugement primaire de “Organ-support free days ». Les taux d’évènements thrombotiques (artériels et veineux) étaient moins élevés chez les patients recevant des dose thérapeutiques (5.7% vs. 10.3%) mais sans diminution de la morbidité et la mortalité. La prévention primaire à dose thérapeutique est aussi associée à une augmentation du risque hémorragique de 1.3% (définition de l’ISTH). L’étude iranienne INSPIRATION nous donne quelques indices pour décider entre une dose préventive et intermédiaire chez les patients en réanimation. Une dose intermédiaire n’a pas diminué le risque de survenue du critère de jugement principal (thromboses artérielles et veineuses, mortalité et traitement d’oxygénation extracorporelle) mais semble augmenter le risque hémorragique (définition de BARC; 2.5 vs 1.4%). Il y a donc peu de données randomisées en faveur d’une dose thérapeutique ou intermédiaire chez les patients Covid-19 en réanimation.
https://www.medrxiv.org/content/10.1101/2021.03.10.21252749v1
https://jamanetwork.com/journals/jama/fullarticle/2777829Pensez-vous que les anticoagulants oraux directs aient une place dans la prévention de la maladie thrombo embolique, chez les patients Covid-19 hospitalisés mais non en réanimation ?
Il y a plusieurs essais en cours et nous aurons peut-être une perspective différente dans les prochaines semaines ou mois. Pour l’instant l’étude ACTION, qui a comparé le rivaroxaban à une dose de 20 mg par jour (patients hospitalisés stables et au long cours (30 jours)) et l’énoxaparine 1 mg/kg BID (patients en réanimation) à une dose préventive (énoxaparine 40 mg par jour) pendant l’hospitalisation, n’a pas démontré de bénéfices mais une augmentation du risque hémorragique. Donc, pour l’instant, je ne crois pas que les anticoagulants oraux directs aient une place mais des études pré- et post-hospitalisation sont en cours et les données pourraient changer notre prise en charge. Il est possible que les héparines (HBPM ou non-fractionnée) puissent avoir d’autres fonctions (ex. diminution de l’entrée du virus, etc.) qui pourraient avoir des bénéfices chez les patients hospitalisés avec Covid-19
Pensez-vous que les D Dimères chez les patients hospitalisés en médecine et ou en réanimation en cas de Covid-10 puissent aider à moduler la gestion de la prévention de la thrombose en ce qui concerne sa posologie ?
Plusieurs études et essais en cours utilisent différents biomarqueurs (incluant les D-dimères) afin de stratifier les patients hospitalisés avec la Covid-19. Donc nous aurons plus d’information dans les prochains mois.
Au début de la pandémie, les niveaux élevés des D-dimères chez les patients hospitalisés semblaient être associés à une coagulopathie spécifique à la Covid-19. Maintenant, nous savons que les D-dimères peuvent être générés dans l’espace alvéolaire. L’écoulement de protéines plasmatiques (afin d’activer les cytokines) contient aussi de la thrombine et du fibrinogène qui éventuellement sera dégradé en D-dimères. Donc les D-dimères pourraient être un facteur pronostique de détérioration pulmonaire (et de mortalité) plutôt que d’un risque thrombo-embolique ou vasculaire.
L’essai mRCT n’a pas rapporté de différences importantes dans les odds-ratio favorisant une dose thérapeutique plutôt qu’une dose standard chez les patients hospitalisés (mais pas en réanimation) qui avaient des D-dimères élevés (2X la limite de la normale) ou non. Les odds ratios pour le critère de jugement principal (voir question 2) étaient de 1.3 (probabilité de 97%) et 1.2 (probabilité de 92%) chez les patients hospitalisés avec la Covid-19 (mais pas en réanimation) avec des D-dimères élevés ou non, respectivement. Donc pour l’instant, les données probantes semblent démontrer que les D-dimères ne sont pas très importants pour moduler la gestion de la thrombose chez les patients hospitalisés avec la Covid-19.
https://www.medrxiv.org/content/10.1101/2021.05.13.21256846v1
A. Khorana a évoqué dans un article du JTH, qu’il existait des ressemblances entre le Cancer et la Covid-19 en matière de maladie thrombo embolique veineuse, les 2 CC. Qu’en pensez-vous ?
Comme je suis un des auteurs de la publication, je suis un peu biaisé. Le but était de réviser la pathophysiologie de ces deux maladies pro-thrombo emboliques en donnant une perspective différente afin de générer une discussion et un débat. Je crois, en effet, qu’il y a des ressemblances intéressantes. Le risque thrombotique est élevé, les d-dimères sont très élevés et possiblement associé à un mauvais pronostic et la prévention primaire à dose de prophylactique semble insuffisante. Cependant, les différences entre les deux maladies (Cancer et COVID) permettent aussi aux cliniciens de réfléchir à la pathophysiologie sous-jacente et d’établir une prise en charge optimale afin de prévenir la malade thromboembolique chez ces patients. Je vous encourage à lire l’article :
https://onlinelibrary.wiley.com/doi/10.1111/jth.15294
Avez-vous été confronté dans votre pratique à des thromboses veineuses classiques, thrombose veineuse profonde des membres, thrombose veineuse superficielle et/ou embolie pulmonaire post vaccination anti Covid-19 et avec quel vaccin ?
C’est une excellente question. Comme la vaccination s’est accélérée dans les derniers mois au Canada, toutes les nouvelles TVP, thromboses superficielles et EP sont diagnostiquées chez des patients ayant récemment reçu la vaccination (Pfizer, Moderna et Astra-Zeneca). Cependant, nous avons eu quelques cas de thromboembolies veineuses dans le contexte de thrombocytopénie thrombotique associée au vaccin Astra-Zeneca. Tous les patients avaient des anticorps anti-PF4 positifs. Les immunoglobulines polyvalentes, les échanges plasmatiques et l’argatroban ont été utilisés avec succès dans la prise en charge de ces patients. Une série de cas Canadiens sera bientôt publiée afin de partager notre expérience clinique. Ce vaccin n’est plus utilisé au Canada et donc, nous avons eu aucun cas dans les dernières semaines.
MERCI
Une penseé pour Cleave Kearon -
Entretien avec Marie -Antoinette Sevestre Pietri, Présidente de la SFMV

“Science sans conscience n'est que ruine de l'âme.” Rabelais
"Think Different !"
La SFMV (Société Française de Médecine Vasculaire) est Présidée pour 2 ans par le Pr Marie - Antoinette Sevestre Pietri avec brio. Il était donc logique d'aller un peu plus loin avec elle afin de mieux la connaître et qu'elle nous décrypte la SFMV.
Professeur Marie-Antoinette SEVESTRE-PIETRI
Professeur des Universités - Praticien Hospitalier
Médecine vasculaire
Chef du Service de Médecine Vasculaire
CHU d'Amiens
Présidente de la SFMV

Être Présidente d’une Société Savante est une aventure que je qualifierai de fantastique. C’est aussi une grande responsabilité à la fois organisationnelle et scientifique. Peux-tu nous faire partager ce qui pour toi est ta ligne de conduite, ta politique à la tête de la SFMV, ta gestion des conflits quand ils existent. Quand j’ai été élu à la Présidence, Michel Vayssairat m’avait dit « être Président d’une Société Savante c’est être assistant(e) social(e). Est-ce vrai aujourd’hui ?Ah non, pas du tout ! je ne suis pas là pour cela, c’est peut-être un tort mais… on a tellement d’autres choses à faire… par contre, il faut essayer de ne rien oublier et ce n’est pas facile parce qu’il faut se frayer une place parmi les spécialités, équilibrer la belle dualité de notre Société et bien sûr assurer l’avenir. Donc la ligne de conduite est : gérer les finances, développer la recherche, apporter des informations pertinentes aux membres et qui leur conviennent, leur permettre de participer avec plaisir à la vie de la SFMV, être un partenaire amical des autres sociétés nationales et internationales, avoir de plus en plus de projets ensemble, dialoguer avec les tutelles grâce au CNP (Collège National Professionnel de Médecine Vasculaire) et communiquer bien sûr !
Tes racines scientifiques ont imprégnées tes deux premières années de ta Présidence. Quelles sont pour toi les grandes orientations actuelles et à venir scientifiques de la SFMV. Quelles sont tes domaines de prédilections ?Les thèmes qui m’intéressent ne sont pas forcément ceux qu’il faut mettre en avant dans la société mais bien sûr j’y suis favorable. Je crois qu’il faut que la SFMV fasse de la recherche en phlébologie ; c’est en train de démarrer mais il faut continuer et que la qualité soit au rendez-vous !
Les maladies artérielles athéromateuses doivent aussi nous pousser à être plus pro-actifs pour le traitement médical de ces patients à haut risque de mortalité cardio-vasculaire et on doit organiser mieux les filières qui traitent, faire valoir notre expertise dans ce domaine : une recherche clinique avec des projets d’envergure vont venir !
La thrombose veineuse est toujours au cœur de notre métier et des thèmes nous concernent plus particulièrement : les facteurs de risque, les formes cliniques particulières, les traitements et leur durée, les séquelles pour un traitement personnalisé pour chaque patient. Le médecin vasculaire diagnostique, traite la thrombose, ses séquelles. Son rôle est privilégié ! quel chemin parcouru ! et à venir !
Enfin les maladies vasculaires rares, la lymphologie doivent être mieux représentées dans notre spécialité : les compétences existent, le morcellement inhérent à ce domaine doit finir et comme la recherche évolue très vite, il ne faut pas prendre de retard.
Il faut enfin favoriser les idées des plus jeunes et leur permettre de s’exprimer en créant des réseaux avec d’autres spécialités qui nous connaissent peu
Communiquer est indispensable aujourd’hui. La pandémie (mais pas que) a poussé toutes les Sociétés Savantes à s’exprimer dans leur domaine d’intervention. Pour la Médecine Vasculaire la Thrombose. La SFMV a été largement présente, merci. Comment as-tu envisagé cette exposition ? Quelles sont les avantages et les limites des médias en matière de Science ?C’est une grande découverte pour nous que de vivre ce moment si particulier qu’est la pandémie liée au SARS-Cov-2. L’emballement médiatique, les opinions tranchées et définitives basées sur à peu près rien, la peur omniprésente nous ont fait réagir avec ce que l’on savait afin de fournir le maximum d’informations raisonnables. Par contre, il a fallu réagir également aux fameuses « fake news » qui sont déversées dans les réseaux sociaux et là on comprend une chose : quel que soit le niveau d’éducation d’un pays, tout peut arriver : conduites magiques, mise sur un même plan de scientifiques reconnus et d’obscurs rebouteux, mise en cause de données scientifiques banales, en un mot déni de la science. Le tout est aggravé par les réseaux sociaux mais ils amplifient un phénomène connu depuis longtemps. La langue est la meilleure et la pire des choses disait Esope !
Les WEBINARS ont été une très bonne idée et une innovation avec un franc succès. Ils rassemblent avec une optimisation du temps. Comment vois-tu leur évolution dans l’avenir ?C’est un peu tôt pour le dire mais nous avons fait le choix d’une diffusion large et d’un format court avec des thèmes d’actualité ; c’est ce qui explique le grand succès des webinaires ; souvent des audiences autour de 1000 personnes en temps réel et des replays mutipliés par 6 : c’est un vrai succès !
Cela change des formats d’une heure façon interview qui sont moins flexibles et plus conventionnels ; les objectifs sont différents mais un temps court impose une information condensée et bien ordonnée. Je pense que c’est moins le format que le contenu qui devra évoluer et je verrai bien des informations plus diversifiées avec infos scientifiques pointues et mises au point métier ou pratique voire organisationnelles variées. Le format compte aussi et Olivier qui nous accompagne dans cette aventure est exceptionnel et a beaucoup d’idées !
La Médecine Vasculaire est une spécialité transversale d’où sa présence dans les congrès d’autres spécialités. Les rencontres inter spécialités sont toujours constructives. Comment partager en allant au-delà des congrès : publications, sessions communes, projets de recherche, études etc.Oui tu as raison des coopérations sont souhaitables et notre représentation européenne est aussi importante. D’ailleurs, nous avons deux jeunes qui vont participer à l’ESVM en amont du congrès de Saint Malo, ils s’impliquent aussi avec les jeunes d’autres spécialités ; ils créent ce lien plus facilement que nous !
la SFMV est étroitement associée à FCRIN, INNOVTE, une excellente chose. Quelles sont les études collaboratives à venir ?Oui tu as raison, la SFMV et InnoVTE ont des liens très forts et c’est une grande chance pour tous !
Les PHRC en cours comme Ultrec et endoPTS nous concernent directement et sont menés par des médecins vasculaires au sein d’InnoVTE. D’autres vont venir concernant le risque de la femme, le risque hémorragique des antithrombotiques et un projet de grande envergure sur la durée de traitement anticoagulant via une approche multi-modalités. Beaucoup de projets très stimulants qui pourraient être présentés dans un webinaire d’ailleurs !
Le réseau Paladin prépare également des travaux concernant l’AOMI qui seront au cœur de nos compétences ; tout cela fait que notre société est très active sur le plan de la recherche clinique. L’investissement via les Bourses de Recherche et la promotion des plus jeunes doit se poursuivre et cela paye !
Enfin quels sont tes conseils pour le futur de la SFMV pour les prochaines et prochains Présidents de la SFMV ? Quelle est la meilleure politique vis-à-vis de nos partenaires ? Ce qu’il faut inventer pour l’avenir ? Anticiper est important, alors anticipation 2023/2030 !
Je me garderai bien de donner des conseils car chaque approche est nouvelle et c’est pour cela que l’alternance est importante, néanmoins il y a des aspects nouveaux qui doivent être pris en compte. La médecine vasculaire est une spécialité à part entière et à ce titre elle a une représentativité auprès des tutelles via son CNP et sa société savante qui est très importante et qui a un impact majeur. La communication auprès du grand public, la recherche et la promotion de références pour l’exercice du métier de médecin vasculaire sont des incontournables mais il faut aussi avoir des idées neuves : « think different ! »
Merci Marie-Antoinette d'avoir joué le jeu des questions avec franchise et une grande pertinence...de Présidente. -
Entretien avec Nicolas Gendron : Le Syndrome VEXAS
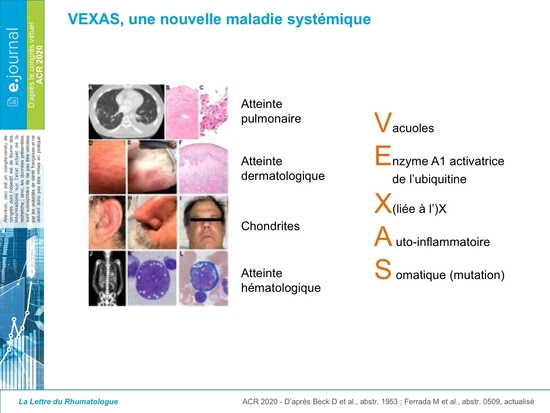
iconographie : VEXAS
"C'est dans l'ancienneté et la longue durée d'un gouvernement que se perdent ou les souvenirs, ou les occasions d'un changement, car chaque mutation laisse des pierres d'attente pour une nouvelle." Nicolas Machiavel
"Ce qui donne à un individu sa valeur génétique, ce n'est pas la qualité propre de ses gènes. C'est qu'il n'a pas la même collection de gènes que les autres ". François Gros et François Jacob
Le syndrome VEXAS est une nouvelle entité clinique décrite en 2020J’ai donc sollicité le Dr Nicolas Gendron pour "tout nous dire " sur ce syndrome, peu connu mais proche de la médecine vasculaire.
Un grand merci d'avoir accepté.
HématologistePraticien Hospitalier :
Service d'Hématologie biologique de l'Hôpital européen Georges Pompidou avec le Pr D SMADJA (cheffe de service, Pascale GAUSSEM)
Université de Paris, Innovation Thérapeutique en Hémostase, INSERM UMRS 1140 et Laboratoire de Recherches Biochirurgicales (Fondation Carpentier), Paris, France
Service d'hématologie biologique, Hôpital européen Georges Pompidou, Paris, France
Syndrome VEXAS . qu'est-ce que c'est ?Le syndrome VEXAS (acronyme pour Vacuoles, E1 enzyme, X-linked, Autoinflammatory, Somatic) est une maladie auto-inflammatoire décrite chez l’adulte, causé par une mutation somatique du gène Ubiquitin like modifier activating enzyme 1 (UBA1) caractérisée en fin d’année 2020 aux états Unis et rapidement confirmée par plusieurs équipes Française.
Le syndrome VEXAS est majoritairement décrit chez les hommes avec une apparition progressive de la maladie après 50 ans. Les 25 patients de la cohorte initiale sont exclusivement des hommes, il a donc été suggéré que l’allèle du second chromosome X de la femme protégeait de l’action néfaste de l’allèle UBA1 muté. La description plus récente de plusieurs femmes VEXAS présentant au caryotype une monosomie du X conforte cette hypothèse. La vraie prévalence de ce syndrome est à ce jour inconnue mais les nombreuses descriptions tendent à monter que cette entité n’est pas si rare avec cependant une grande majorité de cas masculins atteints.
Typiquement les patients VEXAS présentent une maladie inflammatoire systémique avec des épisodes de fièvre inexpliqués, une atteinte pulmonaire, cutanée, vasculaire et articulaire. La majorité des patients répondent aux critères de diagnostic établis pour différentes maladies inflammatoires telles que le syndrome de Sweet, la polyartérite noueuse, la polychondrite récidivante. D’un point de vue hématologique, les patients VEXAS présentent des cytopénies et notamment une anémie macrocytaire (96%), un syndrome myélodysplasique (SMD, 24%), un myélome multiple (20%) et des évènement thromboemboliques.
Il s’agit d’une pathologie sévère, progressive et relativement résistante aux traitements jusqu’alors mis en place. Le taux de mortalité est élevé, de 25 % à 35 % à 5 ans.
Les complications thrombotiques sont rapportées chez environ 40% des patients VEXAS, avec une prédominance d’évènement thromboemboliques veineux (36.4%) plutôt qu’artériels (1.6%). A noter que la fréquence élevée d’
évènement thrombotique survenant au décours de maladies auto-inflammatoires ou avec dérégulation de l’immunité est déjà bien connue. Le diagnostic est génétique doit être suspecté face à une maladie inflammatoire systémique ne répondant pas au traitement habituel ou face à un SMD associé à des signes inflammatoires systémiques,. Ce diagnostic moléculaire du syndrome VEXAS se fait par séquençage du gène UBA1. Il ne s’agit pas d’une analyse de routine, actuellement disponible en centres très spécialisés (par exemple au laboratoire d’Hématologie de l’Hôpital Cochin, Pr O Kosmider)
Chez qui le rechercher en cas de MTEV chez un homme de plus de 50 ans sans facteur déclenchant ?
Pour rappel, selon les dernières recommandations de bonne prise en charge de la MTEV (Sanchez O, Rev Mal Res 2019).
R132 -Chez les patients présentant un premier épisode non provoqué de MVTE, il est recommandé :
- d’effectuer un examen physique attentif et de recueillir les antécédents néoplasiques personnels et familiaux et de répéter cette évaluation au cours des six premiers mois de suivi et d’orienter les investigations en fonction des éventuelles anomalies observées (grade 1+) ;
- en dehors de la surveillance du traitement anticoagulant classique (ionogramme sanguin avec créatininémie, tests hépatiques), de réaliser une radiographie de thorax (si un scanner thoracique n’a pas été réalisé pour le diagnostic d’EP), une numération formule sanguine, calcémie (grade1+) ;
- de mettre à jour les dépistages recommandés dans la population générale (grade 1+) : réaliser un frottis chez toutes les femmes, une mammographie après50 ans, et un PSA chez tous les hommes de plus de50 ans, sauf si ces examens ont été réalisés dans l’année précédente ;
- les éventuelles autres explorations seront guidées par les résultats des premiers examens (grade 1+).
R138 — Il est recommandé de ne pas réaliser de bilan de thrombophilie constitutionnelle chez les patients ayant un premier épisode de TVP proximale ou d’EP après 50 ans que la thrombose soit provoquée ou non
Dans notre étude qui incluait 97 patients de sexe masculin issus de la cohorte FARIVE (Pr J Emmerich) inclus à l’HEGP entre 2003 et 2009 pour lesquels de l’ADN était disponible et ayant présenté un évènement thrombotique veineux (dont 50.5% d’évènement non provoqué) : aucun patient ne présentait cette mutation.
Ces résultats ne sont pas en faveur de la recherche de mutations de l'exon 3 d'UBA1 chez tous les hommes de plus de 50 ans ayant un premier événement thromboembolique veineux, sans tenir compte des autres symptômes cliniques pouvant être associés au VEXAS.
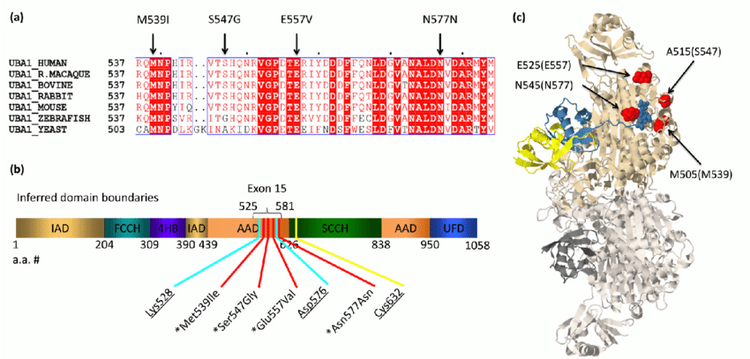 Mutation gène UBA1
Mutation gène UBA1La présence de la mutation du gène UBA1 a quelles conséquences ?
Il s’agit d’une mutation somatique du gène Ubiquitin like modifier activating enzyme 1 (UBA1). Ce gène est situé sur le chromosome X et est impliqué dans le processus d’ubiquitination des protéines.
Chez les patients VEXAS, il est supposé que le défaut d’ubiquitination entraine une dérégulation de l’immunité innée et une inflammation systémique vasculaire favorisant la survenue de thrombose. En effet il est décrit une activation aberrante des monocytes et neutrophiles, un relargage important de cytokines qui participent à un état d’hypercoagulabilité. De plus, les vascularites rapportées chez certains de ces patients favorisent une dysfonction endothéliale participant au phénomène hypercoagulant. Il est à noter que les patients VEXAS présentent une formation accrue de NETS et que 44% des patients présentent des anticorps antiphospholipides persistants.
Merci Nicolas de cette mise au point qui était nécessaire et très utile. -
Entretien avec Nicolas Gendron : D Dimères
 “L’expérience est une observation provoquée dans le but de faire naître une idée.” Claude Bernard« Le savant n’étudie pas la nature parce que cela est utile ; il l’étudie parce qu’il y prend plaisir et il y prend plaisir parce qu’elle est belle. » Henri Poincaré" Comprendre c'est le reflet de créer " Auguste de Villiers de l'Isle-Adam
“L’expérience est une observation provoquée dans le but de faire naître une idée.” Claude Bernard« Le savant n’étudie pas la nature parce que cela est utile ; il l’étudie parce qu’il y prend plaisir et il y prend plaisir parce qu’elle est belle. » Henri Poincaré" Comprendre c'est le reflet de créer " Auguste de Villiers de l'Isle-Adam
Les D-dimères font la une depuis quelques années, mais quand et pourquoi sont-ils intéressants dans la démarche médicale actuelle. Sont-ils trop prescrits ? Sont-ils si utiles ?
Il était donc nécessaire de faire le point avec un spécialiste afin d’avoir un éclairage EBM sur leur utilisation.
J’ai donc sollicité le Dr Nicolas Gendron afin qu’une fois pour toute les D-dimères soient démystifiés, un grand merci d'avoir accepté. Hématologiste
Hématologiste
Praticien Hospitalier :
Service d'Hématologie biologique de l'Hôpital européen Georges Pompidou avec le Pr D SMADJA (cheffe de service, Pascale GAUSSEM)
Université de Paris, Innovation Thérapeutique en Hémostase, INSERM UMRS 1140 et Laboratoire de Recherches Biochirurgicales (Fondation Carpentier), Paris, France
Service d'hématologie biologique, Hôpital européen Georges Pompidou, Paris, France
@GendronNico
C’est tout d’abord un honneur de participer à cette interview et parler de l’apport et des limites d’un examen de biologie médicale dans la prise en charge des patients.Question 1
Pouve- vous nous rappeler ce que sont le D-dimères plasmatiques ?
On rentre dans le vif du sujet. Il faut d’abord se rappeler que le but de la cascade de la coagulation c’est de générer de la thrombine (facteur IIa) pour former à partir du fibrinogène de la fibrine (formation du caillot) et donc coaguler. Cette fibrine sera d’abord soluble puis avec l’action du FXIII, il va y avoir un cross-linking de cette fibrine pour qu’elle devienne insoluble et forme un caillot de fibrine insoluble et stable. C’est ensuite que les mécanismes de la fibrinolyse physiologiques vont dégrader ce caillot, par l’action de plasmine, en produits de dégradations de la fibrine (PDF) et en D-dimères.
Ainsi les D-dimères sont un marqueur indirect de la coagulation car ils représentent en fait la lyse d’un caillot préalablement formé. Ainsi les monomères de fibrines sont quant à eux un marqueur de coagulation.
A noter qu’en cas de fibrinolyse sur un caillot de fibrine soluble (avant l’action du FXIII) dans le cas de la fibrinogénolyse (pathologie acquise et extrêmement rare de la coagulation), on aurait formation de PDF sans formation D-dimères.
Question 2A votre avis quand doit-on prescrire l’évaluation des D-dimères et pourquoi ?
A mon avis, par ordre de priorité/pertinence/évidence clinico-biologique
- Dans le cadre d’une suspicion d’embolie pulmonaire de probabilité clinique faible ou modérée du fait leur très bonne valeur prédictive négative (VPN). Dans le but d’exclure en toute sécurité le diagnostic d’EP et d’éviter le recours à un angio-scanner cher, irradiant et potentiellement néphrotoxique. Il y a actuellement, plusieurs stratégies d’exclusion de l’EP en fonction du taux de D-dimères. La plus utilisée en France et selon les recommandations Française de 2019 de prise en charge de la maladie veineuse thromboembolique (MTEV, Sanchez O et al., Rev Mal Res 2019) : Age-ADJUST+++ : le seuil D-dimères ajusté à l’âge. Après évaluation de la probabilité clinique, le taux D-dimères pour exclure l’EP est : 500 ng/mL pour les moins de 50 ans ou 10 ng/mL x âge pour les >50 ans
Mais il existe d’autres stratégies en cours de développement qui adaptent le taux de D-dimères à la probabilité clinique : par exemple, le seuil de D-dimères sera plus élevé lorsque la probabilité clinique sera faible et inversement. Il s’agit des stratégies YEARS (van der Hulle T et al., Lancet 2017) ou encore PEGeD (Kearon C et al., PEGeD ,NEJM 2019).
Pour rappel, il n’est pas recommandé de réaliser un dosage des D-dimères chez un patient sous anticoagulation à dose curative, en effet le taux peut-être faussement négatif (perte de sa VPN) et si il est positif, il faudra, dans tous les cas, recourir à l’imagerie.
Dans le diagnostic d’exclusion de thrombose veineuse profonde (TVP) les D-dimères peuvent être utile pour le diagnostic de la TVP des membres inférieurs voire des membres supérieurs. Le score âge-ADJUST est souvent utilisé mais il n’y a encore à ce jour de validation prospective de ce score, seulement rétrospectif.- La place des D-dimères est devenue importante pour évaluer la durée de traitement anticoagulant chez les femmes (uniquement !) et sous anticoagulant dans le cadre du score HERDOO-2 (men continue). En effet, chez une femme sous anticoagulant après un 1er évènement non provoqué de TVP/EP si le score HERDOO-2 est <2, on pourra arrêter le traitement anticoagulant avec un très faible risque de récidive.
Pour les puristes, le score HERDOO-2 a été validé en évaluant les taux de D-dimères sous anticoagulant mais en très grande majorité sous AVK et avec le kit de D-dimères VIDAS uniquement.
- Dans le diagnostic biologique de coagulation intravasculaire systémique (CIVD),en effet dans cette situation d’urgence (thrombopénie, diminution du TP, du FV et du fibrinogène) mais parfois difficile en cas de sepsis (car D-dimères souvent déjà élevés). Dans cette situation-là, les monomères de fibrines semblent plus pertinents car un vrai marqueur d’activation de la coagulation.
- Nouvelle indication des D-dimères dans la COVID-19,mais attention à ce qu’on veut leur faire dire. Dans la COVID-19, ces taux importants de D-dimères reflètent la microthrombose vasculaire associée à la maladie et font partie de la nouvellement nommée « coagulopathie associée à la COVID-19 ».
Les D-dimères comme marqueurs pronostiques uniquement : de nombreuses études ont montré que le taux de D-dimères à l’admission pour COVID-19 était associé à la gravité de la maladie mais aussi prédictible au risque de passage en réanimation et de mortalité (Zhou et al., Lancet 2020 et Tang JTH 2020). Par ailleurs, notre équipe (INSERM_1140, Pr D SMADJA) a montré à partir d’une étude multicentrique de la Société Française de Cardiologie qu’un seuil supérieur à 1120 ng/mL de D-dimères chez les patients en unité médicale COVID-19 était prédictif de mortalité indépendamment du risque de MVTE.
Au cours de la COVID-19, de nombreuses équipes ont voulu « réinventer » le rôle des D-dimères dans la MTEV,et donc de prédire le risque de faire une thrombose… Il faut recourir à l’imagerie et non pas faire des D-dimères pour leur valeur prédictive positive (ce qui n’a jamais été leur rôle). Le dépistage systématique de la MTEV n’est pas recommandé par l’ISTH (Spyropoulos AC et al., JTH 2021). Les stratégies classiques devant une suspicion de TVP ou d’EP proposent d’évaluer les D-dimères devant une probabilité clinique faible, ce qui n’est pas applicable dans cette population du fait de la coagulopathie et des D-dimères élevés, il faudrait probablement définir un seuil de D-dimères adapté à cette pathologie (des études sont en cours…). En attendant, l’ISTH suggère donc de réaliser un angio-TDM pulmonaire ou une scintigraphie ventilation/perfusion d’emblée devant une suspicion clinique d’EP.
Question 3
Aujourd’hui on assiste à des demandes de dosages des D Dimères à tort et à travers, notamment en médecine de ville. Ces demandes ne sont pas toujours justifiées. Pouvez- vous nous dire quand faut-il vraiment les prescrire ? Dans quelles circonstances ?
Actuellement, dans le contexte de vaccination de masse anti-COVID-19 et après la description de très rares cas de VITT (vaccine-induced thrombotic thrombocytopenia) après la vaccination par AstraZeneca et Janssen, certains médecins prescrivent des contrôles de NFS et de D-dimères après vaccination pendant 15-21 jours, sans que pour l’instant il n’y ait de rationnel scientifique/médical à une telle pratique.
En revanche, il y a une jolie étude des Italiens sur 30 volontaires sains vaccinés par comirnaty (Pfizer/BioNTech) avec évaluation de l’hémostase avant vaccination, à J7 et J21 qui montre, parmi les nombreux tests globaux et très spécialisés d’hémostase que rien ne bouge après vaccination (ni D-dimères, ni anticorps anti-PF4/héparine entre autres, Peyvandi F et al., Thromb Up 2021).Concernant la VITT, il faut garder en mémoire qu’elle est très rare (entre 1 :100000 et 1 :500000) et que les cas ont eu lieux chez des patients sans thrombophilie et sans antécédent de thrombose.
Il faut savoir qu’un dosage de D-dimères, c’est autour de 15 euros,ce qui en biologie médicale commence à être un examen cher. Concernant les situations où les prescrire, je reviendrais à la question précédente, n°2.
Question 4
On se retrouve quelquefois avec des D Dimères très élevés en l’absence de maladie thrombo embolique veineuse. Quelle est la conduite à tenir ? Quelles sont les circonstances cliniques qui expliquent cette augmentation ? Que faut-il faire en cas de D Dimères élevés en l’absence de toute cause à priori ? Les D Dimères élevés peuvent-ils être des annonciateurs de cancer.
Encore une fois, tout D-dimères en dehors de tout contexte évoqué plus haut n’a pas d’intérêt.
En l’absence de MTEV, si les D-dimères sont élevés chez un patient, le prélèvement peut être coagulé et la libération de D-dimères sera un marqueur de « coagulation dans le tube », votre laboratoire est sensé vérifié le « pré-analytique » c’est-à-dire si le tube est conforme (pas coagulé, bien rempli et pas hémolysé). Il s’agit de la 1èreétape de raisonnement d’un biologiste devant un D-dimères élevés.Puis évaluer le taux en fonction du reste du bilan : TP, facteurs du TP, fibrinogène et plaquettes pour s’assurer qu’il n’y ait pas de consommation de la coagulation faisant suspecter une CIVD.
Et enfin, vérifier le contexte clinique et autre cause d’élévation des D-dimères : syndrome inflammatoire aiguë ou chronique, sepsis, (COVID-19), grossesse et cancer.
En l’absence de suspicion clinique de thrombose, il ne faut pas réaliser d’examen d’imagerie à la recherche de thrombose. Vérifier le bilan inflammatoire du patient notamment. Oui les D-dimères élevés sont observés le cas du cancer, et pourraient faire donc suspecter un cancer chez un patient asymptomatique. Dans le cas d’une découverte « fortuite » de D-dimères élevés chez un sujet de + de 50 ans, il peut paraître utile de vérifier tout d’abord si les dépistages liés à l’âge et au sexe ont bien été réalisés.
Question 5
L’ajustement à l’âge du dosage des D Dimères est désormais validé en cas de suspicion de maladie thrombo embolie veineuse notamment en cas de suspicion d’embolie pulmonaire. Quelle est votre expérience dans ce domaine ?
De notre expérience, comme évoqué en question n°2, nous utilisons le score Age-Adjust. Encore une fois, bien évaluer la probabilité clinique pré-test et pas de dosage D-dimères chez des patients sous anticoagulant à dose curative.
Question 6
La Covid-19 est à l’origine d’une augmentation des D Dimères. Comment faut-il les gérer pour les patients hospitalisés en médecine et les patients en réanimation. Les D Dimères sont-ils un curseur de gravité ? Ont-ils un impact sur la décision d’augmenter éventuellement la dose des HBPM en prophylaxie ?
La COVID-19 a été rapidement associée à une forte activation de la coagulation suggérée par une élévation importante du taux de D-dimères associé à une mortalité accrue (Zhou et al., Lancet 2020), une activation endothéliale (Smadja DM et al., Angiogenesis 2020 et 2021) et à une prévalence inattendue de thromboses veineuses et artérielles. Dans ce contexte de réponse inflammatoire intense, l’activation de la coagulopathie peut être liée à des mécanismes de thrombo-inflammation.
Au début de l’épidémie chinoise, les auteurs ont évoqué une prévalence élevée de CIVD chez leur patient avec des taux de D-dimères très élevés (2). Rapidement les premières séries européennes ont démontré que l’hyperfibrinogénémie, les taux d’antithrombine et de monomères de fibrine ainsi que l’absence de thrombopénie profonde dans la majorité des cas (7) n’étaient pas en faveur d’une CIVD chez les patients mais plutôt d’une coagulopathie spécifique à la COVID-19. Les taux de D-dimères très élevés au cours de la COVID-19 seraient le reflet à de la micro et/ou macrothrombose disséminées et ainsi que d’anomalies de la fibrinolyse.Je le rappelle encore une fois, mais dans la COVID-19, les D-dimères sont à ce jour qu’un marqueur de gravité et de mauvais pronostique.
Le risque de MTEV dans la COVID-19 est élevé (environ 20% des patients avec une forme critique), même s’il reste actuellement mal défini, en particulier chez les patients ambulatoires. L’ISTH suggère un monitoring de différents paramètres de la coagulation (TP, D-dimères, plaquettes et fibrinogène) et une anticoagulation préventive par HBPM chez tous les patients COVID-19 nécessitant une hospitalisation en l’absence de contre-indication. Chez les patients atteints de COVID-19 pris en charge en ambulatoire, ou sortant d’un séjour hospitalier pour une infection à SARS-CoV-2, une thromboprophylaxie médicamenteuse systématique n’est pas recommandée (ni dosage de D-dimères) mais elle est suggérée en cas de présence de facteurs de risques additionnels tels qu’un antécédent connu de MVTE ou un cancer évolutif d’après les propositions de la Société Française de Médecine Vasculaire (Khider L et al., JMV 2020)
Par ailleurs, la posologie des traitements anticoagulants en prévention fait débat: un essai multicentrique français (via le réseau INNOVTE) a évalué l'efficacité d’une posologie d’héparine de bas poids moléculaire intermédiaire ajustée au poids, comparativement à une posologie prophylactique conventionnelle, sur la survenue d’événements thromboemboliques veineux chez les patients atteints de COVID-19 hospitalisés (COVI-DOSE; NCT04373707). Les résultats sont à venir prochainement.
Brièvement, a ce jour, on se rapproche de la « bonne dose », il semble que la théorie du « Earlier is Better » semble se confirmer. L'anticoagulation aurait un rôle important dans la phase précoce de la maladie. En tous cas, chez le patient en réanimation, la dose d’anticoagulation préventive standard semble l’idéal. En revanche, chez le patient hospitalisé en unité médical COVID-19, il semble que l’anticoagulation à dose curative semble intéressante et notamment chez ceux avec les D-dimères les plus élevés (donc la maladie la plus active ?).
De plus, nous avions montré dans une étude rétrospective multicentrique avec la Société Française de Cardiologie que les patients hospitalisés pour COVID-19 et qui étaient sous anticoagulation orale à dose curative pour de la FA ou MTEV présentaient un meilleur pronostique que ceux non (Chocron R et al., JAHA 2021). Affaire à suivre !Dernière question : carte blanche
Si je peux donner un conseil, je pense que tout Médecin ayant appétence pour la MTEV et les traitements anticoagulants doit se rapprocher de son laboratoire (hospitalier et/ou libéral) et de son biologiste médical afin de connaître les types de tests que réalise son laboratoire (Kit de D-dimères, dosage des anticoagulants, délai de rendu) et ses besoins pour sa pratique clinique afin d’identifier les axes de prescription biologique à améliorer.
Le dialogue clinico-biologique est important et fait progresser le Biologiste Médicale ainsi que le Médecin (Vasculaire ou Généraliste, entre autres) mais surtout la prise en charge des patients atteints de MTEV.
Un grand MERCI,les D Dimères font partie de notre quotidien en Médecine Vasculaire, nous allons grâce à ces réponses claires et pertinentes encore mieux les maîtriser et mieux les utiliser...et mieux les faire prescrire....... -
Entretien avec Pascal Giordana : écho-Doppler et hémodialyse
iconographie : FAV
“Enseigner, c’est apprendre deux fois.”Joseph Joubert
“Peindre, c’est faire apparaître une image qui n’est pas celle de l’apparence naturelle des choses, mais qui a la force de la réalité.”Raoul DufyCet entretien avec Pascal Giordana est destiné aux médecins pratiquants ce type d’examen, donc former pour cette indication et travaillant en collaboration avec un centre d’hémodialyse. L'écho-Doppler des FAV en hémodialyse, s'apprend mais ne s'improvise pas.

Dr Pascal Giordana
Médecin Vasculaire à l’hôpital Pasteur du CHU de Nice
Service de Médecine Vasculaire : Professeur Georges LEFTHERIOTIS
Trésorier de la Société Française de Médecine Vasculaire
Responsable de l'Unité de Lymphologie du CHU de Nice
Co Auteur des standards de qualité de l'écho-Doppler des FAV pour l'hémodialyse (work in progress)
L'écho Doppler avant la création d’une fistule artério veineuse (FAV)
Quels sont les éléments cliniques à rechercher avant la réalisation de l’écho DopplerL’examen clinique est important, tout aussi que la recherche d’antécédents locaux du type de perfusions, pace maker, thromboses veineuses du membre supérieur. On va bien sûr rechercher une cicatrice, analyser la circulation veineuse superficielle, rechercher une induration. On va demander au patient si il y a des difficultés à la piquer pour les prises de sang.
L’examen artériel consiste à analyser la couleur des téguments, le temps de recoloration après vitro-pression. On recherche les pouls, on réalise une manœuvre d'Allen. On réalise une auscultation afin de rechercher un souffle vasculaire. On recherche une claudication des membres supérieurs et évidemment la prise de tension artérielle au niveau des deux membres supérieurs.
Enfin il faut savoir quel est le bras utilisé par le patient et s’il présente des vertiges ou une instabilité (hypoperfusion vertébrale ?).
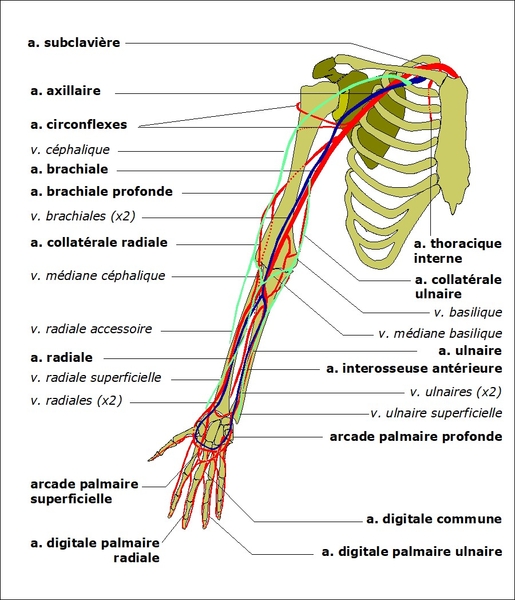 Signé Michel Dauzat
Signé Michel Dauzat
La réalisation de l'écho-Doppler réalise une cartographie de l’anatomie artérielle et veineuse du membre supérieur : qu’est ce qui est le plus important à étudier. Quels sont les diamètres des veines autorisant la FAV ?La cartographie est réalisée dans une pièce chauffée afin d’obtenir un diamètre interne veineux maximal. Le patient ou la patiente est torse nu ou avec seulement un soutien-gorge.
Le réseau artériel et veineux sont étudiés dans leur totalité.
On vérifie la liberté du réseau veineux superficiel, la souplesse des veines. On recherche des volumineuses collatérales ou perforantes.
Le calibre minimal pour une veine utilisable pour une fistule est de 3 mm. On peut avoir recours à ue garrot afin d’augmenter la pression veineuse et donc d’observer une dilatation veineuse.
Que recherche-t-on sur le plan artériel ?Au niveau artériel, on recherche une sténose, on analyse la paroi artérielle et notamment l’importance des calcifications. Au niveau proximal on dépiste les divisions hautes au niveau du tiers proximal du bras. Au niveau distal on analyse les flux des artères radiales et ulnaires, ainsi que l’arcade palmaire. On peut être amené à faire une analyse des pressions digitales en cas de doute. Enfin je réalise systématiquement une analyse écho-Doppler des troncs supra-aortiques et notamment des artères vertébrales.
Une fois la FAV créée, tu réalises un examen écho Doppler combien de temps après la création de la FAV. Que notes-tu et fais-tu une cartographie photographique avant utilisation de cette FAV et pourquoi ?
 Signé Michel Dauzat
Signé Michel DauzatNous avons pour habitude de réaliser un contrôle écho-Doppler à 6/8 semaines qui est la date estimée pour une bonne maturation de la fistule. Nos chirurgiens aiment à réaliser des anastomoses termino-latérale avec un branchement direct de l’artère radiale sur la face latérale de la veine céphalique anté-brachiale lorsque ceci est possible. Il semblerait que les contraintes pariétales veineuses soient moindres et que les complications dans le suivi le soient aussi. Dans ce cas, nous mesurons le diamètre de l’artère radiale 1 cm en amont de l’anastomose, la vitesse maximale au niveau de l’artère radiale à ce niveau. Nous mesurons le diamètre de l’anastomose, le diamètre de la veine de drainage à 3 cm en aval de l’anastomose. Puis nous réalisons une analyse de la veine de drainage à la recherche d’anomalie et on mesure le plus grand diamètre et la profondeur de la veine.
Pour les autres types de fistules, on analyse le versant veineux entièrement et nous mesurons le plus grand diamètre interne et la profondeur de la veine.
Dans tous les cas, nous mesurons le débit de la fistule au niveau de l’artère brachiale. Il est compris entre 500 et 800 mL/min pour les fistules distales et entre 800 et 1 200 mL/min pour les fistules proximales.
Nous ne faisons pas de cartographie photographique systématique, sauf anomalies.
Si la FAV est bien fonctionnelle, envisages tu un rythme de contrôle écho Doppler de la FAV de manière systématiqueNon, nous n’avons pas de suivi systématique, les contrôles sont organisés en fonction des difficultés de dialyse, des anomalies de pression… C’est la clinique qui prédomine.
Baisse de débit de la FAV, pourquoi et quelles sont les causes ?
Les baisses de débit sont d’origine artérielle ou veineuse ou générale.
Je passe vite sur les causes générales et notamment cardiaque chez ces patients à haut risque.
Les causes artérielles sont essentiellement les sténoses qui peuvent être anastomotiques mais aussi en amont voire proximales. Dans ce cas, la veine est souple, elle se vidange rapidement et facilement lors qu’on surélève le membre supérieur. On sent un thrill sur le trajet artériel et l’écho-Doppler exhaustif de l’arbre artériel nous permet de confirmer cette sténose.
Les hypodébits veineuxsont en rapport avec des sténoses veineuses particulièrement au niveau des points de ponction et des thromboses. Là, la veine est rénitente, difficile à comprimer. La vidange est difficile. On perçoit un thrill au niveau de la sténose et la veine est souple en aval. On peut entendre un souffle sous clavier en cas de sténose proximale ou distale selon. En cas de thrombose la veine est dure, incompressible. L’écho-Doppler est ici aussi exhaustif et confirme le diagnostic et permet aussi d’identifier d’autres lésions moindres associées.
Comment met-on en évidence un vol de la FAV au niveau de la main, clinique et écho Doppler ?
Le vol vasculaire distal en rapport avec la FAV a, à mon avis, une importance clinique. On peut avoir une pâleur cutanée distale (doigts, paume de la main), des fourmillements au niveau des doigts, une faiblesse de la main à l’effort, des douleurs distales lors de la réalisation de la dialyse voire, des lésions nécrotiques des extrémités.
L’écho-doppler va retrouver un bon débit de la fistule et des flux amortis voire inversés au niveau de l’arcade palmaire. Là aussi la mesure de la pression digitale peut avoir un intérêt.
Quelle est la ou les causes des hyperdébits d’une FAV pour hémodialyse ?
L’hyperdébit est défini par un débit supérieur à 1,5 L/min. Cet hyperdébit est conditionné par le diamètre de l’anastomose, la souplesse des axes vasculaire et leur facilité à se dilater, tout d’abord au niveau artériel puis au niveau veineux ce qui entraîne une diminution des résistances. A terme, l’hyperdébit va avoir des répercussions cardiaques (hypertrophie ventriculaire, insuffisance cardiaque).
CARTE BLANCHE : deux mots des FAV PERCUTANEE : avantages et inconvénients
https://ebulletin.radiologie.fr/e-quotidien-jfr-lundi/creation-fistule-arterioveineuse-dhemodialyse-voie-percutanee-systeme-ellipsysNous n’avons pas encore d’expérience en ce qui concerne cette technique, mais notre centre va être investigateur dans une étude prochaine. Peu de séries et surtout de petites séries. Il existe deux systèmes de ponction percutanée qui sont réalisés sous contrôle échographique. Ils sont positionnés au niveau du pli du coude. L’un consiste en une transfixion artério-veineuse directe, l’autre utilise une perforante du plis du coude. L’analyse échographique de cette zone est primordiale avec un bonne connaissance anatomique. La deuxième technique fait intervenir le réseau veineux profond et peut nécessiter une embolisation veineuse distale associée en cas de reflux veineux distal.
Il semblerait que ces techniques soient utiles en cas de nécessité de réalisation d’un abord en urgence chez des sujets au capital veineux superficiel pauvre. Ce serait une technique de deuxième intension.
Merci Pascal pour tes réponses claires. Il faut insister sur la proximité nécessaire entre le néphrologue, le médecin vasculaire et le chirurgien vasculaire, un travail d'équipe nécessaire et indispensable.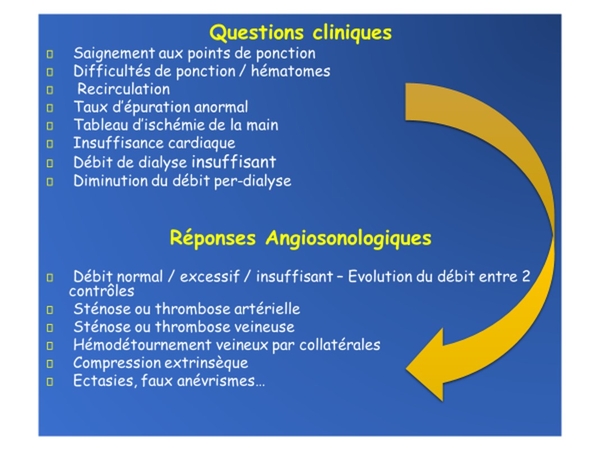
Une synthèse par Michel Dauzat -
Entretien avec Pierre Morange : les thrombophilies
 "Ce qui donne à un individu sa valeur génétique, ce n'est pas la qualité propre de ses gènes. C'est qu'il n'a pas la même collection de gènes que les autres."François Gros Et François Jacob
"Ce qui donne à un individu sa valeur génétique, ce n'est pas la qualité propre de ses gènes. C'est qu'il n'a pas la même collection de gènes que les autres."François Gros Et François Jacob" Diversité, c'est ma devise " Jean de La Fontaine
" L'étude de la diversité de nos génomes permet de répondre à des questions capitales en anthropologie, en biologie de l'évolution, en histoire mais aussi et c'est important pour l'avenir, en santé humaine"Lluis Qintana-Murci
Thème : les bilans de thrombophilies
Ils ne sont pas toujours conformes aus recommandations. C'est pourquoi il semble important d'y voir plus clair . Merci à Pierre Emmanuel Morange d'avoir accepté de faire le point sur cette question importante pour https://medvasc.info/
Professeur Pierre Emmanuel MORANGE
Centre d'Exploration des pathologies Hémorragiques et Thrombotiques (CEHT)
Service du laboratoire d'hématologie
Service d'Hématologie Biologique
CHU de Marseille - Hôpital de la Timone
Peux-tu rappeler Pierre la définition de la thrombophilie ?La thrombophilie peut être définie par la prédisposition d’un individu à développer des épisodes thrombotiques touchant le plus souvent le territoire veineux. Une partie de l’origine de cette thrombophilie est identifiée par des facteurs biologiques, certains constitutionnels d’autres acquis tels que la présence d’un syndrome des antiphospholipides.
Il faut distinguer 2 groupes de thrombophilies constitutionnelles : les états thrombophiliques majeurs (ou thrombophilie sévère) représentés par les déficits en inhibiteurs naturels de la coagulation (antithrombine, protéine C, protéine S), les anomalies combinées facteur V Leiden (FVL) hétérozygote (HTZ) + mutation G20210A du gène de la prothrombine (PTM) HTZ, FVL homozygote (HMZ) et PTM HMZ ; et les états thrombophiliques modérés : FVL HTZ, PTM HTZ. La thrombophilie majeure est associée à un risque de maladie thromboembolique veineuse (ou MTEV) important chez le sujet jeune puisqu’on estime qu’à l’âge de 45 ans, la moitié des sujets porteurs de ces anomalies auront thrombosé.
Il faut souligner cependant qu’une grande partie de cette thrombophilie reste encore inexpliquée.
Aujourd’hui les recherches de thrombophilies se multiplient et la plupart du temps sans fondement réel. Alors chez qui rechercher une thrombophilie, quand et pourquoi ?
La recherche d’une thrombophilie biologique doit être restreinte aux indications dans lesquelles l’identification de celle-ci aura une influence sur la prise en charge du patient et/ou de sa famille. De façon générale, la survenue d’un épisode thrombotique chez un sujet jeune incite à poser la question du bilan de thrombophilie. Il n’existe pas de consensus international quant aux indications de ce bilan. En effet, les différentes recommandations/propositions publiées reposent sur de faibles niveaux de preuve (notamment du fait de la rareté des thrombophilies majeures). Toutefois, le critère d’âge et le caractère non provoqué de l’épisode thrombotique sont des facteurs majeurs dans toutes les recommandations.
Le bilan de thrombophilie doit ainsi être réalisé chez les individus ayant présenté un épisode thromboembolique veineux (thrombose veineuse profonde et/ou embolie pulmonaire) non provoqué (c’est-à-dire en l’absence de situation à risque environnementale) avant 50 ans. Chez la femme en âge de procréer, cette indication doit être élargie aux épisodes provoqués puis la présence d’un thrombophilie biologique pourra conditionner la prise en charges des éventuelles grossesses ultérieures. Chez les sujets de plus de 50 ans, ce bilan ne sera discuté que s’il existe des antécédents familiaux documentés.
Concernant les sujets asymptomatiques, les recommandations proposent de réaliser une enquête familiale uniquement chez les apparentés du premier degré, de façon systématique s’il s’agit d’une thrombophilie sévère, après évaluation par un centre expert et uniquement chez les femmes apparentées du premier degré en âge de procréer pour les thrombophilies modérées. En effet, le diagnostic d’une anomalie biologique peut avoir un impact majeur chez les femmes jeunes en raison de leur exposition très fréquentes aux situations hormonales, associées à un risque majeur de MTEV (contraception oestroprogestative et grossesse).
De nombreux paramètres en hémostase seront perturbés au cours du traitement et à la phase aigüe de la thrombose veineuse notamment. Il faut donc retenir ,qu’il n’y a généralement pas d’urgence à effectuer un bilan de thrombophilie dont l’interprétation sera difficile au cours de la prise en charge initiale. Il sera donc préférable de réaliser ce bilan après l’arrêt du traitement anticoagulant ou lorsqu’une fenêtre thérapeutique peut être envisagée (au-delà de 3 mois de traitement bien conduit).
Quand une patiente ou un patient présente une mutation génétique, chez qui la rechercher dans la famille et chez les descendants. Cette recherche doit-elle être ciblée uniquement sur la thrombophilie qui a été mise en évidence initialement ?
Cette question divise encore notre communauté. Logiquement la recherche devrait être ciblée uniquement sur la thrombophilie qui a été mise en évidence chez le cas index. Si l’anomalie est identifiée alors le bilan doit être complétée car il n’est pas rare de retrouver une deuxième thrombophilie fréquente (FV Leiden ou PT G20210A). Cependant certains considère qu’il est plus pratique d’effectuer un bilan complet d’emblée afin d’éviter un deuxième prélèvement.
Quels sont les traitements qui perturbent un bilan de thrombophilie ?
Sans surprise ceux sont essentiellement les anticoagulants. Les antivitamines K font baisser la protéine C et la protéine S (qui sont des protéines vitamine K dépendantes) et peuvent compliquer la recherche d’anticoagulant circulant si l’INR est trop élevée.
Les anticoagulants oraux directs impactent les tests chronométriques de la coagulation et certains dosages des inhibiteurs de la coagulation ne sont pas réalisables.
On note en particulier des difficultés d’interprétation liées aux anticoagulants oraux directs (AOD : apixaban, rivaroxaban, dabigatran). Le dosage des protéines C et S est perturbé sous AOD si le test utilisé est chronométrique (test de première intention). Une surévaluation des taux peut être observée. Le dosage de la protéine C peut être effectué avec une technique chromogénique avec une perte de sensibilité (certains déficits qualitatifs ne sont pas diagnostiqués par la technique chromogénique).
La problématique est comparable pour la protéine S : le dosage antigénique de la protéine S libre peut être réalisé sous AOD mais il ne permet pas le diagnostic des rares déficits qualitatifs.De même, le dosage de l’antithrombine doit tenir compte de l’AOD. En effet les trousses commercialisées utilisent 2 systèmes de mesure différents. Ainsi, le dosage de l’antithrombine chez les patients traités par dabigatran ne sera pas réalisable avec le système anti-IIa. Inversement, le dosage de l’antithrombine sous apixaban ou rivaroxaban ne sera pas réalisable avec le système anti-Xa. La recherche des anticoagulants circulants sous AOD n’est pas non plus possible et une fenêtre de 72 heures est nécessaire pour le dosage.
En raison des difficultés potentielles d’interprétation de ce bilan, pour le prescripteur et pour le laboratoire qui effectue l’analyse, il est recommandé d’adresser les patients susceptibles de bénéficier d’un bilan de thrombophilie à un centre expert qui évaluera l’indication et maitrisera l’exploration en collaboration avec le laboratoire de référence.
Demain quelles sont les orientations à venir du monde de la thrombophilie ?
L’exploration d’une thrombophilie constitutionnelle est à ce jour très dépendante des tests plasmatiques et reste ainsi soumise aux difficultés d’interprétation, notamment en lien avec les traitements anticoagulants. Il est de plus admis qu’il existe des variants délétères dans les gènes codant les inhibiteurs naturels de la coagulation non identifiés par les tests d’activités utilisés pour les dépister. Le développement des outils de biologie moléculaire, notamment les techniques dites de next generation sequencing (ou NGS) laisse entrevoir une évolution dans cette exploration. Le diagnostic moléculaire pourrait ainsi devenir un acteur majeur du bilan de thrombophilie dans un futur proche. D’une part, ses performances diagnostiques sont supérieures à celles des dosages plasmatiques (meilleures sensibilité et spécificité). D’autre part, nous savons que la liste des anomalies génétiques associées à la survenue de la maladie thromboembolique veineuse ne se limite pas aux 5 anomalies du bilan de thrombophilie actuellement pratiqué. Ainsi une approche de type panel avec séquençage systématique des gènes candidats (c’est-à-dire des gènes codant les protéines impliquées dans la physiopathologie) ou de type exome sequencing dans des familles avec thrombophilie inexpliquée permettrait d’identifier le variant rare délétère impliqué dans la pathologie familiale. Plus que jamais, la recherche d’états thrombophiliques doit bénéficier de l’expertise de centres spécialisés.
Le groupe français d’hémostase et thrombose (GFHT) auquel j’appartiens devrait publier ses recommandations actualisées sur le bilan de thrombophilie au cours de cette année.Merci Pierre pour cet entretien très riche et très informatif . Merci aussi d'avoir toujours répondu présent aux sollicitations de la Médecine Vasculaire et de ta présence à nos côtés.
Page 1 sur 2
- 1
- 2


