"Toute subversion commence par celle du vocabulaire " Confucius (551-479 av. J.-C.)
"La science est un outil puissant. L’usage qu’on en fait dépend de l’homme, pas de l’outil." Albert Einstein
"Ce qu'on appelle stratégie consiste essentiellement à passer les rivières sur les ponts et à franchir les montagnes par les cols." Anatole France

Entretien avec F. Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire
Un Maître "és Médecine Vasculaire", Maître Yoda de la Médecine Vasculaire
AOMI, état des lieux
Question 1
Pourquoi l’AOMI est la localisation plus grave de l’athérothrombose ?
FB- Je ne crois qu’on puisse dire les choses comme ça. L’AOMI n’est pas en elle-même la localisation la plus grave de l’athérothrombose, ce sont le contexte et nos comportements qui en font la gravité.
Pour ce qui est de l’AOMI athéromateuse elle-même, la majorité des patients porteurs d’une AOMI sont asymptomatiques ou ne rapportent aucun symptôme durant la vie courante. Parmi les patients-AOMI avec claudication intermittente on estime que, dans les 5 ans suivant le diagnostic, 70-80% s’améliorent ou restent stables, 10 à 20% voient leur claudication s’aggraver, 5 à 10% développent une ischémie critique. Par ailleurs 1% des patients-AOMI se présentent d’emblée en ischémie critique. Parmi ces patients en ischémie critique 40 à 50% auront une amputation majeure (jambe ou cuisse) ou décéderont dans l’année suivant le diagnostic. Il faudrait ajouter le risque d’oblitération artérielle aigue thrombotique, d’ischémie aigüe, (environ 1% par an dans les études), mais il est assez rare qu’une thrombose aigüe survienne sans cofacteur. Au total pour ce qui est strictement du risque de l’AOMI, le risque annuel d’amputation majeure est inférieur à 1%.
Pour ce qui est du risque cardio-vasculaire (CV) général il en va différemment. Le risque annuel d’événements CV graves (infarctus du myocarde, AVC, décès CV) est de 4 à 5% chez le claudicant. La mortalité CV à 10 ans est multipliée par 4 à 6 chez le patient avec AOMI par rapport au patient sans AOMI. La morbi-mortalité CV du patient-AOMI est du même ordre, voire un peu plus élevée, que celle du patient coronarien ou du patient ayant fait un AVC.
Deux facteurs me semblent devoir être pris en compte :
1-le fait que dans l’histoire naturelle de l’athérosclérose les coronaires sont touchées en premier, puis les artères des membres inférieurs, puis les carotides (extra- et intracrâniennes),
2-le fait que la prévalence de l’AOMI augmente de façon exponentielle avec l’âge.
Ainsi le patient-AOMI jeune a souvent aussi des lésions coronaires (connues ou non), le patient-AOMI âgé a souvent des lésions coronaires et des lésions carotides (connues ou non). Deux fois sur 3 le patient-AOMI est un polyvasculaire
La mortalité générale est également augmentée à peu près dans les mêmes proportions car le tabagisme est le facteur de risque majeur de l’AOMI athéromateuse. Il faut donc ajouter la mortalité liée au tabac (cancers, BPCO).
Le diabète est également un facteur de risque à prendre en compte dans l’excès de morbi-mortalité, mais il est plus difficile à mesurer car il faudrait distinguer deux cas de figures : le patient-AOMI dont la glycémie est un peu augmentée et le patient-AOMI ayant clairement une artériopathie diabétique touchant électivement les artères distales. Le second est à plus haut risque d’amputation et d’accidents CV que le premier.
Plus rare, mais peut-être plus grave, est l’AOMI chez l’insuffisant rénal chronique au stade terminal.
Le patient avec AOMI athéromateuse a une autre caractéristique peu flatteuse : toutes les études, sans exception, montrent que c’est le patient vasculaire le plus mal pris en charge ; celui pour lequel les recommandations sont les plus mal appliquées, les plus mal observées (et il y en a eu depuis 25 ans !).
« Mal appréciée, sous-diagnostiquée, sous-traitée » est un leitmotiv dans les articles de synthèse. Et ça n’est pas nouveau, déjà Charcot se plaignait du peu de considération pour « sa claudication » !
Les patients sont d’accord pour une pléthore d’examens et d’angioplasties pas toujours utiles, mais la lutte contre le tabagisme et l’incitation à l’entrainement à la marche passent souvent au second plan (soit que le patient renâcle, soit que le médecin ne prenne pas le temps d’expliquer, de convaincre), mais les règles d’hygiène de vie et le traitement médicamenteux de l’athéro-thrombose laissent à désirer (tant au niveau de l’observance que de la prescription). Ces fondamentaux ne sont pas considérés comme pour le patient avec lésions coronaires ou cervico-encéphaliques alors que le niveau de risque CV du patient-AOMI est le même voire supérieur, alors que la fréquence et la sévérité de lésions coronaires, le risque d’AVC, la mortalité toutes causes sont inversement proportionnelles à l’index de pression à la cheville (IPSch). Au-delà du risque loco-régional, l’AOMI est un puissant marqueur de risque CV que l’AOMI soit symptomatique ou asymptomatique (même niveau de risque à même niveau d’IPSch).
Autre point majeur, l’AOMI est encore souvent considérée comme une affection masculine alors que la prévalence de l’AOMI définie sur la mesure d’IPSch est identique chez l’homme et chez la femme pour chaque tranche d’âge (Rotterdam study 1998). Conséquence le « Mal appréciée, sous-diagnostiquée, sous-traitée » est encore plus criant chez la femme !
Enfin il y a également un problème de terminologie qui ajoute à la confusion. En France on parle volontiers d’artérite alors que le terme désigne partout ailleurs les artériopathies inflammatoires, dans les pays anglo-saxons on parle d’artériopathie périphérique (PAD, peripheral arterial disease) en précisant rarement de quelle artériopathie périphérique il s’agit (artères des membres inférieurs ou toute artériopathie non-coronaire). On précise rarement que l’on parle d’artériopathie oblitérante, alors qu’il y a aussi des artériopathies ectasiantes (artériomégalie, dolicho-méga-artères, anévrysmes). De même on précise rarement artériopathie athéromateuse (ou athérosclérose ou athéro-thrombose) alors qu’il y a aussi des artériopathies non-athéromateuses (compression, dysplasie fibro-musculaire, artérites, ..). On précise rarement artériopathie chronique (les formes aigues sont souvent multifactorielles). Récemment un groupe d’experts sous l’égide de Bauersachs a « tapé du poing sur la table » en demandant un terme unique et précis (Vasa juillet 2021 + l’éditorial de Qanadli).
L’artériopathie dont on parle ici est l’artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse, c’est un peu long j’en conviens mais c’est plus précis et plus juste qu’artérite ou PAD !
Je suis un peu long, mais ça fait pas mal de facteurs qui expliquent la gravité de l’ACOMI et tous ne sont pas liés à l’ACOMI …
Et puis n’oublions pas qu’il s’agit d’une affection très fréquente (3 à 7% de la population adulte, 20% des plus de 70 ans) !
Question 2
L’examen clinique est toujours si important dans le diagnostic et la prise en charge de l’AOMI. Quels sont ses passages obligés ?
FB. Bien sûr que l’examen clinique reste important. Au terme d’une carrière on a des tas d’histoires à raconter, parfois dramatiques, sur des cas où l’étape clinique a été négligée.
Certes ça prend un peu plus de temps que de faire un « bon pour écho-Doppler », pourtant en 20 min on peut obtenir pas mal d’informations pour peu qu’on ait le sens de l’anamnèse et que l’on fasse dévêtir le patient.
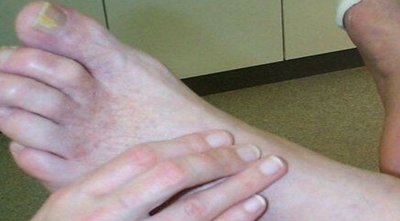 A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
https://www.medicinus.net/examen-peripherique/ (pouls pédieux)
Puis on passe à la palpation des pouls fémoraux au Scarpa membre en rotation externe. Le pouls poplité est parfois plus difficile à percevoir (le rechercher genou fléchi en abduction). L’examen est complété par l’auscultation ilio-fémorale et au niveau de la gouttière fémorale, par la palpation abdominale à la recherche d’un AAA, la palpation simultanée des pouls radiaux et l’auscultation cervicale. Petit détail qui a son importance, attention si un pouls fémoral ou poplité est trop facilement perçu, trop ample, il peut s’agir d’un anévrysme ou d’un pouls de butée.
Si les pouls périphériques ne sont pas perçus, et a fortiori s’il existe des lésions cutanées du pied, il faut savoir « lire le pied » à la recherche de signe d’insuffisance artérielle en testant le remplissage de veines du pied (normalement quasi instantané, anormal si on voit la veine se remplir lentement), en appréciant l’état des pulpes digitales et de la coque talonnière (normalement pleines, anormale si flétries « vides » avec contact osseux facile), en évaluant la pression distale par l’angle de décoloration de la semelle plantaire en surélevant lentement les deux pieds membre en extension (alerte si une semelle plantaire reste colorée alors que l’autre se décolore, si la semelle plantaire coté symptomatique se décolore à moins de 40-50°). Ce temps de l’examen ne prend que 2 ou 3 min et peut rapporter gros.
L’analyse des signes et symptômes cardinaux (claudication intermittente, douleurs de décubitus, troubles trophiques) nécessite d’être à la fois ferme sur certains point-clefs et sensible à la nuance sur d’autres.
Avant de qualifier un patient-AOMI d’asymptomatique, il faut prendre en compte l’activité du patient et distinguer l’asymptomatique sédentaire et le symptomatique actif. Le premier peut être asymptomatique avec une occlusion iliaque, le second peut être symptomatique avec une sténose fémorale à 50% au canal de Hunter. Le premier peut être asymptomatique avec un examen du pied montrant des signes d’insuffisance artérielle prononcée, le second peut avoir un examen du pied parfaitement normal. Le premier est à risque CV bien supérieur à celui du second.
La claudication intermittente artérielle dans sa forme typique (la plus fréquente) est une douleur du mollet survenant à la marche, d’abord sous forme de gêne autorisant la poursuite de la marche (distance initiale de claudication) puis sous forme de crampe obligeant à l’arrêt (distance absolue de claudication). La douleur cède assez rapidement à l’arrêt de l’effort en position debout et se reproduit à l’identique pour une quantité d’effort similaire. Ces caractères distinguent la claudication artérielle de la claudication veineuse (douleur sourde puis constrictive du muscle et ne cèdant pas rapidement à l’arrêt de l’effort mais lentement en position de vidange veineuse allongé ou allongé jambe en l’air), des claudications rhumatologiques (mécaniques apparaissant rapidement et ne concernant pas un groupe musculaire donné), de la claudication neurologique (qui n’est pas une douleur musculaire mais une sensation de faiblesse ou d’engourdissement des membres inférieurs cédant en fléchissant le tronc en avant ou en s’asseyant). Il est très important de demander au patient de montrer du doigt là où il a mal et comment la douleur se calme.
Toutefois le tableau n’est pas toujours aussi simple, il existe des claudications artérielles touchant d’autres territoires que le mollet (fesse, cuisse, muscles de la semelle plantaire et parfois même muscles lombaires) et surtout il existe des douleurs combinées (une sténose de l’iliaque commune ou de l’hypogastrique peut s’exprimer sous forme de coxalgie d’effort, une sténose de la fémorale commune et de la fémorale profonde peut s’exprimer sous forme de gonalgie d’effort, une oblitération de l’aorte sous-rénale peut prendre un masque neurologique).
L’item clef est toujours -déclenché par une certaine quantité d’effort de marche, -cédant rapidement à l’arrêt de l’effort, -se reproduisant à l’identique à la reprise de la marche.
Les douleurs de décubitus d’origine artérielle sont assez typiques pour peu que l’on demande au patient de montrer où il a mal et comment il calme la douleur. Elles intéressent d’abord l’avant-pied, les orteils (le patient les décrit volontiers en coiffant l’avant-pied de sa main). Le patient trouve à les calmer en verticalisant plus ou moins sa jambe (à ce degré d’insuffisance artérielle le réflexe vasoconstricteur postural est aboli et la pression hydrostatique augmente la pression de perfusion).
Elles évoluent en 3 degrés :
1-douleurs de primo-décubitus s’estompant en mettant le talon au bord du lit,
2-le patient doit laisser pendre la jambe hors du lit pour trouver le sommeil,
3-le patient est obligé de passer la nuit assis au fauteuil, à ce stade un œdème du pied et de la cheville s’installe.
Les limites de ce symptôme sont le seuil individuel de sensibilité à la douleur et l’existence éventuelle d’une neuropathie sensitive (fréquente chez le diabétique, non-rare chez le sujet âgé longiligne) ou d’une neuropathie sensitive induite par l’ischémie.
Au total symptôme très précis mais inconstant.
Les troubles trophiques posent plus de problèmes car il n’est pas facile par la seule clinique d’établir le lien de causalité avec l’artériopathie.
Comme les douleurs de décubitus ischémiques, les ulcérations et gangrènes sont aussi acrales, elles siègent aux orteils et sur les zones de frottement du pied (malléole externe, hallux valgus, quintus varus, toute angulation de déformation d’orteil, tout orteil irrité par un ongle adjacent déformé). Elles sont en général douloureuses, plus ou moins sèches ou plus ou moins humides et nécrotiques ; les gangrènes sèches momifiées ne sont pas douloureuses.
Mais AOMI + Trouble trophique du pied n’est pas ipso facto égal à AOMI stade IV :
--le trouble trophique peut être totalement indépendant de l’AOMI, l’AOMI est contingente
--le trouble trophique peut être le fait d’une lésion emboligène plus ou moins sténosante sur l’arbre artériel du membre inférieur.
--l’insuffisance artérielle peut être modeste mais suffisante pour entraver la cicatrisation d’une plaie quelconque (facteur aggravant mais non causal),
--l’insuffisance artérielle peut être directement responsable du trouble trophique que ce dernier soit accidentel ou de survenue spontanée au stade ultime de l’AOMI.
Il est souvent utile d’avoir recours à des examens comme la mesure de pression digitale et la mesure de pression transcutanée d’oxygène à l’avant-pied pour préciser le lien de causalité.
Ces problèmes de qualification des troubles trophiques et leur impact sur l’évaluation des résultats thérapeutiques ont conduit un groupe d’experts à établir la notion d’ischémie critique chronique de membre inférieur (Circulation 1991).
L’ensemble de ces éléments fait que la classification dite de Leriche et Fontaine de 1952-1954 en 4 stades (I asymptomatique, II claudication intermittente, III douleurs de repos et IV troubles trophiques) n’est plus adaptée aux patients tels que nous les voyons aujourd’hui. En termes hémodynamico-cliniques, il n’y a que deux stades : le stade d’ischémie d’effort (regroupant « stades » I et II) et l’ischémie permanente (regroupant stades III et IV et ischémie critique chronique).
Question 3
L’écho-Doppler complète les données cliniques, quel est son apport le plus important ?
Le Doppler puis l’écho-Doppler ont été un tournant dans le diagnostic et la prise en charge de l’AOMI, on peut juste regretter que ça ait pu conduire chez certains à l’abandon de l’examen clinique et à la multiplication d’actes inutiles.
Il est aussi regrettable qu’en France un examen complémentaire soit coté en tant que tel et non pas en fonction de la complexité de l’examen réalisé. Celui qui passe 5 min à faire un écho-Doppler de débrouillage et celui qui passe 45 min à faire un examen complet détaillé cotent le même acte …
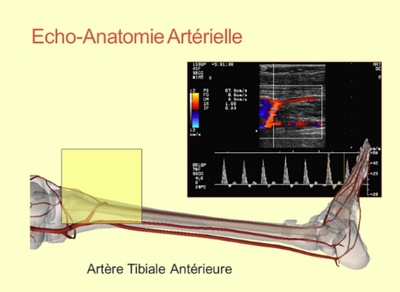 Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.
Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.
Mais faire le même examen pour tout le monde n’est pas logique. Il faut distinguer l’examen de 1ère intention qui peut être très simplifié s’il s’agit simplement de répondre à la question « ACOMI ? oui/non », le premier examen définissant la stratégie qui doit être assez complet, l’examen de surveillance qui peut se focaliser sur les points essentiels (par ex. surveillance post-opératoire), l’examen pré-opératoire qui doit pouvoir se confronter à l’artériographie ou être le seul examen décisionnel pré-opératoire.
Quelle que soit l’étendue de l’examen il doit toujours comprendre une mesure de pression distale, indice de pression systolique à la cheville et mesure de pression digitale (au moins chez les patients à haute probabilité de médiacalcose jambière : diabétique, insuffisant rénal chronique, âge > 75 ans).
Deux autres points sont à mettre à l’actif de l’écho-Doppler
--parfois on est surpris du peu de lésions athéromateuses sur l’arbre artériel et il faut savoir se poser la question d’une artériopathie non-athéromateuse (artérite inflammatoire, dysplasie fibro-musculaire, compression, …) ou d’une thrombophilie en cas d’accident aigu.
--l’écho-Doppler est probablement le meilleur examen pour le diagnostic d’artériomégalie et de dystrophie polyanévrysmale qui sont des variétés assez sévères d’artériopathie des M.I.
Question 4
Plutôt que faire des angioscanners en cas d’AOMI, ne vaudrait-il pas mieux réaliser une angiographie diagnostique et thérapeutique du côté du membre atteint ?
FB. Je ne comprends pas très bien ta question. Il y a 25-30 ans que l’on a démontré qu’un examen écho-Doppler méthodique complet avec un compte-rendu précis fait aussi bien qu’une angiographie (et il s’agissait à l’époque d’artériographie intra-artérielle numérisée), le test de Skinner-Strandness (1967) est très utile dans l’évaluation des claudications douteuses, les appareils écho-Doppler actuels permettent une évaluation très précise des artères de jambe et du pied dans l’ischémie critique. Je crois que sauf question très précise à laquelle on n’a pas pu répondre en écho-Doppler et en exploration fonctionnelle, il n’y a en règle pas de place pour l’angiographie de 1ère intention quelle qu’elle soit.
Si telle est ta question, je ne comprends pas l’utilisation l’angio-scanner ou de l’angio-IRM en 1ère intention, je ne comprends pas ces angio-CT/angio-IRM réalisés de façon systématique « pour vérifier un écho-Doppler », je ne comprends pas les angio-CT/angio-IRM réalisées alors que l’indication thérapeutique est clairement d’ordre médical.
A mon sens dans la très très grande majorité des cas l’angiographie est un examen à titre préopératoire et lorsque l’indication est celle d’une angioplastie ça peut être le 1er temps de l’intervention.
Le manque d’argent en Médecine est un fait et une rengaine, mais si on commençait par supprimer tout ce qui ne sert à rien, tous les actes diagnostiques et thérapeutiques inutiles, et on comblerait une partie du manque.
Question 5
Le traitement médical de l’AOMI est très important après la correction des FDRCV, l’activité physique. Quelles sont les molécules à privilégier ?
De plus quelle est la place de l’association rivaroxaban 2.5 mg X 2 plus aspirine 100 mg et la place de la double anti agrégation plaquettaire ?
FB. Je ne dirai pas les choses tout à fait comme ça.
Le traitement de l’ACOMI est celui de la prévention cardio-vasculaire, primo-secondaire si le patient est asymptomatique, secondaire si le patient est symptomatique. Mais ce distinguo est ici à mon sens de peu d’intérêt, voire flou, car comme déjà dit le risque CV est inversement proportionnel à l’IPSch que le patient soit symptomatique ou symptomatique. Comme discuté à la question 2, considéré comme asymptomatique un patient sédentaire avec un IPSch à 0.50 et partant ne pas lui prescrire d’antiagrégant selon certaines recommandations n’est pas logique.
L’arrêt du tabagisme est peut-être plus fondamental encore que pour les autres localisations d’athérosclérose.
L’entrainement à la marche pour le claudicant c’est un peu plus que les « au moins 30 min de marche ou autre activité physique par jour » recommandés en prévention CV.
Au plan médicamenteux, le traitement comprend au moins un antiagrégant plaquettaire (aspirine à 75 mg/100 mg/j. ou clopidogrel 75 mg. Le clopidogrel est peut-être préférable tant que le tabagisme n’est pas stoppé, le ticagrelor n’est pas supérieur au clopidogrel) et une statine (en allant progressivement à la dose optimale, en étant d’autant plus exigeant sur le seuil de LDLc que l’IPSch est plus bas). A cela s’ajoute le traitement d’une HTA ou d’un diabète si présent(s) en ciblant la normalité. De même si une dyslipidémie n’est pas suffisamment corrigée par le régime et les statines, l’adjonction d’une nouvelle classe de normolipémiant se discute (ézétimibe, anti-PCSK9)
L’adjonction systématique d’un IEC est recommandée mais ne fait pas l’unanimité.
Quant à la double anti-agrégation plaquettaire ou à l’association AAP-AOD vs monothérapie classique les résultats des essais randomisés peuvent se résumer ainsi : double AAP ou AAP-AOD plus efficace mais plus d’accident hémorragique (assez logique). La question tourne donc autour de la balance bénéfice-risque, pour qui ou quand ? Pour qui ?, logiquement les patients à très haut risque d’accident thrombotique. Quand ? : pour couvrir une période à haut risque, en général post-procédure ou au décours d’un accident thrombotique.
Mais les résultats de l’étude COMPASS à laquelle tu fais allusion vont probablement faire évoluer les pratiques avec extension des indications de l’association aspirine-AOD (dans COMPASS aspirine 100 mg et rivaroxaban 2.5 mg x 2). Personnellement je suis assez nuancé, association Aspirine-AOD pour un patient restant à haut risque malgré un TMO basique bien appliqué oui, Aspirine-AOD ou double antiagrégation plaquettaire chez un sédentaire qui continue à fumer son paquet de cigarettes, non (n’oublions pas que le tabac est aussi facteur d’AVC hémorragique).
Question 6
Comme synthétiser les problèmes de l’AOMI ?
FB. Je crois que l’on n’a jamais fait plus synthétique que E. Housley auquel l’éditeur du BMJ demandait « un article bref, clair, précis sur le traitement du patient-ACOMI claudicant destiné aux MG, pas plus de 800 mots ! » Housley commence son article en disant qu’il a été tenté de répondre « je peux le faire en 5 mots : stop smoking and keep walking » (BMJ may 1988). En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!
En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!
Le traitement de fond du patient-ACOMI est le traitement médical optimal de la prévention cardio-vasculaire globale (prévention primo-secondaire et secondaire)
La reconstruction artérielle (angioplastie, chirurgie) est un traitement de seconde intention chez le claudicant (claudication invalidante et restant invalidante après un traitement médical optimal de 3 mois bien conduit) et de première intention chez le patient en ischémie permanente (mais le TMO reprend sa place dès cette phase critique passée).
J’ajouterai qu’il faut arrêter de limiter l’ACOMI au mâle claudicant ou avec gangrène du pied,
il faut être conscient que
- à même niveau d’index de pression systolique à la cheville le risque CV est similaire chez le patient-ACOMI asymptomatique et chez le symptomatique.
- l’ACOMI diagnostiquée par IPSch est aussi fréquente chez la femme que chez l’homme.
Abréviations
ACOMI : artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse
CV : cardiovasculaire
IPSch : index de pression systolique à la cheville
TMO : traitement médical optimal
Références.
Polonsky T.S., McDermott M.M. Lower extremity peripheral artery disease without chronic limb-threatening ischemia. A Review. JAMA. 2021;325(21):2188-2198.
Aday A.W., Matsushita K. Epidemiology of peripheral artery disease and polyvascular Disease. Circulation Research. 2021;128:1818–1832.
Becker F., Robert-Ebadi H. Diagnostic clinique de l’ischémie critique chronique de membre inférieur. Rev Med Suisse 2013 ; 9 : 302-5
Becker F., Robert-Ebadi H., Ricco J.B. et al. Chapter I: Definitions, Epidemiology, Clinical Presentation and Prognosis. European Journal of Vascular and Endovascular Surgery (2011) 42(S2), S4–S12
HAS. Prise en charge de l’artériopathie chronique oblitérante athéroscléreuse des membres inférieurs. RPC. Avril 2006
Becker F. Histoire de la claudication intermittente d’origine artérielle, Syndrome de Bouley-Charcot. J Mal Vasc 2005, 30, 2, 114-117
Second European Consensus Document on Chronic Critical Leg Ischemia. Circulation 1991 ; 84(4) suppl Nov
Becker F. Classification clinique et hémodynamique des artériopathies chroniques oblitérantes des membres inférieurs. Thèse d’Université 1989.
F. Becker 16/07/21
Merci François pour ce tour d'horizon sur l'AOMI qui est clair, complet, didactique , tout simplement parfait. Tout cela a le mérite de ne pas oublier les fondamentaux en médecine vasculaire comme en médecine en général. La clinique "primum movens" que rien ne remplace et ne remplacera jamais.


