AOMI
-
"VOYAGER "et sujets fragiles
 Voyager voyage mal en France
Voyager voyage mal en France
A propos des RECOS AOMI 2024 de l'ESC
 Des points importants
Des points importantsAmputation de membre et pauvreté !
 AOMI le scandale aux USA
AOMI le scandale aux USAAngioplastie ou Pontage fémoro-poplité ?
 Stent Pontage AOMI
Stent Pontage AOMIAnti Inflammatoires et Risque CV Résiduel
 Anti inflammatoires Risque CV résiduel AOMI
Anti inflammatoires Risque CV résiduel AOMIANTITHROMBOTIQUE /ANGIOPLASTIE non cardiaque
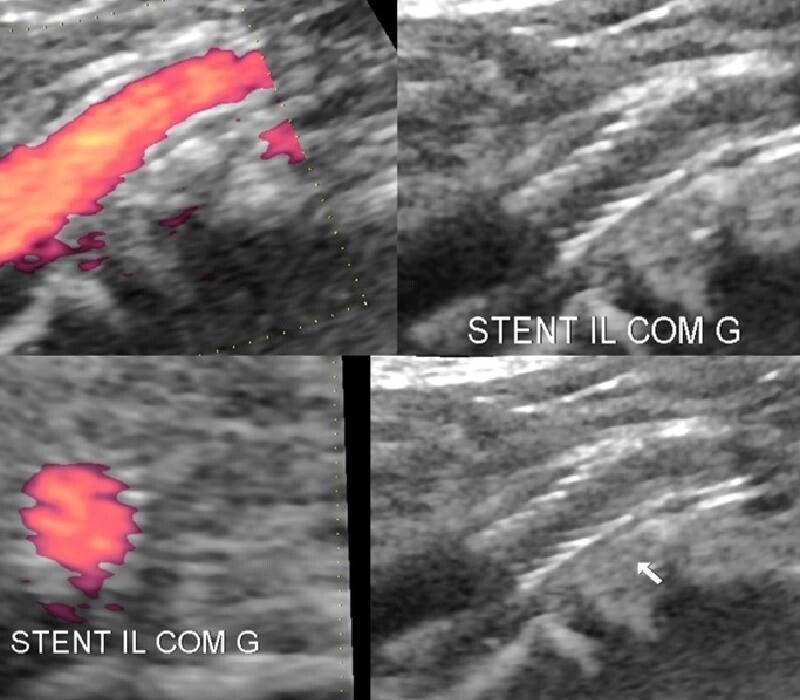 Risque hémorragique à évaluer
Risque hémorragique à évaluerAntithrombotiques et AOMI

AOMI sous traitée
AOMI : facteurs de risque de mortalité
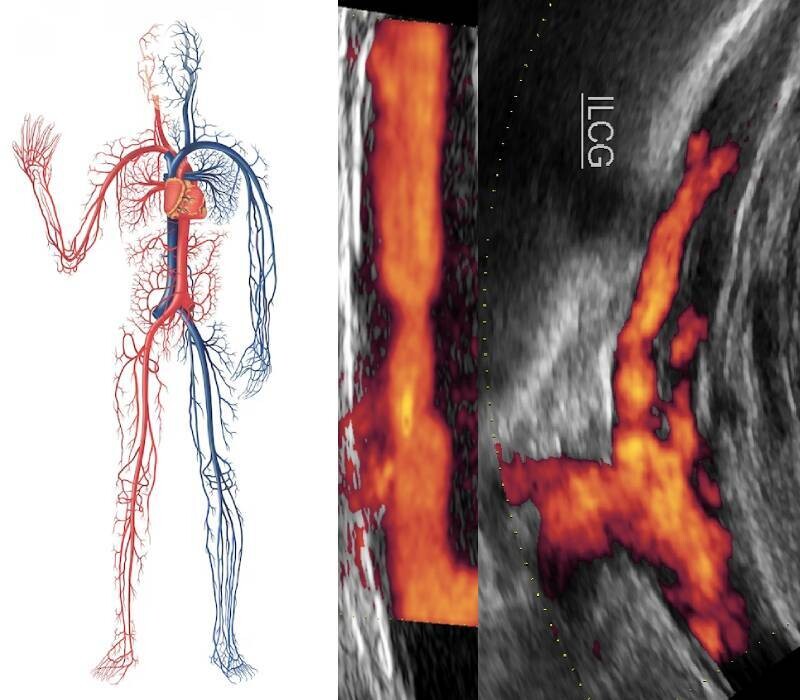 AOMI sur risque CV
AOMI sur risque CVAOMI et médecine de précision
 AOMI Statine forte dose Ischémie d'effort revascularisation antiplaquettaire correction FDRCV
AOMI Statine forte dose Ischémie d'effort revascularisation antiplaquettaire correction FDRCVAOMI sous ,SOUS-TRAITEE !
 MARCHER pour vos ARTERES !
MARCHER pour vos ARTERES !AOMI : critères de prise en charge
 « La poésie, c'est la prise en charge du quotidien, c'est la découverte du présent dans ce qu'habituellement on cherche à fuir. »Pierre Gravel
« La poésie, c'est la prise en charge du quotidien, c'est la découverte du présent dans ce qu'habituellement on cherche à fuir. »Pierre Gravel
"La santé, c'est d'abord une affaire personnelle, pour devenir peut-être ensuite un problème de professionnels." Alain Pintus
ARTICLE 1
Critères d'utilisation appropriée de la Society for Vascular Surgery pour la prise en charge de la claudication intermittente,
Karen Woo, Jeffrey J. Siracuse, Kyle Klingbeil, Larry W. Kraiss, Nicholas H. Osborne, Niten Singh, Tze-Woei Tan, Shipra Arya, Subhash Banerjee, Marc P. Bonaca, Thomas Brothers, Michael S. Conte, David L. Dawson, Young Erben, Benjamin M. Lerner, Judith C. Lin, Joseph L. Mills, Derek Mittleider, Deepak G. Nair, Leigh Ann O’Banion, Robert B. Patterson, Matthew J. Scheidt, Jessica P. Simons,
Society for Vascular Surgery appropriate use criteria for management of intermittent claudication,
Journal of Vascular Surgery, Volume 76, Issue 1, 2022,
https://www.jvascsurg.org/article/S0741-5214(22)01478-1/fulltext, libre d'accés
Préalable : la correction stricte des FDRCV est impérative associée à un traitement médical optimal : anti agérant plaquettaire, statine fote dose et IEC si non CI
Critères d'utilisation appropriée (AUC) de la Society for Vascular Surgery pour la prise en charge de la claudication intermittente ont été créés à l'aide de la méthode d'adéquation RAND, une méthode validée et standardisée qui combine les meilleures preuves disponibles de la littérature médicale avec l'opinion d'experts, à l'aide d'un processus Delphi modifié.
Ces critères servent de cadre sur lequel la prise de décision partagée individualisée entre le patient et le clinicien peut se développer.
Ces critères ne sont pas absolus. L'ASC ne doit pas être interprétée comme une obligation d'administrer des traitements jugés appropriés (le bénéfice l'emporte sur le risque). L'ASC ne doit pas non plus être interprétée comme une interdiction des traitements jugés inappropriés (le risque l'emporte sur le bénéfice).
Des situations cliniques se produiront dans lesquelles des facteurs modérateurs, non inclus dans ces AUC, modifieront le niveau de pertinence d'un traitement pour un patient individuel.
Une mise en œuvre correcte de l'AUC nécessite une description de ces facteurs modérateurs du patient. Pour les scénarios avec une cote indéterminée, le jugement du clinicien combiné aux meilleures preuves disponibles devrait déterminer la stratégie de traitement. Ces scénarios nécessitent des mécanismes pour suivre les décisions de traitement et les résultats. L'ASC doit être revue périodiquement pour s'assurer qu'elle reste pertinente. Les panélistes ont évalué 2 280 scénarios uniques pour le traitement de la claudication intermittente (CI) dans les segments aorto-iliaque, fémoral commun et fémoro-poplité lors de l'évaluation du tour 2.
Parmi ceux-ci, seuls neuf (0,4 %) ont montré un désaccord en utilisant la plage intercentile ajustée pour la formule de symétrie, indiquant un degré de consensus exceptionnellement élevé parmi les panélistes.
Post hoc, le terme « inapproprié » a été remplacé par l'expression « les risques l'emportent sur les avantages ».
Le terme « approprié » a également été remplacé par « les avantages l'emportent sur les risques. ”
Les principes clés pour la gestion de l'IC reflétés dans ces AUC sont les suivants.
1/ La thérapie par l'exercice est la stratégie de prise en charge initiale préférée pour tous les patients atteints de CI.
2/ Pour les patients qui n'ont pas terminé la thérapie par l'exercice, la thérapie invasive pourrait apporter un bénéfice net à certains patients atteints de CI qui sont non-fumeurs, suivent un traitement médical optimal, sont considérés comme présentant un faible risque physiologique et technique et qui ont un mode de vie sévère. limitations et/ou une courte distance de marche.
3/ Compte tenu de la durabilité à long terme de la technologie actuellement disponible, les interventions invasives pour la maladie fémoro-poplitée devraient être réservées aux patients ayant de graves limitations de style de vie et une courte distance de marche.
4/ Dans le segment fémoral commun, endartériectomie fémorale commune ouverte fournira un bénéfice net supérieur à l'intervention endovasculaire pour le traitement de la CI r(cf article 2)
5/ Dans le segment sous-poplité, l'intervention invasive pour le traitement de la Claudication intermittente est d'un bénéfice incertain et pourrait être nocive....à la différence du sauvetage du membre en ischémie.Article 2
Year Outcomes of Thromboendarterectomy vs Endovascular Therapy for Common Femoral Artery Lesions: CAULIFLOWER Study Results
1-Year Outcomes of Thromboendarterectomy vs Endovascular Therapy for Common Femoral Artery Lesions: CAULIFLOWER Study Results | JACC: Cardiovascular Interventions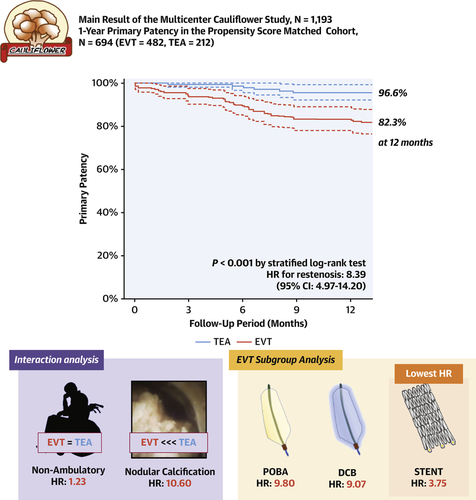
Contexte
La thromboendartériectomie (TEA) est le traitement de référence pour l'artère fémorale commune (CFA). Cependant, en raison de sa faible invasion et de sa courte durée d'hospitalisation, la thérapie endovasculaire CFA (EVT) est réalisée dans la pratique du monde réel. Cependant, les avantages cliniques et la population cible appropriée pour le CFA EVT restent flous.
Objectifs
Les objectifs de cette étude étaient de comparer les résultats cliniques du TEA avec ceux de l'EVT chez les patients atteints de maladies CFA symptomatiques et d'identifier la population cible adéquate pour l'EVT CFA.
Méthodes
Un total de 1 193 patients consécutifs ayant subi un EVT (n = 761) ou un TEA (n = 432) pour CFA ont été identifiés et revus rétrospectivement à partir d'un registre de 66 institutions. Le critère de jugement principal était la perméabilité primaire à 1 an comparée entre l'EVT et l'ATE en utilisant l'appariement des scores de propension. Une analyse d'interaction a été réalisée pour explorer la population cible appropriée pour CFA EVT.
Résultats
Après appariement sur score de propension, le taux de perméabilité primaire à 1 an était significativement plus élevé dans le groupe TEA (82,3 % vs 96,6 % ; P < 0,001), alors que les complications périopératoires étaient plus fréquemment observées dans le groupe TEA ( P = 0,047). Le statut non ambulatoire a atténué le HR de l'EVT par rapport au TEA pour le risque de resténose ( P = 0,021), alors que la présence de calcifications nodulaires a significativement augmenté le HR ( P = 0,040). Dans l'analyse du sous-groupe EVT pour le risque de resténose, l'utilisation d'un stent a montré le plus faible HR par rapport à l'angioplastie par ballonnet simple et à l'angioplastie par ballonnet enrobé de médicament ( P < 0,001).
Conclusion
Le TEA a montré une perméabilité supérieure à 1 an par rapport à l'EVT dans une étude multicentrique nationale. Le statut non ambulatoire atténuait la supériorité, alors que la présence de calcifications nodulaires la rehaussait.
Commentaire
L'artériopathie chronique oblitérante des membres inférieurs (AOMI) est la pathologie ATHEROTHROMBOTIQUE la plus difficile à prendre en charhe. Tout d'abord l'AOMI a le pronostic le plus grave en terme de mortalité du fait le plus souvent de son caractère polyviscéral. Les patients atteints d'AOMI sont des POLYVASCULAIRES. De plus en cas de diabète et ou d'insuffisance rénale chronique terminale les choses se compliquent. L'AOMI est aussi et surtour SOUS-DIAGNOSTIQUEE, SOUS-EVALUEE et SOUS-TRAITEE. Pour compléter le tableau on note en plus une compliance médiocre des patients au traitement. Cette compliance difficile concerne aussi bien la correction des facteurs de risque CV, l'activité physique et enfin la prise des médicaments. Autre difficulté l'examen écho-Doppler ,qu'il faut absolument interpréter en fonction de la clinique, de la présence des facteurs de co morbidité, l'âge, le sexe et l'ethnie.Sur le plan de l'écho-Doppler, c'est la COLLATERALITE qu'il faut analyser avec précision. La mesure de l'IPS est OBLIGATOIRE ou la Pression au Gros Orteil.
Autre difficulté c'est qu'à lésions artérielles identiques on devra pendre des mesures thérapeutiques différentes,en considérant, l'âge des patients , sa gêne, ses souhaits et ses facteurs de comorbidité.
De grâce AOMI n'égale pas systématiquement angio-scanner puis angioplastie. La pertinence des soins est très claire sur l'AOMI : " Il est inutile de réaliser un angioscanner des MI chez un patients qui présente une claudication large ".
On assiste de plus en plus à des angioplasties compationnelles......la prochaine étape , le patient va exiger d'être stenté....puis il choisira son stent......
Une fois de plus la rééducatison supervisée est la meilleure approche pour le traitement de l'AOMI, quand elle est possible. Cependant un préalable nécessaire et obligatoire est à respecter: la correction stricte des FDRCV est impérative associée à un traitement médical optimal : anti agérant plaquettaire, statine fotre dose et IEC si non CI. Les régles restent les mêmes sur le plan de l'approche thérapeutique de l'AOMI. Enfin les nouvelles molécules type anti PCSK9 et autres vont renforcer le traitement médical de l'AOMI et réduire à terme l'angioplastie et la chirurgie à la condition d'avoir un patient compliant notamment sur le controle des FDRCV.
Il est conseillé pour l'AOMI que le médecin traitant et le médecin vasculaire aient un suivi très régulier du patient porteur d'une AOMI. Il doit s'agir d'un PARCOURS de SOINS adapté à chaque cas donc très personnalisé. Ce suivi vasculaire n'égale pas écho-Doppler itératifs mais de simples consultations MEDICALES.
Demain les infirmier(e)s de pratique avancée seront en première dans le suivi des AOMI.
Dernières choses à prendre en considération les événements climatiques (canicule) et la pollution dont on SOUS ESTIME largement leur impact en cas d'AOMI. La canicule stoppe la marche quotidienne (un peu comme la Covid-19) , elle réduit l'HYDRATATION, et enfin elle renforce la SEDENTARITE. La pollution cardio vasculaire est une réalité, s'en préoccuper est une urgence.
Et puis cerise sur le gâteau l'INERTIE CLINIQUE des médecins, la cause majeure de l'absence de suivi des recommandations........AOMI : l'expérience et l'urgence
 Urgence vasculaire périphérique
Urgence vasculaire périphériqueAOMI : le score hémorragique OAC3-PAD Risk
 "Rien n'est plus dangereux que d'avoir raison" François Jacob
"Rien n'est plus dangereux que d'avoir raison" François JacobAOMI : les disparités ethniques
 AOMI DISPARITES ETHNIQUES PREVENTION
AOMI DISPARITES ETHNIQUES PREVENTIONAOMI : News ESVM
 “Mon médecin m’a recommandé d’arrêter les petits dîners pour quatre. A moins qu’il n’y ait trois autres personnes.” Orson Welles
“Mon médecin m’a recommandé d’arrêter les petits dîners pour quatre. A moins qu’il n’y ait trois autres personnes.” Orson Welles
Lipid-lowering and anti-thrombotic therapy in patients with peripheral arterial disease European A
therosclerosis Society/European Society of Vascular Medicine Joint Statement
Lipid-lowering and anti-thrombotic therapy in patients with peripheral arterial disease: European Atherosclerosis Society/European Society of Vascular Medicine Joint Statement: Vasa: Vol 50, No 6 (hogrefe.com) Résumé : Les patients atteints d’une maladie artérielle périphérique (AOMI) présentent un risque très élevé d’événements cardiovasculaires, mais la gestion des facteurs de risque est généralement sous-optimale. Ce groupe de travail conjoint de la Société européenne de l’athérosclérose et de la Société européenne de médecine vasculaire a mis à jour les données probantes sur la prise en charge de la dyslipidémie et des facteurs thrombotiques chez les patients atteints d’AOMI. Les lignes directrices recommandent un objectif de cholestérol avec de réduction du LDL de plus de 50 % par rapport à l’inclusion et de <1,4 mmol/L (<55 mg/dL) chez les patients atteints d’AOMI. Comme l’ont démontré des essais contrôlés randomisés, la réduction du LDL réduit non seulement les événements cardiovasculaires, mais également les événements indésirables majeurs des membres (MALE), y compris les amputations, de l’ordre de 25%.
Résumé : Les patients atteints d’une maladie artérielle périphérique (AOMI) présentent un risque très élevé d’événements cardiovasculaires, mais la gestion des facteurs de risque est généralement sous-optimale. Ce groupe de travail conjoint de la Société européenne de l’athérosclérose et de la Société européenne de médecine vasculaire a mis à jour les données probantes sur la prise en charge de la dyslipidémie et des facteurs thrombotiques chez les patients atteints d’AOMI. Les lignes directrices recommandent un objectif de cholestérol avec de réduction du LDL de plus de 50 % par rapport à l’inclusion et de <1,4 mmol/L (<55 mg/dL) chez les patients atteints d’AOMI. Comme l’ont démontré des essais contrôlés randomisés, la réduction du LDL réduit non seulement les événements cardiovasculaires, mais également les événements indésirables majeurs des membres (MALE), y compris les amputations, de l’ordre de 25%.
L’ajout d’ézétimibe ou d’un inhibiteur de PCSK9 diminue encore le risque d’événements cardiovasculaires, et l’inhibition de PCSK9 a également été associée à une réduction du risque de MALE jusqu’à 40%.
En outre, le traitement à base de statines a amélioré les performances de marche, y compris la distance de marche maximale, ainsi que la distance et la durée de marche sans douleur. Ce groupe de travail recommande des stratégies pour gérer les symptômes musculaires associés aux statines afin de s’assurer que les patients atteints d’AOMI bénéficient d’un traitement optimal.
Un traitement antiplaquettaire, soit du clopidogrel quotidien à 75 mg, soit une combinaison d’aspirine à 100 mg et de rivaroxaban (2×2,5 mg) est également indiqué pour prévenir les événements cardiovasculaires.
L’inhibition à double voie (aspirine et rivaroxaban) peut être envisagée après la revascularisation, en tenant compte du risque de saignement.
Ce groupe de travail conjoint croit que le respect de ces recommandations pour le traitement hypomididique et antithrombotique améliorera la morbidité et la mortalité chez les patients atteints d’AOM
Les RECOMMANDATIONS Commentaires
Commentaires
Rien que l'on ne savait dèjà excepté l'apparion de l'association rivaroxaban et aspirine. Cependant ces recommendations sont très importantes car dans vrie vie si oin ne ptend que le point sur les statines, elles sont sous dosée dans l'AOLI et la cible LDL à ateindre ne l'est pratiquement jamais.C'est un point majeur. Rappelons qu'en France pour l'instant le rivaroxaban 2,5 mg n'est pas sur le marché. Enfon il est urgent que les médecins vasculaires puissient prescrire les anti PCSK9.#VACCINE3.0AOMI : one more times !
 AOMI Action Gravité Multidisciplinaire
AOMI Action Gravité MultidisciplinaireAOMI : Revue du NEJM

J'ai une artérite des MI , donc je marche.
AOMI 2024 Recommandations
 AOMI : encore mieux la connaître
AOMI : encore mieux la connaîtreAOMI aujourd'hui et demain
 AOMI , prise n chage de base, l'ecellence
AOMI , prise n chage de base, l'ecellence
AOMI chez la femme : VASCO 2022
 “Ainsi sont toutes femmes, femmes.” Rabelais
“Ainsi sont toutes femmes, femmes.” Rabelais
“S’il est vrai que les hommes sont meilleurs que les femmes parce qu’ils sont plus forts, alors pourquoi les lutteurs de Sumo ne sont-ils pas au gouvernement ?” – Kishida Toshiko
“Il est temps que les femmes arrêtent d’être aimablement énervées” – Leymah Gbowee, Prix Nobel de la Paix
Le congrès VASCO 2022 est dédié à la femme et en partuliers aux artères des femmes.A PROPOS DE VASCO
L’Association de Chirurgie Thoracique et Vasculaire de l’Océan Indien a pour objet le développement et la promotion des techniques de chirurgie vasculaires, endovasculaires et thoraciques.A ce titre, elle organise régulièrement des formations théoriques et/ou pratiques.Également, elle peut entreprendre ou favoriser des études cliniques et expérimentales sur les traitements des maladies thoraciques et vasculaires humaines
Cette année c'est le XIII°congrès qui se déeoule à l'île Maurice et dédié aux Mauritiens et aux Réunionais du 28 Octobre au 1 Novembre 2022
Merci à Reuben Veerapen et Gilles Lerussi de leur travail incessant, merci aux intervenents et aux pariticipants
Sex Differences in Peripheral Artery Disease Pabon Maria; Cheng Susan; Altin S. Elissa, Sethi, Sanjum S.; Nelson, Michael D.; Moreau, Kerrie L.; Hamburg, Naomi; Hess, Connie N.Circulation Research Numéro : Volume 130(4), 18 February 2022, p 496-511 : Lien
Différences entre les sexes dans la maladie artérielle périphérique
La maladie artérielle périphérique (AOMI) est une affection prévalente qui confère une morbidité et une mortalité substantielles et reste sous-diagnostiquée ainsi que sous-traitée dans la population globale.
Bien que la prévalence de l'AOMI soit similaire ou supérieure chez les femmes par rapport aux hommes, les associations de facteurs de risque traditionnels et non traditionnels avec l'AOMI et ses manifestations cliniques diffèrent selon le sexe et peuvent contribuer au retard ou à l'absence de diagnostic chez les femmes.
De telles différences basées sur le sexe dans la manifestation de l'AOMI peuvent provenir du dysmorphisme sexuel dans le substrat vasculaire en bonne santé ainsi que de la variation sexuelle dans les réponses aux facteurs de stress vasculaires.
Malgré la disponibilité de thérapies éprouvées pour améliorer les symptômes et réduire le risque d'événements ischémiques cardiovasculaires et des membres chez les patients atteints d'AOMI diagnostiquée, d'importantes différences entre les sexes dans le traitement et les résultats ont été observées.L'AOMI fait généralement référence aux maladies artérielles du système vasculaire non coronaire qui peuvent résulter d'athérosclérose, d'anévrisme, d'inflammation ou d'une combinaison de pathologies.
* Pour nous concentrer sur la forme la plus répandue de maladie vasculaire périphérique, nous nous référons ici à l'AOMI en tant que rétrécissement athéroscléreux des artères périphériques qui affecte classiquement les membres inférieurs. Définie comme telle, la prévalence de l'AOMI a non seulement persisté mais doublé au cours des 3 dernières décennies, en partie à cause de l'allongement de l'espérance de vie, de l'augmentation de l'incidence des facteurs de risque tels que l'obésité et le diabète, et de l'augmentation du dépistage et de la détection.
* Il est important de noter que la présence ou l'absence d'AOMI ce qui confère un risque de mortalité plus élevé
* Il existe un risque global similaire ou pire d'événements cardiovasculaires ischémiques par rapport aux personnes atteintes uniquement d'une maladie coronarienne.
* Nonobstant ces statistiques, la'AOMI reste sous-diagnostiquée et, à son tour, sous-traitée par rapport à d'autres maladies cardiovasculaires .* Dans ce contexte, les femmes sont particulièrement vulnérables. Malgré une prévalence similaire ou supérieure de l'AOMI, la reconnaissance clinique est souvent retardée ou différée chez les femmes par rapport aux hommes.Facteurs de risque indépendants du sexe et spécifiques au sexe pour la maladie artérielle périphérique. Un certain nombre de facteurs de risque de maladie artérielle périphérique indépendants du sexe ont été identifiés, le tabagisme étant l'un des plus importants et contribuant potentiellement à un fardeau de risque de maladie plus important chez les femmes que chez les hommes, sur la base d'analyses d'associations de métabolites du tabac. Le fardeau excessif et la prédominance multivasculaire de la maladie artérielle périphérique chez les femmes peuvent également provenir d'une prédisposition spécifique au sexe pour le dysfonctionnement endothélial et, à son tour, le dysfonctionnement et la maladie artériels dans le cadre d'une carence en œstrogènes liée à l'âge survenant avec ou sans un trouble vasculaire antérieur. trouble de l'événement de la grossesse. À partir de: Pabon: Circ Res, Volume 130(4).February 18, 2022.496-511
* Même parmi les patients diagnostiqués, les différences fondées sur le sexe dans les traitements et les résultats de l'AOMI sont évidentes.
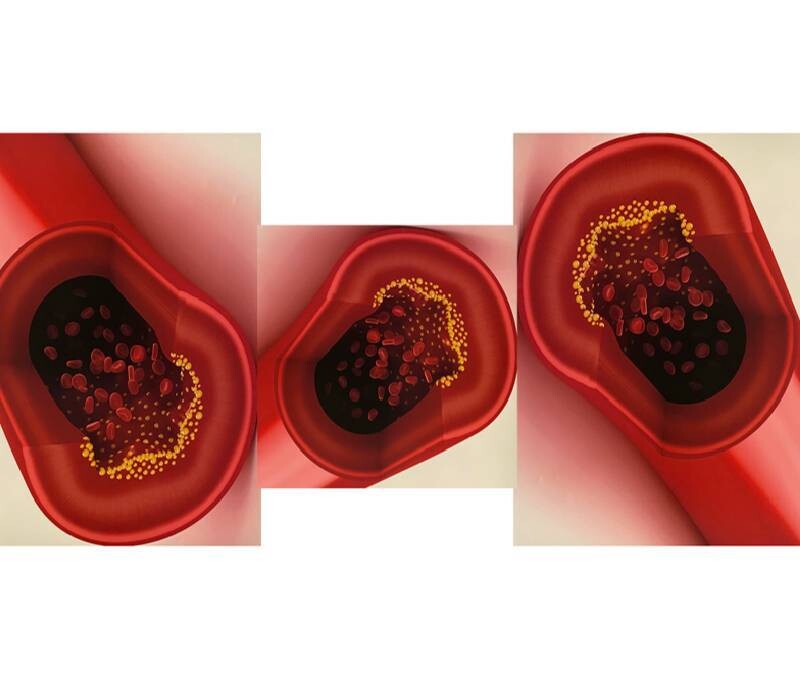
Par conséquent, nous résumons les connaissances actuelles concernant les différences entre les sexes dans l'épidémiologie, la physiopathologie, la présentation clinique et la gestion de l'AOMI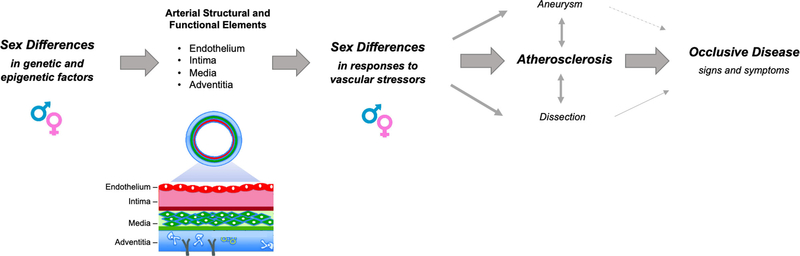 Différences entre les sexes dans les réponses aux facteurs de stress vasculaires et aux séquelles. Un paradigme conventionnel propose que lorsque le même substrat structurel et fonctionnel artériel es t exposé à des facteurs de stress, les différences entre les sexes en réponse à ces facteurs de stress entraînent des variations de la maladie vasculaire périphérique manifeste, y compris la prédominance de l'anévrisme et de la dissection de l'aorte chez les hommes ainsi que la prévalence probablement plus élevée de la maladie athéroscléreuse classique des membres inférieurs chez les femmes qui a également tendance à se présenter davantage comme une maladie multitronculaire chez les femmes que chez les hommes. De nouvelles preuves suggèrent que les différences sexuelles intrinsèques dans le substrat artériel, résultant de facteurs génétiques ou épigénétiques, contribuent probablement également au dimorphisme sexuel dans les phénotypes de maladies vasculaires.À partir de: Pabon: Circ Res, Volume 130(4).February 18, 2022.496-511
Différences entre les sexes dans les réponses aux facteurs de stress vasculaires et aux séquelles. Un paradigme conventionnel propose que lorsque le même substrat structurel et fonctionnel artériel es t exposé à des facteurs de stress, les différences entre les sexes en réponse à ces facteurs de stress entraînent des variations de la maladie vasculaire périphérique manifeste, y compris la prédominance de l'anévrisme et de la dissection de l'aorte chez les hommes ainsi que la prévalence probablement plus élevée de la maladie athéroscléreuse classique des membres inférieurs chez les femmes qui a également tendance à se présenter davantage comme une maladie multitronculaire chez les femmes que chez les hommes. De nouvelles preuves suggèrent que les différences sexuelles intrinsèques dans le substrat artériel, résultant de facteurs génétiques ou épigénétiques, contribuent probablement également au dimorphisme sexuel dans les phénotypes de maladies vasculaires.À partir de: Pabon: Circ Res, Volume 130(4).February 18, 2022.496-511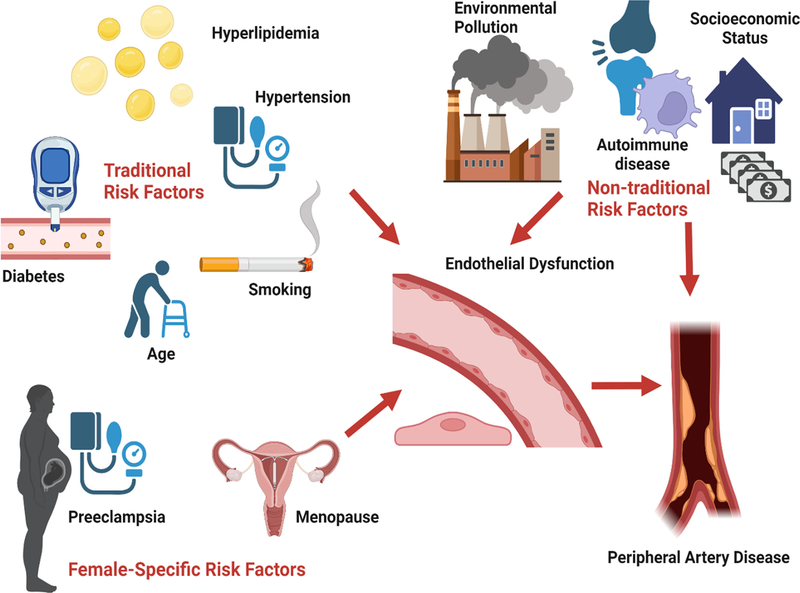
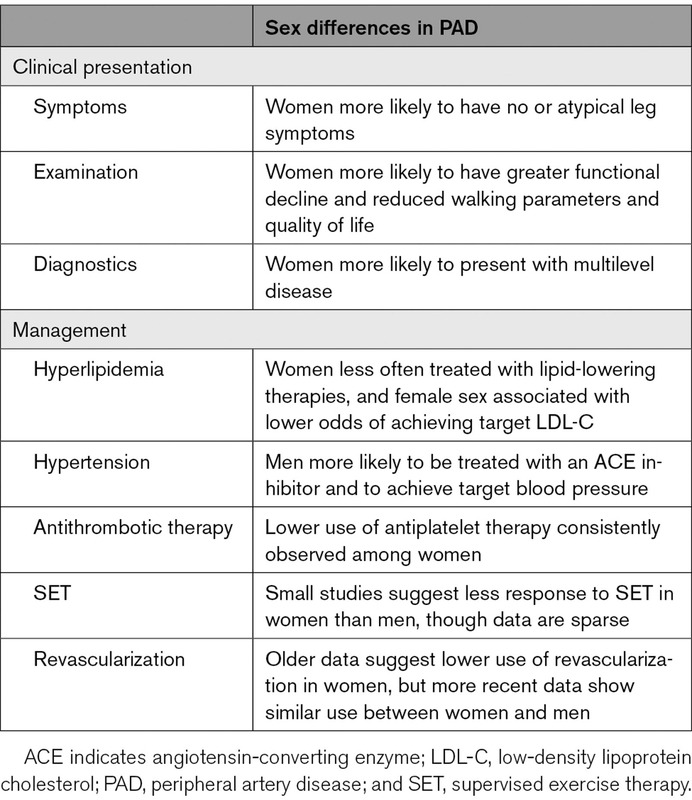 Différences entre les sexes dans la présentation et la prise en charge de l'AOMI : Pabon : Circ Res, Volume 130(4).February 18, 2022.496-511
Différences entre les sexes dans la présentation et la prise en charge de l'AOMI : Pabon : Circ Res, Volume 130(4).February 18, 2022.496-511
Diagnostic de l'AOMI chez la femme :
Plusieurs tests peuvent être utilisés pour le diagnostic de l'AOMI. L' IPS est le test de diagnostic de choix en raison de son faible coût, de son caractère non invasif et de sa grande disponibilité. Les modalités de test supplémentaires utilisées pour confirmer le diagnostic de l'AOMI et de définir l'anatomie artérielle comprennent l'écho-Doppler, l'angio scannet et l'angiographie par résonance magnétique. L'angiographie invasive reste l'étalon-or pour le diagnostic de l'AOMI, mais elle est généralement réalisée lorsque les méthodes non invasives ne sont pas réalisables ou ne sont pas concluantes ou lorsqu'une revascularisation est prévue.
Malgré les artères de plus petit calibre observées chez les femme par rapport aux hommes, aucune étude n'a montré de différences basées sur le sexe dans la précision de l'imagerie pour l'AOMI. Un obstacle important au diagnostic de l'AOMI chez les femmes reste le biais du clinicien et l'incapacité à reconnaître les symptômes atypiques.
Commentaire
On a la triste impression que les médecins commencent à comprendre que les femmes sont des "cardiovasculaires " en puissance. L'AOMI est sous diagnotiquée sous évaluées et sous traitées au même titre que les atteintes coronariennes et l'anévrisme de l'Aorte Abdominale. Les atteintes cardiovasculaires représentent chez les femmes leur première cause de mortalité devant le cancer. Il est temps de se réveiller .Claire Mounier Véhier l'a bien compris en créant Agir pour le Coeur des Femmes @ACF_WCHF et le Bus su Coeur. Il est important que toute femme en pré ménopause bénéficie d'un examens de dépistrage cardio-vasculaire d'auant p)us qu'elle a des FDR CV comme des atcds obstéricaux artériels, qu'elle fume, qu'elle présente une héréditré CV, une HTA, un diabète, une dyslipidémie, qu'elle est en surpoids et ou sédentaire. Le stade de la prévention primaire ne doit pas âtre "loupé".Alessandra Bura-Rivière à animé récemment un webinar (SFMV) sur l'artériopathie chez la femme. Quelques données importantes au niveau de l'Europe : 55% des femmes décèdent de pathologie CV vs 43% des hommes. Décès par IDM 24% chez les femmes, 21% chez les hommes, autres atteintes CV , 15%F vs 11% H. Chez la femme, l'AOMI asymptomatique 12% vds 9% H, symptomes atypiques X 2 chez les femmes, enfin les femmes sont moins à l'aise pour parler de douleurs des membres inférieurs. La claudication chez les femmes ; 33% plus courte, distance de marche 23% plius courte que chez l'homme. Un % de déclin fonctionnel et déficit fonctionne plus élévé chez les femmes. Dans l'étude REACH, les hommes ont le double de chances d'obtenir un contrôle optimal des FDRCV. Les traitements médicaux de l'AOMI est moins fréquemment adliministré chez les femmes; enfin moins de revasularisation que chez les homes (étude COPART).Les femmes participent moins aux protocoles clinques. Il y a un travail énorme à développer et une communication importante à réaliser encore et encore. Ne pas publier que la pollution, est un FDRCV importan ttout comme la PRECARITE. Une consultation dédiée cardiologique et de Médecine Vasculaire est à mettre en place en urgence dès la pré ménopause . La prévention primaire doit être un passage indispensable quant à la prévention secondaire il faut la renforcer. +++
Grégoire Détriché "conseille de prendre l’initiative de réaliser des dosages des taux FSH plasmatique durant la période péri-ménopausique afin d’en établir une cinétique qui rmettrait sans doute de stratifier le risque cardiovasculaire chez les femmes à cette période de leur vie et de planifier un suivi cardiovasculaire personnalisé pour chaque patiente.Des effets cardiovasculaires protecteurs des estrogènes ont été démontrés. Ils favorisent en effet la vasodilatation artérielle, diminuent l’action des cytokines pro-inflammatoires, abaissent les lipoprotéines de basse densité et augmentent les lipoprotéines de haute densité. A la ménopause, de manière schématique, un switch hormonal a lieu : les estrogènes chutent et la concentration plasmatique d’une des gonadotrophines, par boucle de rétrocontrôle, augmente : il s’agit de l’hormone folliculostimulante (FSH). Des études ont même rapporté la corrélation entre taux plasmatique de FSH et épaisseur intima-média carotidienne et score calcique coronaire chez la femme. Mais concernant le taux de FSH, un autre paramètre est intéressant à regarder : la cinétique d’augmentation du taux plasmatique de cette hormone pendant la période péri-ménopausique. En effet, des auteurs ont souligné que les femmes ayant une cinétique d’augmentation plus faible de la FSH pendant leur transition vers la ménopause pouvaient être moins à risque de développer une athérosclérose symptomatique que celles avec une cinétique d’augmentation moyenne ou élevée de FSH durant cette même période. Il est ainsi possible que durant leur vie pré-ménopausique, l’athérome reste asymptomatique et que le trigger des manifestations cliniques chez les femmes soit l’augmentation des taux plasmatiques de FSH et leur niveau d’augmentation durant leur période de transition péri-ménopausique." Affaire à suivre.......
“Saisissez chaque opportunité qui se présente à vous, vivez chaque expérience. Laissez une marque dans le monde, pour les bonnes raisons” – Chrissie Wellington
A lire
https://medvasc.info/1516-entretien-avec-le-pr-claire-mounier-v%C3%A9hier-le-c%C5%93ur-des-femmes
https://medvasc.info/1424-calcifications-aorte-abdominale-et-risque-de-chutes-chez-les-femmes
https://medvasc.info/869-agir-pour-le-coeur-des-femmes
https://medvasc.info/1527-entretien-avec-l-auteur-gr%C3%A9goire-detrich%C3%A9-aomi-femme
https://medvasc.info/1298-aaa-et-la-femme-2
https://www.agirpourlecoeurdesfemmes.com/#
https://www.agirpourlecoeurdesfemmes.com/medecine-vasculaire.php
https://www.agirpourlecoeurdesfemmes.com/fonds-de-dotation/Ambassadeurs/Consensus-d-experts-HTA-HORMONES-ET-FEMME

