AOMI
-
AOMI chez la femme revascularisée en France
 AOMI Femmes revascularisation
AOMI Femmes revascularisation -
AOMI disparités (USA)
 AOMI quand on change de continent
AOMI quand on change de continent -
AOMI disparités liées au sexe
 AOMI FEMMES DISPARITES INTERSECTIONALITE
AOMI FEMMES DISPARITES INTERSECTIONALITE -
AOMI et Covid-19
 "Quand le coeur d'un grand homme cesse de battre, on donne son nom à une artère." Pierre Daninos
"Quand le coeur d'un grand homme cesse de battre, on donne son nom à une artère." Pierre Daninos
"Un fleuve telle une artère redonne à la mer ce que la mer avait donné à la Terre." Axonezone
Analyse de 3 articles :
ARTICLE 1 : A cross-sectional study evaluating hospitalization rates for chronic limb-threatening ischemia during the COVID-19 outbreak in Campania, Italy, Eugenio Stabile et Coll, Vascular Medicine 2021, Vol. 26(2) 174– 179 (https://journals.sagepub.com/doi/full/10.1177/1358863X20977678)
Une étude transversale évaluant les taux d'hospitalisation pour l'ischémie chronique menaçant les membres pendant la pandémie COVID-19 en Campanie, en Italie
L'expansion de la maladie à coronavirus 2019 (COVID-19) a incité le gouvernement italien a décidé d'un confinement national le 9 mars 2020.Le but de cette étude est d'évaluer le taux d'hospitalisation et le mode de traitement hospitalier des patients atteints d'ischémie chronique menaçant les membres (CLTI) avant et pendant le confinement dans la région de Campanie en Italie.
La population de l'étude comprend tous les patients atteints de CLTI hospitalisés en Campanie sur une période de 10 semaines: 5 semaines avant et 5 semaines pendant le confinement ( n= 453). Les patients ont été traités médicalement et / ou ont subi une revascularisation urgente et / ou une amputation majeure des membres inférieurs. L'âge moyen était de 69,2 ± 10,6 ans et 27,6% des patients étaient des femmes.
Pendant l'hospitalisation, 21,9% des patients ont été traités médicalement, 78,1% ont subi une revascularisation et 17,4% ont nécessité des amputations. Dans les semaines pendant le confinement un taux d'hospitalisation réduit pour CLTI a été observé par rapport aux semaines précédant le confinement (25 vs 74/100 000 habitants / an; taux d'incidence: 0,34, IC à 95% 0,32-0,37). Cet effet a persisté jusqu'à la fin de la période de cetteétude.Cette étude a rapporté qu'au cours des 5 semaines pendant le confinement de la région de Campanie en Italie:- Le taux d'hospitalisation CLTI a été réduit à 1/3 de celui observé dans les 5 semaines précédant le verrouillage.- Le taux d'amputation des patients hospitalisés avec CLTI a été augmenté par rapport à celui observé avant le confinement.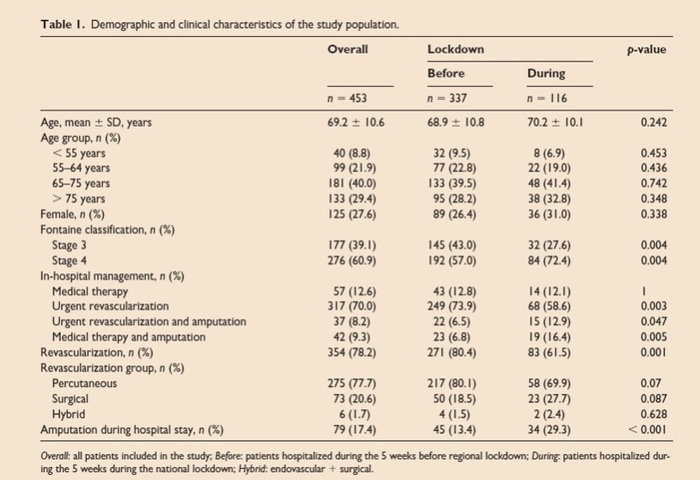
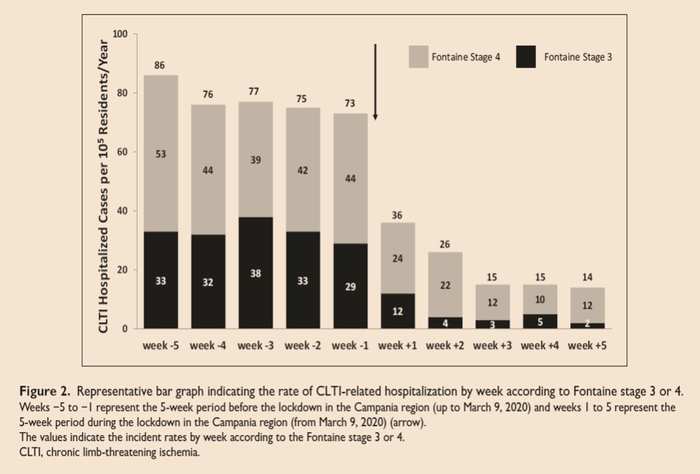
Une augmentation du taux d'amputation dans les semaines pendant le confinement a été observée (29,3% vs 13,4%; p<0,001). Cette étude rapporte un taux réduit d'hospitalisation liée à lla CLTI et une augmentation du taux d'amputation à l'hôpital pendant le confinement en Campanie.
Assurer un traitement approprié pour les patients atteints de CLTI doit être une priorité, même pendant les périodes du confinement de la maladie en raison de la pandémie de COVID-19 ou d'autres conditions similaires.
ARTICLE 2 : Prevalence of COVID-19 Risk Factors and Risks of Severe Acute Respiratory Disease are Markedly Higher in Patients with Symptomatic Peripheral Arterial Occlusive Disease,Frederik Peters,EJVES Volume 61, Issue 5, May 2021, Pages 859-860
https://www.ejves.com/article/S1078-5884(21)00207-0/abstract
La prévalence des facteurs de risque du COVID-19 et les risques de maladie respiratoire aiguë sévère sont nettement plus élevés chez les patients atteints de maladie occlusive artérielle périphérique symptomatique (AOMI)
La prévalence des facteurs de risque de la COVID-19 et les risques de maladie respiratoire aiguë sévère sont nettement plus élevés chez les patients atteints d'AOMI symptomatique La cohorte la plus vulnérable présentant le risque le plus élevé de maladie grave a été récemment décrite dans diverses publications.Les hommes, les octogénaires, les patients atteints de maladie cardiovasculaire, de diabète, de maladie hépatique chronique, de maladie rénale chronique, de maladie pulmonaire chronique, de tumeur maligne et ceux souffrant d'obésité et de tabagisme sont plus à risque que la population en bonne santé. Les patients présentant un (AOMI sont connus pour présenter d'une multimorbidité complexe chronique comprenant tous ces facteurs de risque.
Jusqu'à ce que des connaissances plus spécifiques et de meilleures données sur la COVID-19 soient disponibles, des maladies comparables telles que la grippe et le syndrome respiratoire aigu sévère ou généralement une maladie respiratoire aiguë peuvent servir d'indicateurs de la vulnérabilité de certais sous-groupes.
Les résultats évalués au cours du suivi d'un an après le séjour de référence concernaient l'hospitalisation associée à la grippe, au SDRA et aux maladies respiratoires aiguës. Les taux normalisés selon l'âge et le sexe et les différences de taux pour 1 000 personnes (facteurs de risque) et 1 000 années-personnes (résultats) avec des intervalles de confiance à 95% ont été calculés.Les patients présentant une AOMI symptomatique ( n = 11 299) étaient plus souvent des hommes (52,8%) et plus âgés (âge moyen 73,3 ± 11,0 ans) que l'échantillon témoin ( n = 99 730, 35,9% d'hommes, âge moyen 63,1 ± 12,9 ans).
Standardisés pour ces différences, les patients atteints d'AOMI avaient un profil de facteur de risque moins favorable que l'échantillon témoin . Les risques étaient élevés pour le tabagisme, le diabète, les maladies coronariennes, l'hypertension, l'obésité, les atteintes hépatiques et les maladies pulmonaires chroniques, mais pas pour le cancer. La vaccination antigrippale a été notée plus souvent chez les patients atteints d'AOMI que dans l'échantillon témoin
Le risque d'hospitalisation associé à la grippe, au SDRA et aux maladies respiratoires aiguës était plus de quatre fois plus élevé chez les patients atteints d'AOMIque dans l'échantillon témoin. Sur 10 000 personnes, 63,6 ont souffert de la grippe, 8,3 du SDRA et 734,3 d'une maladie respiratoire aiguë pendant un an de suivi après le séjour de référence.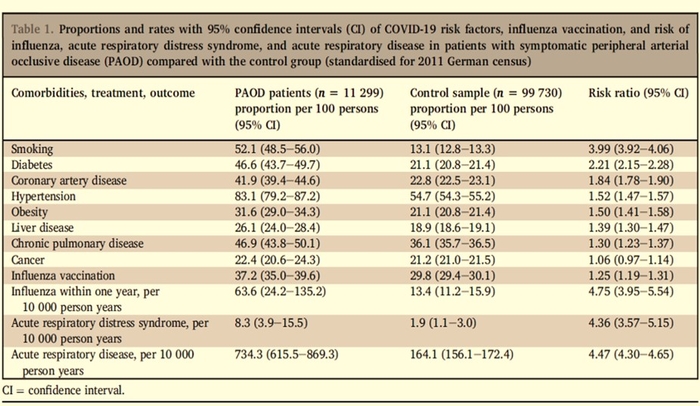
Ces résultats confirment que les patients traités pour une AOMI symptomatique sont non seulement plus âgés et plus souvent de sexe masculin, mais sont également confrontés à des facteurs de risque de COVID-19 considérablement élevés et sont particulièrement sensibles aux maladies respiratoires graves associées à l'hospitalisation. Malgré une probabilité plus élevée de vaccination contre la grippe chez les patients atteints d'AOMI, les taux sont encore considérablement inférieurs aux objectifs de couverture nationale et aux recommandations des lignes directrices de l'American Heart Association / American College of Cardiology. Cette situation est préoccupante d' autant plus que la grippe comme les maladies ne sont pas seulement liées à un risque plus élevé d'événements indésirables respiratoires , mais aussi à la morbidité cardiovasculaire et mortalité toutes causes confondues chez les patients atteints de la maladie athéromateuse coronarienne et d' autres.
ARTICLE 3 : An increased severity of peripheral arterial disease in the COVID-19 era,Giuseppe Sena et coll, J Vasc Surg . 2020 Aug;72(2):758
Une gravité accrue de la maladie artérielle périphérique à l'ère du COVID-19
Aug;72(2):758 https://pubmed.ncbi.nlm.nih.gov/32360372/
La récente pandémie Covid-19 a considérablement accru la pression sur notre système de santé dans le monde. L'urgence sanitaire a modifié l'organisation des établissements de santé et a focalisé l'attention sur la gestion de la pandémie. Cela a conduit à des changements importants dans le traitement des patients sans COVID-19 et a abouti à l'accès plus difficile aux soins avec des retards dans le diagnostic et le traitement. Les maladies vasculaires, y compris les maladies artérielles périphériques, nécessitent un traitement rapide dans la plupart des cas. L'atteinte la plus sévère de l'AOMI est ischémie critique des membres (CLI). La CLI nécessite une revascularisation rapide pour éviter la perte de tissu et l'amputation. L'introduction du confinement en Italie à partir du 9 mars 2020 a conduit à la fermeture des activités ambulatoires et a empêché l'accueil précoce des patients atteints de CLI. De plus, la peur de la contagion a conduit à une sous-estimation des symptômes et a retardé l'accès au traitement en urgence. Ainsi, des patients atteints de CLI sévère avec ulcères septiques importants et gangrène sont arrivés dans notre service de chirurgie vasculaire. Pour la plupart de ces patients, il n'a pas été possible de sauver les membres et, par conséquent, ils ont subi une chirurgie d'amputation. Nous avons observé que le nombre d'amputations pratiquées dans notre service du 9 mars au 20 avril 2020 était significativement supérieur au nombre pratiqué au cours de la même période en 2019. Plus précisément, nous avons pratiqué 9 amputations au cours de cette période contre 5 amputations réalisées en 2019 sur la même période; une augmentation de près de 50%. Nous pensons que la pandémie COVID-19 a conduit à un mauvais traitement des patients atteints d'autres entités pathologiques; il est donc nécessaire d'adopter des mesures plus adaptées pour éviter d'autres conséquences graves sur la santé des citoyens. Par conséquent, il est nécessaire d'identifier les solutions qui permettront à ces patients d'avoir un accès rapide au traitement avec des améliorations marquées des résultats.
CommentairesToutes les atteintes cardiovasculaires, le diabète, l'obésité sont des facteurs de co morbidité majeurs en cas de Covid-19. Les patients qui sont porteurs d'une AOMI cumulent tous les facteurs de co-morbidité, d'autant plus qu'ils sont le plus souvent des polyvasculaires. Ces patients sont tous prioritaires pour être vaccinés et se protéger du mieux possible.
Ces trois articles et leurs résultats sont applicables sur toute la planète AOMI !
De plus durant le premier confiement en France, nous avons assisté chez les patients porteurs d'AOMI à différentes situations : reprise du tabac, réduction de la marche, abandon d'une partie du traitement médical .Après le premier confinement , les patients on été revu en consultation avec souvent des aggravations de leur AOMI. La faute des autorités en France est d'avoir dit lors du premier confinement, restrez chez vous ne consulter pas votre médecin, ce qui n'a plus été le cas pour les autres confinbements, erreur regrettable.Les affections cardiovasculaire représentent un surrisque en cas de Covid-19. L'AOMI en fait partie avec un surrisque encore augmenté. Les patients qui présentent une AOMI sont prioritaires pour la vaccination. Autre point ,en cas de confinement , le suivi de ces patients ne doit pas être interrompu.
#VACCINE2.0 -
AOMI et DIABETE : 2025 ACCC
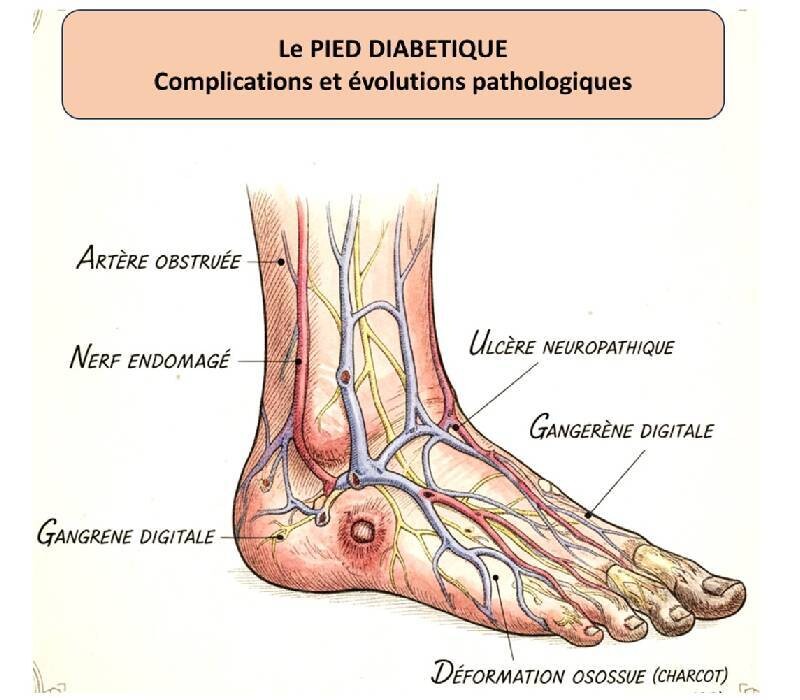 Attention au pied diabétique.
Attention au pied diabétique. -
AOMI et Diabète : effet GLT2 et GLP1
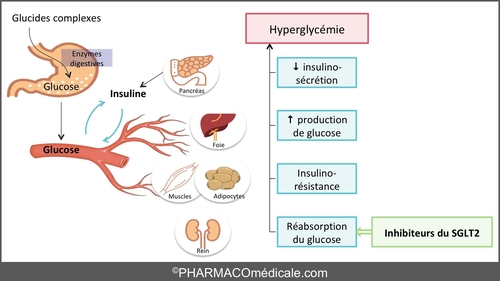 “Que ton aliment soit ton premier médicament.” Hippocrate
“Que ton aliment soit ton premier médicament.” Hippocrate
Skeik N, Elejla SA, Sethi A, Manunga J, Mirza A. Effets des inhibiteurs du SGLT2 et des agonistes des récepteurs GLP1 sur les événements cardiovasculaires et des membres dans la maladie artérielle périphérique :une revue. Médecine Vasculaire . 2023;0(0). doi : 10.1177/1358863X221143811La maladie artérielle périphérique (AOMI) et le diabète sucré sont deux problèmes de santé accablants associés à des événements cardiovasculaires (CV) et des membres majeurs, en plus d'une mortalité accrue, malgré les progrès des thérapies médicales, notamment les statines et les inhibiteurs du système rénine-angiotensine.
Les inhibiteurs du cotransporteur sodium-glucose de type 2 (SGLT2i)et les agonistes du récepteur du peptide 1 de type glucagon (GLP1-RA)sont deux nouvelles classes de médicaments antihyperglycémiants qui ont été associées à une réduction significative des événements cardiovasculaires indésirables majeurs (MACE) chez les patients atteints de type 2 diabète (DT2) et risque CV.
Alors que la plupart des études avaient recruté des patients atteints de DT2 et de maladie CV concomitante (MCV), les patients atteints d'AOMI étaient manifestement sous-représentés.
De plus, il y avait un signal de risque accru d'amputation dans l'un des principaux essais avec la canagliflozine.L'objectif de cetgte étude est de fournir une revue générale de la littérature actuelle et de résumer les recommandations des recommandations des sociétés savantgs sur le rôle des médicaments SGLT2i et GLP1-RA chez les patients atteints de maladies cardiovasculaires en se concentrant sur la population d'AOMI lorsque les données sont disponibles.
Les paramètres d'intérêt étaient les MACE et, lorsqu'ils étaient disponibles, les événements indésirables majeurs des membres (MALE).
Rappel :
Evénements cardiovasculaires indésirables majeurs (MACE)
Evénements indésirables majeurs des membres (MALE).Les preuves émergentes des avantages CV des thérapies antihyperglycémiques ont certainement eu un impact sur la prise en charge des patients diabétiques et, pour la première fois, le choix de l'antidiabétique ne dépend pas uniquement des taux d'HbA1c.
Une approche multidisciplinaire, impliquant des cardiologues et des diabétologues (...et les médecins vasculaires), est nécessaire pour de meilleurs soins et résultats chez les patients atteints de DT2 et à risque CV.
Aucune des société actuelles ne fait de recommandations spécifiques principalement pour les patients atteints d'AOMI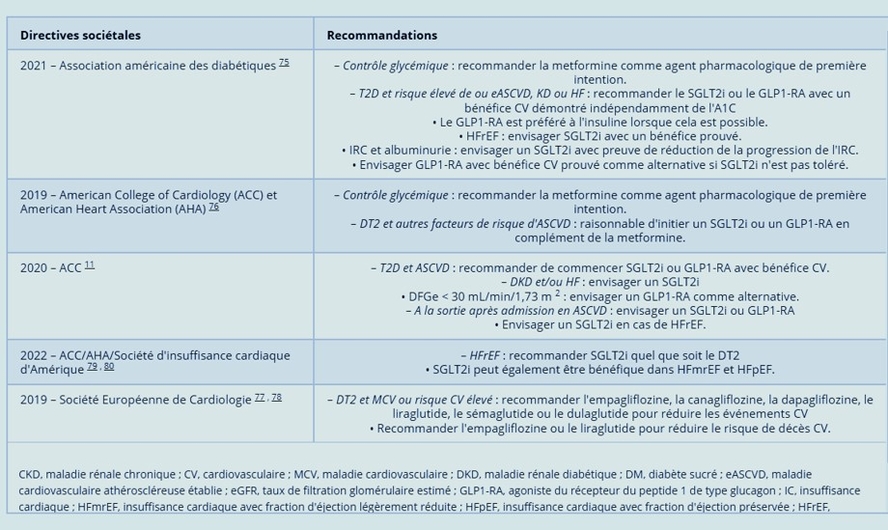
Normes 2021 de l'Association américaine du diabète
Chez les patients atteints de DT2 avec une ASCV établie ou des indicateurs de maladie rénale (MR) ou d'IC à haut risque, un SGLT2i ou GLP1-RA avec un bénéfice CV démontré est recommandé dans le cadre du traitement hypoglycémiant indépendant de l'A1c, et dans prise en compte des facteurs spécifiques au patient.
Chez les patients atteints de DT2, un GLP1-RA est préféré à l'insuline lorsque cela est possible. Chez les patients atteints d'HFrEF, le SGLT2i avec un bénéfice prouvé dans cette population doit être envisagé. Chez les patients atteints d'IRC et d'albuminurie, un SGLT2i avec des preuves primaires de réduction de la progression de l'IRC doit être envisagé. Le GLP1-RA avec un bénéfice CV prouvé est une alternative si les médicaments SGLT2i ne sont pas tolérés.Recommandations 2019 de l'American College of Cardiology (ACC)/American Heart Association (AHA) sur la prévention primaire des maladies cardiovasculaires
L'American Heart Association (AHA) recommande le dépistage de l'ABI chez les patients diabétiques asymptomatiques, âgés de 50 à 64 ans ou < 50 ans, avec au moins un facteur de risque supplémentaire d'athérosclérose si les résultats ont un impact sur le plan de prise en charge.
Pour les patients diabétiques et atteints d'une ASCV établie (p. ex. AOMI), un objectif d'HbA1c < 7 doit être envisagé. Des objectifs moins stricts peuvent être acceptés chez les patients âgés présentant de multiples comorbidités.Pour les adultes atteints de DT2 et d'autres facteurs de risque d'ASCVD qui nécessitent un traitement hypoglycémiant malgré les modifications initiales du mode de vie et la metformine, il peut être raisonnable d'initier un SGLT2i ou un GLP1-RA pour améliorer le contrôle glycémique et réduire le risque CV.2020 ACC Expert Consensus Decision Pathway sur les nouvelles thérapies pour la réduction du risque cardiovasculaire chez les patients atteints de diabète de type 2
Chez les patients atteints de DT2 et d'ASCVD, recommander de commencer le SGLT2i ou le GLP1-RA avec un bénéfice CV en fonction des facteurs et des comorbidités spécifiques au patient. Les patients avec DKD et/ou HF concomitants envisagent un SGLT2i. Alternativement, un GLP1-RA peut être envisagé pour un DFGe < 30 mL/min/1,73 m 2 . A la sortie de l'hôpital (avec un suivi ambulatoire rapproché) après une admission pour un ASCVD, envisager un SGLT2i ou GLP1-RA, et un SGLT2i en cas de HFrEF. 11Recommandations 2019 de la Société européenne de cardiologie sur le diabète et les maladies cardiovasculaires
L'empagliflozine, la canagliflozine, la dapagliflozine, le liraglutide, le sémaglutide ou le dulaglutide sont recommandés plutôt que la metformine en monothérapie chez les patients atteints de DT2 et de MCV, ou à risque CV très élevé/élevé, afin de réduire les événements CV. De plus, l'empagliflozine ou le liraglutide sont recommandés chez les patients atteints de DT2 et de maladies cardiovasculaires, ou à risque CV très élevé/élevé, afin de réduire le risque de décès.Des déclarations de position plus récentes de l'ESC ont fourni un résumé fondé sur des preuves soutenant l'utilisation du SGLT2i chez les patients atteints d'IC, de DT2 avec risque CV et d'IRC. 78 Chez les patients atteints d'HFrEF (avec ou sans DT2), la dapagliflozine ou l'empagliflozine ont réduit le risque de décès CV et d'HHF.Bien que l'empagliflozine et la canagliflozine aient réduit le risque de MACE chez les patients atteints de DT2 à risque élevé/très élevé de MCV, l'empagliflozine a également été associée à une réduction des décès CV dans cette population.Chez les patients atteints de DT2 à risque élevé/très élevé de MCV, l'empagliflozine, la canagliflozine ou la dapagliflozine ont réduit le risque de décès CV ou d'HHF. Cependant, l'ertugliflozine n'était associée qu'à un risque réduit de HHF. Chez les patients atteints de DT2, le risque de progression de la MK est réduit par l'empagliflozine, la canagliflozine ou la dapagliflozine.Chez les patients atteints de DT2 et de MK diabétique protéinurique, la progression vers l'IRT est réduite par la canagliflozine ou la dapagliflozine. Chez les patients atteints d'IRC protéinurique, avec ou sans DT2, le risque de progression de la MK est réduit par la dapagliflozine. De plus, chez les patients atteints de DT2 et d'IRC, le risque de décès CV ou d'HHF est réduit par la canagliflozine, la dapagliflozine ou la sotagliflozine.Directive 2022 de l'ACC/AHA/Heart Failure Society of America (HFSA) pour la prise en charge de l'insuffisance cardiaque
La nouvelle classification de HF est la suivante : HFrEF : FEVG (fraction d'éjection ventriculaire gauche) ⩽ 40 % ; HFimpEF (HF avec FE améliorée) : FEVG précédente ⩽ 40 % et mesure de suivi de la FEVG > 40 % ; HFmrEF (HF avec FE légèrement réduite) : FEVG 41–49 % ; HFpEF (insuffisance cardiaque avec fraction d'éjection préservée) : FEVG ⩾ 50 %. De nouvelles recommandations ont été faites pour l'utilisation du SGLT2i en HF. Chez les patients symptomatiques atteints d'HFrEF chronique, le SGLT2i est recommandé pour réduire les hospitalisations et la mortalité CV, indépendamment de la présence de DT2 (Classe de recommandation 1a). SGLT2i peut également être bénéfique chez les patients atteints de HFmrEF et HFpEF (classe de recommandation 2a).Bien que la directive AHA/ACC 2016 sur la prise en charge des patients atteints d'AOMI des membres inférieurs ne fasse pas référence à l'utilisation du SGLT2i ou du GLP1-RA, nous nous attendons à ce que la prochaine mise à jour inclue de nouvelles recommandations concernant l'utilisation de ces médicaments chez ce patient à haut risque. population.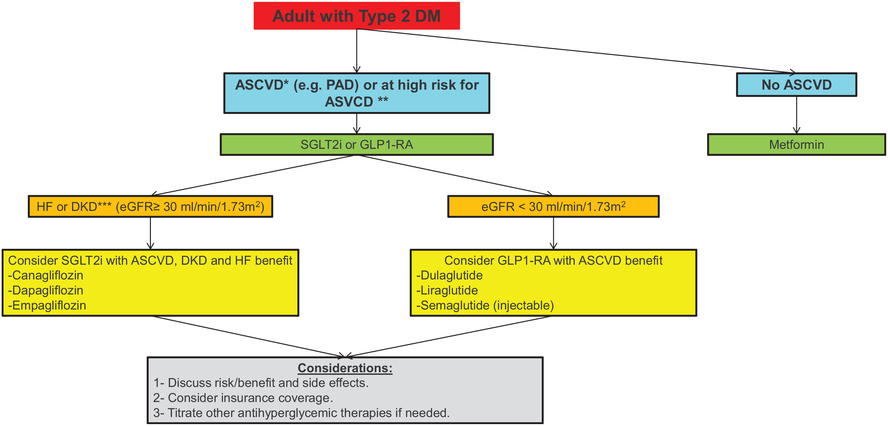
Algorithme fondé sur des données probantes résumant les recommandations actuelles pour réduire le risque CV chez les patients atteints de DT2 et à risque CV comme l'AOMI*Défini comme des antécédents de syndrome coronarien aigu, d'infarctus du myocarde, d'angor stable ou instable, de maladie coronarienne, d'accident vasculaire cérébral, d'athérosclérose.**Âge, hypertension, tabagisme, dyslipidémie, obésité ou patients présentant des lésions des organes cibles (p. ex., hypertrophie ventriculaire, rétinopathie).***Défini comme un DFGe réduit, une albuminurie ou les deux.ASCVD, maladie cardiovasculaire athéroscléreuse ; DKD, maladie rénale diabétique ; DM, diabète sucré ; eGFR, taux de filtration glomérulaire estimé ; GLP1-RA, agoniste du récepteur du peptide 1 de type glucagon ; IC, insuffisance cardiaque ; PAD, maladie artérielle périphérique ; SGLT2i, inhibiteur du cotransporteur sodium-glucose 2.
RECOMMANDATIONS CANADIENNES 2022, les plus affirmatives
https://www.onlinecjc.ca/article/S0828-282X(22)00156-8/fulltext#secsectitle0050
-
Nous recommandons que les patients atteints de MAP et de diabète de type 2 se voient proposer un inhibiteur du SGLT-2 par rapport au contrôle habituel du diabète en raison de la réduction des MACE sans aucun risque accru d'amputation (Recommandation forte ; données probantes de haute qualité).
-
Nous suggérons que les patients atteints d'AOMI et de diabète pourraient bénéficier de l'utilisation d'un agoniste du GLP-1 ou d'un inhibiteur de la DPP-4 (recommandation faible ; preuves de faible qualité).
Conseil pratique. À l'heure actuelle, il n'y a aucune raison de soupçonner que l'empagliflozine ou la dapagliflozine augmentent le risque d'AOMI ou d'amputation des membres inférieurs. Le risque, ou l'absence de risque, associé à la canagliflozine reste à établir.
La maladie artérielle périphérique et le DT2 sont deux problèmes de santé majeurs qui ont été associés à une morbidité et une mortalité accrues.
Ces patients ont continué à présenter un risque significativement accru de complications CV et de décès malgré les progrès majeurs de la thérapie médicale au cours des deux dernières décennies.
Le SGLT2i et le GLP1-RA sont deux classes de médicaments prometteuses qui ont montré une réduction significative des MACE chez les patients atteints de DT2 et de MCV.
Bien que certains des médicaments SGLT2i aient montré une réduction significative de la mortalité CV, de l'HHF et des résultats rénaux, peu de médicaments GLP1-RA ont montré une réduction du risque d'AVC ischémiqueCertes, le bénéfice de ces thérapeutiques peut s'étendre pour inclure les patients atteints d'AOMI.Cependant, il existe un manque important de preuves concernant cette population à l'heure actuelle, principalement basées sur des analyses post hoc ou des études du monde réel.
Heureusement, des recherches supplémentaires sont en cours pour étudier le bénéfice exclusivement dans cette population.
Bien qu'il y ait eu un signal de risque d'amputation accru dans l'essai CANVAS avec la canagliflozine, une analyse post hoc de l'essai LEADER a montré un risque plus faible avec le liraglutide.
Sur la base de notre revue, nous ne pouvons pas fournir de recommandations solides en faveur d'une classe de médicaments chez les patients atteints d'AOMI.
Cependant, jusqu'à ce que des preuves solides soient disponibles, les patients atteints d'AOMI doivent se voir proposer le GLP1-RA s'ils ont une IRC concomitante (DFGe < 30 mL/min/1,73 m nous ne pouvons pas fournir de recommandations fortes en faveur d'une classe de médicaments chez les patients atteints de MAP.
Cependant, jusqu'à ce que des preuves solides soient disponibles, les patients atteints d'AOMI doivent se voir proposer le GLP1-RA s'ils ont une IRC concomitante (DFGe < 30 mL/min/1,73 m2 ) et d'autres ASCVD à haut risque d'amputation (amputation antérieure, ulcères ischémiques ou neuropathie), et SGLT2i s'ils ont une IC et/ou une DKD concomitante.
Rappel :
La famille la plus récente d'antidiabétiques oraux est celle des gliflozines ou inhibiteurs du co-transporteur sodium glucose de type 2 (SGLT2). A ce jour, 2 substances appartenant à cette famille sont commercialisées en France : la dapagliflozine (FORXIGA) et l'empagliflozine (JARDIANCE) . De plus le XIGDUO qui contient les substances actives dapagliflozine et metformine.
VOIE ORALE
GLP1RA ,tous en injectables
Commentaire sur DIABETE type 2 et AOMI symptomatique
L'association Diabète de type 2 et AOMI symptomatique (ischémie d'effort) est une association à SUR-RISQUE CV et à haut risque. Dans cerains cas il existe un troisimème facteure délétère l'insuffisance rénale chronique terminale.
Diabète type 2 + AOMI (et ou atteinte cadiaque, cérébrale)
- traitement intensif du diabète avec le recours aux iGLT2 en un , ou GLP1
- Traitement par STATINE à dose forte, la cibles du LDL < 0.55, si impossible avec une STATINE, association STATINE/EZETIMIDE et en dernier lieu recourir à un anti PCSK9- Un antiplaquettaire, un IEC- Mais avant tout la correction des FDRCV et l'activité physique
- Diabète type 2 , AOMI revascularisée (chirurgie et ou endovasculaire) < 10 j, indication possible au cas par cas rivaroxaban 2.5 mg X 2 plus aspirine 100 mg
- EDUCATION THERAPEUTIQUE
Complément d'enquête :
DIABETE CARE 2023 : https://diabetesjournals.org/care/article/46/Supplement_1/S5/148048/Summary-of-Revisions-Standards-of-Care-in-Diabetes
Etude DECLARE- PAD , un inhibiteur SGLT2 efficace dans l’artérite du diabétique
https://www.cardio-online.fr/Actualites/A-la-une/Congres-ACC-2019-DECLARE-PAD-dapagliflozine-inhibiteur-SGLT2-patients-arteriopathies-peripheriques-AOMI -
-
AOMI et Insuffisance Rénale
 Une association délétère
Une association délétère -
AOMI et IR : association à surrisque CV
 Approche holistique de l'AOMI
Approche holistique de l'AOMI -
AOMI et le cFAS
 Un nouveau biomarqueur pour l'AOMI
Un nouveau biomarqueur pour l'AOMI -
AOMI et POLLUTION
 La pollution amplifie le RCV
La pollution amplifie le RCV -
AOMI FRCV de MTEV ?
 Photo JPL
Photo JPL
“Hybride. Fruit d'une démarche associative.”Ambrose BierceSykora D, Firth C, Girardo M, Bhatt S, Tseng A, Chamberlain A, Liedl D, Wennberg P, Shamoun FE. Peripheral artery disease and the risk of venous thromboembolism.Vasa. 2022 Nov;51(6):365-371. doi: 10.1024/0301-1526/a001029. Epub 2022 Sep 22. PMID: 36134738.Maladie artérielle périphérique et risque de thromboembolie veineuseArticle libre d'accésContexte :
La maladie artérielle périphérique (AOMI) touche 3 à 12 % des patients dans le monde et se caractérise par un dysfonctionnement endothélial et des voies inflammatoires qui sont également communs à la thromboembolie veineuse (MTEV), mais il existe peu de preuves concernant le risque de MTEV dans l'AOMI . Nous avons cherché à savoir si l'AOMI est un facteur de risque indépendant de MTEV.
Patients et méthodes:
Nous avons examiné les dossiers médicaux des patients subissant des études sur l'ABI à la Mayo Clinic du 01/1996 au 02/2020. Nous avons classé les patients selon l'IPS (faible [<1,0], normal [1,0–1,4] ou élevé [>1,4]), ainsi que par sous-groupe spécifique d'IPS bas : sévèrement réduit (IPS : 0,00–0,39), modérément réduit (0,40 –0,69), légèrement réduite (0,70–0,90) et limite réduite (0,91–0,99). Le critère de jugement principal était l'événement incident de MTEV (thrombose veineuse profonde aiguë des membres inférieurs ou embolie pulmonaire) après la mesure de l'IPS. La régression proportionnelle multivariable de Cox a été utilisée pour calculer les risques relatifs (HR) avec des intervalles de confiance (IC) à 95 % après ajustement pour l'âge, le sexe, le tabagisme actif, le cancer, les antécédents de MTEV, la thrombophilie, l'anticoagulation et la revascularisation.
Résultats:
39 834 patientsuniques (âge moyen 66,3 ± 14,3 ans, suivi médian 34 mois) ont été identifiés. 2 305 événements de MTEV sont survenus chez des patients sans AOMI (13,0 %), 2 218 chez des patients avec un IPS bas (13,0 %) et 751 chez des patients avec un IPS élevé (14,8 %). Après ajustement des facteurs de risque, le risque de MTEV était légèrement augmenté pour l'AOMI globale (HR : 1,12, IC à 95 % [1,06, 1,18]), y compris les groupes avec un IPS faible (HR : 1,11, IC à 95 % [1,04, 1,18]) et des groupes avec un IPS élevé ( HR : 1,15, IC 95 % [1,04, 1,26]), par rapport aux patients sans MAP. Le plus grand risque de MTEV était chez les patients avec un IPS sévèrement bas (HR : 1,46, IC à 95 % [1,31, 1,64]).
Conclusion :
Dans une grande cohorte longitudinale, nous présentons des preuves cliniques solides d'AOMI, avec un ICB faible et élevé, en tant que facteur de risque indépendant de MTEV, le risque le plus élevé étant observé chez les patients présentant un IPS très faible. Des recherches continues sont nécessaires pour étudier plus avant cette relation et son intersection avec l'état de la performance fonctionnelle afin d'optimiser les stratégies de réduction du risque de MTEV ou d'anticoagulation dans la population d'AOMI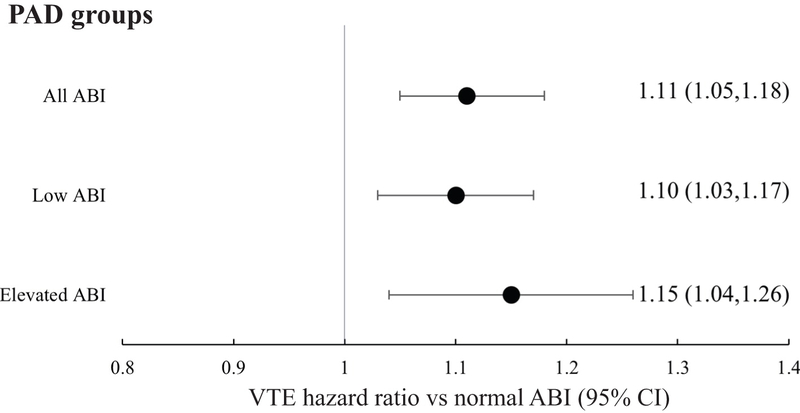
Rapports de risque pour le risque de thromboembolie veineuse (TEV) par groupe de maladie artérielle périphérique (MAP) par rapport aux patients ayant un indice cheville-bras normal (IPS), après ajustement pour les facteurs de risque pertinents de TEV, notamment l'âge, le cancer, la thrombophilie et la revascularisation.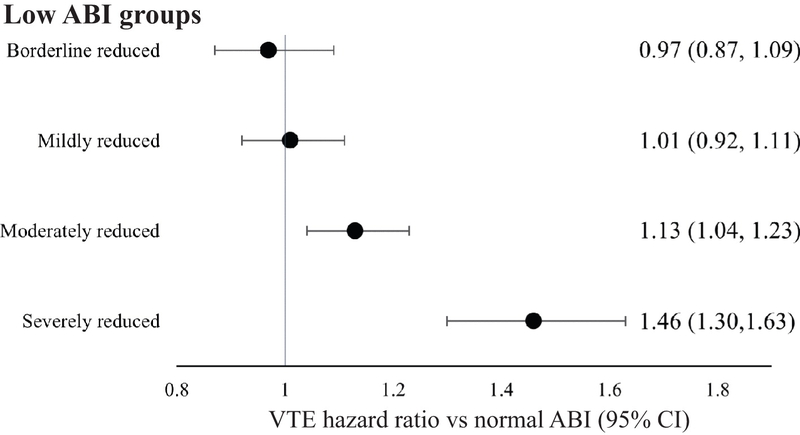
apports de risque pour le risque de thromboembolie veineuse (TEV) par sous-groupe à faible indice cheville-bras (ICB) par rapport aux patients ayant un ICB normal, après ajustement pour les facteurs de risque pertinents de MTEV, notamment l'âge, le cancer, la thrombophilie et la revascularisation.SynthéseIl existe peu de données cliniques sur le risque de MTEV chez les patients atteints d'AOMI malgré leur chevauchement physiopathologique. Dans cette grande étude de cohorte rétrospective, après ajustement sur les principaux facteurs de risque confondants de MTEV, nous avons démontré que l'AOMI avec IPS sévèrement réduit est un facteur de risque indépendant de MTEV. Dans l'ensemble, l'AOMI confère une augmentation modeste du risque de MTEV par rapport aux patients sans AOMI
CommentaireMTEV facteur de risque cardio vasculaire ou AOMI facteur de risque de MTEV ou de récidive de MTEV cela semble fonctionner dans les deux sens
Rappel: "Nous avons constaté que les patientes présentant un profil de risque cardiovasculaire avaient un risque de récidive particulièrement élevé encore plus élevé que celui des patientes ayant déjà subi une MTEV." Aaron Iding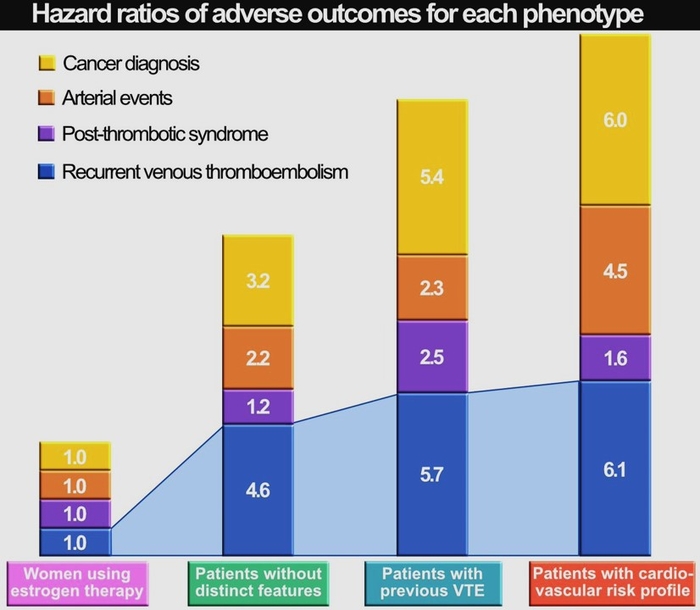 https://medvasc.info/1952-ph%C3%A9notypes-tvp-et-commentaire-de-l-auteur: phénotype MTEV
https://medvasc.info/1952-ph%C3%A9notypes-tvp-et-commentaire-de-l-auteur: phénotype MTEV
https://medvasc.info/1861-mtev-et-antiplaquettaire : l'immunothrombose, aspirine et MTEV
https://medvasc.info/1784-statine-et-pr%C3%A9vention-mvpt : statine et prévention MVPT, ça ne marche pas
Ces différentes études concourent au rapprochement de la MTEV , du risque cardiovasculaire et de l'athérogénése. Face à une TVP et ou une EP il serait intéressant aussi de se polariser qur les Facteurs de RC concomitttents et de les corriger. afin de limiter le risque de récidive de MTEV. En cas d'AOMI avec un IPS bas la prévention de la MTEV decrait être aussi une autre pré occupation. Bien sûr nous avons encore besoisn de preuves pour y voir plus clair. MTEV, athérothrombose un couple infernal dont n'avons pas encore toutes les clefs, pour l'instant.Des facteurs de risque communs existent, c'est déjà un bon début. L'hybridation de ces deux entités, une solution...peut être......l'inflammation et la dysfonction endothéliale restent le point commun majeur. -
AOMI sous traitée
 « Les choses en médecine ne se mesurent et ne se considèrent que par leurs sens et effets. »Ambroise Paré
« Les choses en médecine ne se mesurent et ne se considèrent que par leurs sens et effets. »Ambroise Paré
« Quand on est tombé malade, il faut changer de manière de vivre. Il est clair que celle qu’on suivait est mauvaise en tout, ou en grande partie, ou en quelque chose. » Hippocrate
Analyse article : Under-Prescription of Medical Treatment for Peripheral Artery Disease in the Under 50s: A Retrospective Study, Simon Soudet, Lorène Bultel Lamrani Adnane,
Thierry Reix, and Marie Antoinette Sevestre, Angiology 2021, Vol. 0(0) 1–6 © The Author(s) 2021, https://journals.sagepub.com/doi/10.1177/00033197211042155
Sous-prescription du traitement médical de la maladie artérielle périphérique chez les moins de 50 ans : une étude rétrospective.
La maladie artérielle périphérique (MAP) est une cause fréquente de morbidité et de mortalité; cependant, les données sur son étiologie et son évolution chez les patients de moins de 50 ans sont rares. Les auteurs ont effectué une analyse rétrospective des données des dossiers médicaux, y compris les facteurs de risque cardiovasculaire, l'étiologie, le traitement médical et chirurgical et le suivi. Ont été inclus tous les patients avec MAP âgés de 18 à 50 ans au CHU d' d'Amiens entre 2005 et 2015. Sur les 87 patients inclus, 32 (36%) étaient des femmes. Le tabagisme était reconnu par 81 patients (93 %) et 37 avaient une dyslipidémie (42,5 %). Le suivi médian était de 24 mois (10-59). Une récidive est survenue chez 41 patients (47,1%), tous fumeurs actifs, avec un délai médian de 14 mois (7-47). L'ischémie aiguë des membres au moment du diagnostic était significativement associée à une amputation majeure, rapport de cotes (OR) 5,95 (IC à 95 % 1,41-40,90,P = 0,029, ce qui était nécessaire pour 11 patients (12,6 %). Les traitements comprenaient un traitement antiplaquettaire ( 87,4 %), les statines ( 77 %), et les antihypertenseurs (69 %) et 32,1 % patients ont bénéficié d'une rééducation vasculaire. Cette cohorte de patients relativement jeunes avec MAP a montré un niveau élevé de récurrence des symptômes. L'athérosclérose était l'étiologie la plus fréquente.
Cette étude a révélé que les traitements médicaux sont souvent sous-prescrits dans cette tranche d'âge et doivent être améliorés.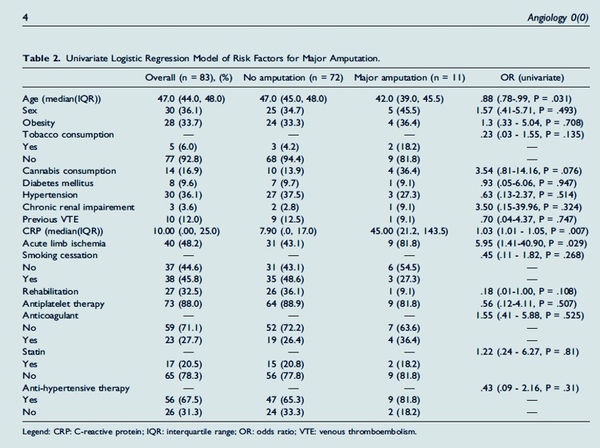
Ce tableau est très important. C'est la synthèse de cet article.Tout d'abord 30% d'obése, une consommation de cannabis > à celle du tabac, l'âge jeune explique certainement cela.12% d'antécédent e MTEV, la MTEV doit être consédérée comme un FDRCV. 9% de diabétique , c'est peu ,effet âge aussi. Un patient sur deux avait arrêter de fumer.80% des patients étaient traités par antiagrégants plaquettaires, c'est ce que l'on retrouve en général y compris pour des patients plus âgés .A noter dans cette population que 70% sont sous statine et 65% ont un IEC. A noter enfion que la persistance du tabac est un facteur de récidive significatif.
Je rapprocherai cet article avec celui d'Alessandra Bura (CHU Toulouse) : Outcomes and management costs of peripheral arterial disease in France (https://www.jvascsurg.org/action/showPdf?pii=S0741-5214%2817%2932504-1).
Le thème est différent ce sont les côuts qui sont analysés mais la conclusion est très proche de l'article de Simon Soudet : "Mortality is elevated and cardiovascular events are frequent among French PAD patients.PAD drug treatment guidelines are not fully implemented in France", certe dans une tranche d'âge différente, plus large, mais le résultat est le même. (J Vasc Surg 2018;67:1834-43.) Commentaires
Commentaires
Bravo à l'équipe du CHU d'Amiens et à Simon Soudet, une des jeune graine vivifiante de la Médecine Vasculaire et elles sont nombreuses, le Club des Jeunes Médecins Vasculaires montre l'exemple chaque jour. Merci !
L'AOMI est sous diagnostiquée et quand elle est diagnostiquée est est sous traitée quelque soit la tranche d'âge. La rééducation est le parent pauvre en France du traitement de l'AOMI, dans l'article de Simon Soudet 32% dez patients bénéficiaent d'une ré éducation, ce qui est très important. Je pense que c'est du à l'âge des patients inéfieurs ou égal à 50 ans. De plus si les statines ne sont pas toujours prescrites, quand elle le sont ,c'est le plus souvent à "dose homéopathique " alors que ce sont les doses fortes 40 mg qui sont recommandées. la tri-thérapie de l'AOMI est rarement prescrite, on peut l'estimer à 30 à 40% des patients qui le sont Enfin en cas d'AOMI la cible du LDL est de 0,55, et ça c'est une autre affaire......Les coûts engendrés par l'AOMI étaient estimés en 2014 à 14 959 € / patient présentant une AOMI symptomatique. Tout le problème de l'AOMI comme pour le diabète, les patients doivent changer de vie, ci-desous cette caricature qui illustre parfiaitement les difficultés rencontrèes.....
L'AOMI affection grave qui engendre des coûts importants. Trop souvent l'AOMI est sous diagnostiquée et sous traitée; La compliance des patients en matière d'AOMI ne doit pas différer des autres pathologies. A un an qu'en est il du traitement médical ? De plus ces patiuents ont souvent des facteurs de co morbidités et de multiples atteintes des autres territoires artériels. L'éducation thérapeutique pour ces patients est primordiale. C'est un voeux pieux, l'éducation thérapeutique est encore en 2021 le parent pauvre de notre système de Santé.
La Médecine Vasculaire doit se mobiliser pour promouvoir et organiser l'éducation thérapeutique chez les artéritiques, le chantier est immense. Enfin ne pas oublier pour la prise en charge globale de ces patients, la pertinence des soins. L'AOMI ne doit pas se résumer à un angioscanner, une dilatation et "basta"......le trait est accentué, mais......
Documents info-patient :
https://fedecardio.org/wp-content/uploads/2021/03/2020-AOMI-Web-1.pdf
http://www.ficheinfopatient.com/wp-content/uploads/2021/01/site_AOMI.pdfPour en savoir plus:https://medvasc.info/1336-entretien-aomi-avec-fran%C3%A7ois-becker
https://medvasc.info/1284-aomi-en-13-points
https://medvasc.info/1340-esc-2021-antithrombotiques
https://medvasc.info/1314-l-aspirine
#VACCINE2.0 -
AOMI/ Faible capacité fonctionnelle/ activité plaquettaire
Quand les plaquettes s'en mêlent,
-
AOMI+DIABETE = DANGER
 ICONOGRAPHIRE : https://citations.ouest-france.fr/citation-coluche/vie-mettra-pierres-sur-route-133336.html"La vie mettra des pierres sur ta route, à toi de décider si tu en fera un mur ou un pont".ColucheTemporal trends in patients with peripheral artery disease influenced by diabetes mellitus in Germany,Volker H. Schmit et Coll Journal of Diabetes.2022;1–15.Maladie artérielle périphérique impactée par le diabète sucré en Allemagne
ICONOGRAPHIRE : https://citations.ouest-france.fr/citation-coluche/vie-mettra-pierres-sur-route-133336.html"La vie mettra des pierres sur ta route, à toi de décider si tu en fera un mur ou un pont".ColucheTemporal trends in patients with peripheral artery disease influenced by diabetes mellitus in Germany,Volker H. Schmit et Coll Journal of Diabetes.2022;1–15.Maladie artérielle périphérique impactée par le diabète sucré en Allemagne
https://onlinelibrary.wiley.com/doi/epdf/10.1111/1753-0407.13316Article libre d'accésChez les patients atteints de maladie artérielle périphérique (AOMI), la présence d'un diabète sucré (DM) est associée à une morbidité et une mortalité plus élevées. Parce que d'énormes efforts sont faits pour améliorer les soins médicaux des patients atteints de DM, y compris les programmes de maladies chroniques, le but de la présente étude était d'étudier les tendances temporelles concernant le fardeau clinique du DM sur les patients atteints d'AOMI au cours d'une période d'observation de 15 ans.Méthodes
Nous avons analysé tous les patients hospitalisés pour MAP entre 2005 et 2019 en Allemagne stratifiés en fonction du DM.
Résultats
Au total, 2 654 871 hospitalisations de patients AOMI (865 823 avec DM) ont été incluses.
Les hospitalisations basées sur l'AOMI sont passées de 142 778 en 2005 à 190 135 en 2019 ( β 3956 par an ; intervalle de confiance [IC] à 95 % 3034–4878, p < 0,001) avec une augmentation simultanée des hospitalisations de patients atteints d'AOMI avec DM (2005 : 41609 (29,1%) versus 2019 : 65 302 (34,3%) ; β 2019 par an [IC 95% 1593–2446], p < 0,001). Taux d'amputation ( β -0,42 [IC à 95 % -0,44 à -0,40] ; p < 0,001) ainsi que taux de létalité à l'hôpital (2005 : 4,7 %, 2019 : 2,8 % ; β -0,64 [IC à 95 % -0,69 à -0,59] ; p < 0,001) a diminué chez les patients diabétiques atteints d'AOMI pendant la période d'observation.
Malgré une amélioration de la morbidité et de la mortalité au cours des dernières années de la période d'observation, les patients atteints de DM souffraient toujours d'un risque accru de morbidité et de mortalité au cours de la période d'observation par rapport aux patients non diabétiques atteints d'AOMIConclusion
Malgré les progrès des traitements du DM, le DM était toujours associé à un profil clinique défavorable des patients et restait un facteur de risque important de morbidité et de mortalité chez les patients hospitalisés atteints d'AOMI et de DM en Allemagne entre 2005 et 2019.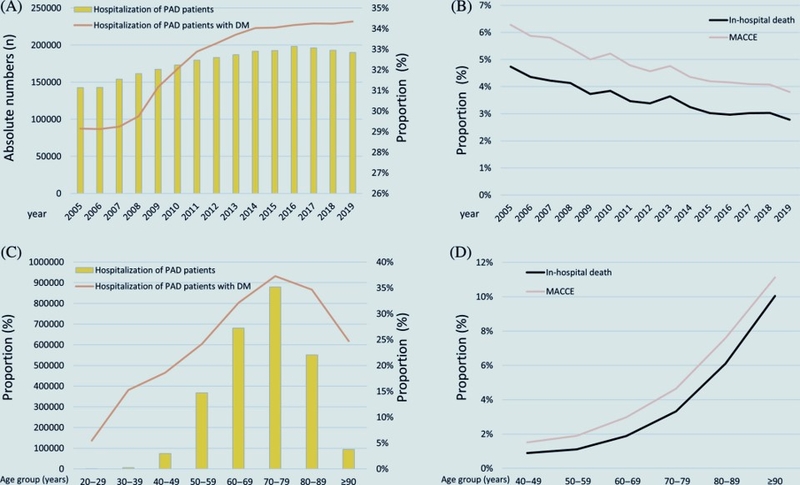
Evolutionconcernant le nombre absolu d'hospitalisations dues à la maladie artérielle périphérique (MAP) et le taux relatif de MAP avec diabète sucré (DM) ainsi que les résultats indésirables des patients atteints de MAP atteints de DM. (A) : Tendances temporelles concernant le nombre absolu d'hospitalisations de patients atteints d'AOMI (barres jaunes) et la proportion de patients atteints d'AOMI atteints de DM par rapport à tous les patients atteints d'AOMI (ligne orange) stratifiés pour l'année. (B) : Evolution concernant les taux de mortalité hospitalière (ligne noire continue) et MACCE (ligne orange) des patients atteints de MAP avec DM stratifiés pour l'année. (C) : Evolutionconcernant le nombre absolu d'hospitalisations de patients atteints d'AOMI (barres jaunes) et la proportion de patients atteints d'AOMI atteints de DM par rapport à tous les patients atteints d'AOMI (ligne orange) stratifiés par âge-décennie. (RÉ): Evolutio concernant les taux de mortalité hospitalière (ligne noire continue) et MACCE (ligne orange) des patients atteints de MAP avec DM stratifiés par décennie d'âge. MACCE, événements indésirables cardiaques et cérébrovasculaires majeurs.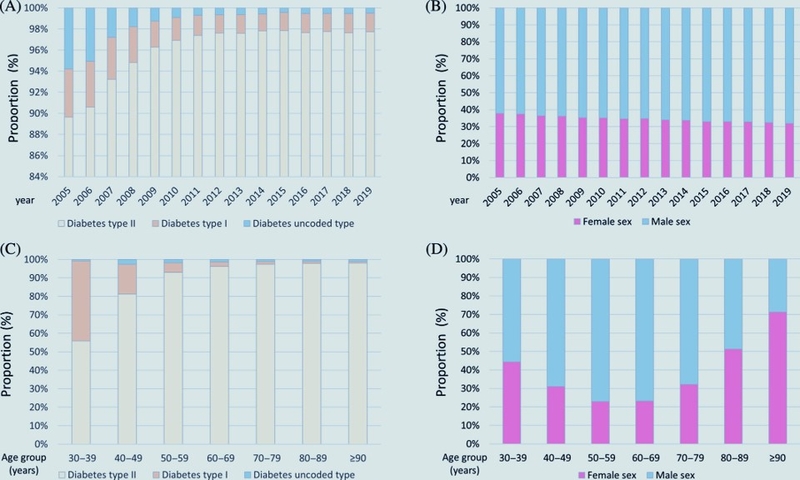
Evolution concernant le sous-type de diabète sucré et la distribution par sexe chez les patients atteints de maladie artérielle périphérique (AOMI). (A) : Evolution concernant le sous-type de diabète sucré dans les hospitalisations de patients atteints d'AOMI stratifiées sur l'année. (B) : Evolution concernant la répartition par sexe dans les hospitalisations de patients atteints de diabète sucré stratifiées pour l'année. (C) : Evolution concernant le sous-type de diabète sucré dans les hospitalisations de patients atteints d'AOMI stratifiées par âge-décennie. (D) : Evolution concernant la répartition par sexe dans les hospitalisations de patients atteints de diabète sucré stratifiées par décennie d'âge.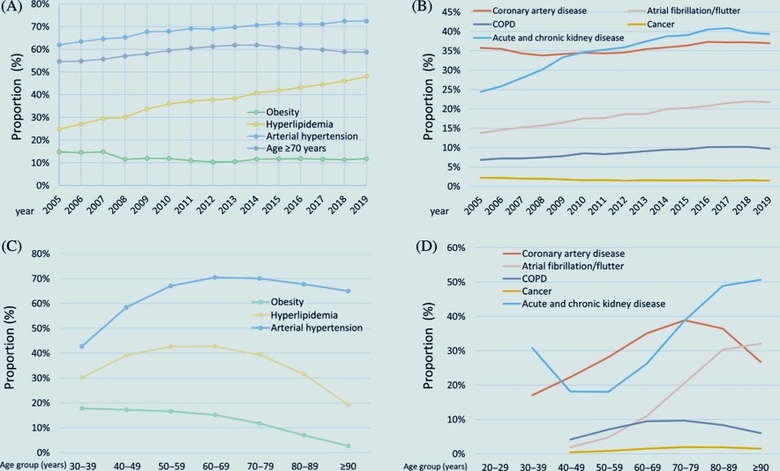 Evolution concernant les facteurs de risque cardiovasculaire et les comorbidités chez les patients hospitalisés en raison d'une maladie artérielle périphérique (AOMI) avec diabète sucré. (A) :Evolution concernant la proportion de patients âgés de ≥ 70 ans et la prévalence des facteurs de risque cardiovasculaire chez les patients atteints de MAP atteints de diabète sucré, stratifiées sur l'année. (B) : Evolution concernant la fréquence des comorbidités chez les patients atteints de MAP avec diabète sucré stratifiées sur l'année. (C) : Evolution concernant la proportion de patients âgés de ≥ 70 ans et la prévalence des facteurs de risque cardiovasculaire chez les patients atteints d'AOMI atteints de diabète sucré, stratifiées selon l'âge et la décennie. (D) : Evolution concernant la fréquence des comorbidités chez les patients atteints de MAP avec diabète sucré stratifiées par décennie d'âge. Abréviation : MPOC, maladie pulmonaire obstructive chronique.
Evolution concernant les facteurs de risque cardiovasculaire et les comorbidités chez les patients hospitalisés en raison d'une maladie artérielle périphérique (AOMI) avec diabète sucré. (A) :Evolution concernant la proportion de patients âgés de ≥ 70 ans et la prévalence des facteurs de risque cardiovasculaire chez les patients atteints de MAP atteints de diabète sucré, stratifiées sur l'année. (B) : Evolution concernant la fréquence des comorbidités chez les patients atteints de MAP avec diabète sucré stratifiées sur l'année. (C) : Evolution concernant la proportion de patients âgés de ≥ 70 ans et la prévalence des facteurs de risque cardiovasculaire chez les patients atteints d'AOMI atteints de diabète sucré, stratifiées selon l'âge et la décennie. (D) : Evolution concernant la fréquence des comorbidités chez les patients atteints de MAP avec diabète sucré stratifiées par décennie d'âge. Abréviation : MPOC, maladie pulmonaire obstructive chronique.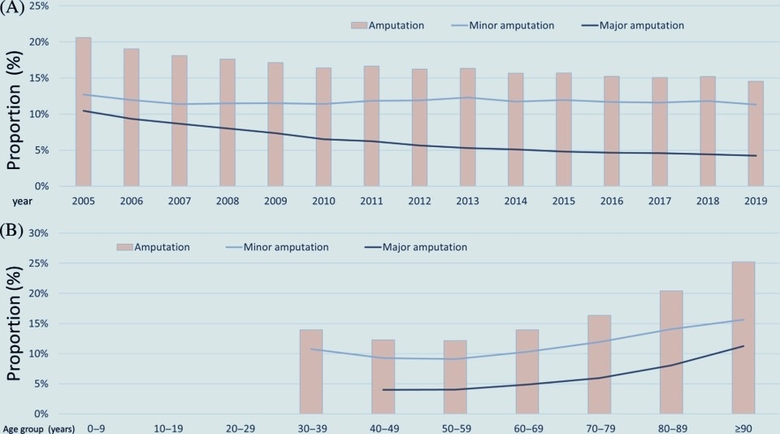 Evolution concernant les chirurgies d'amputation chez les patients atteints de diabète sucré (DM) hospitalisés en raison d'une maladie artérielle périphérique (AOMI). (A) : Tendances temporelles concernant les amputations chez les patients atteints d'AOMIavec diabète sucré stratifiées sur l'année. (B) : Evolution concernant les amputations chez les patients atteints de diabète sucré stratifiées selon l'âge et la décennieL'analyse des tendances actuelles a révélé des améliorations au cours des dernières années concernant les résultats cliniques des patients atteints d'AOMIet de DM concomitant. Cependant, malgré la diminution des taux de mortalité à l'hôpital et d'amputation chez les patients atteints de DM, ce groupe présentait toujours un profil clinique de patient plus mauvais et un risque significativement plus élevé de morbidité et de mortalité par rapport aux patients atteints d'AOMI sans DM en Allemagne au cours de la période 2005-2019 . Cet écart énorme entre les patients atteints d'AOMI avec et sans DM en ce qui concerne la morbidité et la mortalité souligne la nécessité de nouvelles améliorations pour réduire le poids de la maladie, en particulier dans le groupe vulnérable des patients atteints d'AOMI avec DM.
Evolution concernant les chirurgies d'amputation chez les patients atteints de diabète sucré (DM) hospitalisés en raison d'une maladie artérielle périphérique (AOMI). (A) : Tendances temporelles concernant les amputations chez les patients atteints d'AOMIavec diabète sucré stratifiées sur l'année. (B) : Evolution concernant les amputations chez les patients atteints de diabète sucré stratifiées selon l'âge et la décennieL'analyse des tendances actuelles a révélé des améliorations au cours des dernières années concernant les résultats cliniques des patients atteints d'AOMIet de DM concomitant. Cependant, malgré la diminution des taux de mortalité à l'hôpital et d'amputation chez les patients atteints de DM, ce groupe présentait toujours un profil clinique de patient plus mauvais et un risque significativement plus élevé de morbidité et de mortalité par rapport aux patients atteints d'AOMI sans DM en Allemagne au cours de la période 2005-2019 . Cet écart énorme entre les patients atteints d'AOMI avec et sans DM en ce qui concerne la morbidité et la mortalité souligne la nécessité de nouvelles améliorations pour réduire le poids de la maladie, en particulier dans le groupe vulnérable des patients atteints d'AOMI avec DM.
Commentaire in http://lecardiologue.com/wp-content/uploads/2017/04/FMC401_BD.pdfL‘ARTÉRIOPATHIE PÉRIPHÉRIQUE ATTEINT ENVIRON 12 MILLIONS DE PERSONNES AUX ETATS-UNIS. PARMI ELLES 20 À 30 % SONT DIABÉTIQUES.
L’existence d’un diabète multiplie par un facteur variant de 2 à 4 le risque de développer une artériopathie.
50 % des diabétiques de type 2 sont porteurs d’une artériopathie.
Chaque augmentation de 1 % de l’HBA1c est corrélée à une augmentation de 28 % du risque d’artériopathie.
Par contre , les études d’intervention n’ont pas montré de bénéfice évident du contrôle glycémique en termes de réduction du risque d’artériopathie.
L’artériopathie y est un marqueur de surrisque cardiovasculaire : le taux d’amputation est 5 fois plus élevé et la mortalité supérieure est plus précoce que chez le non-diabétique.
Néanmoins, la prévalence exacte de l’artériopathie diabétique est rendue plus délicate car l’association fréquente à une neuropathie rend le diagnostic plus tardif et que l’absence des pouls périphériques n’est pas forcément un bon indice diagnostique.L’artériopathie des membres inférieurs chez le diabétique n’a pas de spécificité histologique ou lésionnelle particulière. Elle combine athérosclérose et artériolosclérose
Cependant la macro angiopathie diabétique se caractérise par ses localisations, ses modes de présentation, son évolution souvent sévère.
L’imagerie vasculaire par écho-Doppler est bien entendu très utile au diagnostic de l’artériopathie, mais souvent insuffisante eu égard à la grande diffusion des lésions notamment en cas d’ischémie critique
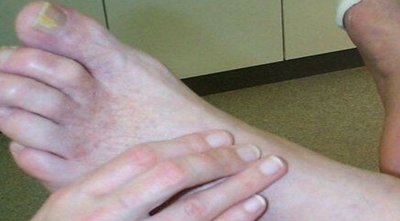
Le DANGER AOMI et DIABETE : conduite à tenir
AOMI et DIABETE : conduite à tenir
- Evolution rapide de l'AOMI au cours du diabète.donc surveillance renforcée, clinique et par clinique- Correction absolue des FDRCV notamment le tabac, la surcharge pondérale , la dyslipidélmie, la sédentarité, l'HTA etc.- Suivi très régulier de la fonction rénale (IR) : clairance la créatinine et albuminurie, L'IR associée entraine un sur sur-risque CV- Traitement médical de l'AOMI : antplquettaire et statine 40 mg voire Statine + Ezetilmide, voire anti Pcsk9- Traitement du diabète : importance des anti GLT2 et anti GLP1, mais aussi de l'insuline
- Education thérapeutique iNDISPENSABLE
- La parcours de soins du diébétique est à mettre en place cas par cas
- Rôle très important du médecin généraliste
- Rôle majeur des intervenenants du diabète : endocrinologue, cardiologue, médecin vasculaire, néphrologue , chirurgien vasculaire, ophtalmologie,podologue Tous ces intervenants en cas d'AOMI + DIABETE doivent être présents. L'AOMI dloit êre dépisté chez les diabétiques en commençant par la mesure de l'IPS à la cheville à partir de 40 ans dès lors qu'il existe un FDRCV en plus du diabète.- Vaccination anti Covid en régle
- Vaccination anti grippe et anti tétanique
- Vaccinatioin pneumocoque
RAPPEL
https://recomedicales.fr/recommandations/diabete-type-2/Toute personne avec un diabète type 2 est à haut voire très haut risque cardiovasculaire (rarement modéré) (risque CV x 3-4)- Arrêt du tabac (passif également)
- Hypertension artérielle
- Seuil diagnostique ≥ 140/90 mmHg (160 après 80 ans, ESC 2018)
- Cible 120-130/70-79 mmHg (ESC 2019 diabetes)
- ≥ 65 ans: 130-139/70-79 mmHg (ESC 2019 diabetes)
- Bithérapie d’emblée IEC + TZD/ICa ou ARA2 + TZD/ICa
Considérer si albuminurie sans hypertension.
- LDL cible (ESC 2019)
- < 0,7 g/L
- < 0,55 g/L si maladie cardiovasculaire, > 20 ans d’évolution ou ≥ 3 autres FRCV
- Activité physique
Au moins 150 minutes (2h30) d’activité physique par semaine (modérée à intense). Endurance et renforcement musculaire. Commencer par 1000 pas supplémentaires/j. - Cible d’HbA1c: globalement 7% (SFD 2021)
- Surpoids
Perte de poids (5-10%) ou chirurgie bariatrique. - Régime méditerranéen
- Dépister des apnées du sommeil (65-85%) et dysfonction érectile (50%)
- ALD 8 et proposer le service de suivi Sophia
Le contrôle glycémique, tensionnel et lipidique réduit la survenue d’événements cardiovasculaires de 75% (ESC 2019 diabetes)
DEPISTAGE des COMPLICATIONS
Tableau. Rythme de dépistage des complications du diabète. Dr JB Fron d'après Sociétés Savantes mentionnées Appareil Soins Source AAA Échographie si homme 65-75 ans et tabac (sevré < 20 ans) ou 50-75 ans avec ATCD familial AAA 1er degré ESC 2014 aortic AOMI Symptômes + pouls annuels, IPS au diagnostic puis /5-10 ans ESC 2019 diabetes Aspirine prev primaire 75-100 mg envisageable si (très) haut risque CV ou coronaire sans risque de saignement ESC 2019 diabetes Aspirine prev secondaire 75-160 mg ± associé selon la pathologie, prolonger bi-antiagrégants si bien toléré (max 3 ans) ESC 2019 diabetes Cancer du pancréas Diabète < 12 mois: +50 ans sans ATCD familial ni surpoids OU amaigrissement > 10%
Pancréatite chronique + apparition ou décompensation de diabèteINCa 2019 Chir bariatrique < 65 ans et IMC ≥ 40 OU IMC ≥ 35 avec ≥ 1: HTA, SAOS ou autres, diabète type 2, ostéo-articulaires invalidantes, NASH HAS 2009 obésité Dentaire Suivi annuel IDF 2009 Dysfonction érectile Systématique. Si +: dépistage annuel hypotension orthostatique, dysfonction vésicale AIUS 2018 ECG Annuel (VPN très faible) SFD 2021 CAD Épreuve d’effort Angor, dyspnée inexpliquée, réduction des performances, très haut risque coronaire (/3-5 ans) SFD 2021 CAD Insuffisance cardiaque (NT-pro)BNP annuel si: obésité, HTA, dyslipidémie, MRC, coronaropathie, femme, bas socio-éco ADA 2022 Neuropathie Dépistage annuel monofilament ESC 2019 diabetes Rénal Créatininémie, albuminurie sur échantillon annuels ESC 2019 diabetes Rétinopathie Dépistage annuel. Tous les 2 ans si: pas d’insuline, équilibre tensionnel et glycémique optimaux SFD 2016 Score calcique ≥ 2 facteurs de haut risque coronaire ± EE SFD 2021 CAD Vaccins Covid-19, grippe, pneumocoque Calendrier vaccinal AAA = anévrysme de l’aorte abdominale ; EE = épreuve d’effort ; MRC = maladie rénale chronique ; aspirine: IPP si risque élevé de saignement digestif ;
Épreuve d’effort: évaluer les facteurs de risque: FRCV usuels, tour de taille, ancienneté du diabète, HbA1c, complications, dysfonction érectile, SAOS, NASH
Au total, le dépistage précose de l'AOMI chez le diabétique est absolument déterminant et obligatoire. Le médecin vasculaire occupe une position centrale pour le dépistage puis pour le suivi de ces patients à SUR-RISQUE CV. -
Colchicine et AOMI
 AOMI, nouvelle donne
AOMI, nouvelle donne -
Entretien avec François Becker : AOMI
 iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
"Toute subversion commence par celle du vocabulaire " Confucius (551-479 av. J.-C.)
"La science est un outil puissant. L’usage qu’on en fait dépend de l’homme, pas de l’outil." Albert Einstein
"Ce qu'on appelle stratégie consiste essentiellement à passer les rivières sur les ponts et à franchir les montagnes par les cols." Anatole France
Entretien avec F. Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire
Un Maître "és Médecine Vasculaire", Maître Yoda de la Médecine VasculaireAOMI, état des lieux
Question 1
Pourquoi l’AOMI est la localisation plus grave de l’athérothrombose ?FB- Je ne crois qu’on puisse dire les choses comme ça. L’AOMI n’est pas en elle-même la localisation la plus grave de l’athérothrombose, ce sont le contexte et nos comportements qui en font la gravité.
Pour ce qui est de l’AOMI athéromateuse elle-même, la majorité des patients porteurs d’une AOMI sont asymptomatiques ou ne rapportent aucun symptôme durant la vie courante. Parmi les patients-AOMI avec claudication intermittente on estime que, dans les 5 ans suivant le diagnostic, 70-80% s’améliorent ou restent stables, 10 à 20% voient leur claudication s’aggraver, 5 à 10% développent une ischémie critique. Par ailleurs 1% des patients-AOMI se présentent d’emblée en ischémie critique. Parmi ces patients en ischémie critique 40 à 50% auront une amputation majeure (jambe ou cuisse) ou décéderont dans l’année suivant le diagnostic. Il faudrait ajouter le risque d’oblitération artérielle aigue thrombotique, d’ischémie aigüe, (environ 1% par an dans les études), mais il est assez rare qu’une thrombose aigüe survienne sans cofacteur. Au total pour ce qui est strictement du risque de l’AOMI, le risque annuel d’amputation majeure est inférieur à 1%.
Pour ce qui est du risque cardio-vasculaire (CV) général il en va différemment. Le risque annuel d’événements CV graves (infarctus du myocarde, AVC, décès CV) est de 4 à 5% chez le claudicant. La mortalité CV à 10 ans est multipliée par 4 à 6 chez le patient avec AOMI par rapport au patient sans AOMI. La morbi-mortalité CV du patient-AOMI est du même ordre, voire un peu plus élevée, que celle du patient coronarien ou du patient ayant fait un AVC.
Deux facteurs me semblent devoir être pris en compte :
1-le fait que dans l’histoire naturelle de l’athérosclérose les coronaires sont touchées en premier, puis les artères des membres inférieurs, puis les carotides (extra- et intracrâniennes),
2-le fait que la prévalence de l’AOMI augmente de façon exponentielle avec l’âge.
Ainsi le patient-AOMI jeune a souvent aussi des lésions coronaires (connues ou non), le patient-AOMI âgé a souvent des lésions coronaires et des lésions carotides (connues ou non). Deux fois sur 3 le patient-AOMI est un polyvasculaireLa mortalité générale est également augmentée à peu près dans les mêmes proportions car le tabagisme est le facteur de risque majeur de l’AOMI athéromateuse. Il faut donc ajouter la mortalité liée au tabac (cancers, BPCO).
Le diabète est également un facteur de risque à prendre en compte dans l’excès de morbi-mortalité, mais il est plus difficile à mesurer car il faudrait distinguer deux cas de figures : le patient-AOMI dont la glycémie est un peu augmentée et le patient-AOMI ayant clairement une artériopathie diabétique touchant électivement les artères distales. Le second est à plus haut risque d’amputation et d’accidents CV que le premier.
Plus rare, mais peut-être plus grave, est l’AOMI chez l’insuffisant rénal chronique au stade terminal.
Le patient avec AOMI athéromateuse a une autre caractéristique peu flatteuse : toutes les études, sans exception, montrent que c’est le patient vasculaire le plus mal pris en charge ; celui pour lequel les recommandations sont les plus mal appliquées, les plus mal observées (et il y en a eu depuis 25 ans !).
« Mal appréciée, sous-diagnostiquée, sous-traitée » est un leitmotiv dans les articles de synthèse. Et ça n’est pas nouveau, déjà Charcot se plaignait du peu de considération pour « sa claudication » !
Les patients sont d’accord pour une pléthore d’examens et d’angioplasties pas toujours utiles, mais la lutte contre le tabagisme et l’incitation à l’entrainement à la marche passent souvent au second plan (soit que le patient renâcle, soit que le médecin ne prenne pas le temps d’expliquer, de convaincre), mais les règles d’hygiène de vie et le traitement médicamenteux de l’athéro-thrombose laissent à désirer (tant au niveau de l’observance que de la prescription). Ces fondamentaux ne sont pas considérés comme pour le patient avec lésions coronaires ou cervico-encéphaliques alors que le niveau de risque CV du patient-AOMI est le même voire supérieur, alors que la fréquence et la sévérité de lésions coronaires, le risque d’AVC, la mortalité toutes causes sont inversement proportionnelles à l’index de pression à la cheville (IPSch). Au-delà du risque loco-régional, l’AOMI est un puissant marqueur de risque CV que l’AOMI soit symptomatique ou asymptomatique (même niveau de risque à même niveau d’IPSch).
Autre point majeur, l’AOMI est encore souvent considérée comme une affection masculine alors que la prévalence de l’AOMI définie sur la mesure d’IPSch est identique chez l’homme et chez la femme pour chaque tranche d’âge (Rotterdam study 1998). Conséquence le « Mal appréciée, sous-diagnostiquée, sous-traitée » est encore plus criant chez la femme !
Enfin il y a également un problème de terminologie qui ajoute à la confusion. En France on parle volontiers d’artérite alors que le terme désigne partout ailleurs les artériopathies inflammatoires, dans les pays anglo-saxons on parle d’artériopathie périphérique (PAD, peripheral arterial disease) en précisant rarement de quelle artériopathie périphérique il s’agit (artères des membres inférieurs ou toute artériopathie non-coronaire). On précise rarement que l’on parle d’artériopathie oblitérante, alors qu’il y a aussi des artériopathies ectasiantes (artériomégalie, dolicho-méga-artères, anévrysmes). De même on précise rarement artériopathie athéromateuse (ou athérosclérose ou athéro-thrombose) alors qu’il y a aussi des artériopathies non-athéromateuses (compression, dysplasie fibro-musculaire, artérites, ..). On précise rarement artériopathie chronique (les formes aigues sont souvent multifactorielles). Récemment un groupe d’experts sous l’égide de Bauersachs a « tapé du poing sur la table » en demandant un terme unique et précis (Vasa juillet 2021 + l’éditorial de Qanadli).
L’artériopathie dont on parle ici est l’artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse,c’est un peu long j’en conviens mais c’est plus précis et plus juste qu’artérite ou PAD !
Je suis un peu long, mais ça fait pas mal de facteurs qui expliquent la gravité de l’ACOMI et tous ne sont pas liés à l’ACOMI …
Et puis n’oublions pas qu’il s’agit d’une affection très fréquente (3 à 7% de la population adulte, 20% des plus de 70 ans) !
Question 2
L’examen clinique est toujours si important dans le diagnostic et la prise en charge de l’AOMI. Quels sont ses passages obligés ?
FB. Bien sûr que l’examen clinique reste important. Au terme d’une carrière on a des tas d’histoires à raconter, parfois dramatiques, sur des cas où l’étape clinique a été négligée.
Certes ça prend un peu plus de temps que de faire un « bon pour écho-Doppler », pourtant en 20 min on peut obtenir pas mal d’informations pour peu qu’on ait le sens de l’anamnèse et que l’on fasse dévêtir le patient.
 A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
https://www.medicinus.net/examen-peripherique/ (pouls pédieux)
Puis on passe à la palpation des pouls fémoraux au Scarpa membre en rotation externe. Le pouls poplité est parfois plus difficile à percevoir (le rechercher genou fléchi en abduction). L’examen est complété par l’auscultation ilio-fémorale et au niveau de la gouttière fémorale, par la palpation abdominale à la recherche d’un AAA, la palpation simultanée des pouls radiaux et l’auscultation cervicale. Petit détail qui a son importance, attention si un pouls fémoral ou poplité est trop facilement perçu, trop ample, il peut s’agir d’un anévrysme ou d’un pouls de butée.Si les pouls périphériques ne sont pas perçus, et a fortiori s’il existe des lésions cutanées du pied, il faut savoir « lire le pied » à la recherche de signe d’insuffisance artérielle en testant le remplissage de veines du pied (normalement quasi instantané, anormal si on voit la veine se remplir lentement), en appréciant l’état des pulpes digitales et de la coque talonnière (normalement pleines, anormale si flétries « vides » avec contact osseux facile), en évaluant la pression distale par l’angle de décoloration de la semelle plantaire en surélevant lentement les deux pieds membre en extension (alerte si une semelle plantaire reste colorée alors que l’autre se décolore, si la semelle plantaire coté symptomatique se décolore à moins de 40-50°). Ce temps de l’examen ne prend que 2 ou 3 min et peut rapporter gros.
L’analyse des signes et symptômes cardinaux (claudication intermittente, douleurs de décubitus, troubles trophiques) nécessite d’être à la fois ferme sur certains point-clefs et sensible à la nuance sur d’autres.
Avant de qualifier un patient-AOMI d’asymptomatique, il faut prendre en compte l’activité du patient et distinguer l’asymptomatique sédentaire et le symptomatique actif. Le premier peut être asymptomatique avec une occlusion iliaque, le second peut être symptomatique avec une sténose fémorale à 50% au canal de Hunter. Le premier peut être asymptomatique avec un examen du pied montrant des signes d’insuffisance artérielle prononcée, le second peut avoir un examen du pied parfaitement normal. Le premier est à risque CV bien supérieur à celui du second.
La claudication intermittente artérielle dans sa forme typique (la plus fréquente) est une douleur du mollet survenant à la marche, d’abord sous forme de gêne autorisant la poursuite de la marche (distance initiale de claudication) puis sous forme de crampe obligeant à l’arrêt (distance absolue de claudication). La douleur cède assez rapidement à l’arrêt de l’effort en position debout et se reproduit à l’identique pour une quantité d’effort similaire. Ces caractères distinguent la claudication artérielle de la claudication veineuse (douleur sourde puis constrictive du muscle et ne cèdant pas rapidement à l’arrêt de l’effort mais lentement en position de vidange veineuse allongé ou allongé jambe en l’air), des claudications rhumatologiques (mécaniques apparaissant rapidement et ne concernant pas un groupe musculaire donné), de la claudication neurologique (qui n’est pas une douleur musculaire mais une sensation de faiblesse ou d’engourdissement des membres inférieurs cédant en fléchissant le tronc en avant ou en s’asseyant). Il est très important de demander au patient de montrer du doigt là où il a mal et comment la douleur se calme.
Toutefois le tableau n’est pas toujours aussi simple, il existe des claudications artérielles touchant d’autres territoires que le mollet (fesse, cuisse, muscles de la semelle plantaire et parfois même muscles lombaires) et surtout il existe des douleurs combinées (une sténose de l’iliaque commune ou de l’hypogastrique peut s’exprimer sous forme de coxalgie d’effort, une sténose de la fémorale commune et de la fémorale profonde peut s’exprimer sous forme de gonalgie d’effort, une oblitération de l’aorte sous-rénale peut prendre un masque neurologique).
L’item clef est toujours -déclenché par une certaine quantité d’effort de marche, -cédant rapidement à l’arrêt de l’effort, -se reproduisant à l’identique à la reprise de la marche.Les douleurs de décubitus d’origine artérielle sont assez typiques pour peu que l’on demande au patient de montrer où il a mal et comment il calme la douleur. Elles intéressent d’abord l’avant-pied, les orteils (le patient les décrit volontiers en coiffant l’avant-pied de sa main). Le patient trouve à les calmer en verticalisant plus ou moins sa jambe (à ce degré d’insuffisance artérielle le réflexe vasoconstricteur postural est aboli et la pression hydrostatique augmente la pression de perfusion).
Elles évoluent en 3 degrés :
1-douleurs de primo-décubitus s’estompant en mettant le talon au bord du lit,
2-le patient doit laisser pendre la jambe hors du lit pour trouver le sommeil,
3-le patient est obligé de passer la nuit assis au fauteuil, à ce stade un œdème du pied et de la cheville s’installe.Les limites de ce symptôme sont le seuil individuel de sensibilité à la douleur et l’existence éventuelle d’une neuropathie sensitive (fréquente chez le diabétique, non-rare chez le sujet âgé longiligne) ou d’une neuropathie sensitive induite par l’ischémie.
Au total symptôme très précis mais inconstant.
Les troubles trophiques posent plus de problèmes car il n’est pas facile par la seule clinique d’établir le lien de causalité avec l’artériopathie.
Comme les douleurs de décubitus ischémiques, les ulcérations et gangrènes sont aussi acrales, elles siègent aux orteils et sur les zones de frottement du pied (malléole externe, hallux valgus, quintus varus, toute angulation de déformation d’orteil, tout orteil irrité par un ongle adjacent déformé). Elles sont en général douloureuses, plus ou moins sèches ou plus ou moins humides et nécrotiques ; les gangrènes sèches momifiées ne sont pas douloureuses.
Mais AOMI + Trouble trophique du pied n’est pas ipso facto égal à AOMI stade IV :
--le trouble trophique peut être totalement indépendant de l’AOMI, l’AOMI est contingente
--le trouble trophique peut être le fait d’une lésion emboligène plus ou moins sténosante sur l’arbre artériel du membre inférieur.
--l’insuffisance artérielle peut être modeste mais suffisante pour entraver la cicatrisation d’une plaie quelconque (facteur aggravant mais non causal),
--l’insuffisance artérielle peut être directement responsable du trouble trophique que ce dernier soit accidentel ou de survenue spontanée au stade ultime de l’AOMI.
Il est souvent utile d’avoir recours à des examens comme la mesure de pression digitale et la mesure de pression transcutanée d’oxygène à l’avant-pied pour préciser le lien de causalité.
Ces problèmes de qualification des troubles trophiques et leur impact sur l’évaluation des résultats thérapeutiques ont conduit un groupe d’experts à établir la notion d’ischémie critique chronique de membre inférieur (Circulation 1991).
L’ensemble de ces éléments fait que la classification dite de Leriche et Fontaine de 1952-1954 en 4 stades (I asymptomatique, II claudication intermittente, III douleurs de repos et IV troubles trophiques) n’est plus adaptée aux patients tels que nous les voyons aujourd’hui. En termes hémodynamico-cliniques, il n’y a que deux stades : le stade d’ischémie d’effort (regroupant « stades » I et II) et l’ischémie permanente (regroupant stades III et IV et ischémie critique chronique).
Question 3
L’écho-Doppler complète les données cliniques, quel est son apport le plus important ?
Le Doppler puis l’écho-Doppler ont été un tournant dans le diagnostic et la prise en charge de l’AOMI, on peut juste regretter que ça ait pu conduire chez certains à l’abandon de l’examen clinique et à la multiplication d’actes inutiles.
Il est aussi regrettable qu’en France un examen complémentaire soit coté en tant que tel et non pas en fonction de la complexité de l’examen réalisé. Celui qui passe 5 min à faire un écho-Doppler de débrouillage et celui qui passe 45 min à faire un examen complet détaillé cotent le même acte …
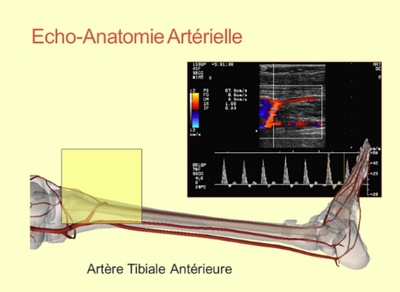 Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.
Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.Mais faire le même examen pour tout le monde n’est pas logique. Il faut distinguer l’examen de 1ère intention qui peut être très simplifié s’il s’agit simplement de répondre à la question « ACOMI ? oui/non », le premier examen définissant la stratégie qui doit être assez complet, l’examen de surveillance qui peut se focaliser sur les points essentiels (par ex. surveillance post-opératoire), l’examen pré-opératoire qui doit pouvoir se confronter à l’artériographie ou être le seul examen décisionnel pré-opératoire.
Quelle que soit l’étendue de l’examen il doit toujours comprendre une mesure de pression distale, indice de pression systolique à la cheville et mesure de pression digitale (au moins chez les patients à haute probabilité de médiacalcose jambière : diabétique, insuffisant rénal chronique, âge > 75 ans).
Deux autres points sont à mettre à l’actif de l’écho-Doppler
--parfois on est surpris du peu de lésions athéromateuses sur l’arbre artériel et il faut savoir se poser la question d’une artériopathie non-athéromateuse (artérite inflammatoire, dysplasie fibro-musculaire, compression, …) ou d’une thrombophilie en cas d’accident aigu.
--l’écho-Doppler est probablement le meilleur examen pour le diagnostic d’artériomégalie et de dystrophie polyanévrysmale qui sont des variétés assez sévères d’artériopathie des M.I.
Question 4
Plutôt que faire des angioscanners en cas d’AOMI, ne vaudrait-il pas mieux réaliser une angiographie diagnostique et thérapeutique du côté du membre atteint ?
FB. Je ne comprends pas très bien ta question. Il y a 25-30 ans que l’on a démontré qu’un examen écho-Doppler méthodique complet avec un compte-rendu précis fait aussi bien qu’une angiographie (et il s’agissait à l’époque d’artériographie intra-artérielle numérisée), le test de Skinner-Strandness (1967) est très utile dans l’évaluation des claudications douteuses, les appareils écho-Doppler actuels permettent une évaluation très précise des artères de jambe et du pied dans l’ischémie critique. Je crois que sauf question très précise à laquelle on n’a pas pu répondre en écho-Doppler et en exploration fonctionnelle, il n’y a en règle pas de place pour l’angiographie de 1ère intention quelle qu’elle soit.
Si telle est ta question, je ne comprends pas l’utilisation l’angio-scanner ou de l’angio-IRM en 1ère intention, je ne comprends pas ces angio-CT/angio-IRM réalisés de façon systématique « pour vérifier un écho-Doppler », je ne comprends pas les angio-CT/angio-IRM réalisées alors que l’indication thérapeutique est clairement d’ordre médical.
A mon sens dans la très très grande majorité des cas l’angiographie est un examen à titre préopératoire et lorsque l’indication est celle d’une angioplastie ça peut être le 1er temps de l’intervention.
Le manque d’argent en Médecine est un fait et une rengaine, mais si on commençait par supprimer tout ce qui ne sert à rien, tous les actes diagnostiques et thérapeutiques inutiles, et on comblerait une partie du manque.
Question 5
Le traitement médical de l’AOMI est très important après la correction des FDRCV, l’activité physique. Quelles sont les molécules à privilégier ?
De plus quelle est la place de l’association rivaroxaban 2.5 mg X 2 plus aspirine 100 mg et la place de la double anti agrégation plaquettaire ?FB. Je ne dirai pas les choses tout à fait comme ça.
Le traitement de l’ACOMI est celui de la prévention cardio-vasculaire, primo-secondaire si le patient est asymptomatique, secondaire si le patient est symptomatique. Mais ce distinguo est ici à mon sens de peu d’intérêt, voire flou, car comme déjà dit le risque CV est inversement proportionnel à l’IPSch que le patient soit symptomatique ou symptomatique. Comme discuté à la question 2, considéré comme asymptomatique un patient sédentaire avec un IPSch à 0.50 et partant ne pas lui prescrire d’antiagrégant selon certaines recommandations n’est pas logique.
L’arrêt du tabagisme est peut-être plus fondamental encore que pour les autres localisations d’athérosclérose.
L’entrainement à la marche pour le claudicant c’est un peu plus que les « au moins 30 min de marche ou autre activité physique par jour » recommandés en prévention CV.
Au plan médicamenteux, le traitement comprend au moins un antiagrégant plaquettaire (aspirine à 75 mg/100 mg/j. ou clopidogrel 75 mg. Le clopidogrel est peut-être préférable tant que le tabagisme n’est pas stoppé, le ticagrelor n’est pas supérieur au clopidogrel) et une statine (en allant progressivement à la dose optimale, en étant d’autant plus exigeant sur le seuil de LDLc que l’IPSch est plus bas). A cela s’ajoute le traitement d’une HTA ou d’un diabète si présent(s) en ciblant la normalité. De même si une dyslipidémie n’est pas suffisamment corrigée par le régime et les statines, l’adjonction d’une nouvelle classe de normolipémiant se discute (ézétimibe, anti-PCSK9)
L’adjonction systématique d’un IEC est recommandée mais ne fait pas l’unanimité.
Quant à la double anti-agrégation plaquettaire ou à l’association AAP-AOD vs monothérapie classique les résultats des essais randomisés peuvent se résumer ainsi : double AAP ou AAP-AOD plus efficace mais plus d’accident hémorragique (assez logique). La question tourne donc autour de la balance bénéfice-risque, pour qui ou quand ? Pour qui ?, logiquement les patients à très haut risque d’accident thrombotique. Quand ? : pour couvrir une période à haut risque, en général post-procédure ou au décours d’un accident thrombotique.
Mais les résultats de l’étude COMPASS à laquelle tu fais allusion vont probablement faire évoluer les pratiques avec extension des indications de l’association aspirine-AOD (dans COMPASS aspirine 100 mg et rivaroxaban 2.5 mg x 2). Personnellement je suis assez nuancé, association Aspirine-AOD pour un patient restant à haut risque malgré un TMO basique bien appliqué oui, Aspirine-AOD ou double antiagrégation plaquettaire chez un sédentaire qui continue à fumer son paquet de cigarettes, non (n’oublions pas que le tabac est aussi facteur d’AVC hémorragique).
Question 6
Comme synthétiser les problèmes de l’AOMI ?
FB. Je crois que l’on n’a jamais fait plus synthétique que E. Housley auquel l’éditeur du BMJ demandait « un article bref, clair, précis sur le traitement du patient-ACOMI claudicant destiné aux MG, pas plus de 800 mots ! » Housley commence son article en disant qu’il a été tenté de répondre « je peux le faire en 5 mots : stop smoking and keep walking »(BMJ may 1988).
 En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!
En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!Le traitement de fond du patient-ACOMI est le traitement médical optimal de la prévention cardio-vasculaire globale (prévention primo-secondaire et secondaire)
La reconstruction artérielle (angioplastie, chirurgie) est un traitement de seconde intention chez le claudicant (claudication invalidante et restant invalidante après un traitement médical optimal de 3 mois bien conduit) et de première intention chez le patient en ischémie permanente (mais le TMO reprend sa place dès cette phase critique passée).
J’ajouterai qu’il faut arrêter de limiter l’ACOMI au mâle claudicant ou avec gangrène du pied,
il faut être conscient que
- à même niveau d’index de pression systolique à la cheville le risque CV est similaire chez le patient-ACOMI asymptomatique et chez le symptomatique.
- l’ACOMI diagnostiquée par IPSch est aussi fréquente chez la femme que chez l’homme.
Abréviations
ACOMI : artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse
CV : cardiovasculaire
IPSch : index de pression systolique à la cheville
TMO : traitement médical optimal
Références.
Polonsky T.S., McDermott M.M. Lower extremity peripheral artery disease without chronic limb-threatening ischemia. A Review. JAMA. 2021;325(21):2188-2198.
Aday A.W., Matsushita K. Epidemiology of peripheral artery disease and polyvascular Disease. Circulation Research. 2021;128:1818–1832.
Becker F., Robert-Ebadi H. Diagnostic clinique de l’ischémie critique chronique de membre inférieur. Rev Med Suisse 2013 ; 9 : 302-5
Becker F., Robert-Ebadi H., Ricco J.B. et al. Chapter I: Definitions, Epidemiology, Clinical Presentation and Prognosis. European Journal of Vascular and Endovascular Surgery (2011) 42(S2), S4–S12
HAS. Prise en charge de l’artériopathie chronique oblitérante athéroscléreuse des membres inférieurs. RPC. Avril 2006
Becker F. Histoire de la claudication intermittente d’origine artérielle, Syndrome de Bouley-Charcot. J Mal Vasc2005, 30, 2, 114-117
Second European Consensus Document on Chronic Critical Leg Ischemia. Circulation 1991 ; 84(4) suppl Nov
Becker F. Classification clinique et hémodynamique des artériopathies chroniques oblitérantes des membres inférieurs. Thèse d’Université 1989.
F. Becker 16/07/21

Merci François pour ce tour d'horizon sur l'AOMI qui est clair, complet, didactique , tout simplement parfait. Tout cela a le mérite de ne pas oublier les fondamentaux en médecine vasculaire comme en médecine en général. La clinique "primum movens" que rien ne remplace et ne remplacera jamais.
-
Entretien avec l'auteur : Grégoire Détriché (AOMI/FEMME)
 "C'est par l'expérience que la science et l'art font leur progrès chez les hommes." Aristote
"C'est par l'expérience que la science et l'art font leur progrès chez les hommes." Aristote
Entretien avec le Dr Grégoire Détriché :au sujet de son article "Women Specific Characteristics and 1-Year Outcome Among Patients Hospitalized for Peripheral Artery Disease: A Monocentric Cohort Analysis in a Tertiary Center," Caractéristiques spécifiques aux femmes et résultat à 1 an chez les patientes hospitalisées pour une maladie artérielle périphérique : une analyse de cohorte monocentrique dans un centre tertiaire" in Front. Cardiovasc. Med., 07 February 2022 | https://doi.org/10.3389/fcvm.2022.824466, Co Auteurs : Alexis Guédon, Nassim Mohamedi, Olfa Sellami, Charles Cheng, Alexandre Galloula, Guillaume Goudot, Lina Khider Hélène Mortelette, Jonas Sitruk, Nicolas Gendron, Marc Sapoval, Pierre Julia, David M. Smadja,Tristan Mirault and Emmanuel Messas, "Team HEGP"
le principe de cet entretien est d'aller au delà d'un article Grégoire Détriché est Spécialiste en Médecine Vasculaire, MD PhD
Grégoire Détriché est Spécialiste en Médecine Vasculaire, MD PhD
Ancien interne des hôpitaux de Paris, Chef de Clinique des Universités - Assistant des hôpitaux de Paris
Service de médecine vasculaire, Hôpital Européen Georges-Pompidou, Assistance Publique Hôpitaux de Paris, Université de Paris (APHP-CUP), Paris, FranceUniversité de Paris, Thérapies Innovantes en Hémostase, INSERM, Paris, France
Laboratoire de recherche en biochirurgie (Fondation Carpentier), Assistance Publique Hôpitaux de Paris, Centre-Université de Paris (APHP-CUP), Paris, France
Merci Grégoire de ta réactivité et bravo pour l'article qui montre que les femmes comme les hommes présentent des atteintes cardio vasculaires qui ne sont pas à minimiser, bien au contraire.
Résumé de l'article :Bien que les femmes aient des taux d'incidence, de prévalence et de décès liés aux maladies cardiovasculaires normalisés selon l'âge inférieurs à ceux des hommes, il existe également des rapports indiquant que les femmes atteintes de maladies cardiovasculaires reçoivent moins de soins, moins d'examens et ont de moins bons résultats après un événement coronarien. Les objectifs de cette étude étaient de comparer les caractéristiques des hommes et des femmes hospitalisés pour une maladie artérielle périphérique (MAP), leurs résultats cardiovasculaires et des membres, et leur mortalité à 1 an. L'étude est un registre prospectif recueillant des données sur tous les patients consécutifs hospitalisés pour MAP au sein du service vasculaire du centre tertiaire Hôpital Européen Georges-Pompidou (Paris, France). Les patients devaient répondre à l'un des trois critères d'inclusion : revascularisation antérieure du membre inférieur ou toute occlusion artérielle du membre inférieur due à une maladie vasculaire athérosclérotique ou à des signes hémodynamiques de MAP. Les critères d'exclusion étaient les patients présentant une occlusion artérielle des membres inférieurs due à une autre cause. Tous les patients ont été suivis pendant au moins 12 mois après l'hospitalisation initiale. Parmi les 235 patients inclus, il y avait 61 femmes (26%), plus âgées que les hommes avec un âge médian de 75,6 et 68,3 ans respectivement. Les principaux facteurs de risque cardiovasculaire et les comorbidités étaient similaires pour les hommes et les femmes sauf plus d'anciens ou d'actuels fumeurs [145 (83,4 %) vs 33 (54,1 %)] et plus d'antécédents de maladie coronarienne [42 (24,1 %) vs 7 (11,5 %)] chez les hommes. La plupart des patients [138 (58,8 %)] avaient une ischémie critique des membres et 97 (41,3 %) avaient une claudication, sans différence selon le sexe. Après décharge, 218 patients ont reçu un traitement antithrombotique (93,2 %), 195 un hypolipémiant (83,3 %), 185 un inhibiteur de l'enzyme de conversion ou un antagoniste des récepteurs de l'angiotensine (78,9 %), de même entre les sexes. A 1 an, la mortalité globale, les événements indésirables cardiovasculaires majeurs, les événements indésirables majeurs des membres ne différaient pas avec 23 (13,2 %), 11 (6,3 %) et 32 (18,4 %) chez les hommes, et 8 (13,1 %), 3 ( 4,9%), 15 (24,6%) chez les femmes, respectivement, malgré la différence d'âge. La mortalité globale, les résultats cardiovasculaires, la revascularisation d'un membre ou l'amputation ne différaient pas entre les hommes et les femmes, 1 an après l'hospitalisation pour MAP bien que ces dernières soient plus âgées, moins fumeuses et moins coronariennes.
L'entretien
Aujourd'hui la mortalité chez les femmes et liée aux accidents cardiovasculaires, est largement sous-estimés. Quels sont les facteurs de RCV prédominants chez les femmes par rapport aux hommes ?En effet, pendant longtemps, la pathologie cardiovasculaire féminine a été reléguée au second plan, considérant que cette pathologie atteignait principalement les hommes.
En dehors des facteurs de risque cardiovasculaire modifiables ou non, commun aux deux sexes que nous connaissons tous, des facteurs de risque sont spécifiques aux femmes.
Mes travaux de thèse de sciences m’ont permis, entre autres, de m’y intéresser, et ils sont de deux types : je les qualifierai d’une part d’intrinsèques liés au sexe féminin et d’autre part d’extrinsèque liés à l’environnement féminin. Ces derniers ne sont hélas, pas tout le temps reconnu et recherché.
Les facteurs de risque intrinsèques sont représentés notamment par une ménopause précoce, un diabète gestationnel, des troubles hypertensifs durant la grossesse, un accouchement prématuré et des maladies telles que le syndrome des ovaires polykystiques.
Concernant les facteurs de risque extrinsèques,il s’agit principalement de facteurs de risque psychosociaux tels que les abus et violences sexuelles, les difficultés socio-économiques, l’environnement et le stress au travail etc.
Désormais, lors de nos consultations, notre interrogatoire doit également se tourner vers la recherche de ces facteurs de risque et nous devons notamment retracer avec rigueur l’historique des grossesses de nos patientes.
L'artériopathie chronique oblitérante des membres inférieurs (AOMI) présente-t-elle chez les femmes des spécificités particulières, sur le plan clinique et sur la topographie des atteintes retrouvées https://www.frontiersin.org/articles/10.3389/fcvm.2022.824466/fullL’artériopathie oblitérante des membres inférieurs (AOMI) chez les femmes semble avoir un début plus tardif que chez les hommes. En effet, nous montrons dans notre étude que les patients tout sexe confondus hospitalisés pour AOMI ont un âge médian de 70 ans. Les femmes, à l’admission, ont en moyenne 76 ans alors que les hommes en ont 68, soit 8 ans d’écart ! Cependant, nous avons inclus que des artéritiques hospitalisés, donc très majoritairement des ischémies critiques.
https://www.frontiersin.org/articles/10.3389/fcvm.2022.824466/fullL’artériopathie oblitérante des membres inférieurs (AOMI) chez les femmes semble avoir un début plus tardif que chez les hommes. En effet, nous montrons dans notre étude que les patients tout sexe confondus hospitalisés pour AOMI ont un âge médian de 70 ans. Les femmes, à l’admission, ont en moyenne 76 ans alors que les hommes en ont 68, soit 8 ans d’écart ! Cependant, nous avons inclus que des artéritiques hospitalisés, donc très majoritairement des ischémies critiques.
Nous sous-estimons par conséquent la part de claudicants et d’asymptomatiques chez les femmes dans la population générale !
Cependant, nous devons être alertés par le fait que les symptômes chez les femmes sont volontiers atypiques et moins fréquents que chez les hommes, pouvant expliquer en partie cette sous-estimation diagnostique et la prise en charge tardive de cette pathologie, alors déjà à un stade assez avancé. Pour preuve, nous soulignons dans notre étude, qu’avec moins de facteurs de risque cardiovasculaire que les hommes, les femmes avaient une survie globale, des événements cardiovasculaires majeurs ou des événements majeurs indésirables sur les membres inférieurs définis par des amputations ou des revascularisations, similaires aux hommes !
Pour ce qui est de la topographie des atteintes, nous pensons que le sexe n’influe pas cela mais que c’est plutôt les facteurs de risque cardiovasculaire associé au sexe qui influencent la topographie des atteintes. En effet, les diabétiques ont des atteintes plutôt distales alors que chez les tabagiques, les atteintes sont plutôt proximales.
Quelles sont les atteintes cardio-vasculaires associées chez les femmes qui présentent une AOMILes autres atteintes cardiovasculaires chez les femmes sont comme chez les hommes d’où la nécessité impérative d’un bilan d’extension artériel de l’AOMI, au niveau de l’aorte abdominale (recherche d’anévrisme), au niveau cardiaque et au niveau des troncs supra-aortiques. Je souligne également que la recherche d’une bronchopneumopathie chronique obstructive (BPCO) est aussi pertinente.
En effet dans notre étude, à l’inclusion, notre population présente de manière similaire une insuffisance cardiaque, une BPCO, un anévrisme de l’aorte abdominale et des antécédents d’accidents vasculaires cérébraux, qu’ils soient ischémiques ou transitoires. Seuls les antécédents de cardiopathie ischémique semblent être plus fréquents chez les hommes à l’inclusion.
Rappelons enfin qu’à la lumière des recommandations de la Société Européenne de Cardiologie datant de 2017 et toujours d’actualité, les patients présentant une AOMI ont une probabilité associée de présenter une cardiopathie ischémique dans 25 à 70% des cas, une atteinte carotidienne significative dans 14 à 19% des cas et une sténose de plus de 70% des artères rénales dans 10 à 23% des cas.
Quelles sont tes constatations sur le traitement de cette AOMI chez les femmes ?Certaines études internationales ont mis en exergue le fait que les femmes sont moins bien traitées que les hommes. Ceci doit nous faire vivement réagir !
Nous apprenons qu’in fine, la pathologie cardiovasculaire n’a pas de sexe si j’ose dire. Le traitement vasculo-protecteur, cette fameuse triplette composée d’un inhibiteur de l’enzyme de conversion (IEC) ou d’un antagoniste du récepteur de l’angiotensine II (ARA2), d’un antiplaquettaire (sauf en cas d’AOMI asymptomatique isolée sans autre atteinte artérielle) et d’un traitement hypolipémiant optimal avec un objectif de LDL cholestérol inférieur à 1,4 mmol/l (0,55 g/L) doit être prescrit et appliqué chez tous nos patients ! Après sortie d’hospitalisation dans notre étude, nous constatons l’égalité de prescriptions de ces traitements quel que soit le sexe, et dans des proportions similaires aux grands essais thérapeutiques récents tels que COMPASS et EUCLID.
Les premiers signes de l'AOMI chez la femme sont-ils en rapport avec leur statut hormonal ?Quand on parle de pathologie cardiovasculaire féminine, immanquablement nous pensons bien sûr aux estrogènes. Cependant, je vous propose d’aller un peu plus loin dans la physiopathologie féminine.
Les premières constatations ont été relevées avec les études publiées à partir de la cohorte de Framingham il y a quelques décennies. En effet, il a été montré que les femmes en pré ménopause développaient moins de maladies coronariennes que les femmes ménopausées ou que les femmes du même âge ayant eu une ménopause précoce.
Depuis, les effets cardiovasculaires protecteurs des estrogènes ont été démontrés. Ils favorisent en effet la vasodilatation artérielle, diminuent l’action des cytokines pro-inflammatoires, abaissent les lipoprotéines de basse densité et augmentent les lipoprotéines de haute densité. A la ménopause, de manière schématique, un switch hormonal a lieu : les estrogènes chutent et la concentration plasmatique d’une des gonadotrophines, par boucle de rétrocontrôle, augmente : il s’agit de l’hormone folliculostimulante (FSH). Des études ont même rapporté la corrélation entre taux plasmatique de FSH et épaisseur intima-média carotidienne et score calcique coronaire chez la femme.
Mais concernant le taux de FSH, un autre paramètre est intéressant à regarder : la cinétique d’augmentation du taux plasmatique de cette hormone pendant la période péri-ménopausique. En effet, des auteurs ont souligné que les femmes ayant une cinétique d’augmentation plus faible de la FSH pendant leur transition vers la ménopause pouvaient être moins à risque de développer une athérosclérose symptomatique que celles avec une cinétique d’augmentation moyenne ou élevée de FSH durant cette même période.
Il est ainsi possible que durant leur vie pré-ménopausique, l’athérome reste asymptomatique et que le trigger des manifestations cliniques chez les femmes soit l’augmentation des taux plasmatiques de FSH et leur niveau d’augmentation durant leur période de transition péri-ménopausique.
A la lumière des données de cet article doit-on proposer un dépistage de l'AOMI chez les femmes ? Quand ? Comment ? Périodicité ? Ce dépistage doit-il être global sur le plan CVJe pense bien sûr qu’il faut proposer un dépistage de l’AOMI chez les femmesMerci Grégoire pour ces réponses claires, précises et d'une grande qualité scientifique.
Tout d’abord il s’agit de cibler ce dépistage à la lumière des facteurs de risque cardiovasculaire classique : les femmes de plus de 60 ans.
Après, il nous faut cibler les femmes plus à risque et leur proposer un dépistage plus précoce, en les interrogeant sur leurs facteurs de risque spécifiques. La collaboration avec nos confrères gynécologues et sage-femme prend alors tout son sens, pour une prise en charge globale et pluridisciplinaire des femmes à tous les moments de leur vie.
Nous devons en plus avoir toujours en tête l’atypie des symptômes chez les femmes, et qu’à chaque consultation, même pour un motif totalement différent, prendre des pouls ou enregistrer des flux aux chevilles permettrait de dépister ce « silent killer » qu’est l’AOMI asymptomatique, trop souvent sous diagnostiquée…
Par ailleurs, prendre l’initiative de réaliser des dosages des taux FSH plasmatique durant la période péri-ménopausique afin d’en établir une cinétique permettrait sans doute de stratifier le risque cardiovasculaire chez les femmes à cette période de leur vie et de planifier un suivi cardiovasculaire personnalisé pour chaque patiente.
Enfin, devant l’association non négligeable des lésions artérielles athéromateuses, je pense qu’un dépistage global cardiovasculaire par écho-Doppler de l’aorte abdominale, des membres inférieurs et des troncs supra-aortique pour dépistage des plaques (et de l’anévrisme de l’aorte abdominale), associé avec l’échocardiographie trans-thoracique et le scanner coronaire est nécessaire afin de limiter le plus possible l’entrée dans une athérosclérose symptomatique. Je reste persuadé que la prévention cardiovasculaire associé à l’éducation thérapeutique pour toutes et tous permettra, à terme, de réduire de manière significative la morbi-mortalité cardiovasculaire. J'ajouterai que Grégoire fait partie des jeunes médecins vasculaires regroupés au sein du Club du même nom (CJMV) , il sont TOUTES et TOUS l'avenir de la Médecine Vasculaire.
J'ajouterai que Grégoire fait partie des jeunes médecins vasculaires regroupés au sein du Club du même nom (CJMV) , il sont TOUTES et TOUS l'avenir de la Médecine Vasculaire. -
Foire aux questions "patient" : AOMI
 “Les questions hypothétiques obtiennent des réponses hypothétiques.”Joan Baez
“Les questions hypothétiques obtiennent des réponses hypothétiques.”Joan Baez
“Il faut savoir poser des questions qui déboulonnent les certitudes.” Raymond Lévy
#septembremoisarteriopathie
Foire aux questions sur la maladie artérielle périphérique (MAP/AOMI) made in USA
Si vous avez reçu un diagnostic de maladie artérielle périphérique (MAP) , vous avez probablement des questions.

Aux USA Vascular Centers, nos spécialistes vasculaires peuvent fournir des réponses.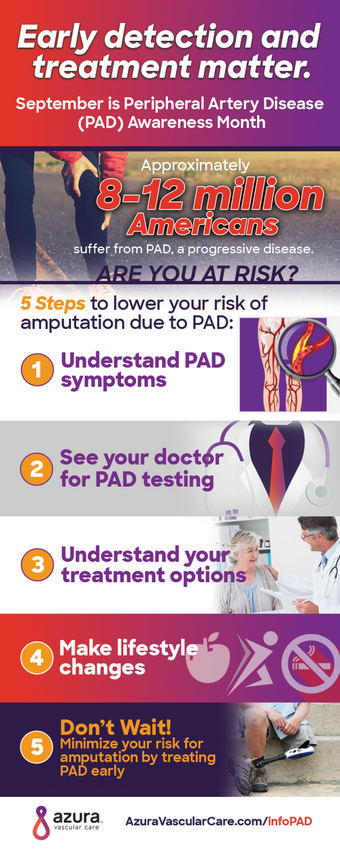
Nous travaillons individuellement avec chaque patient pour développer un plan de traitement PAD personnalisé. Nos principaux objectifs sont d'améliorer votre qualité de vie et de réduire vos risques de conséquences graves pour votre santé.
Ci-dessous, nous fournissons des réponses à un certain nombre de questions fréquemment posées sur le PAD.
 Quel est le symptôme le plus courant de la maladie artérielle périphérique ?
Quel est le symptôme le plus courant de la maladie artérielle périphérique ?
Le symptôme le plus courant de la maladie artérielle périphérique ou artériopathie chronique oblitérante des MI (AOMI) est la claudication.La claudication est une douleur ou une faiblesse musculaire qui commence par une activité physique, comme la marche, et s'arrête quelques minutes après le repos. Ce symptôme est ressenti par environ une personne sur quatre atteinte d'AOMID'autres types de symptômes des jambes, comme les douleurs dans les jambes au repos, affectent environ 50 % des patients atteints d'AOMI. Environ 40 % des personnes atteintes d'AOMI ne présentent aucun symptôme aux jambes.
Quel type de vitamines dois-je prendre pour une AOMI ?
Avant de prendre des vitamines ou des suppléments, assurez-vous d'en parler à votre médecin. La meilleure façon d'atténuer les symptômes de la MAP est de suivre les recommandations de traitement personnalisées d'un spécialiste vasculaire.Gardez à l'esprit qu'une alimentation saine et équilibrée peut offrir tous les nutriments dont vous avez besoin. Nous vous suggérons de manger beaucoup de fruits et légumes frais, de protéines maigres, de grains entiers et de graisses saines.
Commentaire : Vitamines et AOMI : INUTILES, de même que les compléments alimentaires
Une personne peut-elle mourir d'une AOMI ?
L'AOMI vous expose à un risque accru de conditions de santé dangereuses. Certains d'entre eux incluent:Crise cardiaque
Accident vasculaire cérébral
Amputation d'un membre
L 'AOMI peut parfois entraîner la mort. Dans la plupart des cas, la mort survient lorsque l'AOMI non traitée entraîne une crise cardiaque ou un accident vasculaire cérébral.
Copmmentaire : vous présentez une AOMI symptomatique, prenez rigoureusement votre traitemenbt médical, corrigez vos facteurs de RCV afin d'éviter et de miimiser des accidentts CV à très haut risque
Comment la maladie artérielle périphérique affecte-t-elle les autres systèmes du corps ?
La santé de vos artères peut avoir un impact sur d'autres systèmes du corps. En effet, les artères sont responsables du transport du sang dans tout le corps.Bien que l'AOMI affecte le plus souvent les artères menant aux membres inférieurs, elle peut également restreindre le flux sanguin vers votre cerveau et d'autres organes. De plus, certains hommes atteints d'AOMI souffrent de dysfonction érectile.
Commentaire : vous présentez une AOMI, toutes vos artères périphériques doivent être examinés par écho-Doppler ainsi que le caiyur par le cardiologue. Le point commun entre ces différentes localisations c'est l'ATHEROTHROMBOSE, affection chronique , évolutive dans le temps
Quel est le pronostic de l'AOMI ?
L'AOMI est une maladie chronique évolutive dans le temps. Bien qu'il n'y ait pas de remède, il existe un traitement. La bonne nouvelle est que vous pouvez vivre une vie pleine et productive avec AOMI si vous suivez un traitement le plus régulièrement possible.
Quel est la localisation la plus courante de l'AOMI ?
Les jambes sont la localisation la plus fréquente de la maladie artérielle périphérique. Les symptômes des jambes peuvent inclure la claudication, des changements cutanés et des douleurs au repos.
Est-ce que plus d'hommes ou de femmes souffrent d'AOMI ?
Depuis de nombreuses années, il est de notoriété publique que l'AOMI est principalement une affection à prédominance masculine. De nouvelles études ont montré que les femmes peuvent être au moins aussi touchées que les hommes. Elles peuvent également présenter des symptômes plus graves, tels que l'ischémie critique des membres (CLI).
Peux-t-on prendre l'avion avec une AOMI ?
Voler peut être préoccupant pour une personne atteinte d'AOMI. Des périodes prolongées en position assise peuvent avoir un impact sur la circulation sanguine, ce qui peut aggraver vos symptômes d'AOMI Avant de voler, nous vous suggérons de parler à votre médecin pour obtenir des recommandations. Ils peuvent conseiller :Apportez des médicaments dans votre bagage à main ainsi que les ordonnances
Buvez beaucoup de liquides
Évitez le sodium et l'alcool
Levez-vous et marchez quand c'est possible
Étirez et massez vos jambes et vos pieds en position assiseLes chaussettes de compression aident-elles l'AOMI?
Les chaussettes de compression ne sont généralement pas conseillées aux personnes atteintes d'AOMI, car elles peuvent restreindre davantage le flux sanguin vers la région. Si vous portez des chaussettes de compression pour d'autres raisons, telles que des caillots sanguins ou un gonflement, discutez des meilleures options avec votre médecin.
La kinésithérapie aide-t-elle l'AOMI?
La kinésithérapie peut être bénéfique pour soulager temporairement les symptômes de l'AOMI Cependant, des études supplémentaires sont nécessaires pour déterminer son efficacité. elle ne doit pas être utilisé à la place d'un traitement médical.Si vous décidez d'essayer la kinésithérapire consultez d'abord votre médecin. Ensuite, recherchez les services d'un kinésithérapeute agréé qui a de l'expérience avec les patients avec AOMI
AUTRES QUESTIONS "made in France"Quels sont les facteurs de risques qui favorisent l'AOMI ?
On distingue les FDRCV NON MODIFIABLESLe sexe : sous estimation du risque CV chez la femmeL’âge : > 70 ans, mais ….à partir de 40 ansLes antécédents CV : 1° degré , avant 60 ansL’ethniedes FDRCV MODIFIABLES
Le tabac : entre 30 et 70 ans, 4 décès cardio-vasculaires sur 10 sont dus au tabagisme.L’hypertension artérielleLe diabèteL'excès de cholestérol : un taux trop élevé de LDL-cholestérol dans le sang. Un taux trop bas de HDL-cholestérol est également un facteur de risque.L’obésité et le surpoids. Il faut être vigilant si le tour de taille est ≥ 88 cm chez la femme et ≥ 102 cm chez l'homme.L’insuffisance rénaleMon médecin traitant m' a pris un rdv chez un Médecin Vasculaire : pourquoi ?
Les affections inflammatoires
La POLLUTION
La Maladie Thrombo Embolique Veineuse
La dépression
La précarité
La Marijuana
Le médec n vasculaire est le spécialiste des maladies artérielle périphériques. Il va vous examiner, réaliser un écho Doppler avec prise de l'index de pression à la cheville, un écho Doppler aussi des carotides et de l'aorte abdominale (dépistage anévrisme qui peut être associé dans 15% des cas à votre AOMI). A l'issue de cette consultation le diagnostic de votre AOMI sera un diagnostic de certitude, vos facteurs de risque CV seront à corriger, un traitement médical vous sera prescrit. Enfin si le médecin vasculaire le juge utile (25% des cas) il vous prescrira un angio scanner des artères des membres inférieursMais pourquoi un scanner, l'écho Doppler n'est pas fiable ?
L'écjp-Doppler est trés fiable. La prescription d'un angio scanner est réalisé uniquement quand votre médecin vasculaire pense qu'il ya chez vious une indication potentielle de "déboucher vos artères" par voie endovasculaire ou par chirurgie. Avec l'écho Doppler et l'angio scanner vous serez adressé en consulatation à un chirurgie vasculaire, puis vous serez suivi régulièrement par votre médecin (tous les 3 mois) et par le médecin vasculaire (1 fois / an, le plus souvent).J'ai mal à la jambe en marchant et on me parle de marche active, c'est pas logique ?
L'activité physique est recommandé chez tous les patients qui ont des problèmles cardio vasculaires. La marche active quotidienne, qui peut être supervisée danb un premier temps par un kinésithérapeute . La marche active est la clé du succès pour améliorer votre périméte de marche et elle diminue en plus votre risque CV. La marche aide à développer de petites artères pour suppléer celles qui sont malades , "opération bison futé " en quelque sorte.
Le médecin vasculaire m'a prescrit 3 médicaments et en plus il y a une statine, je ne veux pas de statine
Vos médecins, médecin traitant, médecin vasculaire et cadiologque ont eu raison. Le premier médicament est le plus souvent de l'aspirine faible ou du clopidogrel. Ce sont des antiplaquettaires qui empêchent les artères "de se boucher". Le deuxième, la fameuse staine qui va diminuer le cholesterol (surtout le maubvis, le LDL) et aussi et surtout réduit le risque CV, donc de faire un accident vasculaire dans un autre territoire. Le risque de "crampes" est très faible 6% des personnes qui prennent une statine. Enfin on vous a prescrit un IEC (inhibiteurs de l'enzyme de conversion) qui est un hypotenseur très bénéfique sur le risque CV. Si vous n'être pas hypertendu on le prescrira à doses faibles puis en augmentant très progrssidement. Que votre AOMI soint uniquement médicale ou qu'elle a nécessité un geste de revascularisation, le traitement médical sera DEFINITIF !
Est ce que je peux remplacer la statine par la levure de riz ouge, mes amis m'en parlent constamment ?NON et NON , la levure de riz rouge est un complément alimantaite couteux qui n'a jamais été étudie de manière scientifique dans l'AOMI, les statines oui. De plus cettre levure peut avoir des effets secondairse graves , la rabdomiolyse (nécrose musculaire). Faite confaince à la science rien qu'à la science, vos amis , la famille , ne sont pas médecins...alors ?
On peut multiplier les questions/ réponses à l'infini
CommentaireCes questions et leurs réponses sont "made in USA", avec un complément "made in France" . Les foires aux questions ont beaucoup de succés auprès des patients. Souvent les patients viennent en consultation avec leur liste de questions. Il faut y répondre avec attention, avec des mots simples, il faut souvent oublier le langage technico médical et se mettre à la portée du patient. Ne pas hésiter à dessiner vos réponses.Références -
IRT/AOMI/Score HFRS
 La fragilité est un facteur aggravant
La fragilité est un facteur aggravant
Ischémie des MI : angioplastie ou chirurgie ?
 “La guerre est la seule véritable école du chirurgien.”Hippocrate“Le chirurgien doit avoir un oeil d'aigle, un coeur de lion, et une main de femme.”Proverbe anglaisChirurgie ou thérapie endovasculaire pour l'ischémie chronique menaçant les membres
“La guerre est la seule véritable école du chirurgien.”Hippocrate“Le chirurgien doit avoir un oeil d'aigle, un coeur de lion, et une main de femme.”Proverbe anglaisChirurgie ou thérapie endovasculaire pour l'ischémie chronique menaçant les membres
Surgery or Endovascular Therapy for Chronic Limb-Threatening Ischemia
Alik Farber, MD,Matthew T. Ménard, MD,Michael S. Conte, MD,John A. Kaufman, MD,Richard J. Powell, MD,Niteesh K. Choudhry, MD, Ph.D.,Taye H. Hamza, Ph.D.,Susan F. Assmann, Ph.D.,Mark A. Creager, MD,Mark J. Cziraky, docteur en pharmacie,Michael D.Dake, MD,Michael R. Jaff, DO,et al.,pour les enquêteurs BEST-CLI †, NEJM 2022, November 7, 2022 DOI: 10.1056/NEJMoa2207899https://www.nejm.org/doi/10.1056/NEJMoa2207899
RAPPEL :" l 'ischémie chronique menaçant les membres (CLTI), la manifestation la plus grave de la maladie artérielle périphérique, est définie par une douleur ischémique du pied au repos, des ulcérations ischémiques ou une gangrène. Plus de 200 millions de personnes souffrent de maladie artérielle périphérique dans le monde ; Le CLTI touche jusqu'à 11 % de cette population. Mis à part les graves problèmes de santé associés au CLTI, l'effet économique de la maladie est substantiel, avec un coût annuel estimé à environ 12 milliards de dollars aux États-Unis seulement. "
CONTEXTE
Les patients atteints d'ischémie chronique menaçant les membres (CLTI) nécessitent une revascularisation pour améliorer la perfusion des membres et ainsi limiter le risque d'amputation. Il n'est pas certain qu'une stratégie initiale de thérapie endovasculaire ou de revascularisation chirurgicale pour CLTI soit supérieure pour améliorer les résultats des membres.MÉTHODES
Dans cet essai international randomisé, nous avons recruté 1830 patients atteints de CLTI et de maladie artérielle périphérique sous-inguinale dans deux essais de cohorte parallèle. Les patients qui avaient un seul segment de la grande veine saphène pouvant être utilisé pour la chirurgie ont été affectés à la cohorte 1. Les patients qui avaient besoin d'un conduit de pontage alternatif ont été affectés à la cohorte 2. Le résultat principal était un composite d'un événement indésirable majeur au membre - qui était défini comme une amputation au-dessus de la cheville ou une réintervention majeure d'un membre (un nouveau pontage ou une révision de greffe, une thrombectomie ou une thrombolyse) - ou un décès quelle qu'en soit la cause.RÉSULTATS
Dans la cohorte 1, après un suivi médian de 2,7 ans, un événement de résultat principal est survenu chez 302 des 709 patients (42,6 %) dans le groupe chirurgical et chez 408 des 711 patients (57,4 %) dans le groupe endovasculaire (risque relatif , 0,68 ; intervalle de confiance à 95 % [IC], 0,59 à 0,79 ; P<0,001). Dans la cohorte 2, un événement de critère de jugement principal est survenu chez 83 des 194 patients (42,8 %) dans le groupe chirurgical et chez 95 des 199 patients (47,7 %) dans le groupe endovasculaire (risque relatif, 0,79 ; IC à 95 %, 0,58 à 1,06 ; P=0,12) après un suivi médian de 1,6 ans. L'incidence des événements indésirables était similaire dans les deux groupes des deux cohortes.CONCLUSION
Parmi les patients avec CLTI qui avaient une grande veine saphène adéquate pour la revascularisation chirurgicale (cohorte 1), l'incidence d'un événement indésirable majeur de membre ou de décès était significativement plus faible dans le groupe chirurgical que dans le groupe endovasculaire. Parmi les patients qui n'avaient pas de conduit veineux saphène adéquat (cohorte 2), les résultats dans les deux groupes étaient similaires. (Financé par le National Heart, Lung, and Blood Institute ; numéro BEST-CLI ClinicalTrials.gov, NCT02060630. s'ouvre dans un nouvel onglet.)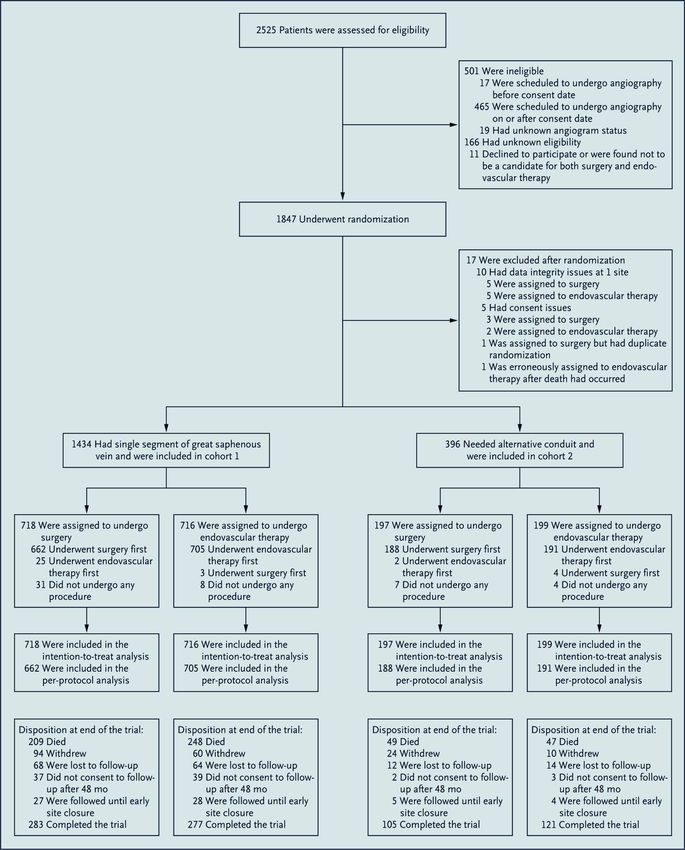
Figure 1. Randomisation et résultats.
Les données présentées concernent les patients avec un seul segment de la grande veine saphène (qui ont été inclus dans la cohorte 1) et ceux qui avaient besoin d'un conduit de pontage alternatif (qui ont été inclus dans la cohorte 2). Les patients de chaque cohorte ont ensuite été randomisés séparément pour subir soit une chirurgie, soit un traitement endovasculaire. Dans la description de la disposition des patients à la fin de l'essai, les patients qui ont fourni un consentement limité jusqu'au suivi à 48 mois ont terminé la visite de 48 mois mais n'ont pas consenti à recevoir un suivi supplémentaire, comme indiqué dans la version 5.0 du protocole.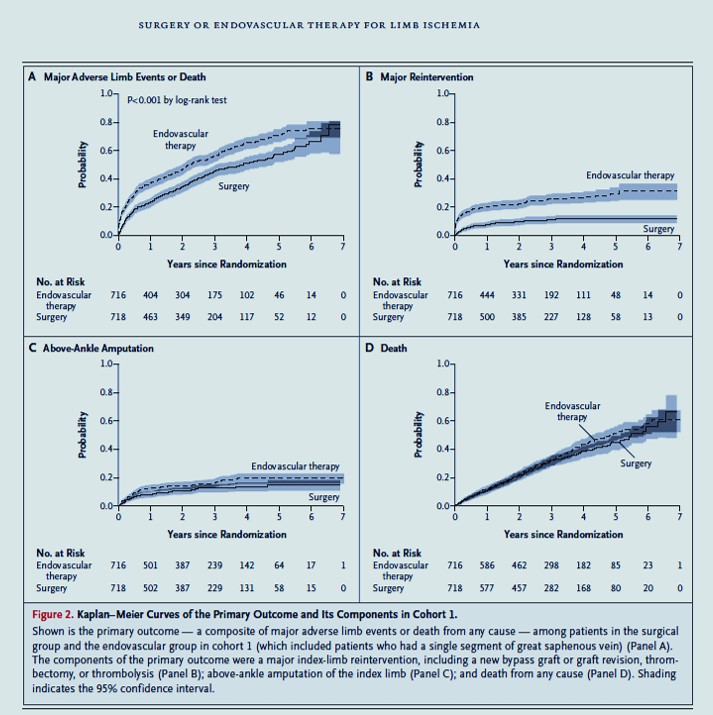
Figure 2. Courbes de Kaplan-Meier du résultat principal et de ses caractéristiques dans la cohorte 1.L'illustration montre le résultat principal - un composite d'événements indésirables majeurs des membres ou de décès quelle qu'en soit la cause - chez les patients du groupe chirurgical et du groupe endovasculaire de la cohorte 1 (qui comprenait des patients qui avaient un seul segment de la grande veine saphène) (Panel A) . Les composants du critère de jugement principal étaient une réintervention majeure du membre index, y compris un nouveau pontage ou une révision de pontage, une thrombectomie ou une thrombolyse (groupe B) ; amputation au-dessus de la cheville du membre index (panneau C); et la mort quelle qu'en soit la cause (partie D). L'ombrage indique l'intervalle de confiance à 95 %.
Commentaire
"Le pontage chirurgical et la thérapie endovasculaire sont les principales stratégies de revascularisation utilisées pour traiter le CLTI. Le choix de la chirurgie ou de la thérapie endovasculaire comme traitement initial varie considérablement d'un fournisseur à l'autre et est basé sur le profil de la maladie artérielle du patient, le risque chirurgical, la disponibilité d'un conduit autogène pour le pontage veineux et la préférence du patient, ainsi que sur des facteurs tels que la formation, ensemble de compétences et biais de traitement.7-9 La mesure dans laquelle cette variabilité affecte les résultats cliniques chez les patients atteints de CLTI est inconnue. Nous avons réalisé l'essai Best Endovascular versus Best Surgical Therapy in Patients with CLTI (BEST-CLI) pour déterminer si la revascularisation endovasculaire était supérieure à la revascularisation chirurgicale chez les patients atteints de CLTI causé par une maladie de l'artère périphérique sous-inguinale et jugés appropriés candidats aux deux approches."Comaparer deux techniques dans plusieurs centres ne peut qu'entrainer des biais de sélection. Les auteurs le reconnaissent. Chirurgie ou endovasculaire une question récurrente dans différents domaines vasculaires périphériques. L'endovasculaire "se vend mieux" auprès des patients et des médecins, ce qui est logique. La chirurgie effraie toujours. Le stent rassure, qui n'a pas son stent ? Les fabriquants de stents sont là en embuscade avec une pression au quotidien terrible auprès des poseurs de stents.
Reprer une saphène et la cartographier dans la prespective d'un pontage par écho-Doppler n'est pas un réflexe systématique en cas d'ischémie critique , il devrait être systématique de la manière suivante : Patient en décubitus dorsal puis en orthostatisme, sonte barrette haute fréquence. Repérage précis qui doit mettre en évidence les variations anatomiques, le trajet de la grande saphène, inter aponévrotique ou sus aponévrotique et la présence de reflux . La mesure des diamètres est très importantres comme celle de la profondeur, la présence d'un refflux significatif contre indique l'utilisation de la veineLe post op et le suivi écho Doppler est primordial la première années : J+2, M3, M6, M12 puis 1 fois / an si pontage simple non composite
Patient en décubitus dorsal puis en orthostatisme, sonte barrette haute fréquence. Repérage précis qui doit mettre en évidence les variations anatomiques, le trajet de la grande saphène, inter aponévrotique ou sus aponévrotique et la présence de reflux . La mesure des diamètres est très importantres comme celle de la profondeur, la présence d'un refflux significatif contre indique l'utilisation de la veineLe post op et le suivi écho Doppler est primordial la première années : J+2, M3, M6, M12 puis 1 fois / an si pontage simple non composite
Des critères vélocimétriques à connaître :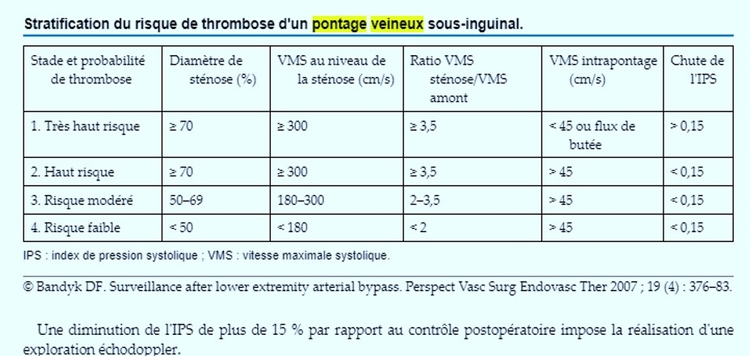

Référence : Traité de Médecine Vasculaire 2021, Ed Masson Elsevier
Et la vraie vie ?
Les pontages veineux notamment fémoro poplités sont rares, le stenting fait la course en tête....jusqu'à quand ? Les pontages veineux semblent donner de bons résultats en terme de perméabilité mais leur rareté rend toute conclusion hasardeuse. Le stent, a du ressort, et les patients adorent les stents....alors ?Une autre étude est en cours : BASIL-2
https://www.isrctn.com/ISRCTN27728689
Contexte et objectifs de l'étude
Une personne sur 1 000 à 2 000 personnes au Royaume-Uni sera diagnostiquée chaque année avec des cas avancés d'ischémie sévère des membres (SLI). En raison d'une combinaison de tabagisme, de diabète, d'hypertension artérielle, d'un taux de cholestérol élevé, d'une insuffisance rénale et du processus de vieillissement, certaines personnes développent un « durcissement » des artères de leurs jambes. Dans le SLI, même des blessures mineures au pied peuvent ne pas guérir, entraînant le développement d'une ulcération, voire d'une gangrène. À moins que l'approvisionnement en sang de la jambe et du pied ne soit amélioré, de nombreuses personnes touchées par le SLI perdront leur membre et/ou mourront dans les 12 mois. En plus de causer de grandes souffrances, les SLI font peser une lourde charge financière sur les services de santé et de protection sociale. Les deux traitements actuellement disponibles pour le SLI sont le pontage veineux (VB) et le meilleur traitement endovasculaire (BET). Dans VB, une veine est utilisée pour contourner le blocage. BET consiste à ouvrir les artères malades avec des ballons et parfois l'utilisation de petits tubes métalliques appelés stents. Les deux traitements ont des avantages et des inconvénients et il y a débat et incertitude quant à savoir lequel est préférable, quand, dans quelles artères et chez quels patients.
N'oublions pas que le BEST MEDICAL TREATMENT doot être aussi de la partie. L'association rivaroxaban 2,5 mg X 2 + aspirine 100 mg semble être intéressante avec une statine forte dose et un LDL<0,55. Une double anti agrégation plaquettaire de 3 à 6 mois en cas de stent est aussi une alyernative . La réédication physique supervisée aussi.
N'oublions pas qu'en cas de PONTAGE ou de TRAITEMENT ENDO VASCULAIRE, le chirurgien léve un obstacle mais ne guérit pas l'athérothrombose, le traitement médical associé est très important et au long cours. Devant une ischémie chronique il faut mettre en balance ces deux techniques, discussion nau cas par cas......
Données COCHRANE 2010Il y a eu un bénéfice net en termes de perméabilité primaire pour la veine autologue comparé aux matériaux synthétiques pour les pontages au-dessus du genou. A long terme (cinq ans), le Dacron confère un léger bénéfice de perméabilité primaire par rapport au PTFE pour le pontage au-dessus du genou. Le PTFE avec un manchon veineux a amélioré la perméabilité primaire comparé au PTFE seul pour les pontages au-dessous du genou. D'autres données randomisées sont nécessaires pour établir si ces informations se traduisent par une amélioration de la survie des jambes.
A lire : https://www.ssvq.org/traitement/information-preoperatoire-sur-le-pontage-femoro-poplite-ou-langioplastie-femorale/