François Becker
-
Dossier : dissections des artères cervicales (Partie 1)
Analyse de la bibliographie récente sur ce sujet
-
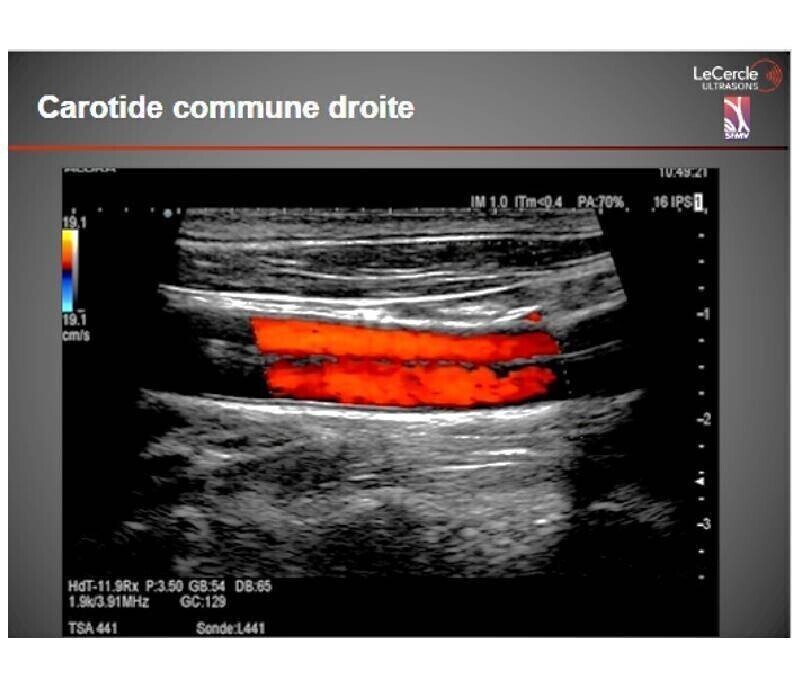
Entretien avec François BECKER : Sténose carotidienne asymptomatique

iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
"Ce qu'on appelle stratégie consiste essentiellement à passer les rivières sur les ponts et à franchir les montagnes par les cols." Anatole France
Entretien avec F. Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire La question de la sténose carotidienne asymptomatique est une question toujours complexe avec des réponses trop souvent discordantes. C'est pourquoi j'ai demandé à François Becker son avis éclairé . En le lisant vous allez découvrir l'essence même de cette question . Vous allez aller, à la rencontre de la sténose carotidienne asymptomatique et in fine à une connaissance optimale. Le partage du savoir est toujours enrichissant.
La question de la sténose carotidienne asymptomatique est une question toujours complexe avec des réponses trop souvent discordantes. C'est pourquoi j'ai demandé à François Becker son avis éclairé . En le lisant vous allez découvrir l'essence même de cette question . Vous allez aller, à la rencontre de la sténose carotidienne asymptomatique et in fine à une connaissance optimale. Le partage du savoir est toujours enrichissant.
Question 1 : Peux-tu définir avec précision ce qu’est une sténose carotidienne asymptomatique ?Avant de répondre à ta question, il me parait bon de rappeler 4 points importants :
1- D’abord ce qu’on entend par sténose carotide* car dans les documents d’ordre épidémiologique on mélange parfois lésions extra- et intracrâniennes, ce qui surestime l’évaluation de la responsabilité des sténoses carotides extra-crâniennes dans les AVC ischémiques. Sans autre précision, on entend par sténose carotide les sténoses intéressant la bifurcation carotide proprement dite et/ou les 1ers cms de l’artère carotide interne cervicale : bifurcation carotide, origine de l’ACI ou bulbe carotide, ACI post-bulbaire immédiate. Sont exclues les sténoses de la carotide commune thoracique et cervicale, de l’ACI cervicale haute sous la base du crâne, les sténoses intra-crâniennes (siphon carotidien, sylvienne) et les sténoses limitées au tronc de la carotide externe.
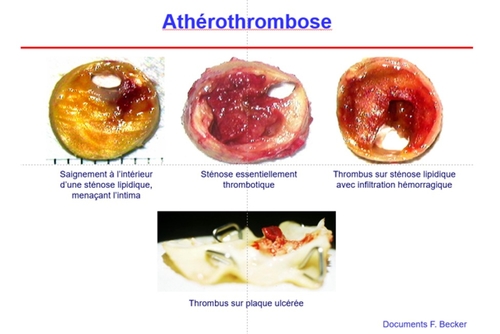
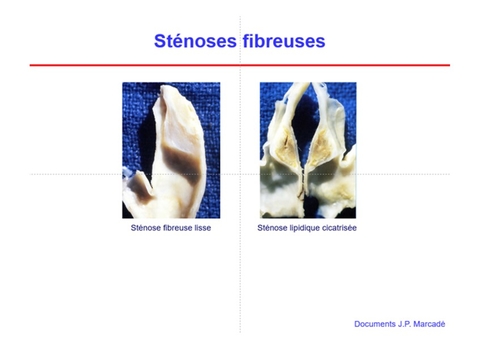
2- Sans précision, on parle de sténose par athérosclérose, les lésions d’artériopathie non-athéroscléreuse sont exclues du propos (bien que nettement moins fréquentes que les sténoses athéroscléreuses, il faut savoir les évoquer ,car leur gestion est spécifique).
3- Plaque, sténose les deux mots sont souvent utilisés l’un pour l’autre alors que du point de vue étymologique et hémodynamique les deux termes sont différents (parler d’une plaque à 80% ou d’une sténose à 20% a quelque chose d’incongru). Probablement pour pallier ces aléas de langage est apparu le terme de sténose significative qui n’est pas plus précis. S’il existe quelques variantes dans la définition du mot plaque, toutes agréent qu’une plaque est un élément plutôt rigide, plutôt plat et en tout cas peu épais. Une sténose est non seulement un rétrécissement mais un rétrécissement anormal. Il est communément admis en hydraulique qu’une sténose régulière ne perturbe pas le flux jusqu’à atteindre au moins 70% section. On peut appliquer aux carotides la méthode de Bollinger pour les membres inférieurs en distinguant sténoses ≥ 50% diam., sténoses 25-50% diam., plaques ≤ 25% diam.
4- Une cause majeure de discordance dans l’appréciation du degré de sténose des lésions carotides est que les uns parlent de sténose en réduction de diamètre quand les autres parlent en réduction de section. Ce n’est pas supportable ! Il faut toujours préciser X%-diam ou X%-section.
Pour répondre à ta question, il faut encore faire un brin d’histoire. Jusqu’en 1950 et les travaux de C.M. Fisher les lésions carotides extra-crâniennes ont été négligées. Il faut peut-être rappeler que l’artériographie a été développée pour l’étude des tumeurs cérébrales (E. Moniz 1927), que l’apoplexie était considérée comme liée à la thrombose d’artère intra-crânienne (XVIIème-XVIIIème siècle) et que les premiers liens entre lésions carotides extra-crâniennes et AVC ischémique homolatérale ont été établis pour des plaques ulcérées avec matériel thrombotique extra-crâniennes (Chiari 1905).
La définition du caractère symptomatique ou asymptomatique des sténoses carotides (SC) est liée aux études sur la chirurgie carotidienne.
Initialement une sténose carotide était définie comme asymptomatique si sans aucun antécédent de séméiologie neurologique ou oculaire attribuable (étude VA) ou aucun antécédent de séméiologie neurologique ou oculaire attribuable dans le territoire carotide concerné (études Casanova et ACAS).
Puis l’étude ECST (1981-94) a défini une sténose carotide symptomatique comme avec AIT, infarctus rétinien ou AVC non-invalidant dans le territoire carotidien homolatéral dans les 6 mois précédents l’inclusion et l’étude NASCET (1987-1997) comme AIT, CMOT (Cécité Monoculare Transitoire) AVC non-invalidant dans le territoire carotidien homolatéral dans les 4 mois précédents l’inclusion.
Il est important de noter qu’il ne s’agit que de déficit focalisé : vertige isolé, malaise, syncope, toute séméiologie non-hemisphérique ne sont pas pris en compte, il en est de même des infarctus silencieux en imagerie cérébrale.
Suite à l’étude ACST (1993-2003), une sténose carotide asymptomatique a été définie par opposition à une sténose symptomatique.
Une sténose carotide asymptomatique est donc définie comme sans aucun antécédent neurologique déficitaire focalisé, hémisphérique ou oculaire, dans le territoire homolatéral à la sténose dans les 4 à 6 mois précédents.
Le délai de 4 à 6 mois pourrait actuellement être réduit à 6 sem.*Carotide est à la fois adjectif qualificatif et nom commun.
Question 2 : Dans quelles circonstances doit-on rechercher une sténose carotidienne asymptomatique ?
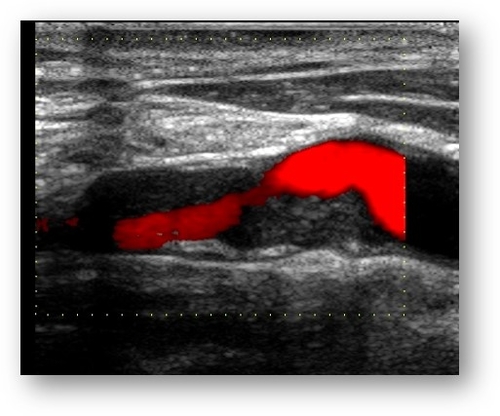
Sujet polémique ! L’USPSTF (US Preventive Services Task Force Recommendation Statement) a réitéré en 2021 son opposition de 2014 au dépistage de sténose carotide en se prononçant against. L’American Heart Association (AHA) et l’American Stroke Association (ASA) ont fait de même.
Certes,il s’agit de dépistage en population générale mais les trois raisons majeures de cette opposition sont- La cascade d’examens lorsque le 1er examen n’est pas jugé suffisamment crédible (problème de l’écho-Doppler « opérateur-dépendant ») ou lorsque le 1er examen (en général l’écho-Doppler) est systématiquement vérifié par une artériographie dès lors qu’il n’est pas normal ou lorsqu’il est seulement demandé à l’écho-Doppler des critères de vitesse systolique de sténose « ≥ 50% » auquel cas une artériographie est réalisée pour décider de la suite (position radiologique).
- La iatrogènie liée aux actes inutiles etsurtout le fait que dans la vraie vie le taux de complications opératoires est assez souvent supérieur au maximum de 3% requis pour pratiquer la chirurgie ou le stenting pour sténose carotide asymptomatique (et encore ces 3% datent d’études anciennes, maintenant ce devrait être < 1.5%).
- Le fait qu’il n’y a pas de bénéfice prouvé à la chirurgie ou au stenting préventif pour les sténoses carotides asymptomatiques (tout particulièrement chez la femme).Les dernières données sont celles de l’étude SPACE-2 interrompue prématurément à 513 patients pour recrutement trop lent. Dans cette étude le taux d’AVC et décès post-opératoires (chirurgie ou stenting) était de 2.5%, et à 1 an il n’y avait pas de différence dans le critère d’évaluation principal (tout AVC et décès à 30 j. + AVC ischémique ipsilatéral à 5 ans) : 2.5% pour l’endartériectomie, 3% pour le stenting, 0.9% pour le traitement médical optimal (Chaturverdi, jama neurol. Fev. 2021).

Il faut se poser la question du pourquoi intervenir préventivement par chirurgie ou stenting sur une sténose carotide asymptomatique : pour prévenir un AVC ischémique fatal ou invalidant !
Les AIT ont pu être inclus dans certaines études, mais si l’AIT est un très bon signe d’alerte, la prévention par chirurgie ou stenting des AIT n’a pas d’intérêt puisque par définition la durée de la séméiologie est < 24h.Prévenir par chirurgie ou stenting un AVC ischémique fatal ou invalidant n’est pas évident. En effet la sténose carotide est marqueur de risque cardio-vasculaire, marqueur de risque d’AVC toute cause, marqueur de risque d’AVC ischémique homo ou bilatéral, facteur d’AVC ischémique homolatéral. Même en cas de sténose carotide 70-99%, 20% des AVC dans le territoire d’une sténose dite symptomatique et 45% des AVC dans le territoire d’une sténose asymptomatique sont sans rapport avec la sténose carotide en question.
Au total, les sténoses > 50% diamètre et oblitérations ACI sont jugées responsables d’environ 10% des AVC ischémiques(ESVS Guidelines, Naylor AR et al. Eur J Vasc Endovasc Surg 2018 Jan; Mas JL Académie Médecine 2019 Oct; Chatuverdi S. et al. F1000Research 2020 Aug)
Le patient avec sténose carotide est souvent polyvasculaire (connu ou non). Il existe une corrélation positive entre sévérité des sténoses carotides et sévérité des lésions coronaires (que la sténose carotide soit symptomatique ou non). L’HTA est facteur de risque de sténose carotide, d’infarctus lacunaire, d’AVC cardio-embolique, d’AVC hémorragique. Le tabagisme est facteur de risque d’AVC ischémique et d’AVC hémorragique … 10% des patients avec sténose carotide ont une FA, 10% des patients avec FA ont une sténose carotide (Noubiap et al, Am J Cardiol2020).
Ainsi pour prévenir les AVC il est bien plus rentable d’agir sur les facteurs de risque !
Un exemple avec le tabagisme est particulièrement impressionnant. Si la prévalence du tabagisme de l’adulte USA était réduite de 1%, dès la première année seraient épargnées 924 hospitalisations pour infarctus du myocarde, 538 hospitalisations pour AVC (Stroke), 190 décès pre-hospitaliers, 44 millions US$ 1995. Pour parvenir au même résultat pour les seuls AVC, sur base ACAS-ACST, il faudrait opérer 46.000 sténoses carotides asymptomatiques … après avoir dépisté environ 1.000.000 de sujets/patients haut risque ! (Hankey GJ. Journal of Cardiovascular Risk 1999. Lightwood JM, Glantz SA. Circulation 1997).
Enfin n’oublions pas que passé un certain âge, l’âge lui-même est le facteur de risque principal, d’où l’intérêt du maintien d’une bonne hygiène de vie et d’une activité physique.
Le dépistage des sténoses carotides asymptomatiques ne se discute que si les règles du traitement médical optimal sont appliquées et respectées. Chercher à dépister une sténose carotide asymptomatique chez un patient tabagique actif hypertendu non-contrôlé n’a pas de sens.
Si la prévention médicale de l’athérosclérose est bien conduite, si on maitrise la qualité des examens et de la suite qui leur est donnée, il peut être raisonnable de dépister des lésions carotides chez le patient asymptomatique présentant un souffle carotidien (Guidelines communs à 22 sociétés de Cardiologie et Neurologie) ou chez les patients avec facteurs de risque multiples ou avec une artériopathie des membres inférieurs connue ou toute affection cardio-vasculaire (Society for Vascular Surgery) dans l’idée d’affiner la quantification du risque cardio-vasculaire et d’identifier les sténoses carotides asymptomatiques à haut risque neuro-vasculaire ischémique homolatéral, on y reviendra plus loin.
Pour ceux qui aiment encore l’examen clinique, le souffle cervical systolique strident ou le souffle continu systolo-diastolique fin, feutré sont en règle le fait d’une sténose très serrée sous-jacente.
Tu peux me dire que j’ai oublié le classique dépistage pré-opératoire des sténoses carotides (chirurgie cardiaque, chirurgie lourde non-cardiaque) : les études récentes montrent que -la majorité des AVC post-op surviennent en l’absence de sténose carotide ou ne peuvent pas être attribués à une sténose carotide asymptomatique préalable, -en cas de sténose carotide unilatérale les AVC sont autant ipsilatéraux que controlatéraux à la sténose. Au total ce dépistage pré-op ne semble plus justifié.
Pour mémoire la prévalence des sténoses carotides ≥ 50% diamètre en population générale augmente de façon exponentielle avec l’âge : de l’ordre de 1% dans la tranche 50-59 ans, de l’ordre de 8% pour les 80 ans et plus.
En France cela donne environ 750.000 personnes avec une sténose ≥ 50% et 220.000 avec une sténose ≥ 70% (J.L. Mas).Question 3 : Le traitement médical complet ou BMT joue un rôle important dans la gestion thérapeutique des sténoses carotidiennes en général et notamment en cas de sténose asymptomatique, jusqu’à quel degré de sténose ?
Réponse courte, le traitement médical optimal (TMO) ou Best Medical Treatment (BMT) joue un rôle majeur dans la gestion, dans le traitement des sténoses carotides, qu’elles soient asymptomatiques ou symptomatiques, et ce quel que soit le degré de sténose.
Les études princeps sont en partie périmées parce que le traitement médical a fait un bond avec l’arrivée des statines, la prise en compte plus rigoureuse de l’HTA et la « découverte » du rôle majeur de l’hygiène de vie. Le traitement médical peut réduire une sténose mais ne la fait pas disparaitre. Son rôle est dans la prévention des complications de la plaque ou de la sténose carotide, dans la lutte contre le passage de l’athérosclérose à l’athérothrombose et ce quel que soit le siège des lésions (c’est là un atout majeur, la prévention primo-secondaire des accidents liés à la sténose carotide,c’est aussi la prévention des AVC dans leur ensemble, la prévention des accidents coronaires, la prévention des complications de l’artériopathie des membres inférieurs, …).
Le TMO ne se limite pas à une ordonnance standardisée délivrée à la va vite en fin d’examen. Il faut expliquer en détail les enjeux et les modalités au patient, bien lui préciser qu’il s’agit d’un traitement au long cours, au besoin on complètera en demandant au patient de revenir pour un entretien spécifique.
Outre l’arrêt définitif du tabagisme, une activité physique régulière, une alimentation de type méditerranéen et la lutte contre le surpoids ou l’obésité, ce traitement inclue une statine au long cours (en ciblant LDL < 1 voire < 0.7 g/L, voire < 0.5 g/L, un antiplaquettaire au long cours (en général aspirine 75-325 mg), le contrôle strict de la pression artérielle (PA < 140/90 mm Hg), et le traitement d’un diabète éventuel (HbA1c < 7%). L’adhérence au traitement doit être testée à chaque consultation.
Il importe aussi d’expliquer au patient les symptômes et signes d’AIT ou de CMOT pour qu’il consulte rapidement en cas de survenue.
Question 4 : A partir de quel degré de sténose asymptomatique doit-on envisager un traitement chirurgical
A la suite de l’étude ACAS (1987-1993), le seuil d’indication opératoire était sténose > 60% (plus petit diamètre luminal vs diamètre luminal de l’ACI distale où les parois sont parallèles). Il est monté à 70% avec l’étude ACST (1993-2003).
Actuellement le degré de sténose n’est plus que la 1ère étape du diagnostic. Il faut ensuite préciser les caractères de la sténose tant au point de vue du risque thrombo-embolique que du risque hémodynamique.
En effet, l’ensemble des études suggère que, sous traitement médical optimal (TMO), le risque annuel d’AVC ischémique homolatéral à une sténose carotide asymptomatique se situe actuellement entre 0,5 et 1 % / an. Si le TMO est appliqué et si on est logique, la place pour une indication opératoire est restreinte.
Il faut aussi prendre en compte l’espérance de vie du patient, une espérance de vie > 5 ans est un critère dans l’indication opératoire pour sténose carotide asymptomatique et ce quel que soit l’âge du patient (ESVS guidelines 2018).
Maintenant je ne suis pas naïf, des guidelines à la vraie vie, d’autres critères sur lesquels je ne m’étendrai pas interviennent dans les indications opératoires. Les taux d’interventions pour sténose carotide asymptomatique parmi l’ensemble des interventions pour sténose carotide laissent perplexe : 90% aux USA, 65-70% en Italie et en France, 40-45% en Hongrie et en Suisse, 33% en Australie, 15-25% en Finlande, Norvège, Suède et Royaume-Uni, 0% au Danemark ! (données 2004-2010).
Question 5 : Quels sont les paramètres de vulnérabilité de la sténose dont on dispose. Est-ce que la vulnérabilité de la plaque est aujourd’hui un paramètre important décisionnel ?
Je n’aime pas trop ce terme de vulnérabilité de la plaque ou de la sténose. Vulnérable « qui est exposé à recevoir des coups, qui est exposé aux atteintes de la maladie, … », alors que là ,c’est l’inverse , c’est la plaque ou la sténose qui est l’agresseur pour le cerveau. Tu veux parler de l’identification des lésions carotides probablement à plus haut risque d’être responsable d’un AVC ischémique. Cinq pistes ont été retenues (toutefois sur des études portant sur de faibles effectifs) :
1- Patients avec infarctus cérébral silencieux,
2- Progression sténosante de la lésion,
3- Risque thrombo-embolique,
4- Risque hémodynamique et.....peut-être
5- Marqueurs biologiques ?La présence d’un infarctus cérébral non-lacunaire asymptomatique dans le territoire de l’ACI sténosée est retenue in ESVS Guidelines 2018 (RR 3 - IC95% 1.46-6.29, p 0,002).
L’évolution sténosante de la lésion (plaque, sténose) est lente, une progression « rapide » est a priori le fait d’un hématome intra-plaque ou d’un thrombus. Pour les sténoses 50-99% stables le taux annuel d’AVCi, le risque, double avec la progression de la sténose dans une étude multicentrique observationnelle, l’augmentation du risque est plus net si la sténose progresse franchement rapidement RR 4,7 (95%IC: 2,3-9,6) dans un RCT multicentrique. Mais tout cela dépend de par qui et comment est fait le suivi, c’est surtout valable si c’est le même examinateur et si la rapidité d’évolution est appréciée sur un graphique.
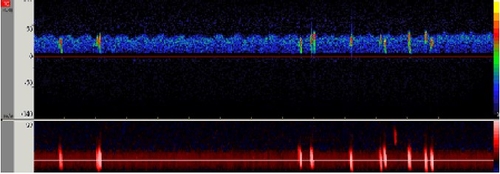 L’évaluation du risque thrombo-embolique repose sur plusieurs paramètres : l’échostructure de la lésion (an-hypoéchogène, hypoéchogène-hétérogène) d’autant plus précise que l’on dispose d’un support informatique, la vascularisation de la lésion en écho de contraste, la détection de micro-embols ou HITS du côté de la lésion (monitoring Doppler trans-crânien). En imagerie radiologique, analyse de la lésion en IRM de haute définition (la référence actuelle), le volume de la lésion en CT (risque proportionnel à la surface et au volume). Dans une méta-analyse le risque annuel d’AVCi pour les sténoses 50-99% diam est de 4.2% lorsque la sténose est à dominante anéchogène/hypoéchogène versus 1.6% lorsque la sténose est à dominante échogène. Dans une autre méta-analyse la détection de HITS augmente le risque annuel d’AVCi avec un OR à 2,61 (p 0,001). Dans une étude multicentrique, le risque annuel d’AVCi des sténoses 70-99% uniformément anéchogène/hypoéchogène avec détection de HITS du côté de la sténose est de 8.9% vs 0.8% dans le cas contraire.
L’évaluation du risque thrombo-embolique repose sur plusieurs paramètres : l’échostructure de la lésion (an-hypoéchogène, hypoéchogène-hétérogène) d’autant plus précise que l’on dispose d’un support informatique, la vascularisation de la lésion en écho de contraste, la détection de micro-embols ou HITS du côté de la lésion (monitoring Doppler trans-crânien). En imagerie radiologique, analyse de la lésion en IRM de haute définition (la référence actuelle), le volume de la lésion en CT (risque proportionnel à la surface et au volume). Dans une méta-analyse le risque annuel d’AVCi pour les sténoses 50-99% diam est de 4.2% lorsque la sténose est à dominante anéchogène/hypoéchogène versus 1.6% lorsque la sténose est à dominante échogène. Dans une autre méta-analyse la détection de HITS augmente le risque annuel d’AVCi avec un OR à 2,61 (p 0,001). Dans une étude multicentrique, le risque annuel d’AVCi des sténoses 70-99% uniformément anéchogène/hypoéchogène avec détection de HITS du côté de la sténose est de 8.9% vs 0.8% dans le cas contraire.L’évaluation du risque hémodynamique est assez facile en écho-Doppler si on veut bien s’en donner la peine avec la combinaison des critères suivants :
- mesure comparative des index de résistance au niveau des carotides communes (I.Vi),
- mesure comparative des débits carotidiens (en TAMV sur les ACC),
- évaluation comparative des signaux sylviens (amplitude et temps de montée),
- évaluation de la vasoréactivité cérébrale (par blocpnée-hyperpnée en 1ère intention, par test au CO2 en 2ème intention).
Le maintien du débit ACC malgré une sténose très serrée indique a priori une vasodilatation cérébrale pour compenser un défaut de suppléance par le polygone de Willis ; l’augmentation du temps de montée des signaux ACM et l’abolition unilatérale de la vasoréactivité cérébrale indique que la sténose ACI est mal suppléée. L’écho-Doppler cervical et transcrânien fait à mon sens mieux plus facilement et mieux le diagnostic de sténoses pseudo-occlusives de l’ACI que l’angio-MR ou l’angio-CT (la référence était l’artériographie conventionnelle numérisée avec les critères NASCET-Rothwell). Il est important de savoir faire ce diagnostic de sténose pseudo-occlusive (c’est-à-dire qui se comporte comme une occlusion complète) car c’est la sténose hyper-serrée de l’origine de l’ACI pour laquelle le bénéfice de la chirurgie est marginal à 2 ans et nul à 5 ans.Des marqueurs biologiques sont en cours d’évaluation, l’hs-CRP apparait en bonne place.
Question 6 : Sténose asymptomatique de la carotide et occlusion controlatérale de la carotide : quelle est la conduite à tenir et en fonction de quel degré de sténose
Le sujet est en pleine révision, les études récentes (Patel P.B. et al, J Vasc Surg 2018 juin ; Turley R.S. et al, J Vasc Surg 2019 sept ; Schneider J.R. et al ,J Vasc Surg 2020 mars) montrent que le patient avec sténose carotide asymptomatique et occlusion de l’ACI controlatérale asymptomatique n’est pas très différent du patient sans occlusion ACI tant au plan de son risque spontané d’AVCi que de son risque opératoire. En fait on retombe dans les éléments discutés dans la question précédente. Ici il est probable que celui qui a oblitéré une ACI de façon asymptomatique a un bon polygone de Willis.
Question 7 : Où en est l’étude ACTRIS (sténose carotide asymptomatique vs traitement médical) ? Que penses-tu de l’étude récente ACST-2 trail (sténose carotide asymptomatique, chirurgie vs stenting) ?
Toutes les études avec un bras TMO ont du mal à inclure. Avant de parler d’ACST-2 et d’ACTRIS, il faut parler de SPACE-2.
SPACE-2 est une étude Allemagne-Autriche-Suisse avec 3 bras parallèles randomisés à égalité (TMO seul vs Endartériectomie carotidienne + TMO vs Stenting carotidien + TMO). Il était prévu d’inclure 3.000 patients, le critère principal d’évaluation était « taux cumulé de décès et tout AVC à 30j. post-op + taux d’AVC ischémique homolatéral à 5 ans ». Puis devant la difficulté à inclure, il a été décidé de faire 2 études « TMO seul vs EAC + TMO » et « TMO seul vs Stenting + TMO ». Malgré cela, l’étude a été arrêtée au bout de 5 ans pour défaut de recrutement alors qu’il n’était pas encore noté de différence significative entre les groupes. Les raisons de la difficulté à inclure interpellent : « SPACE-2 a conclu que le recrutement a largement échoué parce que (1) de nombreux cliniciens non expérimentés pensaient que les interventions étaient justifiées chez la majorité des patients asymptomatiques, (2) les patients initialement référés pour intervention ne voulaient pas être randomisés dans le bras TMO seul ; (3) le stenting était déjà remboursé dans les pays recruteurs pour le traitement de patients asymptomatiques en dehors de l'essai ; et (4) la randomisation TMO seul signifiait une perte de revenu pour les hôpitaux, les chirurgiens et les interventionnistes.». L’amertume des auteurs et les commentaires de Naylor (in EJVES juin 2016) font peine, difficile d’occulter le fait que la sténose carotide asymptomatique est aussi un business !!
L’étude ACTRIS est une étude française comparant TMO seul vs Endartériectomie + TMOchez 700 patients ayant une espérance de vie > 5 ans et jugés à haut risque sur les critères décrits plus haut (Sténose > 70% NASCET avec au moins 1 des facteurs de risque suivant : Progression rapide de la sténose, Sténose hypoéchogène, Détection de HITS, Hématome intra-plaque en IRM, Infarctus cérébral silencieux de type embolique du côté de la sténose, Antécédent d’infarctus cérébral ou d’AIT du côté opposé). Des collègues nous disent inclure des patients, mais on n’a pas d’information et sur le site ClinicalTrials.gov l’étude est donné comme « Not recruiting » alors qu’elle a débuté en 2019. Personnellement je n’aurais pas considéré avec sténose carotide asymptomatique jugée à haut-risque mais au contraire les patients avec sténose jugée à bas risque neuro-vasculaire ipsilatéral.
L’étude ACST-2 est une étude multicentrique européenne2008-2020 dont les résultats viennent d’être publiés dans le Lancet . Elle a inclus 3.625 patients avec sténose carotide asymptomatique > 60% randomisés, endartériectomie carotidienne vs stenting carotidien. Le traitement médical n’a pas été investigué, il était supposé optimal pour la majorité des patients.
A J30, l’item « tout AVC ou décès » était de 2.7% dans le groupe endartériectomie vs 3.8% dans le groupe stenting, l’item « AVC invalidant ou décès » était de 0.9% dans le groupe endartériectomie vs1% dans le groupe stenting ; le risque d’infarctus du myocarde était un peu plus élevé dans le groupe endartériectomie.
A 5 ans, l’item « tout AVC ou décès » était de 7% dans le groupe endartériectomie vs8.6% dans le groupe stenting, l’item « AVC invalidant ou décès » était de 4.5% dans le groupe endartériectomie vs5.3% dans le groupe stenting.
Au congrès ESC les résultats ont été présentés : morbidité-moralité à j30 1% dans les deux groupes, à 5 ans AVC invalidant ou fatal non-liés à la procédure 2.5% dans les deux groupes, tout AVC non-lié à la procédure 4.5% dans le bras chirurgie et 5.2% dans le bras stenting.
Il a été conclu que les deux procédures affichaient les mêmes résultats.
Il est probable qu’on aille vers des résultats identiques entre endartériectomie et stenting (sauf peut-être chez la femme et le sujet très âgé) mais tout semble fait pour privilégier le stenting.
Dernière question : carte blanche vers le futur.
Je crois avoir déjà laissé transpirer mes sentiments. Comme titrait R. Naylor dans le J Vasc Surg de juin 2009 « Who benefits most from intervention for asymptomatic carotid stenosis: patients or professionals? »
Les études princeps ont été menées pour défendre la chirurgie et valider un degré de sténose seuil d’indication opératoire. Le patient avec sténose carotide asymptomatique, comme le patient avec un petit anévrisme de l’aorte asymptomatique, est victime de la notion de seuil d’indication opératoire. La chirurgie, comme le stenting maintenant, étant perçu comme le traitement le patient dont la lésion carotide est dite non-chirurgicale est renvoyé au suivi en imagerie jusqu’à ce que la sténose soit déclarée « chirurgicale », dans ce schéma le traitement médical passe souvent aux oubliettes.
Pourtant le TMO actuel, s’il est bien appliqué et suivi, est la clef de voute de toute la prise en charge de ces patients avec sténose carotide asymptomatique. Un faible pourcentage de ces patients relèvent de la chirurgie ou du stenting carotidien. Cela veut dire qu’il faut identifier ces patients avec une bonne fiabilité ; non seulement une bonne fiabilité mais, compte-tenu de la prévalence élevée de ces lésions, avec des moyens et des praticiens faciles d’accès.
L’écho-Doppler cervical et transcrânien a un rôle majeur à jouermais à condition qu’on arrête de dire «ah mais, c’est opérateur-dépendant ! », à condition que le but de cet examen aille bien au-delà de sténose < ou > 50%, à condition qu’on sache utiliser toutes les possibilités de l’EDC et de l’EDTC pour dire risque standard ou haut-risque neurovasculaire ipsilatéral.
Dans le cas contraire je crois que l’EDC n’aura bientôt, n’a peut-être déjà, plus d’intérêt dans les sténoses carotides asymptomatiques.
Enfin si demain on se met véritablement à vouloir faire des économies de santé, peut-être qu’on misera tout sur le TMO chez les patients avec des facteurs de risque vasculaires, avec un traitement gradué en fonction du risque, sans chercher à savoir si les patients ont telles ou telle lésions ou sténoses.
F. Becker 21/10/2021
Merci François d'avoir abordé cette question importante de manière détaillée et documentée, as usual....
- La cascade d’examens lorsque le 1er examen n’est pas jugé suffisamment crédible (problème de l’écho-Doppler « opérateur-dépendant ») ou lorsque le 1er examen (en général l’écho-Doppler) est systématiquement vérifié par une artériographie dès lors qu’il n’est pas normal ou lorsqu’il est seulement demandé à l’écho-Doppler des critères de vitesse systolique de sténose « ≥ 50% » auquel cas une artériographie est réalisée pour décider de la suite (position radiologique).
-
Entretien avec François Becker : AOMI
 iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
iconographie : https://www.tartinvillephoto.com/visite-virtuelle/ascension-mont-blanc/
"Toute subversion commence par celle du vocabulaire " Confucius (551-479 av. J.-C.)
"La science est un outil puissant. L’usage qu’on en fait dépend de l’homme, pas de l’outil." Albert Einstein
"Ce qu'on appelle stratégie consiste essentiellement à passer les rivières sur les ponts et à franchir les montagnes par les cols." Anatole France
Entretien avec F. Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire
Un Maître "és Médecine Vasculaire", Maître Yoda de la Médecine VasculaireAOMI, état des lieux
Question 1
Pourquoi l’AOMI est la localisation plus grave de l’athérothrombose ?FB- Je ne crois qu’on puisse dire les choses comme ça. L’AOMI n’est pas en elle-même la localisation la plus grave de l’athérothrombose, ce sont le contexte et nos comportements qui en font la gravité.
Pour ce qui est de l’AOMI athéromateuse elle-même, la majorité des patients porteurs d’une AOMI sont asymptomatiques ou ne rapportent aucun symptôme durant la vie courante. Parmi les patients-AOMI avec claudication intermittente on estime que, dans les 5 ans suivant le diagnostic, 70-80% s’améliorent ou restent stables, 10 à 20% voient leur claudication s’aggraver, 5 à 10% développent une ischémie critique. Par ailleurs 1% des patients-AOMI se présentent d’emblée en ischémie critique. Parmi ces patients en ischémie critique 40 à 50% auront une amputation majeure (jambe ou cuisse) ou décéderont dans l’année suivant le diagnostic. Il faudrait ajouter le risque d’oblitération artérielle aigue thrombotique, d’ischémie aigüe, (environ 1% par an dans les études), mais il est assez rare qu’une thrombose aigüe survienne sans cofacteur. Au total pour ce qui est strictement du risque de l’AOMI, le risque annuel d’amputation majeure est inférieur à 1%.
Pour ce qui est du risque cardio-vasculaire (CV) général il en va différemment. Le risque annuel d’événements CV graves (infarctus du myocarde, AVC, décès CV) est de 4 à 5% chez le claudicant. La mortalité CV à 10 ans est multipliée par 4 à 6 chez le patient avec AOMI par rapport au patient sans AOMI. La morbi-mortalité CV du patient-AOMI est du même ordre, voire un peu plus élevée, que celle du patient coronarien ou du patient ayant fait un AVC.
Deux facteurs me semblent devoir être pris en compte :
1-le fait que dans l’histoire naturelle de l’athérosclérose les coronaires sont touchées en premier, puis les artères des membres inférieurs, puis les carotides (extra- et intracrâniennes),
2-le fait que la prévalence de l’AOMI augmente de façon exponentielle avec l’âge.
Ainsi le patient-AOMI jeune a souvent aussi des lésions coronaires (connues ou non), le patient-AOMI âgé a souvent des lésions coronaires et des lésions carotides (connues ou non). Deux fois sur 3 le patient-AOMI est un polyvasculaireLa mortalité générale est également augmentée à peu près dans les mêmes proportions car le tabagisme est le facteur de risque majeur de l’AOMI athéromateuse. Il faut donc ajouter la mortalité liée au tabac (cancers, BPCO).
Le diabète est également un facteur de risque à prendre en compte dans l’excès de morbi-mortalité, mais il est plus difficile à mesurer car il faudrait distinguer deux cas de figures : le patient-AOMI dont la glycémie est un peu augmentée et le patient-AOMI ayant clairement une artériopathie diabétique touchant électivement les artères distales. Le second est à plus haut risque d’amputation et d’accidents CV que le premier.
Plus rare, mais peut-être plus grave, est l’AOMI chez l’insuffisant rénal chronique au stade terminal.
Le patient avec AOMI athéromateuse a une autre caractéristique peu flatteuse : toutes les études, sans exception, montrent que c’est le patient vasculaire le plus mal pris en charge ; celui pour lequel les recommandations sont les plus mal appliquées, les plus mal observées (et il y en a eu depuis 25 ans !).
« Mal appréciée, sous-diagnostiquée, sous-traitée » est un leitmotiv dans les articles de synthèse. Et ça n’est pas nouveau, déjà Charcot se plaignait du peu de considération pour « sa claudication » !
Les patients sont d’accord pour une pléthore d’examens et d’angioplasties pas toujours utiles, mais la lutte contre le tabagisme et l’incitation à l’entrainement à la marche passent souvent au second plan (soit que le patient renâcle, soit que le médecin ne prenne pas le temps d’expliquer, de convaincre), mais les règles d’hygiène de vie et le traitement médicamenteux de l’athéro-thrombose laissent à désirer (tant au niveau de l’observance que de la prescription). Ces fondamentaux ne sont pas considérés comme pour le patient avec lésions coronaires ou cervico-encéphaliques alors que le niveau de risque CV du patient-AOMI est le même voire supérieur, alors que la fréquence et la sévérité de lésions coronaires, le risque d’AVC, la mortalité toutes causes sont inversement proportionnelles à l’index de pression à la cheville (IPSch). Au-delà du risque loco-régional, l’AOMI est un puissant marqueur de risque CV que l’AOMI soit symptomatique ou asymptomatique (même niveau de risque à même niveau d’IPSch).
Autre point majeur, l’AOMI est encore souvent considérée comme une affection masculine alors que la prévalence de l’AOMI définie sur la mesure d’IPSch est identique chez l’homme et chez la femme pour chaque tranche d’âge (Rotterdam study 1998). Conséquence le « Mal appréciée, sous-diagnostiquée, sous-traitée » est encore plus criant chez la femme !
Enfin il y a également un problème de terminologie qui ajoute à la confusion. En France on parle volontiers d’artérite alors que le terme désigne partout ailleurs les artériopathies inflammatoires, dans les pays anglo-saxons on parle d’artériopathie périphérique (PAD, peripheral arterial disease) en précisant rarement de quelle artériopathie périphérique il s’agit (artères des membres inférieurs ou toute artériopathie non-coronaire). On précise rarement que l’on parle d’artériopathie oblitérante, alors qu’il y a aussi des artériopathies ectasiantes (artériomégalie, dolicho-méga-artères, anévrysmes). De même on précise rarement artériopathie athéromateuse (ou athérosclérose ou athéro-thrombose) alors qu’il y a aussi des artériopathies non-athéromateuses (compression, dysplasie fibro-musculaire, artérites, ..). On précise rarement artériopathie chronique (les formes aigues sont souvent multifactorielles). Récemment un groupe d’experts sous l’égide de Bauersachs a « tapé du poing sur la table » en demandant un terme unique et précis (Vasa juillet 2021 + l’éditorial de Qanadli).
L’artériopathie dont on parle ici est l’artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse,c’est un peu long j’en conviens mais c’est plus précis et plus juste qu’artérite ou PAD !
Je suis un peu long, mais ça fait pas mal de facteurs qui expliquent la gravité de l’ACOMI et tous ne sont pas liés à l’ACOMI …
Et puis n’oublions pas qu’il s’agit d’une affection très fréquente (3 à 7% de la population adulte, 20% des plus de 70 ans) !
Question 2
L’examen clinique est toujours si important dans le diagnostic et la prise en charge de l’AOMI. Quels sont ses passages obligés ?
FB. Bien sûr que l’examen clinique reste important. Au terme d’une carrière on a des tas d’histoires à raconter, parfois dramatiques, sur des cas où l’étape clinique a été négligée.
Certes ça prend un peu plus de temps que de faire un « bon pour écho-Doppler », pourtant en 20 min on peut obtenir pas mal d’informations pour peu qu’on ait le sens de l’anamnèse et que l’on fasse dévêtir le patient.
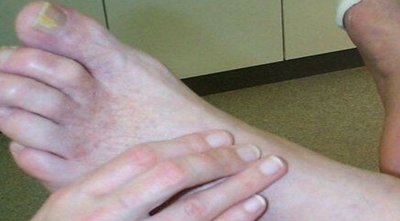 A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
A titre systématique chez un patient présentant des facteurs de risque (tabagisme, diabète, HTA, dyslipidémie, antécédents familiaux) ou chez un patient présentant des symptômes évocateurs d’AOMI, l’examen commence par la palpation des pouls périphériques en sachant que sur un pied froid ils peuvent être difficiles à percevoir et que le pouls pédieux est absent chez 7 à 9% des gens et le pouls tibial postérieur absent dans 3 à 4% (les deux sont absents dans moins de 1% des cas, il existe alors un pouls péronier au bord antérieur de la malléole externe).
https://www.medicinus.net/examen-peripherique/ (pouls pédieux)
Puis on passe à la palpation des pouls fémoraux au Scarpa membre en rotation externe. Le pouls poplité est parfois plus difficile à percevoir (le rechercher genou fléchi en abduction). L’examen est complété par l’auscultation ilio-fémorale et au niveau de la gouttière fémorale, par la palpation abdominale à la recherche d’un AAA, la palpation simultanée des pouls radiaux et l’auscultation cervicale. Petit détail qui a son importance, attention si un pouls fémoral ou poplité est trop facilement perçu, trop ample, il peut s’agir d’un anévrysme ou d’un pouls de butée.Si les pouls périphériques ne sont pas perçus, et a fortiori s’il existe des lésions cutanées du pied, il faut savoir « lire le pied » à la recherche de signe d’insuffisance artérielle en testant le remplissage de veines du pied (normalement quasi instantané, anormal si on voit la veine se remplir lentement), en appréciant l’état des pulpes digitales et de la coque talonnière (normalement pleines, anormale si flétries « vides » avec contact osseux facile), en évaluant la pression distale par l’angle de décoloration de la semelle plantaire en surélevant lentement les deux pieds membre en extension (alerte si une semelle plantaire reste colorée alors que l’autre se décolore, si la semelle plantaire coté symptomatique se décolore à moins de 40-50°). Ce temps de l’examen ne prend que 2 ou 3 min et peut rapporter gros.
L’analyse des signes et symptômes cardinaux (claudication intermittente, douleurs de décubitus, troubles trophiques) nécessite d’être à la fois ferme sur certains point-clefs et sensible à la nuance sur d’autres.
Avant de qualifier un patient-AOMI d’asymptomatique, il faut prendre en compte l’activité du patient et distinguer l’asymptomatique sédentaire et le symptomatique actif. Le premier peut être asymptomatique avec une occlusion iliaque, le second peut être symptomatique avec une sténose fémorale à 50% au canal de Hunter. Le premier peut être asymptomatique avec un examen du pied montrant des signes d’insuffisance artérielle prononcée, le second peut avoir un examen du pied parfaitement normal. Le premier est à risque CV bien supérieur à celui du second.
La claudication intermittente artérielle dans sa forme typique (la plus fréquente) est une douleur du mollet survenant à la marche, d’abord sous forme de gêne autorisant la poursuite de la marche (distance initiale de claudication) puis sous forme de crampe obligeant à l’arrêt (distance absolue de claudication). La douleur cède assez rapidement à l’arrêt de l’effort en position debout et se reproduit à l’identique pour une quantité d’effort similaire. Ces caractères distinguent la claudication artérielle de la claudication veineuse (douleur sourde puis constrictive du muscle et ne cèdant pas rapidement à l’arrêt de l’effort mais lentement en position de vidange veineuse allongé ou allongé jambe en l’air), des claudications rhumatologiques (mécaniques apparaissant rapidement et ne concernant pas un groupe musculaire donné), de la claudication neurologique (qui n’est pas une douleur musculaire mais une sensation de faiblesse ou d’engourdissement des membres inférieurs cédant en fléchissant le tronc en avant ou en s’asseyant). Il est très important de demander au patient de montrer du doigt là où il a mal et comment la douleur se calme.
Toutefois le tableau n’est pas toujours aussi simple, il existe des claudications artérielles touchant d’autres territoires que le mollet (fesse, cuisse, muscles de la semelle plantaire et parfois même muscles lombaires) et surtout il existe des douleurs combinées (une sténose de l’iliaque commune ou de l’hypogastrique peut s’exprimer sous forme de coxalgie d’effort, une sténose de la fémorale commune et de la fémorale profonde peut s’exprimer sous forme de gonalgie d’effort, une oblitération de l’aorte sous-rénale peut prendre un masque neurologique).
L’item clef est toujours -déclenché par une certaine quantité d’effort de marche, -cédant rapidement à l’arrêt de l’effort, -se reproduisant à l’identique à la reprise de la marche.Les douleurs de décubitus d’origine artérielle sont assez typiques pour peu que l’on demande au patient de montrer où il a mal et comment il calme la douleur. Elles intéressent d’abord l’avant-pied, les orteils (le patient les décrit volontiers en coiffant l’avant-pied de sa main). Le patient trouve à les calmer en verticalisant plus ou moins sa jambe (à ce degré d’insuffisance artérielle le réflexe vasoconstricteur postural est aboli et la pression hydrostatique augmente la pression de perfusion).
Elles évoluent en 3 degrés :
1-douleurs de primo-décubitus s’estompant en mettant le talon au bord du lit,
2-le patient doit laisser pendre la jambe hors du lit pour trouver le sommeil,
3-le patient est obligé de passer la nuit assis au fauteuil, à ce stade un œdème du pied et de la cheville s’installe.Les limites de ce symptôme sont le seuil individuel de sensibilité à la douleur et l’existence éventuelle d’une neuropathie sensitive (fréquente chez le diabétique, non-rare chez le sujet âgé longiligne) ou d’une neuropathie sensitive induite par l’ischémie.
Au total symptôme très précis mais inconstant.
Les troubles trophiques posent plus de problèmes car il n’est pas facile par la seule clinique d’établir le lien de causalité avec l’artériopathie.
Comme les douleurs de décubitus ischémiques, les ulcérations et gangrènes sont aussi acrales, elles siègent aux orteils et sur les zones de frottement du pied (malléole externe, hallux valgus, quintus varus, toute angulation de déformation d’orteil, tout orteil irrité par un ongle adjacent déformé). Elles sont en général douloureuses, plus ou moins sèches ou plus ou moins humides et nécrotiques ; les gangrènes sèches momifiées ne sont pas douloureuses.
Mais AOMI + Trouble trophique du pied n’est pas ipso facto égal à AOMI stade IV :
--le trouble trophique peut être totalement indépendant de l’AOMI, l’AOMI est contingente
--le trouble trophique peut être le fait d’une lésion emboligène plus ou moins sténosante sur l’arbre artériel du membre inférieur.
--l’insuffisance artérielle peut être modeste mais suffisante pour entraver la cicatrisation d’une plaie quelconque (facteur aggravant mais non causal),
--l’insuffisance artérielle peut être directement responsable du trouble trophique que ce dernier soit accidentel ou de survenue spontanée au stade ultime de l’AOMI.
Il est souvent utile d’avoir recours à des examens comme la mesure de pression digitale et la mesure de pression transcutanée d’oxygène à l’avant-pied pour préciser le lien de causalité.
Ces problèmes de qualification des troubles trophiques et leur impact sur l’évaluation des résultats thérapeutiques ont conduit un groupe d’experts à établir la notion d’ischémie critique chronique de membre inférieur (Circulation 1991).
L’ensemble de ces éléments fait que la classification dite de Leriche et Fontaine de 1952-1954 en 4 stades (I asymptomatique, II claudication intermittente, III douleurs de repos et IV troubles trophiques) n’est plus adaptée aux patients tels que nous les voyons aujourd’hui. En termes hémodynamico-cliniques, il n’y a que deux stades : le stade d’ischémie d’effort (regroupant « stades » I et II) et l’ischémie permanente (regroupant stades III et IV et ischémie critique chronique).
Question 3
L’écho-Doppler complète les données cliniques, quel est son apport le plus important ?
Le Doppler puis l’écho-Doppler ont été un tournant dans le diagnostic et la prise en charge de l’AOMI, on peut juste regretter que ça ait pu conduire chez certains à l’abandon de l’examen clinique et à la multiplication d’actes inutiles.
Il est aussi regrettable qu’en France un examen complémentaire soit coté en tant que tel et non pas en fonction de la complexité de l’examen réalisé. Celui qui passe 5 min à faire un écho-Doppler de débrouillage et celui qui passe 45 min à faire un examen complet détaillé cotent le même acte …
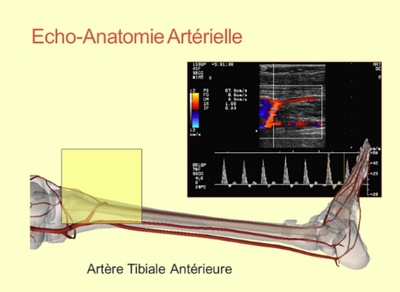 Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.
Un écho-Doppler détaillé avec évaluation directe des lésions étage par étage et analyse des bifurcations-clefs (bifurcation iliaque, bifurcation fémorale, division poplitée), quantification des sténoses les plus significatives, évaluation de la réinjection en cas d’occlusion, évaluation de l’étage iliaque en hyperémie du membre inférieur, évaluation du lit d’aval et mesure de pression distale … est aussi précis qu’une artériographie voire plus.Mais faire le même examen pour tout le monde n’est pas logique. Il faut distinguer l’examen de 1ère intention qui peut être très simplifié s’il s’agit simplement de répondre à la question « ACOMI ? oui/non », le premier examen définissant la stratégie qui doit être assez complet, l’examen de surveillance qui peut se focaliser sur les points essentiels (par ex. surveillance post-opératoire), l’examen pré-opératoire qui doit pouvoir se confronter à l’artériographie ou être le seul examen décisionnel pré-opératoire.
Quelle que soit l’étendue de l’examen il doit toujours comprendre une mesure de pression distale, indice de pression systolique à la cheville et mesure de pression digitale (au moins chez les patients à haute probabilité de médiacalcose jambière : diabétique, insuffisant rénal chronique, âge > 75 ans).
Deux autres points sont à mettre à l’actif de l’écho-Doppler
--parfois on est surpris du peu de lésions athéromateuses sur l’arbre artériel et il faut savoir se poser la question d’une artériopathie non-athéromateuse (artérite inflammatoire, dysplasie fibro-musculaire, compression, …) ou d’une thrombophilie en cas d’accident aigu.
--l’écho-Doppler est probablement le meilleur examen pour le diagnostic d’artériomégalie et de dystrophie polyanévrysmale qui sont des variétés assez sévères d’artériopathie des M.I.
Question 4
Plutôt que faire des angioscanners en cas d’AOMI, ne vaudrait-il pas mieux réaliser une angiographie diagnostique et thérapeutique du côté du membre atteint ?
FB. Je ne comprends pas très bien ta question. Il y a 25-30 ans que l’on a démontré qu’un examen écho-Doppler méthodique complet avec un compte-rendu précis fait aussi bien qu’une angiographie (et il s’agissait à l’époque d’artériographie intra-artérielle numérisée), le test de Skinner-Strandness (1967) est très utile dans l’évaluation des claudications douteuses, les appareils écho-Doppler actuels permettent une évaluation très précise des artères de jambe et du pied dans l’ischémie critique. Je crois que sauf question très précise à laquelle on n’a pas pu répondre en écho-Doppler et en exploration fonctionnelle, il n’y a en règle pas de place pour l’angiographie de 1ère intention quelle qu’elle soit.
Si telle est ta question, je ne comprends pas l’utilisation l’angio-scanner ou de l’angio-IRM en 1ère intention, je ne comprends pas ces angio-CT/angio-IRM réalisés de façon systématique « pour vérifier un écho-Doppler », je ne comprends pas les angio-CT/angio-IRM réalisées alors que l’indication thérapeutique est clairement d’ordre médical.
A mon sens dans la très très grande majorité des cas l’angiographie est un examen à titre préopératoire et lorsque l’indication est celle d’une angioplastie ça peut être le 1er temps de l’intervention.
Le manque d’argent en Médecine est un fait et une rengaine, mais si on commençait par supprimer tout ce qui ne sert à rien, tous les actes diagnostiques et thérapeutiques inutiles, et on comblerait une partie du manque.
Question 5
Le traitement médical de l’AOMI est très important après la correction des FDRCV, l’activité physique. Quelles sont les molécules à privilégier ?
De plus quelle est la place de l’association rivaroxaban 2.5 mg X 2 plus aspirine 100 mg et la place de la double anti agrégation plaquettaire ?FB. Je ne dirai pas les choses tout à fait comme ça.
Le traitement de l’ACOMI est celui de la prévention cardio-vasculaire, primo-secondaire si le patient est asymptomatique, secondaire si le patient est symptomatique. Mais ce distinguo est ici à mon sens de peu d’intérêt, voire flou, car comme déjà dit le risque CV est inversement proportionnel à l’IPSch que le patient soit symptomatique ou symptomatique. Comme discuté à la question 2, considéré comme asymptomatique un patient sédentaire avec un IPSch à 0.50 et partant ne pas lui prescrire d’antiagrégant selon certaines recommandations n’est pas logique.
L’arrêt du tabagisme est peut-être plus fondamental encore que pour les autres localisations d’athérosclérose.
L’entrainement à la marche pour le claudicant c’est un peu plus que les « au moins 30 min de marche ou autre activité physique par jour » recommandés en prévention CV.
Au plan médicamenteux, le traitement comprend au moins un antiagrégant plaquettaire (aspirine à 75 mg/100 mg/j. ou clopidogrel 75 mg. Le clopidogrel est peut-être préférable tant que le tabagisme n’est pas stoppé, le ticagrelor n’est pas supérieur au clopidogrel) et une statine (en allant progressivement à la dose optimale, en étant d’autant plus exigeant sur le seuil de LDLc que l’IPSch est plus bas). A cela s’ajoute le traitement d’une HTA ou d’un diabète si présent(s) en ciblant la normalité. De même si une dyslipidémie n’est pas suffisamment corrigée par le régime et les statines, l’adjonction d’une nouvelle classe de normolipémiant se discute (ézétimibe, anti-PCSK9)
L’adjonction systématique d’un IEC est recommandée mais ne fait pas l’unanimité.
Quant à la double anti-agrégation plaquettaire ou à l’association AAP-AOD vs monothérapie classique les résultats des essais randomisés peuvent se résumer ainsi : double AAP ou AAP-AOD plus efficace mais plus d’accident hémorragique (assez logique). La question tourne donc autour de la balance bénéfice-risque, pour qui ou quand ? Pour qui ?, logiquement les patients à très haut risque d’accident thrombotique. Quand ? : pour couvrir une période à haut risque, en général post-procédure ou au décours d’un accident thrombotique.
Mais les résultats de l’étude COMPASS à laquelle tu fais allusion vont probablement faire évoluer les pratiques avec extension des indications de l’association aspirine-AOD (dans COMPASS aspirine 100 mg et rivaroxaban 2.5 mg x 2). Personnellement je suis assez nuancé, association Aspirine-AOD pour un patient restant à haut risque malgré un TMO basique bien appliqué oui, Aspirine-AOD ou double antiagrégation plaquettaire chez un sédentaire qui continue à fumer son paquet de cigarettes, non (n’oublions pas que le tabac est aussi facteur d’AVC hémorragique).
Question 6
Comme synthétiser les problèmes de l’AOMI ?
FB. Je crois que l’on n’a jamais fait plus synthétique que E. Housley auquel l’éditeur du BMJ demandait « un article bref, clair, précis sur le traitement du patient-ACOMI claudicant destiné aux MG, pas plus de 800 mots ! » Housley commence son article en disant qu’il a été tenté de répondre « je peux le faire en 5 mots : stop smoking and keep walking »(BMJ may 1988).
 En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!
En 2021 cet adage reste princeps, la poursuite du tabagisme et la sédentarité plombent tout traitement du patient-ACOMI !!Le traitement de fond du patient-ACOMI est le traitement médical optimal de la prévention cardio-vasculaire globale (prévention primo-secondaire et secondaire)
La reconstruction artérielle (angioplastie, chirurgie) est un traitement de seconde intention chez le claudicant (claudication invalidante et restant invalidante après un traitement médical optimal de 3 mois bien conduit) et de première intention chez le patient en ischémie permanente (mais le TMO reprend sa place dès cette phase critique passée).
J’ajouterai qu’il faut arrêter de limiter l’ACOMI au mâle claudicant ou avec gangrène du pied,
il faut être conscient que
- à même niveau d’index de pression systolique à la cheville le risque CV est similaire chez le patient-ACOMI asymptomatique et chez le symptomatique.
- l’ACOMI diagnostiquée par IPSch est aussi fréquente chez la femme que chez l’homme.
Abréviations
ACOMI : artériopathie chronique oblitérante des membres inférieurs d’origine athéromateuse
CV : cardiovasculaire
IPSch : index de pression systolique à la cheville
TMO : traitement médical optimal
Références.
Polonsky T.S., McDermott M.M. Lower extremity peripheral artery disease without chronic limb-threatening ischemia. A Review. JAMA. 2021;325(21):2188-2198.
Aday A.W., Matsushita K. Epidemiology of peripheral artery disease and polyvascular Disease. Circulation Research. 2021;128:1818–1832.
Becker F., Robert-Ebadi H. Diagnostic clinique de l’ischémie critique chronique de membre inférieur. Rev Med Suisse 2013 ; 9 : 302-5
Becker F., Robert-Ebadi H., Ricco J.B. et al. Chapter I: Definitions, Epidemiology, Clinical Presentation and Prognosis. European Journal of Vascular and Endovascular Surgery (2011) 42(S2), S4–S12
HAS. Prise en charge de l’artériopathie chronique oblitérante athéroscléreuse des membres inférieurs. RPC. Avril 2006
Becker F. Histoire de la claudication intermittente d’origine artérielle, Syndrome de Bouley-Charcot. J Mal Vasc2005, 30, 2, 114-117
Second European Consensus Document on Chronic Critical Leg Ischemia. Circulation 1991 ; 84(4) suppl Nov
Becker F. Classification clinique et hémodynamique des artériopathies chroniques oblitérantes des membres inférieurs. Thèse d’Université 1989.
F. Becker 16/07/21

Merci François pour ce tour d'horizon sur l'AOMI qui est clair, complet, didactique , tout simplement parfait. Tout cela a le mérite de ne pas oublier les fondamentaux en médecine vasculaire comme en médecine en général. La clinique "primum movens" que rien ne remplace et ne remplacera jamais.
-
Une petite Histoire de l' AOMI (avant 1990)
 iconographie : François Becker
iconographie : François Becker
"Les choses en médecine ne se mesurent et ne se considèrent que par leurs sens et effets. "Ambroise Paré
"Savoir s'étonner à propos est le premier pas fait sur la route de la découverte." Louis Pasteur
"Les erreurs sont les portes de la découverte." James Joyce
"Je crois que la force de la Médecine Vasculaire en pathologie artérielle c’est le mariage de la Clinique, de l’imagerie et de l’hémodynamique, et les corrélations anatomo-hémodynamico-cliniques." François Becker
Ces articles sont à l'origine de la fondation des connaissances sur l'AOMI, notamment la mesure de l'index de pression à la cheville, le fameux IPS a 54 ans et toujours à l'ordre du jour. mais aussi de la notion d'ischémie d'effort et permanente.Plusieurs milliards de millards de mesure de l'IPS en 54 ans !
On doit considérer aujourd'hui :Septembre 2022 : #septembremoisarteriopathieARTICLE 1 : 1968
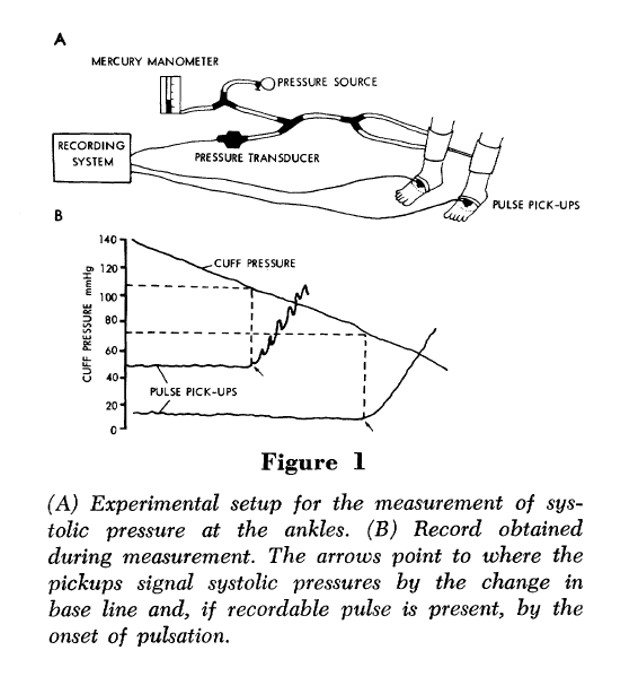
Indirect Systolic Pressures and Pulse Waves in Arterial Occlusive Disease of the Lower Extremities By STEFAN A. CARTER, M.D.Circulation, Volume XXXVII, April 1968
 L'effet Doppler a été vérifié expérimentalement près d'Utrecht en 1845.
L'effet Doppler a été vérifié expérimentalement près d'Utrecht en 1845.
ARTICLE 2 : 1969
ANKLE SYSTOLIC PRESSURE MEASUREMENTS INARTERIAL DISEASE AFFECTING THE LOWER EXTREMITIESBY S. T. YAO, J. T. HOBBS, AND W. T. IRVINEBLOOD FLOW LARORATORY, SURGICAL UNIT, ST. MARY’S HOSPITAL, LONDON, BRIT. J. SURG., 1969, Vol. 56, No. 9, SEPTEMBER ARTICLE 3 : 1968
ARTICLE 3 : 1968
 Echelle de gravité des altérations vélocimétriques selon DESCOTES J; CATHIGNOL D
Echelle de gravité des altérations vélocimétriques selon DESCOTES J; CATHIGNOL D
HOP. EDOUARD-HERRIOT, F69374 LYON CEDEX 2
in NOUV. PRESSE MED.; FR.; DA. 1975; VOL. 4; NO 29; PP. 2091-2093; ABS. ANGLPresse Médicale 1975, modifiée par F Becker.de plus Pratique du Doppler Ed EUROMED 1982, M Dauzat, JP Laroche, JM de Bray, F Becker et L Jonnart ARTICLES 4Becker F, Brenot R, David M. Artériopathie oblitérante des membres inférieurs. Analyse critique de la classification de Leriche et Fontaine. STV (1990)
ARTICLES 4Becker F, Brenot R, David M. Artériopathie oblitérante des membres inférieurs. Analyse critique de la classification de Leriche et Fontaine. STV (1990)
Ces auteurs remettent en question la classification de Leriche et Fontaire en proposant pour la première fois l'ISCHEMIE d'effort et l'ISHEMIE permanente
Cette classification a été consacrée en 2006 (HAS, recommandations AOMI, (https://www.has-sante.fr/upload/docs/application/pdf/AOMI_recos.pdf) et au préalable dans la Thèse d’Université de F.Becker 1989
Commentaires de François Becker in LMV N° 2, 2001 sur l'IPS
L’IPSch naît en 1968 avec la publication des travaux de Carter . A l’époque, ces examens étaient faits en exploration fonctionnelle vasculaire en physiologie. Les mesures de pression distale (cheville, orteil) utilisaient la pléthysmographie avec occlusion veineuse indirecte, outil de base pour les mesures de volume et de pression en physiologie clinique. Le capteur de signal (jauge de mercure) est placé à l’orteil ; la manchette est placée à la cheville pour la mesure de pression à la cheville, et au niveau de la première phalange de l’orteil pour la mesure de pression à l’orteil. La méthode est parfaitement standardisée, on n’a pas à choisir une artère sur laquelle mesurer la pression.
Peu après, le « Doppler » apparaît sur le marché avec le fameux boîtier Parks et sa sonde 10 MHz (résistante à tous les chocs …). Yao (chirurgien vasculaire) perçoit immédiatement l’intérêt de cet outil pour la consultation et donne son essor à l’IPSch en simplifiant la mesure de pression à la cheville
Ces deux auteurs montraient ainsi qu’il y a un gradient de pression de la racine d’un membre à son extrémité, que la pression est normalement un peu plus élevée au membre inférieur (M.Inf.) qu’au membre supérieur (M.Sup.), que les occlusions artérielles significatives induisent d’abord une perte de charge systolique (puis une perte de charge diastolique), que la mesure de la pression au M.Inf. est aussi sensible qu’un test d’hyperémie réactionnelle (test de référence de l’époque) et qu’elle peut être réalisée en clinique avec un appareillage simplifié. Yao montrait par ailleurs dans son travail princeps de 1970 que la valeur moyenne de l’IPSch décroît comme la sévérité de l’AOMI augmente.
Tout était dit ou presque en 1970, il restait aux épidémiologistes à s’emparer de l’outil IPSch et à montrer que la prévalence de l’AOMI est considérablement plus élevée que ne le laissait penser l’item claudication intermittente, puis à introduire la stratification du risque cardio-vasculaire avec une place majeure pour l’IPSch.
La question récurrente depuis l’abandon de la mesure pléthysmographique au profit de la mesure doppler est sur quelle(s) artère(s) faut-il mesurer la pression à la cheville ? Une façon d’y répondre est de revenir aux origines et de distinguer mesure de pressions et mesure d’IPSch dans le cadre de la consultation de tous les jours (examen de niveau 1 en première consultation, en examen de dépistage, en suivi normal), et dans le cadre d’un examen spécialisé avec bilan hémodynamique précis (examen de niveau 2 ou 3).
On peut espérer qu’avec la place de premier plan prise par cet index dans le diagnostic d’AOMI et la gestion des patients à risque cardio-vasculaire, des outils spécifiques et/ou revenant au principe de la mesure globale (en laser-doppler par exemple, plus sensible que la jauge de mercure qui a quasi disparu, plus précis que la photopléthymographie AC) seront bientôt disponibles.....
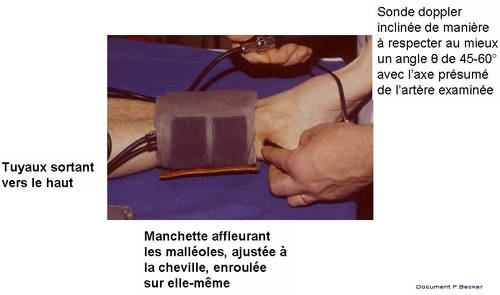
Règles de bases, quelque soit le mode de mesure:Ces règles sont pour l’essentiel communes à toutes les mesures de pressions artérielles.
- Le patient est allongé en décubitus au repos depuis une 10aine de minutes. Il est de bonne pratique de veiller à la chaleur des pieds (la vasoconstriction cutanée est source d’erreur de mesure). Ce temps peut être mis à profit pour l’anamnèse, la palpation et l’auscultation des trajets artériels.
- La pression est mesurée là ou est placée la manchette et non là où est placé le capteur (avec une manchette placée à mi-mollet et une sonde doppler placée sur la pédieuse, on mesure la pression à mi-mollet !). A la cheville, le bord distal de la manchette doit affleurer les malléoles.
- La largeur de la manchette doit être de 1.2 à 1.5 fois le diamètre du segment de membre (bras, cheville) sur lequel elle s’applique. La poche pneumatique doit couvrir la ou les artères où la pression est mesurée.
- La manchette doit y être ajustée (1 travers de doigt maximum entre la manchette et la peau), enroulée aussi parfaitement que possible sur elle-même (meilleure reproductibilité)
- Le même manomètre est utilisé pour la mesure au bras et à la cheville (de manière à ne pas sommer les erreurs de mesure liées au manomètre).
- Il est recommandé de commencer l’examen par la palpation des pouls (à la cheville et au poignet) et l’auscultation des creux sus-claviers de manière à suspecter une sténose sous-clavière. Si on ne prend la pression brachiale que d’un coté, choisir le membre supérieur droit (la grande majorité des sténoses sous-clavières intéresse la sous-clavière gauche).
- L’examinateur se place correctement face au manomètre de façon à éviter l’erreur de parallaxe
- Il est recommandé de mesurer d’abord la pression au bras au stéthoscope (TAS/TAD) et au doppler (PAS), de manière à avoir une idée de la pression normale à la cheville.
- La manchette doit être gonflée rapidement au-delà de la pression systolique présumée et dégonflée lentement jusqu’à réapparition du signal. La pression est mesurée à la réapparition du signal et non la pression de disparition du signal.
Références historiques
- Becker F. Histoire de la claudication intermittente d’origine artérielle, Syndrome de Bouley-Charcot. J Mal Vasc2005 ; 30(2) : 114-7
- Naumann M. Der Blutdruck in der arteria dorsalis pedis in der norm und bei kreislaufstörungen. Z Kreislaufforsch 1933; 31: 513
- Winsor T. Influence of arterial disease on the systolic blood pressure gradients of the extremity. Am J Med Sci 1950; 220 (2): 117
- Gaskel P. Rate of blood flow in the foot and calf before and after reconstruction by arterial grafting of an occlude main artery of the lower limb. Clin Sci 1956; 15: 259
- Strandness D.E., Radke H.M., Bell J.W. Use of a new simplified plethysmograp in the clinical evaluation of patients with arteriosclerosis obliterans. Surg Gyn Obstet 1961; 112: 751
- Carter S.A. Indirect systolic pressures and pulse waves in arterial occlusive disease of the lower extremities. Circulation 1968; 37: 624-38
- Yao S.T., Hobbs J.T., Irvine W.T. Ankle systolic pressure measurements in arterial disease affecting the lower extremities. Br J Surg 1969; 56(9): 676-9.
- Yao S.T. Haemodynamic studies in peripheral arterial disease. Br J Surg 1970; 57(10): 761-6
La mesure de l'IPS est un geste quotidien, il peut être délégué. Il est indispensable dans l'AOMI symptomatique, mais il a sa place aussi dans le dépistage de l'AOMI asymptomatique, dans une population choisie selon les FDRCV . Un compte rendu écho-Doppler dans le contexte de l'AOMI sans mesure de l'IPS est une faute médicale. La mesure de l'IPS au Doppler Continu reste la référence, encore aujourd'hui. Les mesures automatisées n'ont pas encore atteint la perfection en cas d'AOMI symptomatique mais elles sont sur la bonne voie. Par contre pour le dépistage c'est la méthode idéale et délégable.
Les régles que l'on applique aujourd'hui ,notamment l'IPS et une nouvelle approche de la classification de Leriche et Fontaine ont plus de 30 ans , voire 54 ans pour l'IPS ! Comme quoi l'histoire reste une référence inaliénable, elle est en médecine un socle indstructible.
A RELIRE

