McBane RD 2nd, Loprinzi CL, Ashrani A, Lenz CJ, Houghton D, Zemla T, Le-Rademacher JG, Wysokinski WE. Extending venous thromboembolism secondary prevention with apixaban in cancer patients: The EVE trial.
Extension de la prévention secondaire de la thromboembolie veineuse avec l'apixaban chez les patients cancéreux : l'essai EVE
Eur J Haematol. 2020 Feb;104(2):88-96. doi: 10.1111/ejh.13338. Epub 2019 Nov 11. PMID: 31606897.https://www.sciencedirect.com/science/article/pii/S1538783624001697#fig4
Article libre d'accès
Contexte
Les recommandations des lignes directrices sur la prise en charge de la thromboembolie veineuse (MTEV) associée au cancer incluent la poursuite de l'anticoagulation thérapeutique tant que le cancer actif persiste. L'étiquette de la Federal Drug Administration pour l'apixaban pour la prévention secondaire de la MTEV comprend une réduction de la dose à 2,5 mg deux fois par jour après 6 mois de traitement.
Objectifs
Le but de l'étude était de déterminer si cette réduction de dose est recommandée pour la MTEV associée au cancer.
Méthodes
Un essai randomisé en double aveugle a comparé l'apixaban 2,5 mg à 5 mg deux fois par jour pendant 12 mois chez des patients cancéreux atteints de TEV qui avaient suivi un traitement anticoagulant de 6 à 12 mois. Le critère de jugement principal était la combinaison d’hémorragies majeures et d’hémorragies non majeures cliniquement pertinentes.
Résultats
Sur 370 patients recrutés, 360 ont été inclus dans les analyses en intention de traiter. Des hémorragies majeures et non majeures cliniquement significatives sont survenues chez 16 des 179 patients (8,9 %) du groupe apixaban 2,5 mg, contre 22 des 181 patients (12,2 %) du groupe 5 mg (rapport de risque [HR], 0,72 ; IC à 95 %, 0,38-1,37 ; P = 0,39). Des saignements majeurs sont survenus chez 2,8 % du groupe apixaban 2,5 mg et chez 2,2 % du groupe 5 mg (HR : 1,26 ; IC à 95 % : 0,34-4,66 ; P = 0,73). Une TEV récurrente ou une thrombose artérielle est survenue chez 9 des 179 patients (5,0 %) du groupe apixaban 2,5 mg et 9 des 181 patients (5,0 %) du groupe 5 mg (HR : 1,0 ; IC à 95 % : 0,40-2,53 ; P = 1h00). Les taux de mortalité toutes causes confondues étaient similaires entre les groupes, 13 % contre 12 % (HR : 1,14 ; IC à 95 %, 0,63-2,04 ; P = 0,67).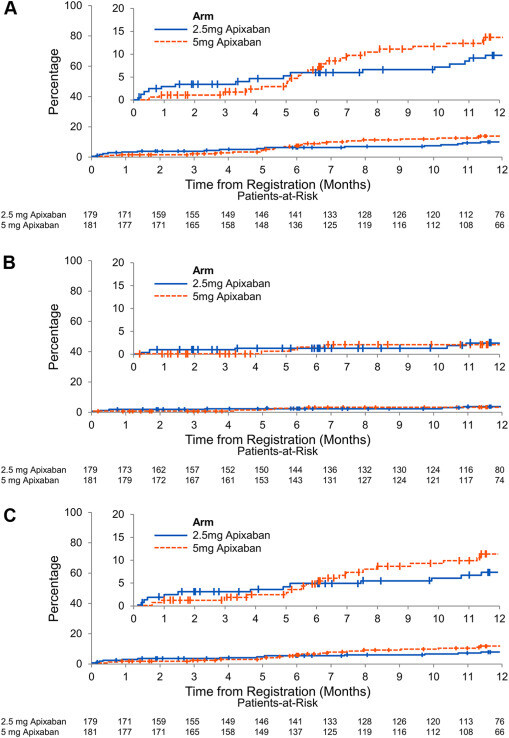
Résultats des saignements. Le principal critère de jugement en matière de sécurité était l'incidence cumulée des hémorragies majeures et des hémorragies non majeures cliniquement pertinentes (A). Aucune différence dans les résultats hémorragiques combinés comparant l'apixaban 2,5 mg deux fois par jour (ligne continue bleue) à l'apixaban 5 mg deux fois par jour (ligne pointillée rouge) n'a été identifiée. Aucune différence en termes d'hémorragie majeure (B) ou d'hémorragie non majeure (C) cliniquement significative à 12 mois n'a été observée entre les groupes de traitement. Les encarts du panneau affichent les mêmes données sur un axe Y développé.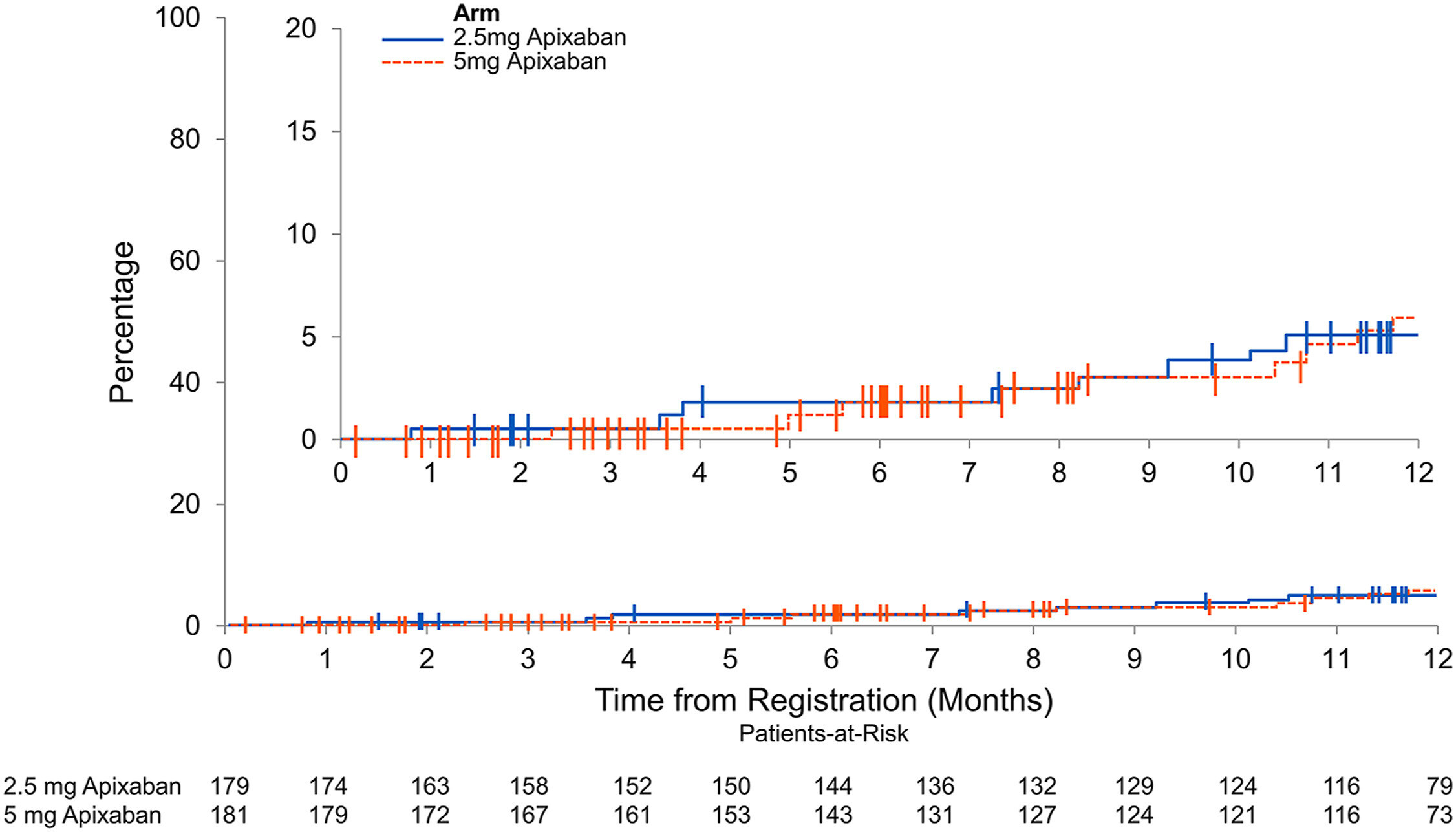
Résultats de la thromboembolie. Les critères d’efficacité incluaient la récidive de thromboembolie veineuse ou la thrombose artérielle. Il n'y avait aucune différence dans la récurrence combinée de la thrombose veineuse et de la thrombose artérielle en comparant l'apixaban 2,5 mg deux fois par jour (ligne continue bleue) à l'apixaban 5 mg deux fois par jour (ligne pointillée rouge). Les encarts du panneau affichent les mêmes données sur un axe Y développé.
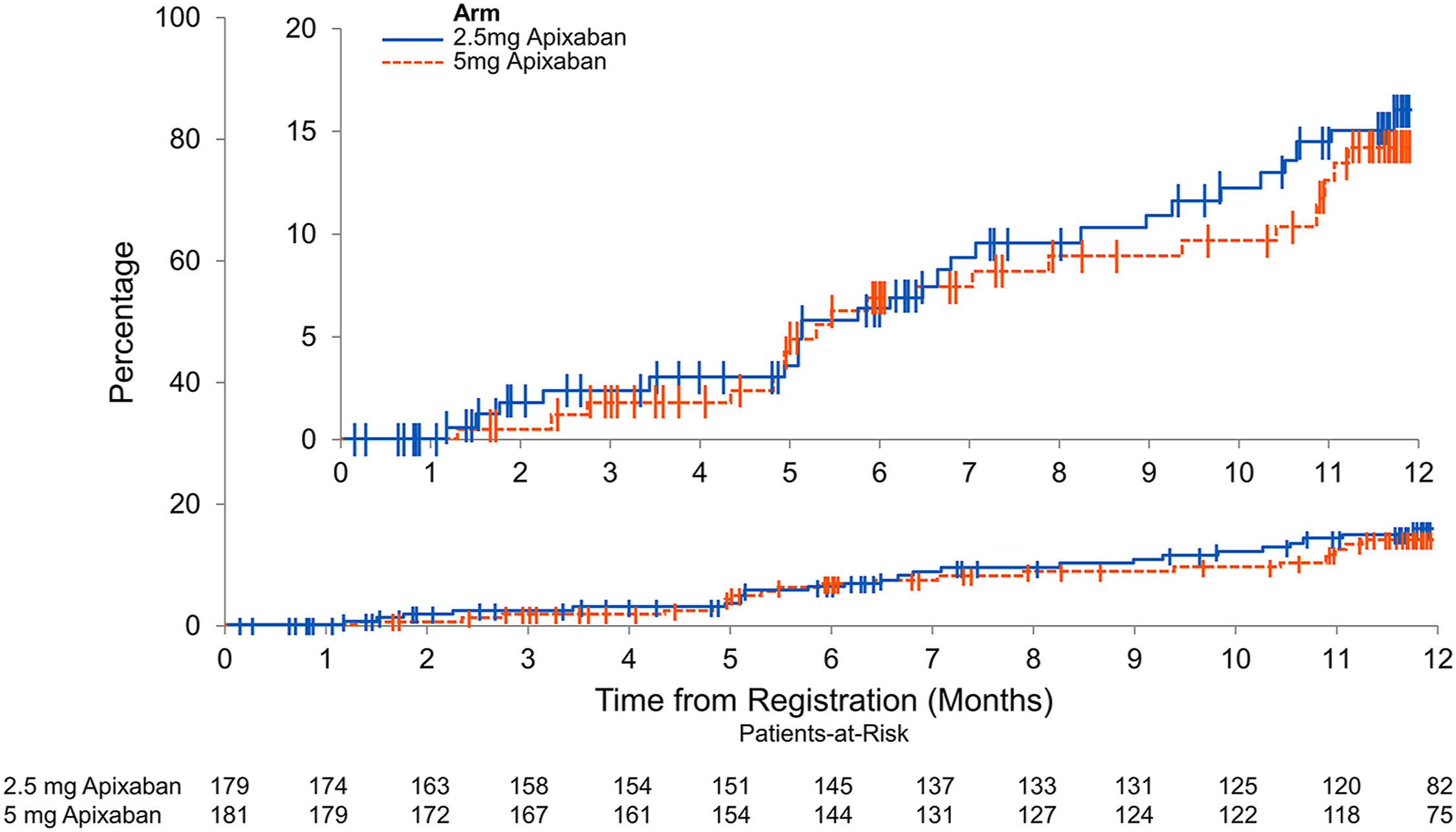
Mortalité toutes causes confondues. La mortalité toutes causes confondues était similaire dans les deux groupes de traitement : apixaban 2,5 mg deux fois par jour (ligne continue bleue) versus apixaban 5 mg deux fois par jour (ligne pointillée rouge). Les encarts du panneau affichent les mêmes données sur un axe Y développé
"Des saignements majeurs sont survenus chez 5 patients recevant 2,5 mg d'apixaban (2,8 %) et 4 patients recevant 5 mg d'apixaban (2,2 %) ( Figure 2 B). L'incidence cumulée estimée des hémorragies majeures à 12 mois était de 3 % pour le groupe 2,5 mg et de 2,4 % pour le groupe 5 mg (HR : 1,26 ; IC à 95 % : 0,34-4,66 ; P = 0,73). Les sites d'hémorragie majeure étaient gastro-intestinaux ( n = 4), génito-urinaires ( n = 2) et intracrâniens ( n = 3) ( Tableau 2 ). Aucun événement hémorragique mortel n’est survenu dans les deux groupes. Pour tous les patients présentant des hémorragies gastro-intestinales, le site principal de la tumeur était gastro-intestinal. Pour les 3 patients présentant une hémorragie intracrânienne, les sites tumoraux étaient le sein, le tractus gastro-intestinal et le poumon. Des hémorragies génito-urinaires sont survenues chez des patients présentant une tumeur maligne hématologique et gynécologique ( n = 1 chacun)."
En conclusion, dans cette étude de prévention secondaire de la TEV associée au cancer, le traitement par apixaban 2,5 mg deux fois par jour n'a pas réduit significativement le taux d'événements hémorragiques combinés par rapport à 5 mg deux fois par jour. De plus, nous n'avons pas trouvé de différences significatives dans les résultats thrombotiques chez les patients recevant 2,5 mg d'apixaban deux fois par jour par rapport à 5 mg deux fois par jour. Ces résultats sont similaires à ceux de l'essai AMPLIFY-EXT de prévention secondaire chez des patients principalement non cancéreux. Une recommandation universelle d'adopter cette réduction de dose à l'apixaban 2,5 mg pour tous les patients atteints de cancer semble imprudente à l'heure actuelle. Davantage de données sont nécessaires pour déterminer si un choix posologique plus nuancé peut être bénéfique en fonction des variables cliniques spécifiques au cancer et au patient.
Pour la prévention secondaire de la MTEV associée au cancer, l'apixaban 2,5 mg par rapport à 5 mg deux fois par jour n'a pas réduit les événements hémorragiques combinés (essai EVE NCT03080883)
Commentaire
EVE trial est une " très petite APICAT" dont nous attendons les résultats , fin 2024 ou début 2025 (Isabelle Mahé) 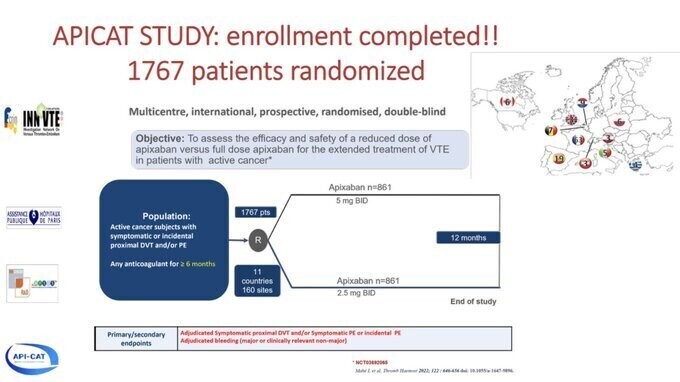

Le nombre de patients inclus et le suivi vont-ils renforcer les résultats de EVE trial ou alors aller dans un autre sens plus positif
Ce qui est sûr la durée de vie des patients ne sera pas modifié , on espère que l'efficacité de l'Apixaban 2,5 mg X 2 sera là, reste les hémorragies, attendons sereinement la publication des résultats.
Ce que l'on espère et que l'on souhaite
Existe t il une spécificité du type de cancer et sa localisation sur l'effet de l'AOD full/dose et Low dose
Existe t il une différence sur le type de la MTEV et l'anticoagulation : EP, EP +TVP, TVPD distale, TVP proximale, TVP dans un site inhabituel et enfin TVS
Le portait type des patients qui nécessitent un AOD full dose ou un AOD Low dose après le traitement initial
Le rôle de l'insuffisance rénale
Les rôles des traitements du cancer
Le risque hémorragique pour quel cancer et avec quelle dose d'Apixaban
Déjà, on doit féliciter Isabelle Mahé et toutes et tous les investigateurs d'avoir mené à bien APICAT
De plus nous attendons les résultats de RENOVE hors cancer (Francis Couturaud)
Quoi qu'il en soit pour l'instant, PAS d'AOD LOW DOSE en cas de MTEV au cous du CANCER, ne pas anticiper les résultats dont on ne connait rien, wait and see !

