L'intelligence artificielle en pharmacothérapie cardiovasculaire : applications et perspectives
Eur Heart J. 2025 Jul 15:ehaf474. doi: 10.1093/eurheartj/ehaf474. Epub ahead of print. PMID: 40662528.https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehaf474/8202687?login=false
Article libre d'accès
Les progrès récents de l'intelligence artificielle (IA) ont démontré un potentiel considérable pour améliorer la pharmacothérapie cardiovasculaire en optimisant la sélection des médicaments, en prédisant l'efficacité thérapeutique et les effets indésirables, et, in fine, en améliorant les résultats pour les patients.
S'appuyant sur des techniques telles que l'apprentissage automatique et la modélisation in silico, l'IA peut identifier les populations susceptibles de bénéficier de traitements spécifiques, accélérer la découverte de nouveaux médicaments et réduire les coûts.
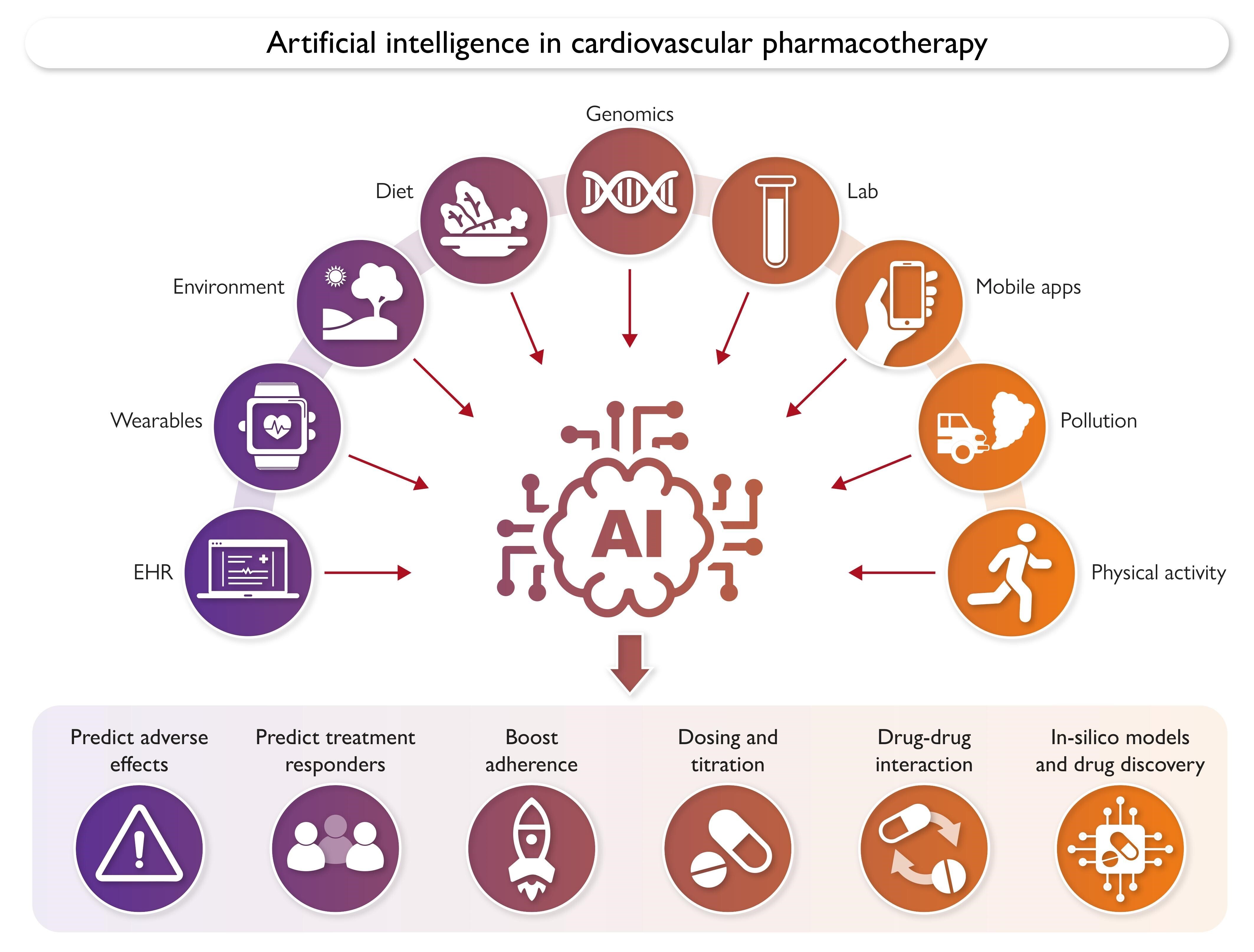
Données sources et applications potentielles de l'intelligence artificielle en pharmacothérapie cardiovasculaire. DSE, dossiers de santé électroniques.
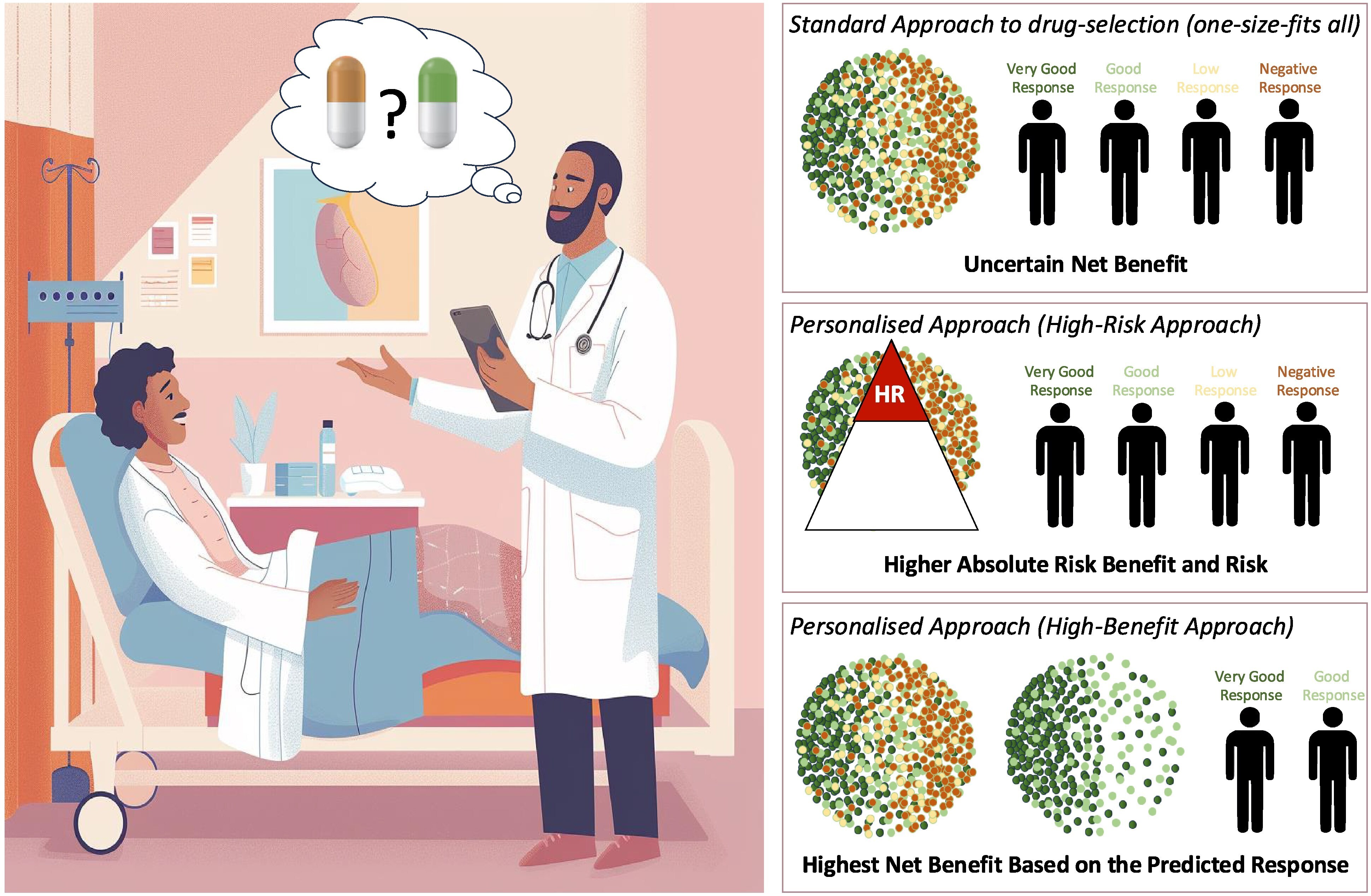
Potentiel de l’intelligence artificielle pour éclairer la prise de décision en matière de traitement en vue de la personnalisation du traitement.
Intelligence artificielle pour les modèles in silico et la découverte de médicaments
Le processus de découverte de médicaments est très coûteux et prend du temps ; les estimations actuelles suggèrent que la mise sur le marché d'une nouvelle molécule nécessite environ un milliard de dollars de financement et plus de 10 ans de travail.
L'IA a un grand potentiel pour rationaliser ce processus, offrant des gains d'efficacité qui réduisent les délais et les coûts associés, à la fois au stade préclinique en renforçant les modèles in silico , et au stade clinique en améliorant la conception et l'exécution des essais cliniques ( Figure 2, ci dessus) ). Classiquement, les modèles in silico ont été utilisés pour le réemploi de médicaments, l'amarrage protéine-protéine, la conception de protéines de novo , ou la prédiction d'événements indésirables, entre autres. Les nouvelles itérations basées sur l'IA permettent une découverte et un développement de médicaments plus rapides et plus précis. Les forêts aléatoires ont été utilisées pour identifier les composés clés et les composés phares, illustrés par les modèles QSAR. De plus, la synthèse de composés phares est améliorée grâce aux algorithmes de rétrosynthèse NN. Français Ces algorithmes, combinés à des arbres de meilleures chances et à l'entrée de vastes quantités de données et de règles accumulées, peuvent générer des voies de synthèse avec une précision de > 90 Plus récemment, l'utilisation de DNN joue un rôle crucial dans l'optimisation de la structure et des propriétés des médicaments, aidant à la prédiction de la structure 3D des protéines ciblées et à la compréhension des interactions protéine-ligand. Par exemple, la nouvelle version d'AlphaFold, un modèle d'IA développé par DeepMind de Google qui prédit les propriétés de repliement des protéines de renom, a démontré une précision significativement plus grande dans la modélisation des interactions protéine-ligand, protéine-acide nucléique et anticorps-antigène par rapport aux outils de pointe actuels. 1Plus récemment, la même société a lancé AlphaProteo, un modèle établi sur DNN capable de concevoir des protéines totalement nouvelles à partir de zéro en fonction des cibles de liaison souhaitées. Ces outils nouveaux et révolutionnaires établis sur des cadres DL ont le potentiel de révolutionner la découverte future de médicaments.

Intelligence artificielle pour les modèles in silico et la découverte de médicaments
Le processus de découverte de médicaments est très coûteux et prend du temps ; les estimations actuelles suggèrent que la mise sur le marché d'une nouvelle molécule nécessite environ un milliard de dollars de financement et plus de 10 ans de travail.
L'IA a un grand potentiel pour rationaliser ce processus, offrant des gains d'efficacité qui réduisent les délais et les coûts associés, à la fois au stade préclinique en renforçant les modèles in silico , et au stade clinique en améliorant la conception et l'exécution des essais cliniques ( Figure ci dessous ). Classiquement, les modèles in silico ont été utilisés pour le réemploi de médicaments, l'amarrage protéine-protéine, la conception de protéines de novo, ou la prédiction d'événements indésirables, entre autres. Les nouvelles itérations basées sur l'IA permettent une découverte et un développement de médicaments plus rapides et plus précis. Les forêts aléatoires ont été utilisées pour identifier les composés clés et les composés phares, illustrés par les modèles QSAR. De plus, la synthèse de composés phares est améliorée grâce aux algorithmes de rétrosynthèse NN. Français Ces algorithmes, combinés à des arbres de meilleures chances et à l'entrée de vastes quantités de données et de règles accumulées, peuvent générer des voies de synthèse avec une précision de > 90 %. 102 Plus récemment, l'utilisation de DNN joue un rôle crucial dans l'optimisation de la structure et des propriétés des médicaments aidant à la prédiction de la structure 3D des protéines ciblées et à la compréhension des interactions protéine-ligand. 104 Par exemple, la nouvelle version d'AlphaFold, un modèle d'IA développé par DeepMind de Google qui prédit les propriétés de repliement des protéines de renom, a démontré une précision significativement plus grande dans la modélisation des interactions protéine-ligand, protéine-acide nucléique et anticorps-antigène par rapport aux outils de pointe actuels. Plus récemment, la même société a lancé AlphaProteo, un modèle établi sur DNN capable de concevoir des protéines totalement nouvelles à partir de zéro en fonction des cibles de liaison souhaitées. Ces outils nouveaux et révolutionnaires établis sur des cadres DL ont le potentiel de révolutionner la découverte future de médicaments.
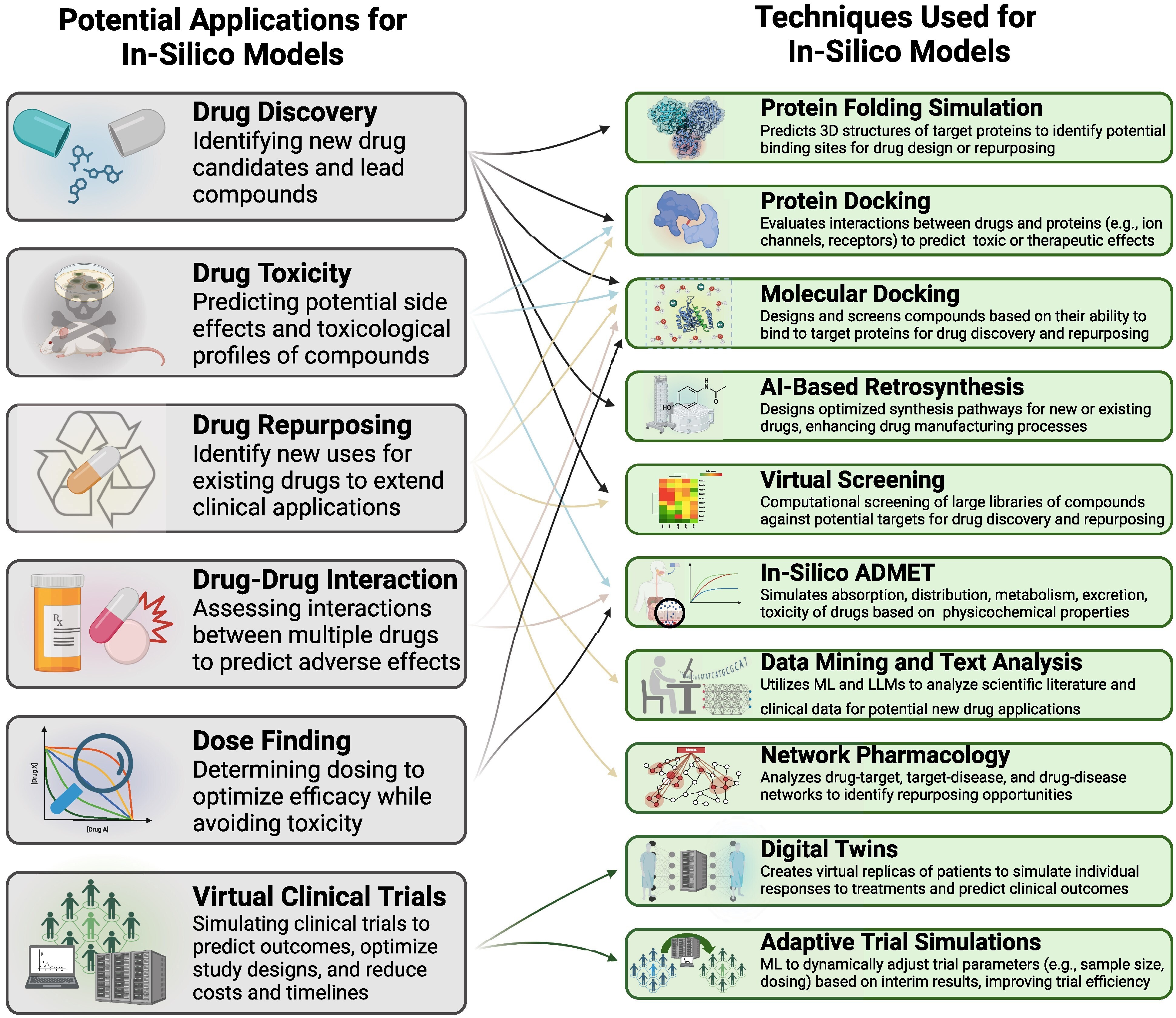
Applications potentielles et techniques utilisées pour les modèles in silico en pharmacothérapie cardiovasculaire. LLM, Large Language Model ; ML, apprentissage automatique.
Un exemple : la THROMBOSE.
Le traitement anticoagulant présente des défis constants dans la pratique médicale, ce qui incite au développement de nombreux modèles de prédiction clinique visant à améliorer l'observance du traitement, à prévenir les événements indésirables et à optimiser la dose d'entretien. Choi et al . ont entraîné plusieurs modèles d'apprentissage automatique pour prédire les doses de warfarine à la sortie à l'aide de données cliniques extraites du DSE au cours des deux premiers jours d'hospitalisation. La performance des modèles a été évaluée en les comparant aux prédictions des médecins. Les résultats ont montré que les quatre modèles entraînés (XGBoost, NN artificiel, forêt aléatoire et régression linéaire) ont surpassé le jugement des médecins en validation interne, démontrant leur précision supérieure dans la prédiction des doses optimales de warfarine à la sortie, mais pas dans l'ensemble de validation externe. De même, Lee et al .ont développé un modèle de prédiction et un système d'aide à la décision pour déterminer les doses d'entretien de warfarine. Leur algorithme a utilisé un NN dense et récurrent entraîné sur les données de 19 719 patients pour prédire le niveau du rapport international normalisé (INR) au cinquième jour après le début du traitement par warfarine. Le modèle d'IA a surpassé le jugement du médecin, prédisant avec précision l'INR à ±0,3 de la valeur réelle dans 84,0 % des cas (10 650/12 673), contre 81,9 % (1 647/2000) pour les médecins experts ( p = 0,014) ; pourtant, aucune validation externe n'a été réalisée. Ces résultats soulignent le potentiel significatif des outils basés sur l'IA pour optimiser le dosage de la warfarine dans la pratique clinique quotidienne. En utilisant des paramètres cliniques facilement disponibles, les modèles d'apprentissage automatique peuvent aider les cliniciens en prévoyant les trajectoires de l'INR et en prédisant à la fois la sélection de la dose initiale et les ajustements ultérieurs, générant ainsi des recommandations spécifiques au patient, adaptées à une intégration directe dans les DSE. Cependant, une validation externe rigoureuse est essentielle. Il existe actuellement un écart notable entre la performance interne de ces modèles et leur efficacité dans les études de validation externe, ce qui limite leur applicabilité immédiate et leur évolutivité à des populations au-delà de la cohorte de développement initiale. Concernant la prédiction du risque, Goto et al ont développé un modèle pour prédire les résultats cliniques jusqu'à 1 an chez les patients atteints de fibrillation auriculaire (FA) recevant des antagonistes de la vitamine K, en utilisant les données du registre GARFIELD-AF. Le NN a été formé sur les mesures de l'INR collectées dans les 30 premiers jours de traitement et les résultats cliniques enregistrés du 31e au 365e jour. Le modèle a atteint des statistiques c de 0,75 pour les saignements majeurs, de 0,70 pour les accidents vasculaires cérébraux ou les embolies systémiques (AVC) et de 0,61 pour la mortalité toutes causes confondues. Notamment, le modèle d'IA a surpassé l'évaluation traditionnelle du temps dans la plage thérapeutique, offrant une approche plus précise de la prédiction du risque chez les patients atteints de FA sous traitement anticoagulant. Plusieurs modèles ML ont été développés pour évaluer le risque hémorragique chez les patients prenant des anticoagulants oraux directs (AOD). Huang et al . ont analysé les données de l'essai RELY, en appliquant des méthodes d'apprentissage automatique intégrées, afin d'identifier les variables clés permettant de prédire les événements vasculaires chez les patients traités par dabigatran 110 mg et les saignements chez ceux traités par dabigatran 150 mg. Le modèle de forêt aléatoire a obtenu des ASC de 0,76 pour la dose de 110 mg et de 0,75 pour celle de 150 mg, tandis que XGBoost a obtenu des ASC de 0,71 pour la dose de 110 mg et de 0,76 pour celle de 150 mg, surpassant la régression logistique. Les deux meilleurs modèles ont identifié dix variables critiques et généré des règles arborescentes pour prédire les événements vasculaires et hémorragiques, soulignant le potentiel des modèles de risque pour la personnalisation de la dose d'AOD.
L'utilisation de l'IA pour identifier les interactions médicamenteuses chez les patients traités par warfarine a également été explorée dans une étude d'exploration de données. Un modèle de forêt aléatoire a été utilisé pour prédire les changements dans les niveaux d'INR après de nouvelles prescriptions chez des patients précédemment traités par warfarine et atteints de FA non valvulaire et présentant un INR stable. L'analyse a identifié deux groupes de médicaments avec des interactions connues — les pénicillines résistantes aux β-lactamases et les dérivés du carboxamide — ainsi que trois agents antithrombotiques qui étaient associés à une diminution de l'INR. De plus, le modèle a redécouvert six groupes de médicaments avec des interactions connues qui ont provoqué une augmentation de l'INR, y compris les antiarythmiques de classe III, les opioïdes (par exemple le tramadol), les glucocorticoïdes et les dérivés du triazole. Notamment, les antipropulsifs ont été identifiés comme ayant une association jusqu'alors inconnue avec une augmentation de l'INR.
Présent et avenir de l'intelligence artificielle en pharmacothérapie cardiovasculaire
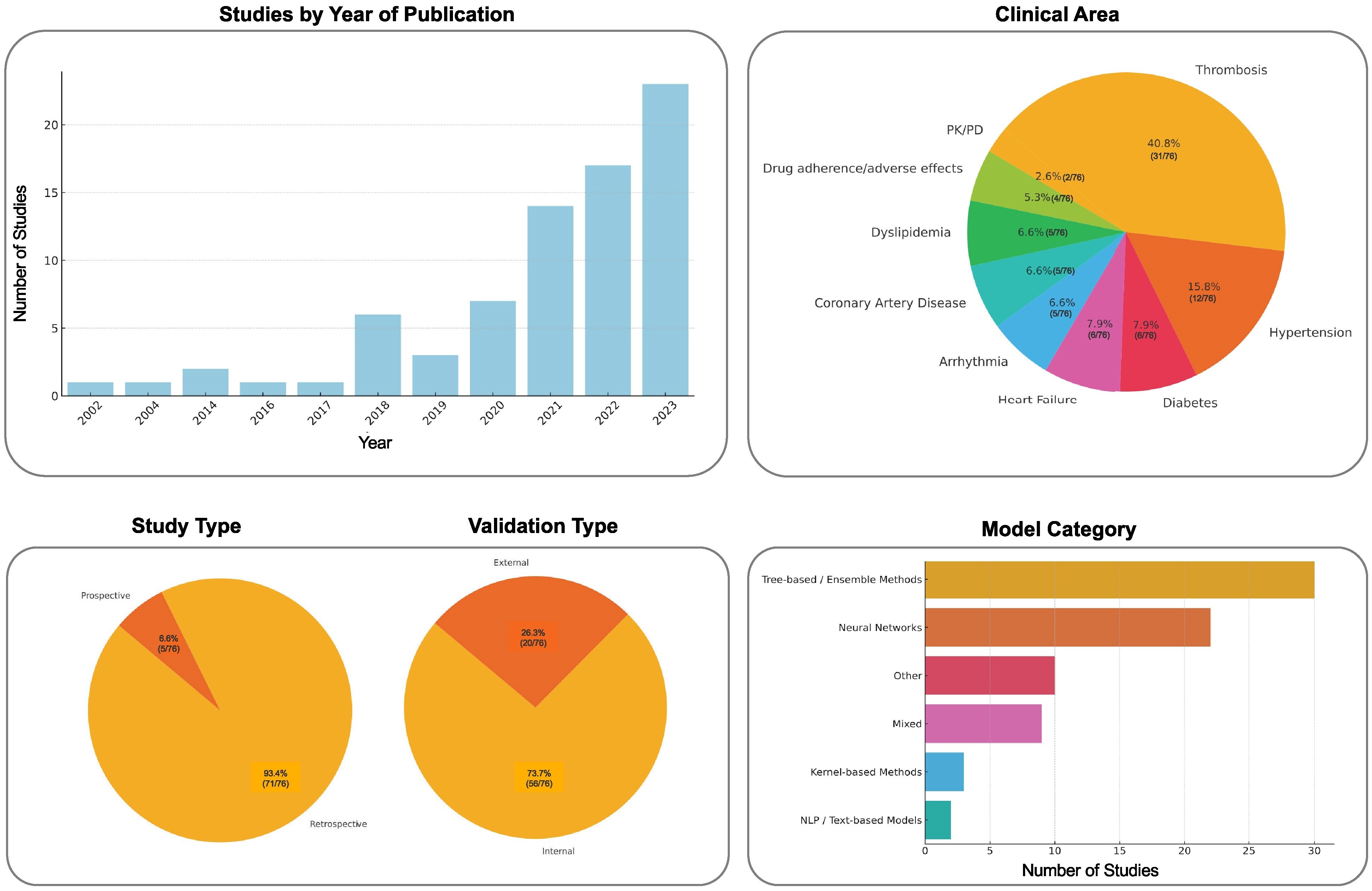
Un résumé global de l’ensemble des preuves examinées dans cette revue est présenté dans la figure ci dessus. Au cours des cinq dernières années, les études sur l'IA en pharmacothérapie cardiovasculaire ont fortement augmenté, avec une répartition homogène entre les domaines thérapeutiques et une concentration relative dans la thrombose et l'hypertension. Pourtant, seule une petite fraction de ces modèles a été évaluée prospectivement ou validée en externe dans des cohortes indépendantes. Les algorithmes d'apprentissage automatique étant intrinsèquement sujets au surajustement, une validation externe et prospective rigoureuse, idéalement intégrée dans des essais cliniques randomisés, est essentielle pour démontrer l'utilité clinique et soutenir l'adoption en pratique courante. Par conséquent, peu de modèles sont actuellement prêts à être mis en œuvre en situation réelle.
Pièges et limites de l'intelligence artificielle
Bien que l'IA présente un potentiel important pour les soins cardiovasculaires, des considérations clés doivent être prises en compte.
Premièrement, l'efficacité des modèles d'IA repose sur des données impartiales et de haute qualité. Pour éviter que l'IA ne perpétue ou n'amplifie les disparités existantes et ne porte involontairement préjudice aux groupes de patients sous-représentés ou vulnérables, il est crucial de prendre en compte la diversité, l'équité et l'inclusion (DE&I) lors de son développement et de son déploiement. Cela nécessite de former et de valider les modèles d'IA sur des données qui reflètent fidèlement l'ensemble des populations de patients, englobant les variations d'âge, de sexe, d'origine ethnique, de milieu socio-économique et de comorbidités. Ces données exhaustives garantissent des performances et une fiabilité adéquates pour tous les groupes de patients, et pas seulement pour la majorité. Il est tout aussi important de déployer équitablement ces outils pour favoriser un accès équitable aux soins en médecine cardiovasculaire, contribuant ainsi à réduire, plutôt qu'à accroître, les écarts existants en matière de soins.
Deuxièmement, l'intégration des technologies d'IA, y compris les grands modèles linguistiques, soulève d'importantes préoccupations en matière de confidentialité. Pour se conformer aux réglementations strictes en matière de confidentialité (par exemple, RGPD, HIPAA), une intégration locale au sein de l'environnement informatique sécurisé de l'hôpital est nécessaire. Cela évite le transfert de données sensibles des patients vers des serveurs externes, atténuant ainsi les risques pour la vie privée. Fondamentalement, l'intégration locale permet à des technologies comme le traitement du langage naturel de traiter en toute sécurité des données de DSE riches, souvent sous-utilisées et non structurées (par exemple, les notes cliniques) aux côtés de données structurées. Enfin, comme de nombreux modèles basés sur l'IA manquent actuellement de validation rigoureuse, l'établissement de cadres normalisés pour la qualité, la validation et l'enregistrement des données est essentiel et devrait être une priorité pour les sociétés scientifiques, les comités de recommandations et les organismes de réglementation. De tels cadres établiraient des normes de qualité des modèles et détermineraient le niveau de preuve requis pour l'adoption clinique, à l'instar des processus pour d'autres dispositifs médicaux.
Perspectives d'avenir
Malgré les limites et les défis actuels, les progrès méthodologiques rapides laissent présager l'émergence prochaine d'un nombre croissant d'outils robustes et cliniquement utiles.
De même que les plateformes in silico élargissent le pipeline de composés entrant dans les études humaines, raccourcissent l'intervalle entre la recherche de dose et les essais de phase avancée et accélèrent les initiatives de réorientation des médicaments, elles sont sur le point d'élargir considérablement notre arsenal pharmacologique.
L'amélioration de l'observance thérapeutique est un autre cas d'utilisation mature de l'IA, déjà largement exploré dans des études prospectives.
De nouveaux capteurs intelligents, objets connectés et interfaces de réalité étendue dotés d'IA peuvent réduire la non-observance, un facteur modifiable majeur d'effets indésirables
Enfin, l'IA soutiendra la prochaine phase de personnalisation des traitements.
L'intégration des données génomiques, des caractéristiques cliniques, de la surveillance physiologique continue (par exemple, glycémie, lactate, électrocardiogramme et pression artérielle), des biomarqueurs circulants, de l'imagerie et des expositions environnementales générera des flux de données multimodaux complexes. Des algorithmes capables de synthétiser ces entrées pour soutenir l'ajustement dynamique des thérapies peuvent être déployés sur plusieurs points de soins, depuis les systèmes de DSE qui assistent les cliniciens jusqu'aux applications mobiles destinées aux patients qui permettent l'autogestion.
Conclusions
L'intégration de l'IA à la pharmacothérapie cardiovasculaire révolutionne la prise en charge des maladies en faisant progresser le développement de médicaments, en personnalisant les traitements, en optimisant la posologie et en prédisant les effets indésirables.
Cependant, des lacunes subsistent dans certains domaines, et une validation externe rigoureuse de ces modèles est essentielle pour confirmer leur généralisabilité et favoriser une adoption plus large.
La poursuite des recherches est essentielle pour exploiter pleinement le potentiel de l'IA, ce qui permettra d'améliorer les résultats pour les patients et d'optimiser l'efficacité des soins de santé. Une attention particulière doit être portée à la qualité des données, aux questions de confidentialité et à la nécessité de cadres de validation robustes pour garantir une intégration fiable et efficace des outils d'IA dans la pratique clinique – une priorité que les comités de recommandations et les organismes de réglementation devraient aborder pour guider la mise en œuvre clinique.
SYNTHESE
Ce texte, une publication du European Heart Journal, examine le rôle transformateur de l'intelligence artificielle (IA) en pharmacothérapie cardiovasculaire. Il explore comment l'IA, y compris l'apprentissage automatique (ML) et la modélisation in silico, peut optimiser le développement de médicaments, personnaliser les traitements pour des conditions telles que l'hypertension et le diabète, et améliorer la prédiction des effets indésirables. Le document met en évidence les applications de l'IA pour améliorer la prise de décision clinique, rationaliser la conception des essais cliniques et aborder des défis tels que l'observance médicamenteuse. Bien que l'IA offre un potentiel immense, l'article souligne également l'importance d'une validation rigoureuse et la nécessité de résoudre les problèmes de qualité des données, de confidentialité et de biais pour une intégration fiable et efficace dans la pratique médicale.
Commentaire
Une avancée supplémentaire de l'IA en médecine. Prédire les effets de nouvelles molécules, modifier les essais cliniques, développer plus rapidement de nouveaux médicaments, ,l'IA est "partout" en médecine. Cette accélération doit être encadrée, validée, elle doit préserver l'éthique. Bien entendu tout cela a un coût, il ne faudrait pas que le développement de médicaments "made by AI" devienne prohibitif et inaccessible pour une partie de la population. La médecine "high-tech" doit être accessible au plus grand nombre. Ce dernier point est un des plus importants, surtout dans un monde "en faillite"......
Mais, l'est-il vraiment ?
Un autre apport de l'IA , l'observance thérapeutique. Il y a tant à faire, 50 % des médicaments prescrits ne sont pas pris. Est ce que là, la mise en place de capteurs "de prise" "est valable ? Plus simplement redescendons sur terre, le médecin qui prescrit doit faire de la pédagogie sans cesse renouvelée, mais en 5 mn ce n'est pas possible. massivement. L'IA ne peut et ne pourra pas résoudre toutes les difficultés de notre système de santé. Le bon sens, OUI !. Ne demandons pas à l'IA de tout faire en médecine, ce n'est qu'un outil, rien qu'un outil. La relation médecin/patient doit s'amplifier et non devenir de la "speed consultation". L'IA va libérer du temps en médecine, alors revenons aux fondamentaux cliniques.
À LIRE
JUMEAU NUMÉRIQUE / ESSAIS IN SILICO
Un jumeau numérique (MISTRAL AI) est une réplique virtuelle d'un objet, d'un processus ou d'un système physique. Il s'agit d'un modèle numérique qui utilise des données en temps réel pour simuler le comportement et les performances de son homologue physique. Les jumeaux numériques sont souvent utilisés dans divers domaines, tels que la fabrication, l'ingénierie, la santé et l'infrastructure, pour plusieurs raisons :
-
Optimisation et amélioration : les jumeaux numériques permettent de tester différentes configurations et scénarios sans affecter le système physique réel. Cela aide à optimiser les performances et à identifier les améliorations potentielles.
-
Maintenance prédictive : en surveillant les données en temps réel, les jumeaux numériques peuvent prédire les pannes ou les problèmes avant qu'ils ne surviennent, permettant ainsi une maintenance proactive.
-
Simulation et formation : ils sont utilisés pour former le personnel sur des systèmes complexes dans un environnement sûr et contrôlé.
-
Prise de décision : les jumeaux numériques fournissent des informations détaillées qui aident à prendre des décisions éclairées concernant la conception, l'exploitation et la gestion des systèmes.
-
Innovation et développement de produits : ils permettent de tester de nouvelles idées et innovations sans les coûts et les risques associés aux prototypes physiques.
En résumé, un jumeau numérique est un outil puissant pour améliorer l'efficacité, réduire les coûts et accélérer l'innovation dans divers secteurs.
Les études in silico sont souvent utilisées pour (MISTRAL AI).
- Modélisation et simulation : simuler des processus complexes qui seraient difficiles ou impossibles à étudier expérimentalement.
- Analyse de données : traiter et analyser de grandes quantités de données biologiques ou chimiques.
- Prédiction : prédire les propriétés de nouvelles molécules ou les effets de modifications génétiques.
- Optimisation : optimiser des processus industriels ou des protocoles expérimentaux avant de les mettre en œuvre dans le monde réel.
Ces études sont particulièrement utiles dans des domaines comme la biologie computationnelle, la bio-informatique, la pharmacologie et la génomique, où elles permettent de réduire les coûts et le temps nécessaires pour effectuer des expériences physiques.
https://medvasc.info/archives-blog/les-jumeaux-num%C3%A9riques
Copyright : Dr Jean Pierre Laroche/2025

