« L’intelligence artificielle serait la version ultime de Google. Le moteur de recherche ultime qui comprendrait tout sur le Web. Il comprendrait exactement ce que vous voulez et vous donnerait la bonne réponse. Nous sommes loin d’y parvenir pour le moment. Cependant, nous pouvons nous en rapprocher progressivement, et c’est essentiellement ce sur quoi nous travaillons. » Larry Page
« La vraie question est : quand allons-nous rédiger une déclaration des droits de l’intelligence artificielle ? En quoi consistera-t-elle ? Et qui en décidera ? » Gray Scott
Warraich HJ, Tazbaz T, Califf RM. FDA Perspective on the Regulation of Artificial Intelligence in Health Care and Biom Perspective de la FDA sur la réglementation de l'intelligence artificielle dans les soins de santé et la biomédecine.
JAMA. Published online October 15, 2024. doi:10.1001/jama.2024.21451
https://jamanetwork.com/journals/jama/fullarticle/2825146?utm_source=silverchair&utm_campaign=jama_network&utm_content=article_alert-jama_ai&utm_medium=email&adv=000003242730
Article libre d'accès
L'abstract
Importance
Les progrès de l'intelligence artificielle (IA) doivent s'accompagner d'efforts visant à mieux comprendre et évaluer les performances de l'IA dans les domaines de la santé et de la biomédecine, ainsi qu'à élaborer des cadres réglementaires appropriés. Cette communication spéciale passe en revue l'historique de la réglementation de l'IA par la Food and Drug Administration (FDA) des États-Unis ; présente les utilisations potentielles de l'IA dans le développement de produits médicaux, la recherche clinique et les soins cliniques ; et présente des concepts qui méritent d'être pris en considération à mesure que le système réglementaire s'adapte aux défis uniques de l'IA.
Observations
La FDA a autorisé près de 1 000 dispositifs médicaux compatibles avec l’IA et a reçu des centaines de demandes réglementaires pour des médicaments qui ont utilisé l’IA dans leur découverte et leur développement. La réglementation de l’IA en santé doit être coordonnée entre tous les secteurs réglementés, le gouvernement américain et les organisations internationales. Les régulateurs devront mettre en place des mécanismes flexibles pour suivre le rythme de l’évolution de l’IA dans les domaines de la biomédecine et des soins de santé. Les promoteurs doivent faire preuve de transparence et les régulateurs doivent être compétents pour évaluer l’utilisation de l’IA dans le développement préalable à la mise sur le marché. Une approche de gestion du cycle de vie intégrant un suivi récurrent des performances locales après la mise sur le marché devrait être au cœur du développement de l’IA en santé. Des mécanismes spéciaux pour évaluer les grands modèles linguistiques et leurs utilisations sont nécessaires. Des approches sont nécessaires pour équilibrer les besoins de l’ensemble des intérêts de l’écosystème de la santé, des grandes entreprises aux start-ups. Le système d’évaluation et de réglementation devra se concentrer sur les résultats de santé des patients afin d’équilibrer l’utilisation de l’IA à des fins d’optimisation financière pour les développeurs, les payeurs et les systèmes de santé.
Conclusions et pertinence
Une surveillance rigoureuse de la part de la FDA protège le succès à long terme des industries en mettant l’accent sur l’évaluation pour faire progresser les technologies réglementées qui améliorent la santé. La FDA continuera de jouer un rôle central pour garantir des outils d’IA sûrs, efficaces et fiables pour améliorer la vie des patients et des cliniciens. Cependant, toutes les entités concernées devront aborder l’IA avec la rigueur que mérite cette technologie transformatrice.
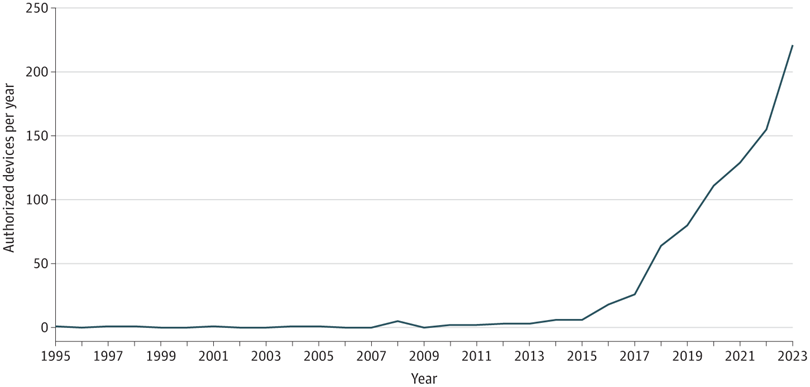
Dispositifs médicaux dotés d’intelligence artificielle dont la commercialisation a été autorisée par la Food and Drug Administration des États-Unis, par année
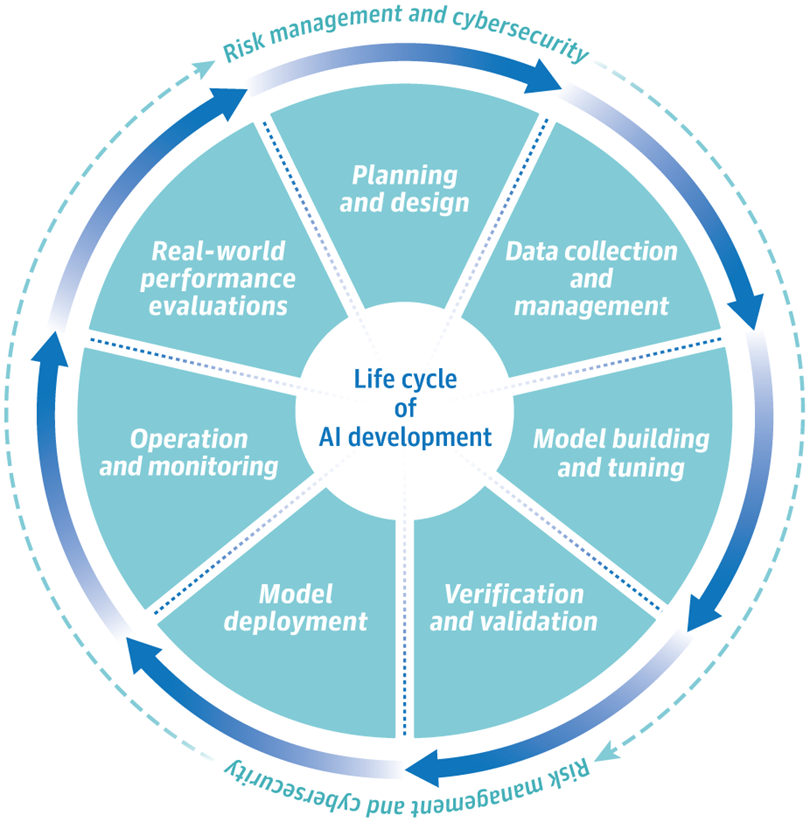
. Approche du cycle de vie total du produit pour l'intelligence artificielle (IA)
Un extrait sur la recherche clinique
Utilisations actuelles et potentielles de l'intelligence artificielle (IA) dans la recherche clinique
"Recrutement des participants
-
Exploitez les données des bases de données d’essais cliniques, des annonces d’essais, des médias sociaux, de la littérature médicale, des registres et des données structurées et non structurées dans les registres et les dossiers médicaux électroniques pour faire correspondre les individus aux essais. -
Assurer une représentation adéquate des populations susceptibles d’utiliser le produit médical (par exemple, par sexe, race et origine ethnique, etc.) lors de la création des algorithmes de correspondance et pour confirmer la réalisation d’une inclusion équitable.
Sélection et stratification des participants et des sites d'essai
-
Prédire le résultat clinique d' un participant individuel en fonction des caractéristiques de base pour enrichir les essais cliniques, réduire la variabilité et augmenter la puissance de l’étude.
-
Stratifier les patients en différents groupes et stratégies de surveillance en fonction de la probabilité prévue d’événements indésirables graves.
-
Évaluez les performances du site et déterminez ceux qui pourraient être en retard en fonction des données antérieures.
Adhérence et rétention
-
Améliorez l'observance au cours d'un essai clinique grâce à des outils tels que les alertes et les rappels sur smartphone, le suivi électronique des médicaments (par exemple, les piluliers intelligents et les outils de confirmation visuelle) et les visites cliniques manquées, qui déclenchent des alertes de non observance.
-
Utiliser des biomarqueurs numériques (par exemple, l’expressivité faciale et vocale) pour surveiller l’observance à distance.
-
Améliorez l'accès des participants aux informations sur les essais en activant des outils tels que les chatbots IA, l'assistance vocale et la recherche intelligente.
-
Réduisez la charge des participants en utilisant la collecte passive de données et en extrayant davantage d’informations à partir des données disponibles générées pendant la pratique clinique ou par le biais d’activités d’étude.
Collecte, gestion et analyse des données des essais cliniques
-
Identifier de nouvelles caractéristiques de conditions ou prédire l’état et la réponse au traitement d’une maladie chronique.
-
Évaluer les données multimodales et les mesures composites .
-
Harmoniser le nettoyage des données, la détection des doublons, la terminologie contrôlée et l’imputation.
-
Améliorez la conservation des données via le masquage et la désidentification des informations personnelles identifiables, la création de métadonnées et la recherche et la récupération des données stockées.
-
Evaluer les candidats médicaments et les résultats à l’aide de cohortes virtuelles avec une variabilité des traits représentant la population souhaitée.
-
Utiliser des jumeaux numériques pour générer des dossiers cliniques simulés afin de prédire la réponse du groupe placebo.
-
Détectez les groupes de symptômes pour identifier les signaux de sécurité.
Surveillance et évaluation de la sécurité post commercialisation
-
Détecter et évaluer les associations d’événements indésirables à partir de la littérature médicale et des médias sociaux.
-
Identifier les événements indésirables pour les soumissions de rapports de sécurité de cas individuels.
-
Déterminer la validité des cas en évaluant les exigences minimales en matière de rapports et en aidant à la priorisation des cas en fonction de leur caractère attendu.
-
Codez les rapports de sécurité des cas individuels dans des dictionnaires médicaux structurés .
-
Classer la probabilité d’une relation causale entre les médicaments et les événements indésirables.
-
Faciliter la production de rapports de sécurité agrégés sur des cas individuels.
Des informations supplémentaires sont disponibles auprès de la Food and Drug Administration des États-Unis ."
Un autre extrait
Les applications de l’IA générative, comme les grands modèles de langage (LLM), présentent un défi unique en raison du potentiel de conséquences imprévues et émergentes ; la FDA n’a pas encore autorisé de LLM. Cependant, de nombreuses applications proposées dans le domaine des soins de santé nécessiteront la surveillance de la FDA étant donné leur utilisation prévue pour le diagnostic, le traitement ou la prévention de maladies ou d’affections. Même les « scribes de l’IA » censés résumer les notes médicales peuvent avoir des hallucinations ou inclure des diagnostics non évoqués lors de la visite. La complexité des LLM et les permutations des résultats nécessitent une surveillance de la part des individus et des institutions en plus des autorités réglementaires. Comme nous ne pouvons pas surcharger indûment les cliniciens individuels avec une telle surveillance, il est nécessaire de disposer d’outils spécialisés permettant de mieux évaluer les LLM dans les contextes et les cadres dans lesquels ils seront utilisés. De tels outils pourraient être développés à partir de zéro ou adaptés à partir d’outils d’évaluation LLM existants, par exemple DeepEval et MLflow. Les applications des LLM s'orientent vers l'aide à la décision pour les cliniciens mais aussi pour les patients qui présentent un risque important. Il peut donc être judicieux de commencer par les domaines où les preuves à l'appui de la prise de décision clinique sont les plus solides, par exemple la cardiologie, l'oncologie et les flux de travail cliniques à faible risque, où il est possible d'évaluer leurs résultats. Les LLM présentent également un grand potentiel pour accroître l'utilité des technologies existantes, telles que les DSE et les technologies de santé numériques portables . Par conséquent, il est nécessaire d'innover en matière de réglementation dans ce domaine pour permettre à la fois l'analyse de ces sources d'information et leur intégration dans la prise de décision clinique. L'engagement proactif des développeurs, des cliniciens, des dirigeants du système de santé et des régulateurs sur des plateformes telles que le Digital Health Advisory Committee de la FDA sera essentiel.
Commentaire
"Une surveillance rigoureuse de la part de la FDA protège le succès à long terme des industries en mettant l’accent sur l’évaluation pour faire progresser les technologies réglementées qui améliorent la santé"
Un cadre contraignant ? Non.
Mai un cadre nécessaire, avec un renforcement de la protection des données et de
l' éthique, ce qui est normal et rassurant.
Nous n'en sommes qu'au début de l'IA en médecine, mais tout va très très vite........trop vite vraisemblablement , mais il faut en rester maitre.
Copyright : Dr Jean Pierre Laroche /2024

