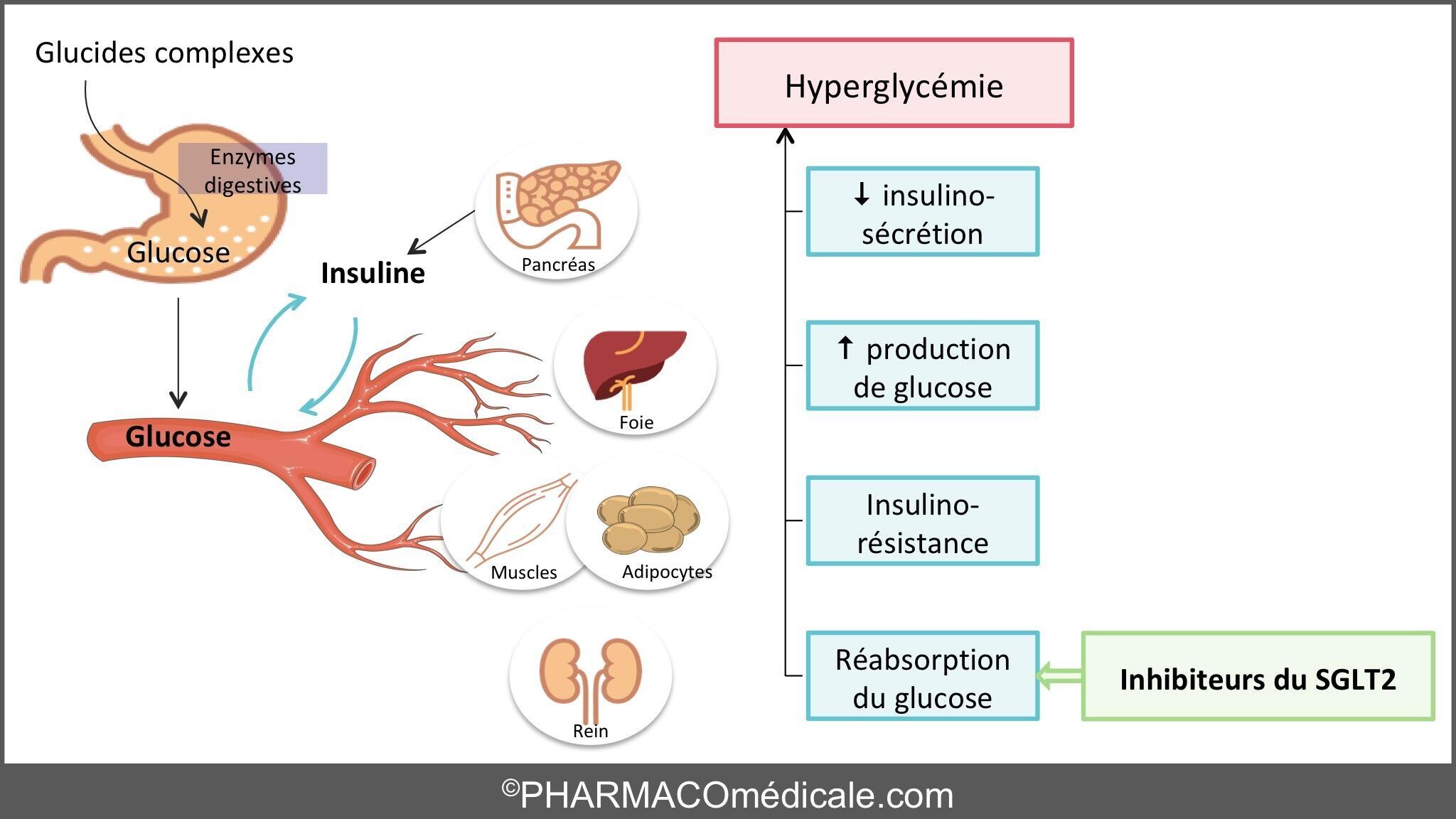
Inhibition d'un transporteur de réabsorption du glucose situé au sein du tube contourné proximal rénal (SGLT2): occasionne une fuite rénale de glucose (glycosurie)
Inhibiteurs du SGLT-2 dans le traitement du cancer : mécanismes d'action et nouvelles perspectives émergentes
Dutka M, Bobiński R, Francuz T, Garczorz W, Zimmer K, Ilczak T, Ćwiertnia M, Hajduga MB. SGLT-2 Inhibitors in Cancer Treatment-Mechanisms of Action and Emerging New Perspectives. Cancers (Basel). 2022 Nov 25;14(23):5811. doi: 10.3390/cancers14235811. PMID: 36497303; PMCID: PMC9738342.
"L’utilisation d’inhibiteurs du SGLT-2 pourrait s’avérer très bénéfique en termes d’amélioration de la sécurité des thérapies anticancéreuses précédemment utilisées. Cela s'applique à l'effet cardioprotecteur des inhibiteurs du SGLT-2, en particulier de l'empagliflozine, lors d'un traitement par sunitinib et doxorubicine. D'autres études sont nécessaires pour confirmer cet effet chez l'homme et déterminer la manière optimale d'utiliser les inhibiteurs du SGLT-2 avec la doxorubicine pour éliminer au maximum son effet cardiotoxique. Des études ont montré que les inhibiteurs du SGLT-2 augmentent la sensibilité des cellules cancéreuses du sein à la doxorubicine . Cela laisse supposer que l'utilisation combinée de l'empagliflozine et de la doxorubicine permettra l'utilisation de doses plus faibles de doxorubicine et réduira ses effets cardiotoxiques. De plus, l’effet synergique des inhibiteurs du SGLT-2 et de la doxorubicine, tel que démontré dans les cellules cancéreuses du sein, laisse imaginer que cette synergie avec les inhibiteurs du SGLT-2 soit également confirmée dans d’autres types de tumeurs et avec d’autres médicaments anticancéreux classiques. Cependant, des études précliniques et cliniques sont nécessaires pour évaluer la possibilité d’utiliser à l’avenir les effets synergiques de ces médicaments en oncologie clinique."
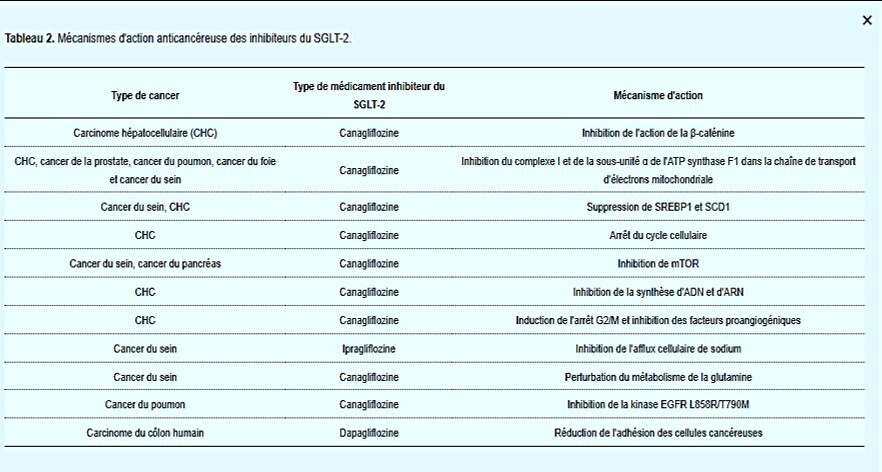
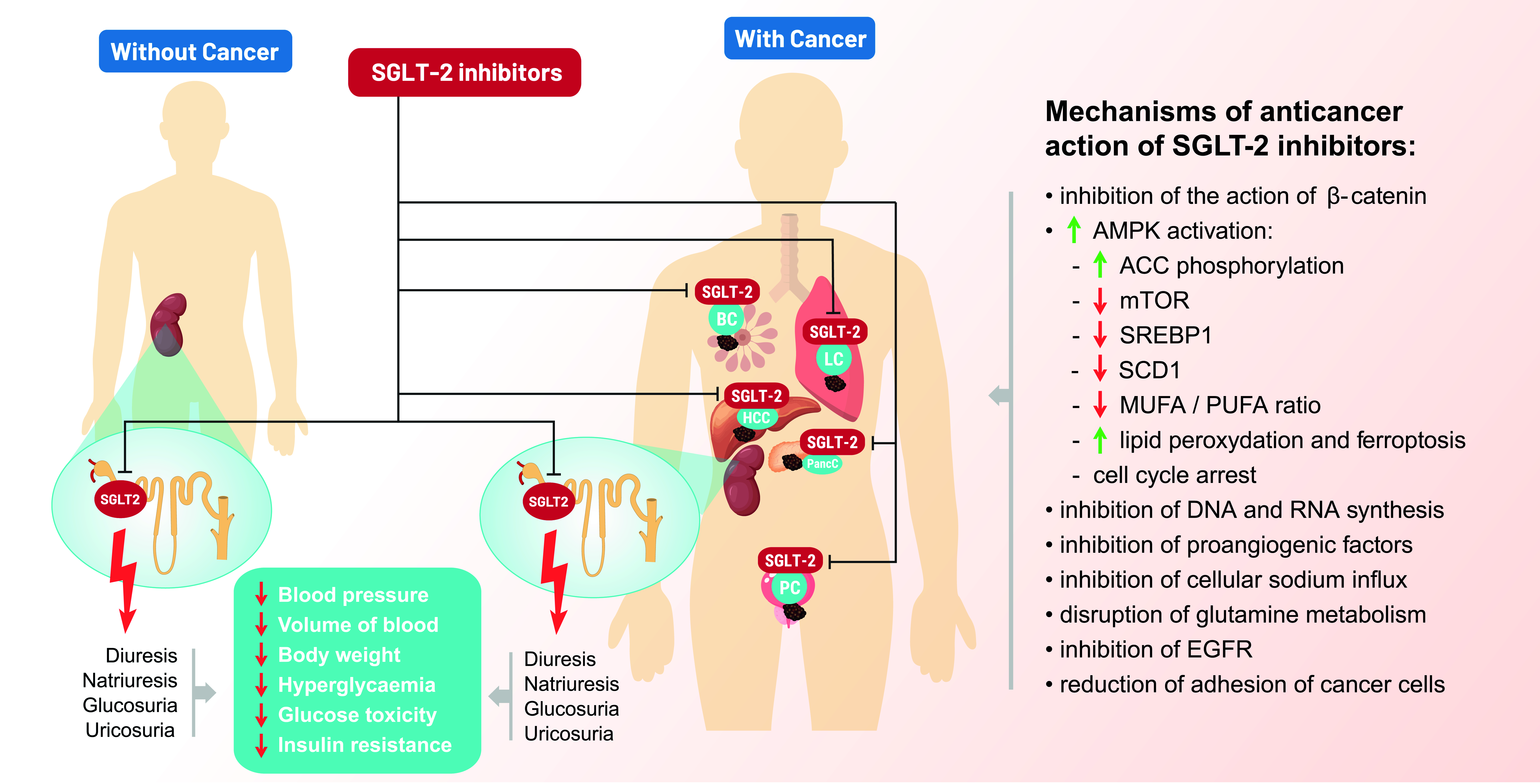
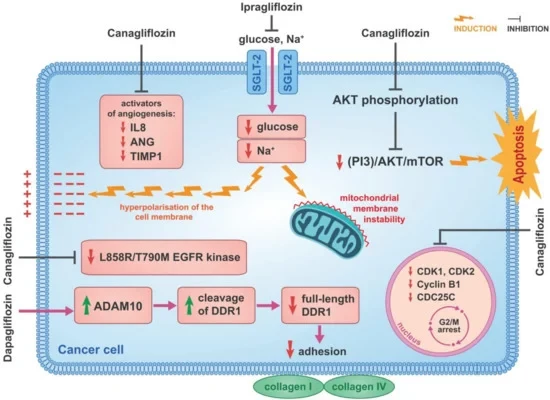 Les mécanismes d'action anticancéreuse des inhibiteurs du SGLT-2. La canagliflozine induit un arrêt G2/M dans les cellules Huh7 et HepG2. Dans ces types de cellules, les effets de la canagliflozine sur les gènes liés au cycle ont été étudiés et la régulation négative de gènes tels que CDK1, CDK2, Cycline B1 et CDC25C a été confirmée. La canagliflozine inhibe également la phosphorylation de l'AKT et, en inhibant la voie de signalisation (PI3K)/AKT/mTOR, induit l'apoptose dans les cellules Huh7 et HepG2. La canagliflozine inhibe les activateurs de l'angiogenèse tels que l'IL-8, l'ANG et le TIMP-1 dans les cellules HCC qui produisent des quantités accrues de ces activateurs. Ces activateurs de l'angiogenèse sont impliqués dans la croissance et la progression du CHC. Il a été confirmé que l'ipragliflozine a un effet antiprolifératif sur les cellules cancéreuses du sein. En inhibant l'afflux cellulaire de sodium, l'ipragliflozine induit à la fois une hyperpolarisation de la membrane cellulaire et une instabilité de la membrane mitochondriale dans les cellules cancéreuses du sein. Il a été confirmé que la canagliflozine inhibe la kinase EGFR L858R/T790M et que c'est le mécanisme de son activité anticancéreuse dans les cellules cancéreuses du poumon. Il a été confirmé que la dapagliflozine réduit la quantité de protéine DDR1 complète. Il a également été démontré qu’il augmente directement l’activité d’ADAM10, qui induit le clivage de DDR1 dans les cellules HCT116. De cette manière, la dapagliflozine perturbe les capacités adhésives des cellules HCT116 au collagène I et IV. Explication des abréviations : SGLT-2 : cotransporteur sodium-glucose 2 ; AKT : protéine kinase B ; PI3K : phosphatidylinositol 3-kinase ; mTOR : cible mammifère de la rapamycine ; IL-8 : interleukine-8 ; ANG : angiogénine ; TIMP-1 : inhibiteurs tissulaires de la métalloprotéinase-1 ; EGFR : tyrosine du facteur de croissance épidermique ; ADAM10 : une protéine 10 contenant un domaine de désintégrine et de métalloprotéinase ; DDR1 : famille des récepteurs du domaine discoïdine, membre 1
Les mécanismes d'action anticancéreuse des inhibiteurs du SGLT-2. La canagliflozine induit un arrêt G2/M dans les cellules Huh7 et HepG2. Dans ces types de cellules, les effets de la canagliflozine sur les gènes liés au cycle ont été étudiés et la régulation négative de gènes tels que CDK1, CDK2, Cycline B1 et CDC25C a été confirmée. La canagliflozine inhibe également la phosphorylation de l'AKT et, en inhibant la voie de signalisation (PI3K)/AKT/mTOR, induit l'apoptose dans les cellules Huh7 et HepG2. La canagliflozine inhibe les activateurs de l'angiogenèse tels que l'IL-8, l'ANG et le TIMP-1 dans les cellules HCC qui produisent des quantités accrues de ces activateurs. Ces activateurs de l'angiogenèse sont impliqués dans la croissance et la progression du CHC. Il a été confirmé que l'ipragliflozine a un effet antiprolifératif sur les cellules cancéreuses du sein. En inhibant l'afflux cellulaire de sodium, l'ipragliflozine induit à la fois une hyperpolarisation de la membrane cellulaire et une instabilité de la membrane mitochondriale dans les cellules cancéreuses du sein. Il a été confirmé que la canagliflozine inhibe la kinase EGFR L858R/T790M et que c'est le mécanisme de son activité anticancéreuse dans les cellules cancéreuses du poumon. Il a été confirmé que la dapagliflozine réduit la quantité de protéine DDR1 complète. Il a également été démontré qu’il augmente directement l’activité d’ADAM10, qui induit le clivage de DDR1 dans les cellules HCT116. De cette manière, la dapagliflozine perturbe les capacités adhésives des cellules HCT116 au collagène I et IV. Explication des abréviations : SGLT-2 : cotransporteur sodium-glucose 2 ; AKT : protéine kinase B ; PI3K : phosphatidylinositol 3-kinase ; mTOR : cible mammifère de la rapamycine ; IL-8 : interleukine-8 ; ANG : angiogénine ; TIMP-1 : inhibiteurs tissulaires de la métalloprotéinase-1 ; EGFR : tyrosine du facteur de croissance épidermique ; ADAM10 : une protéine 10 contenant un domaine de désintégrine et de métalloprotéinase ; DDR1 : famille des récepteurs du domaine discoïdine, membre 1
Néanmoins, de nombreuses études précliniques en cours et de nouveaux essais cliniques probables à venir laissent espérer une utilisation future optimale de ce groupe intéressant de médicaments en oncologie clinique.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9738342/
L'ARTICLE
Les inhibiteurs du cotransporteur sodium-glucose-2 (SGLT2), initialement approuvés pour le diabète sucré de type 2, ont démontré leur efficacité dans la réduction des événements cardiovasculaires, en particulier de l'insuffisance cardiaque, chez les patients diabétiques et non diabétiques.
Un domaine de recherche fascinant consiste à explorer l’application potentielle des inhibiteurs du SGLT2 en cardio-oncologie, dans le but d’atténuer les événements indésirables cardiovasculaires associés aux traitements anticancéreux.
Ces inhibiteurs présentent une double nature unique, offrant à la fois des effets cardioprotecteurs et des propriétés anticancéreuses, conférant un double bénéfice aux patients en cardio-oncologie. Dans cette revue, les auteurs examinent d'abord les effets cardioprotecteurs établis des inhibiteurs du SGLT2 dans l'insuffisance cardiaque, puis explorent l'ensemble des preuves existantes, y compris des études précliniques et cliniques, qui soutiennent l'utilisation des inhibiteurs du SGLT2 dans le contexte de la cardio-oncologie. Les auteurs discutent en outre des mécanismes par lesquels les inhibiteurs du SGLT2 protègent contre la toxicité cardiovasculaire secondaire au traitement du cancer. Enfin, ils explorent les effets anticancéreux potentiels des inhibiteurs du SGLT2 ainsi que les mécanismes proposés.
Points forts
| • |
Des études observationnelles suggèrent que les inhibiteurs du SGLT2 protègent contre la chimiothérapie cardiotoxique. |
||||
| • |
Des études précliniques montrent les effets cardioprotecteurs et anticancéreux des inhibiteurs du SGLT2. |
||||
| • |
Des essais cliniques randomisés sont justifiés pour tester les inhibiteurs du SGLT2 en cardio-oncologie. |
||||
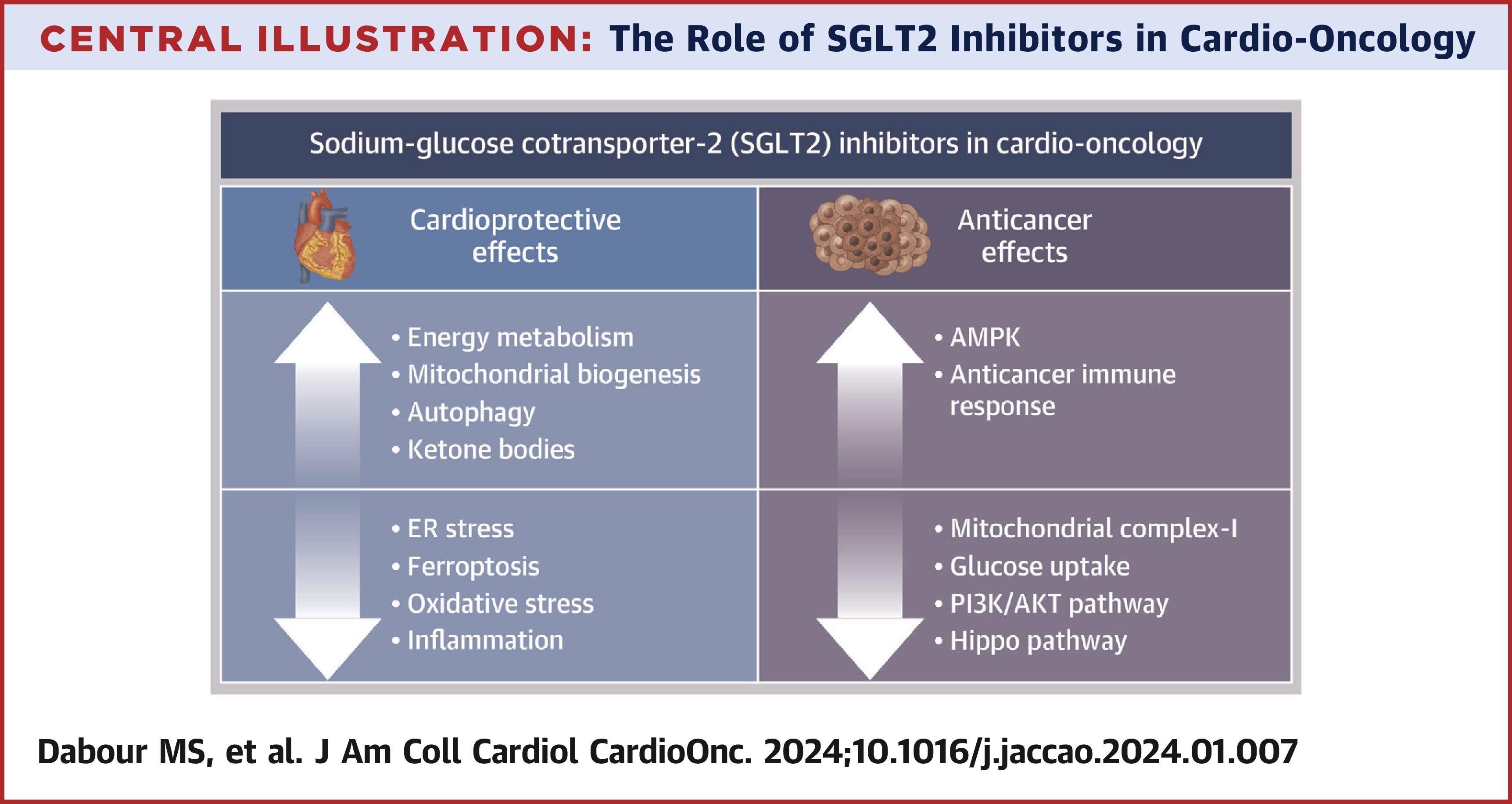
Le rôle des inhibiteurs du SGLT2 en cardio-oncologie
Cette illustration résume à la fois les mécanismes cardioprotecteurs et anticancéreux des inhibiteurs du cotransporteur sodium-glucose-2 (SGLT2). AMPK = protéine kinase activée par l'adénosine monophosphate ; ER = réticulum endoplasmique ; PI3K = phosphoinositide 3-kinase.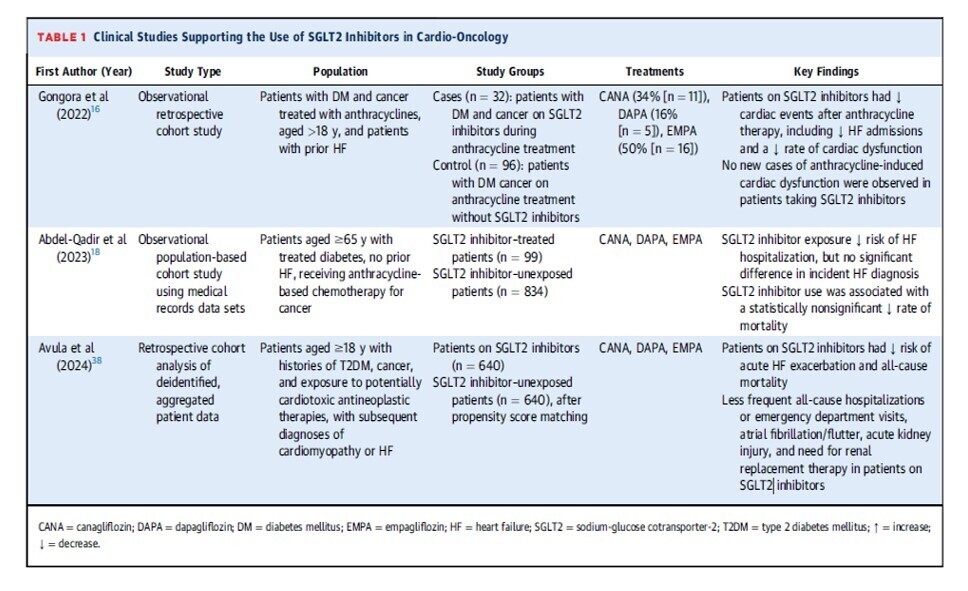
Études cliniques soutenant l'utilisation des inhibiteurs du SGLT2 en cardio-oncologie
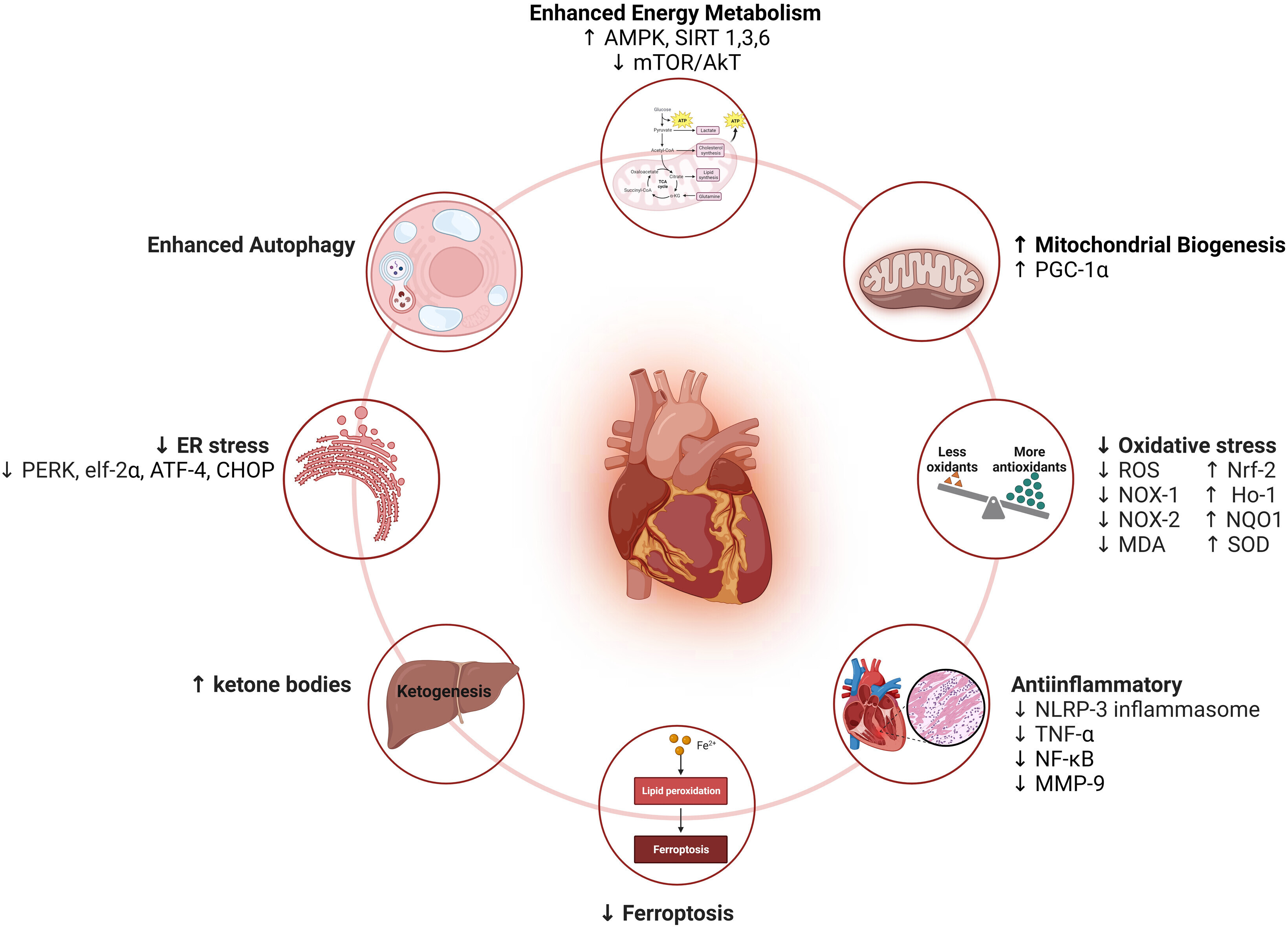
Mécanismes cardioprotecteurs des inhibiteurs du SGLT2 contre la cardiotoxicité induite par le traitement du cancer
Les inhibiteurs du cotransporteur sodium-glucose-2 (SGLT2) protègent contre la toxicité cardiovasculaire induite par les médicaments anticancéreux via de multiples mécanismes. Ils améliorent le métabolisme énergétique en augmentant l'activation des voies de privation de nutriments (adénosine monophosphate - protéine kinase activée [AMPK] et sirtuine [SIRT] 1, SIRT3 et SIRT6) tout en inhibant les voies de surplus de nutriments (AKT/cible mammifère de la rapamycine [mTOR ]), entraînant une augmentation de l'autophagie et une augmentation de la biogenèse mitochondriale (coactivateur du récepteur γ activé par les proliférateurs de peroxysomes-1α [PGC-1α]). De plus, les inhibiteurs du SGLT2 atténuent le stress oxydatif et du réticulum endoplasmique (RE), bloquent les voies inflammatoires, inhibent la ferroptose et améliorent la cétogenèse. Créé à l'aide de BioRender.com. ATF-4 = facteur de transcription activant 4 ; CHOP = protéine homologue C/EBP ; eIF-2α = facteur d'initiation eucaryote 2α ; Ho-1 = hème oxygénase 1 ; MDA = malondialdéhyde ; MMP = métalloprotéinase matricielle ; NLRP-3 = domaine de pyrine du récepteur de type nod contenant 3 ; NF-κB = facteur nucléaire κB ; NOX-1 = NADPH oxydase 1 ; NOX-2 = NADPH oxydase 2 ; Nrf-2 = facteur nucléaire érythroïde 2 – facteur 2 lié ; NQO1 = NAD(P)H quinone déshydrogénase 1 ; PERK = kinase du réticulum endoplasmique de type protéine kinase R ; ROS = espèces réactives de l'oxygène ; SOD = superoxyde dismutase ; TNF = facteur de nécrose tumorale.
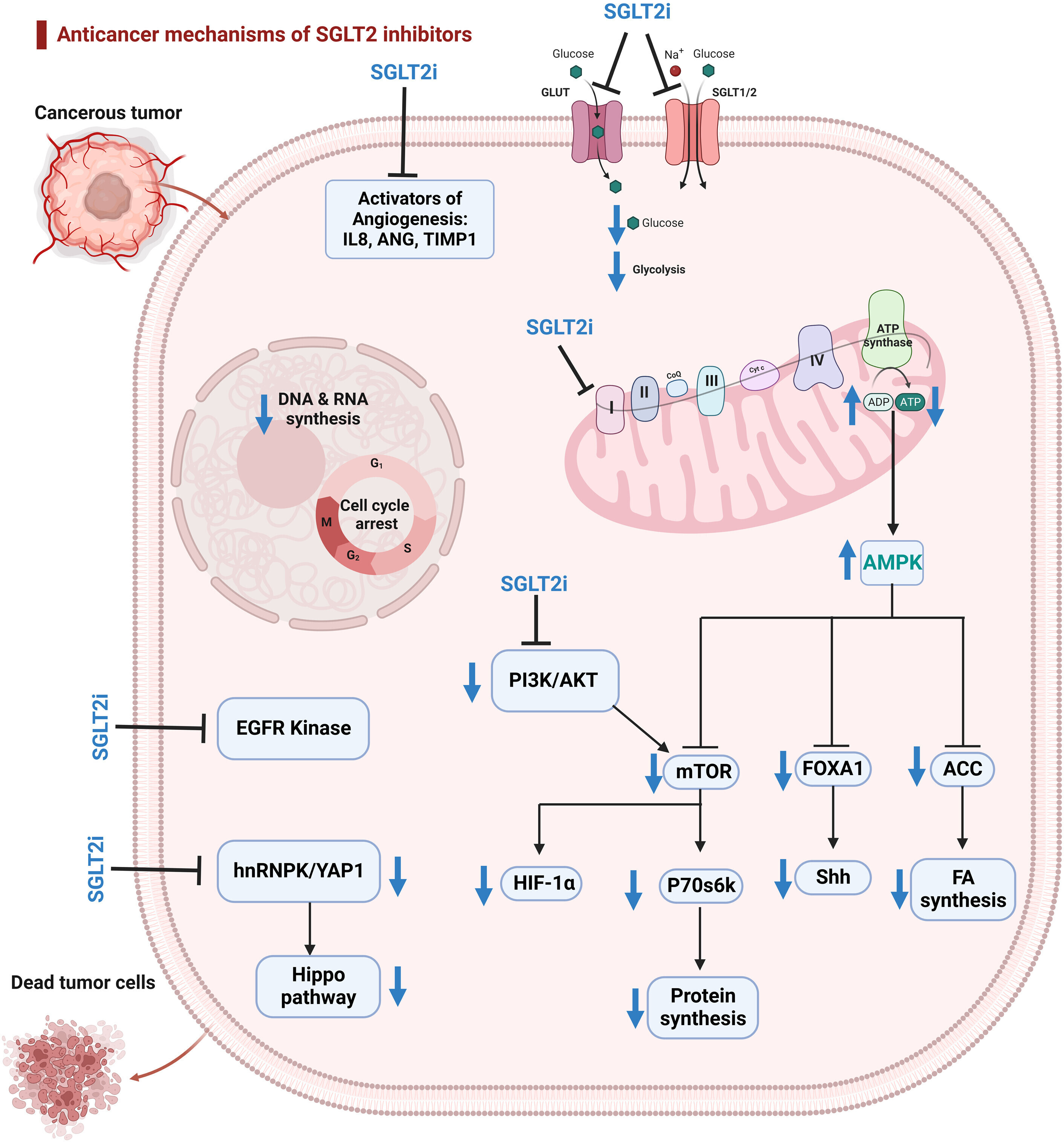
Mécanismes des effets anticancéreux du SGLT2i
Les inhibiteurs du SGLT2 (SGLT2i) inhibent l'absorption du glucose en inhibant les SGLT (SGLT-1 et SGLT-2) et les transporteurs de glucose (GLUT). Les inhibiteurs du SGLT2, en particulier la canagliflozine, inhibent la respiration cellulaire soutenue par le complexe mitochondrial I, réduisant ainsi la production d'adénosine triphosphate et activant l'AMPK. L'AMPK activé inhibe l'acétyl-coenzyme A carboxylase (ACC), supprimant ainsi la synthèse des acides gras. Il régule également à la baisse la boîte de forkhead A1 (FOXA1) et la molécule de signalisation Sonic Hedgehog (Shh) et inhibe mTOR et p70S6K, supprimant ainsi la synthèse des protéines. L'inhibition de mTOR entraîne une régulation négative du facteur 1α inductible par l'hypoxie (HIF-1α). Les inhibiteurs du SGLT2 inhibent la voie phosphoinositide 3-kinase (PI3K)/AKT. Les inhibiteurs du SGLT2 inhibent la voie de signalisation Hippo en régulant à la baisse l'axe ribonucléoprotéine nucléaire hétérogène K (hnRNPK)/protéine 1 associée au YES (YAP1). De plus, les inhibiteurs du SGLT2 inhibent la kinase du récepteur du facteur de croissance épidermique (EGFR) et les activateurs de l'angiogenèse. Créé à l'aide de BioRender.com. ANG = angiogénine ; FA = acide gras ; IL8 = interleukine 8 ; TIMP1 = inhibiteur tissulaire de la métalloprotéinase 1
Conclusion et orientations futures
En conclusion, compte tenu du profil de tolérance favorable et de l’utilisation généralisée des inhibiteurs du SGLT2 dans la prise en charge du DT2, de l’IC et de la maladie rénale chronique, ces agents sont prometteurs en tant que candidats potentiels à la réutilisation de médicaments en cardio-oncologie et dans le traitement du cancer.
Cette revue met en lumière de nombreuses preuves précliniques soutenant l'utilisation des inhibiteurs du SGLT2 en cardio-oncologie. Malgré ces progrès, une multitude de questions restent sans réponse, ce qui rend nécessaire une exploration plus approfondie.
Premièrement, il est impératif d’effectuer d’autres comparaisons directes entre différents inhibiteurs du SGLT2, en examinant à la fois les effets cardioprotecteurs et anticancéreux. La plupart des études démontrant les effets cardioprotecteurs ont utilisé l'empagliflozine et la dapagliflozine, tandis que celles étudiant les effets anticancéreux ont utilisé la canagliflozine.
De plus, bien que les études examinées aient systématiquement montré les effets cardioprotecteurs des inhibiteurs du SGLT2 contre la cardiotoxicité liée au traitement du cancer dans des modèles sans tumeur, aucune n'a encore démontré simultanément les effets cardioprotecteurs et anticancéreux des inhibiteurs du SGLT2 dans des modèles porteurs de tumeurs.
Il existe un besoin urgent d’étudier ces effets dans des modèles porteurs de tumeurs afin d’évaluer leur efficacité et leur sécurité dans un contexte clinique plus pertinent, visant à protéger le cœur en présence du cancer et de ses traitements.
Cependant, d’un point de vue clinique prospectif, le soutien à l’utilisation des inhibiteurs du SGLT2 en cardio-oncologie repose principalement sur des preuves anecdotiques dérivées d’études observationnelles et épidémiologiques.
Compte tenu de la nature inhérente de ces études, qui incluaient principalement des patients atteints à la fois de diabète et de cancer, il existe un besoin crucial d'essais cliniques randomisés.
Ces essais devraient spécifiquement étudier l'innocuité et l'efficacité des inhibiteurs du SGLT2 chez les patients subissant des traitements anticancéreux potentiellement cardiotoxiques, englobant à la fois les diabétiques et les non-diabétiques.
Commentaire
Décidemment les iGLT2 sont pleins de ressources : initialement approuvés pour le diabète sucré de type 2, ils ont démontré leur efficacité dans la réduction des événements cardiovasculaires, en particulier de l'insuffisance cardiaque, chez les patients diabétiques et non diabétiques et t maintenant le cancer avec une double voie possible, la cardio toxicité du cancer par les chimiothérapies et enfin un effet anti cancer.
Bien entendu à ce jour, pour ces deux derniers points, ce sont des pistes sérieuses et prometteuses.
Une série de points forts impressionnant
- Les inhibiteurs du SGLT2, initialement développés pour le diabète, sont apparus comme traitement de l'IC et de l'insuffisance rénale chronique.
- Des études cliniques observationnelles rétrospectives suggèrent que les inhibiteurs du SGLT2 sont associés à une diminution des événements cardiaques et à une survie améliorée chez les patients atteints de cancer recevant des thérapies potentiellement cardiotoxiques.
- Il existe un besoin important d'essais cliniques prospectifs randomisés pour déterminer l'innocuité et l'efficacité de l'utilisation des inhibiteurs du SGLT2 en cardio-oncologie.
- Un vaste ensemble d'études précliniques démontrent les effets cardioprotecteurs des inhibiteurs du SGLT2 dans la prévention de la cardiotoxicité secondaire à divers traitements contre le cancer.
- Les inhibiteurs du SGLT2 offrent des effets cardioprotecteurs multifactoriels sur la cardiotoxicité liée au traitement du cancer.
- Les mécanismes comprennent les anti-inflammatoires, les antioxydants, l'atténuation du stress des urgences, la cétogenèse, l'amélioration du métabolisme énergétique, l'autophagie, l'inhibition de la ferroptose et l'inhibition de l'ET-1
- Des études épidémiologiques associent les inhibiteurs du SGLT2 à une survie globale améliorée dans des cancers spécifiques.
- Des études précliniques démontrent les effets anticancéreux potentiels des inhibiteurs du SGLT2, qu'ils soient utilisés seuls ou en association avec des traitements anticancéreux standards
- Les mécanismes potentiels sous-tendant les effets anticancéreux des inhibiteurs du SGLT2 comprennent l'activation de l'AMPK, l'inhibition du complexe mitochondrial I, l'inhibition de l'absorption du glucose et l'amélioration de la réponse immunitaire.
Toutes ces avancées sont prometteuses pour les patients, elles sont très importantes, et il faut s'en réjouir .

