Un membre de l'Académie de Médecine en 1886 : « Les Rayons X sont une découverte très intéressante mais ils n'auront aucune application en médecine ».
Canadian Association of Radiologists Guidance on Contrast-Associated Acute Kidney Injury, D. Blair Macdonald et Coll, Canadian Journal of Kidney Health and Disease Volume 9: 1– 15, https://journals.sagepub.com/doi/10.1177/08465371221083970, Libre d'accès
Recommandations de l'Association canadienne des radiologistes sur les lésions rénales aiguës associées au contraste iodés
(1) de simplifier le dépistage à un simple questionnaire et de ne pas retarder les examens émergents en raison du besoin de mesurer la créatinine;
(2) d’avoir des considérationsprophylactiques uniquement pour les patients dont le débit de filtration glomérulaire estimé (DFGe) est inférieur à 30 mL/ min/1,73 m2; (3) de ne pas recommander l’arrêt des médicaments visant à réduire le risque d’IRA, comme c’est normalement le cas, sauf la metformine lorsque le DFGe est inférieur à 30 mL/min/1,73 m2 et; (4) ne pas demander de mesures de suivi deroutine de la créatinine sérique après administration d’un agent de contraste iodé.
Limites: Le groupe n’a pas procédé à une revue formelle et systématique de la littérature sur le sujet ni à une méta-analyse. Les suggestions n’ont pas été évaluées dans un environnement clinique.
Synthèse
Recommandations
Résumé des recommandations
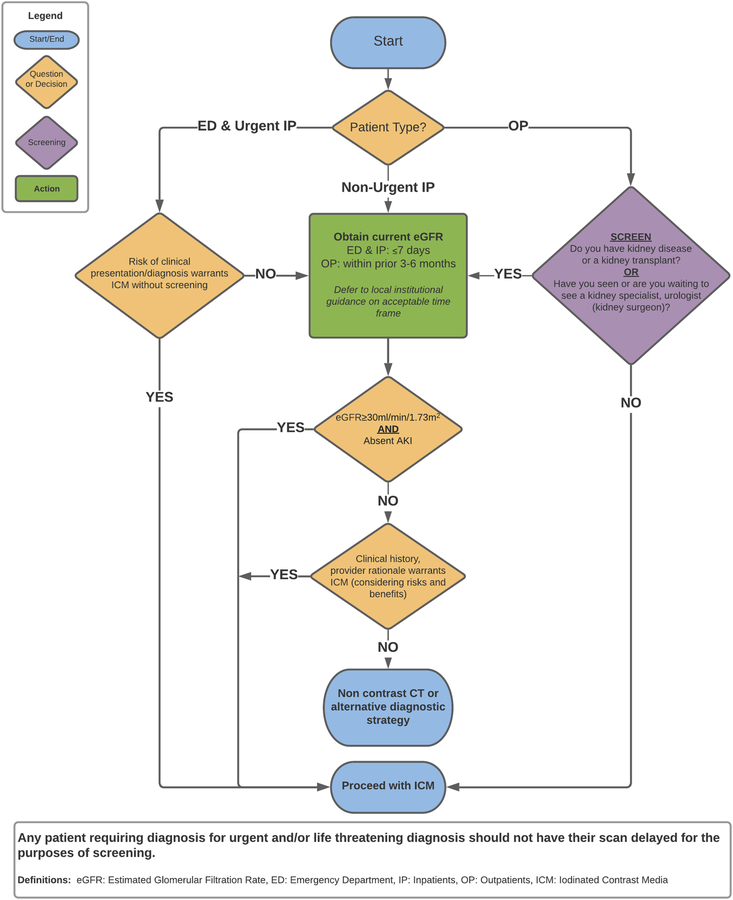
Énoncés de stratification des risques
Ces directives de dépistage se concentrent sur l'équilibre des risques (risque de CA-AKI, retards des patients et coûts des soins de santé) ainsi que sur les avantages significatifs de l'imagerie diagnostique à contraste amélioré en temps opportun.
-
1. Pour les patients ambulatoires stables sans DFGe actuel (3 à 6 mois selon la préférence de l'établissement) au dossier, et ceux sans antécédents d'IRC fournis sur la demande, nous recommandons un questionnaire de dépistage simple pour détecter ceux qui peuvent avoir une IRA ou une IRC grave :
"Avez-vous des problèmes rénaux ou une greffe de rein?"
"Avez-vous vu ou attendez-vous de voir un spécialiste des reins ou un urologue (chirurgien du rein) ?"
-
Lorsque le patient répond OUI à l'une ou l'autre des questions, il doit subir une analyse de sang pour un eGFR actuel avant de protocoler l'étude avec l'ICM.
-
b. Si le patient répond NON , alors un examen ICM indiqué peut se poursuivre sans valeur eGFR actuelle.
-
2. Nous recommandons un eGFR actuel (dans les 7 jours pour les patients hospitalisés ou lors de la présentation pour les patients aux urgences), mais cela ne devrait pas retarder l'examen d'imagerie en urgence.
-
a. Présentation urgence. Lorsque le patient est dans une situation d'urgence (telle qu'un accident vasculaire cérébral aigu suspecté, une embolie pulmonaire, un syndrome aortique aigu, une ischémie ou une perforation intestinale et d'autres affections), une étude d'imagerie avec contraste indiqué doit être effectuée sans délai. Ne tardez pas pour l'eGFR et ne retenez pas le contraste qui est nécessaire pour un diagnostic précis de la pathologie émergente.
-
b. L'utilisation d'un produit de contraste intraveineux ou intra-artériel dans le cadre d'une IRA préexistante doit tenir compte du compromis entre le risque global d'aggravation de l'IRA avec le produit de contraste et l'avantage d'une meilleure capacité de diagnostic et d'une intervention thérapeutique.
-
-
3. Pour les présentations non urgentes des patients stables en ambulatoire, des patients hospitalisés et des patients en urgence lorsque l'eGFR est disponible.
-
a. Si DFGe > 30 mL/min/1,73 m 2 et aucun signe ni symptôme d'IRA, procéder à une étude d'imagerie de contraste indiquée. Si DFGe ≤ 30 mL/min/1,73 m 2 , ou suspicion d'IRA, nous recommandons une décision individuelle du patient impliquant l'équipe soignante ou le décideur du patient/patient pour expliquer et équilibrer les risques d'AC-IRA par rapport aux risques et incertitudes d'une IRA retardée. ou une imagerie sous-optimale.
-
b. L'imagerie avec ICM peut être réalisée chez les patients sous dialyse péritonéale ou sous hémodialyse, quel que soit le débit urinaire résiduel, et aucune modification du programme de dialyse n'est nécessaire.
-
Choix du contraste
-
4. Nous ne recommandons pas l'utilisation préférentielle de l'ICM iso-osmolaire pour réduire le risque de CA-AKI (Acute Kidney Injury); ces décisions doivent être prises en fonction d'autres facteurs (par exemple, le coût et la disponibilité).
-
5. Nous déconseillons de réduire la dose d'administration de contraste IV pour les examens CT car cela réduit le rehaussement parenchymateux et recommandons d'utiliser la dose IV appropriée pour une imagerie CT de haute qualité chez tous les patients.
-
6. Nous recommandons une approche pragmatique du dosage de l'ICM pour les interventions AI en utilisant la dose nécessaire pour obtenir les résultats diagnostiques et thérapeutiques, mais en réduisant judicieusement la dose lorsque l'imagerie complémentaire et les doses sont à faible rendement ou peuvent être retardées.
-
7. Nous ne recommandons pas de restreindre les doses répétées de contraste chez les patients à faible risque (DFGe > 30, pas d'IRA, voie IV) ou de suspendre les doses répétées pour les urgences ou les patients hospitalisés qui présentent une maladie potentiellement mortelle ou aiguë. Nous recommandons d'éviter les expositions répétées au produit de contraste dans les 48 heures pour les procédures électives si les patients présentent un risque plus élevé de CA-AKI (eGFR ≤ 30, AKI, administration intra-artérielle de MCI). Cependant, face à une maladie potentiellement mortelle, des doses répétées d'ICM peuvent être nécessaires et justifiées pour établir un diagnostic et un plan de traitement sûrs.
Prophylaxie de CA-AKI
-
8. Nous ne recommandons pas l'hydratation orale ou intraveineuse pour les patients avec un DFGe > 30 mL/min/1,73 m2, recevant une MCI intraveineuse ou intra-artérielle.
-
9. Pour les patients avec un DFGe ≤ 30 mL/min/1,73 m2, recevant un MCI par voie intraveineuse, il existe un manque de données probantes sur les avantages de l'expansion du volume. Le groupe de travail ne formule donc aucune recommandation à cet égard ; les institutions peuvent choisir les pratiques les mieux adaptées à leur environnement local.
-
10. Pour les patients avec un DFGe ≤ 30 mL/min/1,73 m2, recevant un MCI intra-artériel, certains membres du groupe de travail ont approuvé une stratégie d'hydratation et d'expansion volumique utilisant soit une hydratation intraveineuse (avec une solution saline à 0,9 % ou du bicarbonate de sodium à 1,26 %). ) ou du sel et de l'eau par voie orale. Comme il n'y a pas suffisamment de preuves dans ce groupe de patients, le groupe de travail a ressenti ou non l'utilisation de l'hydratation, et la voie d'hydratation était mieux laissée au jugement du praticien.
-
11. Nous ne recommandons pas l'utilisation préférentielle de l'ICM iso-osmolaire pour réduire le risque de CA-AKI. Nous recommandons que les décisions concernant l'ICM faiblement osmolaire ou iso-osmolaire soient prises en fonction d'autres facteurs (par exemple, le coût et la disponibilité).
-
12. Nous ne recommandons aucune forme de thérapie de remplacement rénal après l'administration de l'ICM, que ce soit la dialyse ou la thérapie de remplacement rénal continue pour réduire le risque de CA-AKI.
-
13. Nous ne recommandons pas l'utilisation de N-acétylcystéine pour la prophylaxie de CA-AKI.
-
14. Nous ne recommandons pas d'initier des statines spécifiquement pour la prévention de CA-AKI.
-
15. Nous ne recommandons pas l'utilisation d'autres agents pharmacologiques décrits dans la littérature, notamment la théophylline, la prostaglandine E1, le nicorandil, l'acide ascorbique, l'allopurinol, l'alpha-tocophérol, le fénoldopam, les peptides natriurétiques et la trimétazidine.
Considérations sur les médicaments
-
16. Nous ne recommandons pas d'arrêter la metformine avant l'injection de produit de contraste et/ou de retester la fonction rénale par la suite, pour les patients avec un DFGe > 30 mL/min/1,73 m2.
-
17. Nous recommandons que chez les patients avec un DFGe ≤ 30 mL/min/1,73 m2 ou une IRA, la metformine soit interrompue au moment ou avant l'administration de l'ICM. La metformine ne doit pas être redémarrée avant au moins 48 heures et seulement si la fonction rénale reste stable (augmentation < 25 % par rapport à la créatinine initiale) et si l'utilisation continue de la metformine a été réévaluée par l'équipe clinique du patient.
-
18. Nous ne recommandons pas l'arrêt systématique des inhibiteurs du système rénine-angiotensine (IECA et ARA) avant ou après l'administration de MCI.
-
19. Nous ne recommandons pas d'arrêter systématiquement les diurétiques avant ou après l'administration de MCI.
Déclarations d'administration post-ICM
-
20. Nous recommandons une mesure de suivi de la créatinine sérique 48 à 72 heures après l'injection intra-artérielle de MCI chez tous les patients avec un DFGe ≤ 30 mL/min/1,73 m2. Pour le reste des patients, le risque d'IRA est extrêmement faible et les tests de routine ne sont pas justifiés. Cependant, tout patient à risque doit être invité à consulter un médecin et à subir un test de la fonction rénale s'il développe un essoufflement accru, un œdème périphérique ou s'il constate une baisse marquée de la production d'urine dans les jours suivant le test d'imagerie.
-
21. Nous recommandons que l'évaluation clinique et la prise en charge de l'IRA due à CA-AKI soient entreprises conformément aux lignes directrices de pratique clinique KDIGO (Kinney Disease Improving Global Outcomes) pour l'IRA et en tenant compte des commentaires de la Société canadienne de néphrologie (CSN) sur ces lignes directrices.
Professeur des universités praticien hospitalier chez APHM (Assistance Publique - Hopitaux de Marseille)
Recommandations canadiennes avant injections d iode. Que du bon sens reposant sur la littérature et on arrête de faire des créatininémie inutile avant et après. Une saine lecture pour les radiologues et les prescripteurs de scanners injectés
Le problème reste la diffusion de l’information dans la communauté radiologique et son adhésion aux nouvelles règles.
Pour les scanners "à froid" pas de problème. Pour les scanners en urgence , comme la recherche d'une embolie pulmonaire ou en cas d'ischémie artérielle aigue ou pour une coronarographie , tout se passe bien avec la ou le radiologie ou alors.....il faut négocier.......Créatinine , oh ma Créatinine !!!!


