Nicolas Gendron
-
Entretien avec Nicolas Gendron : Le Syndrome VEXAS
iconographie : VEXAS
"C'est dans l'ancienneté et la longue durée d'un gouvernement que se perdent ou les souvenirs, ou les occasions d'un changement, car chaque mutation laisse des pierres d'attente pour une nouvelle." Nicolas Machiavel
"Ce qui donne à un individu sa valeur génétique, ce n'est pas la qualité propre de ses gènes. C'est qu'il n'a pas la même collection de gènes que les autres ". François Gros et François Jacob
Le syndrome VEXAS est une nouvelle entité clinique décrite en 2020J’ai donc sollicité le Dr Nicolas Gendron pour "tout nous dire " sur ce syndrome, peu connu mais proche de la médecine vasculaire.
Un grand merci d'avoir accepté.
HématologistePraticien Hospitalier :
Service d'Hématologie biologique de l'Hôpital européen Georges Pompidou avec le Pr D SMADJA (cheffe de service, Pascale GAUSSEM)
Université de Paris, Innovation Thérapeutique en Hémostase, INSERM UMRS 1140 et Laboratoire de Recherches Biochirurgicales (Fondation Carpentier), Paris, France
Service d'hématologie biologique, Hôpital européen Georges Pompidou, Paris, France
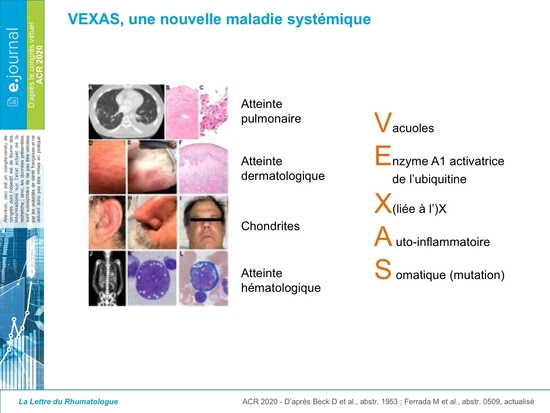
Syndrome VEXAS . qu'est-ce que c'est ?Le syndrome VEXAS (acronyme pour Vacuoles, E1 enzyme, X-linked, Autoinflammatory, Somatic) est une maladie auto-inflammatoire décrite chez l’adulte, causé par une mutation somatique du gène Ubiquitin like modifier activating enzyme 1 (UBA1) caractérisée en fin d’année 2020 aux états Unis et rapidement confirmée par plusieurs équipes Française.
Le syndrome VEXAS est majoritairement décrit chez les hommes avec une apparition progressive de la maladie après 50 ans. Les 25 patients de la cohorte initiale sont exclusivement des hommes, il a donc été suggéré que l’allèle du second chromosome X de la femme protégeait de l’action néfaste de l’allèle UBA1 muté. La description plus récente de plusieurs femmes VEXAS présentant au caryotype une monosomie du X conforte cette hypothèse. La vraie prévalence de ce syndrome est à ce jour inconnue mais les nombreuses descriptions tendent à monter que cette entité n’est pas si rare avec cependant une grande majorité de cas masculins atteints.
Typiquement les patients VEXAS présentent une maladie inflammatoire systémique avec des épisodes de fièvre inexpliqués, une atteinte pulmonaire, cutanée, vasculaire et articulaire. La majorité des patients répondent aux critères de diagnostic établis pour différentes maladies inflammatoires telles que le syndrome de Sweet, la polyartérite noueuse, la polychondrite récidivante. D’un point de vue hématologique, les patients VEXAS présentent des cytopénies et notamment une anémie macrocytaire (96%), un syndrome myélodysplasique (SMD, 24%), un myélome multiple (20%) et des évènement thromboemboliques.
Il s’agit d’une pathologie sévère, progressive et relativement résistante aux traitements jusqu’alors mis en place. Le taux de mortalité est élevé, de 25 % à 35 % à 5 ans.
Les complications thrombotiques sont rapportées chez environ 40% des patients VEXAS, avec une prédominance d’évènement thromboemboliques veineux (36.4%) plutôt qu’artériels (1.6%). A noter que la fréquence élevée d’
évènement thrombotique survenant au décours de maladies auto-inflammatoires ou avec dérégulation de l’immunité est déjà bien connue. Le diagnostic est génétique doit être suspecté face à une maladie inflammatoire systémique ne répondant pas au traitement habituel ou face à un SMD associé à des signes inflammatoires systémiques,. Ce diagnostic moléculaire du syndrome VEXAS se fait par séquençage du gène UBA1. Il ne s’agit pas d’une analyse de routine, actuellement disponible en centres très spécialisés (par exemple au laboratoire d’Hématologie de l’Hôpital Cochin, Pr O Kosmider)
Chez qui le rechercher en cas de MTEV chez un homme de plus de 50 ans sans facteur déclenchant ?
Pour rappel, selon les dernières recommandations de bonne prise en charge de la MTEV (Sanchez O, Rev Mal Res 2019).
R132 -Chez les patients présentant un premier épisode non provoqué de MVTE, il est recommandé :
- d’effectuer un examen physique attentif et de recueillir les antécédents néoplasiques personnels et familiaux et de répéter cette évaluation au cours des six premiers mois de suivi et d’orienter les investigations en fonction des éventuelles anomalies observées (grade 1+) ;
- en dehors de la surveillance du traitement anticoagulant classique (ionogramme sanguin avec créatininémie, tests hépatiques), de réaliser une radiographie de thorax (si un scanner thoracique n’a pas été réalisé pour le diagnostic d’EP), une numération formule sanguine, calcémie (grade1+) ;
- de mettre à jour les dépistages recommandés dans la population générale (grade 1+) : réaliser un frottis chez toutes les femmes, une mammographie après50 ans, et un PSA chez tous les hommes de plus de50 ans, sauf si ces examens ont été réalisés dans l’année précédente ;
- les éventuelles autres explorations seront guidées par les résultats des premiers examens (grade 1+).
R138 — Il est recommandé de ne pas réaliser de bilan de thrombophilie constitutionnelle chez les patients ayant un premier épisode de TVP proximale ou d’EP après 50 ans que la thrombose soit provoquée ou non
Dans notre étude qui incluait 97 patients de sexe masculin issus de la cohorte FARIVE (Pr J Emmerich) inclus à l’HEGP entre 2003 et 2009 pour lesquels de l’ADN était disponible et ayant présenté un évènement thrombotique veineux (dont 50.5% d’évènement non provoqué) : aucun patient ne présentait cette mutation.
Ces résultats ne sont pas en faveur de la recherche de mutations de l'exon 3 d'UBA1 chez tous les hommes de plus de 50 ans ayant un premier événement thromboembolique veineux, sans tenir compte des autres symptômes cliniques pouvant être associés au VEXAS.
 Mutation gène UBA1
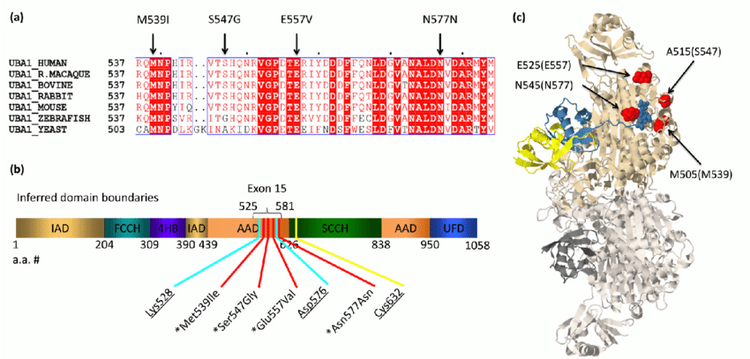
Mutation gène UBA1La présence de la mutation du gène UBA1 a quelles conséquences ?
Il s’agit d’une mutation somatique du gène Ubiquitin like modifier activating enzyme 1 (UBA1). Ce gène est situé sur le chromosome X et est impliqué dans le processus d’ubiquitination des protéines.
Chez les patients VEXAS, il est supposé que le défaut d’ubiquitination entraine une dérégulation de l’immunité innée et une inflammation systémique vasculaire favorisant la survenue de thrombose. En effet il est décrit une activation aberrante des monocytes et neutrophiles, un relargage important de cytokines qui participent à un état d’hypercoagulabilité. De plus, les vascularites rapportées chez certains de ces patients favorisent une dysfonction endothéliale participant au phénomène hypercoagulant. Il est à noter que les patients VEXAS présentent une formation accrue de NETS et que 44% des patients présentent des anticorps antiphospholipides persistants.
Merci Nicolas de cette mise au point qui était nécessaire et très utile. -
Entretien avec Nicolas Gendron : D Dimères
 “L’expérience est une observation provoquée dans le but de faire naître une idée.” Claude Bernard« Le savant n’étudie pas la nature parce que cela est utile ; il l’étudie parce qu’il y prend plaisir et il y prend plaisir parce qu’elle est belle. » Henri Poincaré" Comprendre c'est le reflet de créer " Auguste de Villiers de l'Isle-Adam
“L’expérience est une observation provoquée dans le but de faire naître une idée.” Claude Bernard« Le savant n’étudie pas la nature parce que cela est utile ; il l’étudie parce qu’il y prend plaisir et il y prend plaisir parce qu’elle est belle. » Henri Poincaré" Comprendre c'est le reflet de créer " Auguste de Villiers de l'Isle-Adam
Les D-dimères font la une depuis quelques années, mais quand et pourquoi sont-ils intéressants dans la démarche médicale actuelle. Sont-ils trop prescrits ? Sont-ils si utiles ?
Il était donc nécessaire de faire le point avec un spécialiste afin d’avoir un éclairage EBM sur leur utilisation.
J’ai donc sollicité le Dr Nicolas Gendron afin qu’une fois pour toute les D-dimères soient démystifiés, un grand merci d'avoir accepté. Hématologiste
Hématologiste
Praticien Hospitalier :
Service d'Hématologie biologique de l'Hôpital européen Georges Pompidou avec le Pr D SMADJA (cheffe de service, Pascale GAUSSEM)
Université de Paris, Innovation Thérapeutique en Hémostase, INSERM UMRS 1140 et Laboratoire de Recherches Biochirurgicales (Fondation Carpentier), Paris, France
Service d'hématologie biologique, Hôpital européen Georges Pompidou, Paris, France
@GendronNico
C’est tout d’abord un honneur de participer à cette interview et parler de l’apport et des limites d’un examen de biologie médicale dans la prise en charge des patients.Question 1
Pouve- vous nous rappeler ce que sont le D-dimères plasmatiques ?
On rentre dans le vif du sujet. Il faut d’abord se rappeler que le but de la cascade de la coagulation c’est de générer de la thrombine (facteur IIa) pour former à partir du fibrinogène de la fibrine (formation du caillot) et donc coaguler. Cette fibrine sera d’abord soluble puis avec l’action du FXIII, il va y avoir un cross-linking de cette fibrine pour qu’elle devienne insoluble et forme un caillot de fibrine insoluble et stable. C’est ensuite que les mécanismes de la fibrinolyse physiologiques vont dégrader ce caillot, par l’action de plasmine, en produits de dégradations de la fibrine (PDF) et en D-dimères.
Ainsi les D-dimères sont un marqueur indirect de la coagulation car ils représentent en fait la lyse d’un caillot préalablement formé. Ainsi les monomères de fibrines sont quant à eux un marqueur de coagulation.
A noter qu’en cas de fibrinolyse sur un caillot de fibrine soluble (avant l’action du FXIII) dans le cas de la fibrinogénolyse (pathologie acquise et extrêmement rare de la coagulation), on aurait formation de PDF sans formation D-dimères.
Question 2A votre avis quand doit-on prescrire l’évaluation des D-dimères et pourquoi ?
A mon avis, par ordre de priorité/pertinence/évidence clinico-biologique
- Dans le cadre d’une suspicion d’embolie pulmonaire de probabilité clinique faible ou modérée du fait leur très bonne valeur prédictive négative (VPN). Dans le but d’exclure en toute sécurité le diagnostic d’EP et d’éviter le recours à un angio-scanner cher, irradiant et potentiellement néphrotoxique. Il y a actuellement, plusieurs stratégies d’exclusion de l’EP en fonction du taux de D-dimères. La plus utilisée en France et selon les recommandations Française de 2019 de prise en charge de la maladie veineuse thromboembolique (MTEV, Sanchez O et al., Rev Mal Res 2019) : Age-ADJUST+++ : le seuil D-dimères ajusté à l’âge. Après évaluation de la probabilité clinique, le taux D-dimères pour exclure l’EP est : 500 ng/mL pour les moins de 50 ans ou 10 ng/mL x âge pour les >50 ans
Mais il existe d’autres stratégies en cours de développement qui adaptent le taux de D-dimères à la probabilité clinique : par exemple, le seuil de D-dimères sera plus élevé lorsque la probabilité clinique sera faible et inversement. Il s’agit des stratégies YEARS (van der Hulle T et al., Lancet 2017) ou encore PEGeD (Kearon C et al., PEGeD ,NEJM 2019).
Pour rappel, il n’est pas recommandé de réaliser un dosage des D-dimères chez un patient sous anticoagulation à dose curative, en effet le taux peut-être faussement négatif (perte de sa VPN) et si il est positif, il faudra, dans tous les cas, recourir à l’imagerie.
Dans le diagnostic d’exclusion de thrombose veineuse profonde (TVP) les D-dimères peuvent être utile pour le diagnostic de la TVP des membres inférieurs voire des membres supérieurs. Le score âge-ADJUST est souvent utilisé mais il n’y a encore à ce jour de validation prospective de ce score, seulement rétrospectif.- La place des D-dimères est devenue importante pour évaluer la durée de traitement anticoagulant chez les femmes (uniquement !) et sous anticoagulant dans le cadre du score HERDOO-2 (men continue). En effet, chez une femme sous anticoagulant après un 1er évènement non provoqué de TVP/EP si le score HERDOO-2 est <2, on pourra arrêter le traitement anticoagulant avec un très faible risque de récidive.
Pour les puristes, le score HERDOO-2 a été validé en évaluant les taux de D-dimères sous anticoagulant mais en très grande majorité sous AVK et avec le kit de D-dimères VIDAS uniquement.
- Dans le diagnostic biologique de coagulation intravasculaire systémique (CIVD),en effet dans cette situation d’urgence (thrombopénie, diminution du TP, du FV et du fibrinogène) mais parfois difficile en cas de sepsis (car D-dimères souvent déjà élevés). Dans cette situation-là, les monomères de fibrines semblent plus pertinents car un vrai marqueur d’activation de la coagulation.
- Nouvelle indication des D-dimères dans la COVID-19,mais attention à ce qu’on veut leur faire dire. Dans la COVID-19, ces taux importants de D-dimères reflètent la microthrombose vasculaire associée à la maladie et font partie de la nouvellement nommée « coagulopathie associée à la COVID-19 ».
Les D-dimères comme marqueurs pronostiques uniquement : de nombreuses études ont montré que le taux de D-dimères à l’admission pour COVID-19 était associé à la gravité de la maladie mais aussi prédictible au risque de passage en réanimation et de mortalité (Zhou et al., Lancet 2020 et Tang JTH 2020). Par ailleurs, notre équipe (INSERM_1140, Pr D SMADJA) a montré à partir d’une étude multicentrique de la Société Française de Cardiologie qu’un seuil supérieur à 1120 ng/mL de D-dimères chez les patients en unité médicale COVID-19 était prédictif de mortalité indépendamment du risque de MVTE.
Au cours de la COVID-19, de nombreuses équipes ont voulu « réinventer » le rôle des D-dimères dans la MTEV,et donc de prédire le risque de faire une thrombose… Il faut recourir à l’imagerie et non pas faire des D-dimères pour leur valeur prédictive positive (ce qui n’a jamais été leur rôle). Le dépistage systématique de la MTEV n’est pas recommandé par l’ISTH (Spyropoulos AC et al., JTH 2021). Les stratégies classiques devant une suspicion de TVP ou d’EP proposent d’évaluer les D-dimères devant une probabilité clinique faible, ce qui n’est pas applicable dans cette population du fait de la coagulopathie et des D-dimères élevés, il faudrait probablement définir un seuil de D-dimères adapté à cette pathologie (des études sont en cours…). En attendant, l’ISTH suggère donc de réaliser un angio-TDM pulmonaire ou une scintigraphie ventilation/perfusion d’emblée devant une suspicion clinique d’EP.
Question 3
Aujourd’hui on assiste à des demandes de dosages des D Dimères à tort et à travers, notamment en médecine de ville. Ces demandes ne sont pas toujours justifiées. Pouvez- vous nous dire quand faut-il vraiment les prescrire ? Dans quelles circonstances ?
Actuellement, dans le contexte de vaccination de masse anti-COVID-19 et après la description de très rares cas de VITT (vaccine-induced thrombotic thrombocytopenia) après la vaccination par AstraZeneca et Janssen, certains médecins prescrivent des contrôles de NFS et de D-dimères après vaccination pendant 15-21 jours, sans que pour l’instant il n’y ait de rationnel scientifique/médical à une telle pratique.
En revanche, il y a une jolie étude des Italiens sur 30 volontaires sains vaccinés par comirnaty (Pfizer/BioNTech) avec évaluation de l’hémostase avant vaccination, à J7 et J21 qui montre, parmi les nombreux tests globaux et très spécialisés d’hémostase que rien ne bouge après vaccination (ni D-dimères, ni anticorps anti-PF4/héparine entre autres, Peyvandi F et al., Thromb Up 2021).Concernant la VITT, il faut garder en mémoire qu’elle est très rare (entre 1 :100000 et 1 :500000) et que les cas ont eu lieux chez des patients sans thrombophilie et sans antécédent de thrombose.
Il faut savoir qu’un dosage de D-dimères, c’est autour de 15 euros,ce qui en biologie médicale commence à être un examen cher. Concernant les situations où les prescrire, je reviendrais à la question précédente, n°2.
Question 4
On se retrouve quelquefois avec des D Dimères très élevés en l’absence de maladie thrombo embolique veineuse. Quelle est la conduite à tenir ? Quelles sont les circonstances cliniques qui expliquent cette augmentation ? Que faut-il faire en cas de D Dimères élevés en l’absence de toute cause à priori ? Les D Dimères élevés peuvent-ils être des annonciateurs de cancer.
Encore une fois, tout D-dimères en dehors de tout contexte évoqué plus haut n’a pas d’intérêt.
En l’absence de MTEV, si les D-dimères sont élevés chez un patient, le prélèvement peut être coagulé et la libération de D-dimères sera un marqueur de « coagulation dans le tube », votre laboratoire est sensé vérifié le « pré-analytique » c’est-à-dire si le tube est conforme (pas coagulé, bien rempli et pas hémolysé). Il s’agit de la 1èreétape de raisonnement d’un biologiste devant un D-dimères élevés.Puis évaluer le taux en fonction du reste du bilan : TP, facteurs du TP, fibrinogène et plaquettes pour s’assurer qu’il n’y ait pas de consommation de la coagulation faisant suspecter une CIVD.
Et enfin, vérifier le contexte clinique et autre cause d’élévation des D-dimères : syndrome inflammatoire aiguë ou chronique, sepsis, (COVID-19), grossesse et cancer.
En l’absence de suspicion clinique de thrombose, il ne faut pas réaliser d’examen d’imagerie à la recherche de thrombose. Vérifier le bilan inflammatoire du patient notamment. Oui les D-dimères élevés sont observés le cas du cancer, et pourraient faire donc suspecter un cancer chez un patient asymptomatique. Dans le cas d’une découverte « fortuite » de D-dimères élevés chez un sujet de + de 50 ans, il peut paraître utile de vérifier tout d’abord si les dépistages liés à l’âge et au sexe ont bien été réalisés.
Question 5
L’ajustement à l’âge du dosage des D Dimères est désormais validé en cas de suspicion de maladie thrombo embolie veineuse notamment en cas de suspicion d’embolie pulmonaire. Quelle est votre expérience dans ce domaine ?
De notre expérience, comme évoqué en question n°2, nous utilisons le score Age-Adjust. Encore une fois, bien évaluer la probabilité clinique pré-test et pas de dosage D-dimères chez des patients sous anticoagulant à dose curative.
Question 6
La Covid-19 est à l’origine d’une augmentation des D Dimères. Comment faut-il les gérer pour les patients hospitalisés en médecine et les patients en réanimation. Les D Dimères sont-ils un curseur de gravité ? Ont-ils un impact sur la décision d’augmenter éventuellement la dose des HBPM en prophylaxie ?
La COVID-19 a été rapidement associée à une forte activation de la coagulation suggérée par une élévation importante du taux de D-dimères associé à une mortalité accrue (Zhou et al., Lancet 2020), une activation endothéliale (Smadja DM et al., Angiogenesis 2020 et 2021) et à une prévalence inattendue de thromboses veineuses et artérielles. Dans ce contexte de réponse inflammatoire intense, l’activation de la coagulopathie peut être liée à des mécanismes de thrombo-inflammation.
Au début de l’épidémie chinoise, les auteurs ont évoqué une prévalence élevée de CIVD chez leur patient avec des taux de D-dimères très élevés (2). Rapidement les premières séries européennes ont démontré que l’hyperfibrinogénémie, les taux d’antithrombine et de monomères de fibrine ainsi que l’absence de thrombopénie profonde dans la majorité des cas (7) n’étaient pas en faveur d’une CIVD chez les patients mais plutôt d’une coagulopathie spécifique à la COVID-19. Les taux de D-dimères très élevés au cours de la COVID-19 seraient le reflet à de la micro et/ou macrothrombose disséminées et ainsi que d’anomalies de la fibrinolyse.Je le rappelle encore une fois, mais dans la COVID-19, les D-dimères sont à ce jour qu’un marqueur de gravité et de mauvais pronostique.
Le risque de MTEV dans la COVID-19 est élevé (environ 20% des patients avec une forme critique), même s’il reste actuellement mal défini, en particulier chez les patients ambulatoires. L’ISTH suggère un monitoring de différents paramètres de la coagulation (TP, D-dimères, plaquettes et fibrinogène) et une anticoagulation préventive par HBPM chez tous les patients COVID-19 nécessitant une hospitalisation en l’absence de contre-indication. Chez les patients atteints de COVID-19 pris en charge en ambulatoire, ou sortant d’un séjour hospitalier pour une infection à SARS-CoV-2, une thromboprophylaxie médicamenteuse systématique n’est pas recommandée (ni dosage de D-dimères) mais elle est suggérée en cas de présence de facteurs de risques additionnels tels qu’un antécédent connu de MVTE ou un cancer évolutif d’après les propositions de la Société Française de Médecine Vasculaire (Khider L et al., JMV 2020)
Par ailleurs, la posologie des traitements anticoagulants en prévention fait débat: un essai multicentrique français (via le réseau INNOVTE) a évalué l'efficacité d’une posologie d’héparine de bas poids moléculaire intermédiaire ajustée au poids, comparativement à une posologie prophylactique conventionnelle, sur la survenue d’événements thromboemboliques veineux chez les patients atteints de COVID-19 hospitalisés (COVI-DOSE; NCT04373707). Les résultats sont à venir prochainement.
Brièvement, a ce jour, on se rapproche de la « bonne dose », il semble que la théorie du « Earlier is Better » semble se confirmer. L'anticoagulation aurait un rôle important dans la phase précoce de la maladie. En tous cas, chez le patient en réanimation, la dose d’anticoagulation préventive standard semble l’idéal. En revanche, chez le patient hospitalisé en unité médical COVID-19, il semble que l’anticoagulation à dose curative semble intéressante et notamment chez ceux avec les D-dimères les plus élevés (donc la maladie la plus active ?).
De plus, nous avions montré dans une étude rétrospective multicentrique avec la Société Française de Cardiologie que les patients hospitalisés pour COVID-19 et qui étaient sous anticoagulation orale à dose curative pour de la FA ou MTEV présentaient un meilleur pronostique que ceux non (Chocron R et al., JAHA 2021). Affaire à suivre !Dernière question : carte blanche
Si je peux donner un conseil, je pense que tout Médecin ayant appétence pour la MTEV et les traitements anticoagulants doit se rapprocher de son laboratoire (hospitalier et/ou libéral) et de son biologiste médical afin de connaître les types de tests que réalise son laboratoire (Kit de D-dimères, dosage des anticoagulants, délai de rendu) et ses besoins pour sa pratique clinique afin d’identifier les axes de prescription biologique à améliorer.
Le dialogue clinico-biologique est important et fait progresser le Biologiste Médicale ainsi que le Médecin (Vasculaire ou Généraliste, entre autres) mais surtout la prise en charge des patients atteints de MTEV.
Un grand MERCI,les D Dimères font partie de notre quotidien en Médecine Vasculaire, nous allons grâce à ces réponses claires et pertinentes encore mieux les maîtriser et mieux les utiliser...et mieux les faire prescrire.......

