Un document de consensus Delphi international, fondé sur des experts, sur des questions controversées dans la gestion des anévrismes de l'aorte abdominale
J Vasc Surg. 2024 Aug 13:S0741-5214(24)01712-9. doi: 10.1016/j.jvs.2024.08.012. Epub ahead of print. PMID: 39147288.https://www.jvascsurg.org/article/S0741-5214(24)01712-9/abstract
Objectif : En raison de données contradictoires, inadéquates ou controversées dans la littérature, plusieurs questions concernant la prise en charge des patients atteints d'anévrismes de l'aorte abdominale (AAA) restent sans réponse. L'objectif de ce document de consensus Delphi international, basé sur des experts, était de fournir des orientations aux cliniciens sur ces sujets controversés.
Méthodes : Un document de consensus Delphi en trois étapes a été produit avec 44 experts sur 6 sujets prédéfinis concernant la gestion des AAA. Toutes les réponses ont été fournies de manière anonyme. Le taux de réponse pour chaque étape était de 100 %.
Résultats :
* La plupart des participants (42 sur 44 [95,4 %]) ont convenu qu'un volume minimum de cas par an est essentiel (ou probablement essentiel) pour qu'un centre propose une réparation ouverte ou endovasculaire des AAA (EVAR).
* De plus, 33 sur 44 (75,0 %) pensaient que les programmes de dépistage des AAA sont (probablement) toujours efficaces sur le plan clinique et rentables.
* De plus, la plupart des panélistes (36 sur 44 [81,9 %]) ont voté que la surveillance après EVAR devrait être (ou devrait probablement être) à vie.
* Enfin, 35 des 44 participants (79,7 %) pensaient que les femmes fumeuses devraient (ou devraient probablement/possiblement) être considérées pour un dépistage à 65 ans, comme les hommes. Aucun consensus n'a été atteint concernant l'abaissement du seuil de réparation des AAA et la nécessité d'une prophylaxie de la thrombose veineuse profonde chez les patients subissant une EVAR.
Conclusions : Ce document de consensus Delphi élaboré par des experts fournit des orientations aux cliniciens concernant des questions spécifiques non résolues. Aucun consensus n'a pu être trouvé sur certains sujets, ce qui souligne la nécessité de poursuivre les recherches dans ces domaines.
EXTRAITS
FOCUS SURVEILLANCE
La surveillance après EVAR doit-elle durer toute la vie ?
L’absence de décès lié à l’AAA était de 96,9 % et de 92,0 % à 5 et 10 ans pour les patients faisant l’objet d’un suivi continu, et de 99,7 % et de 98,0 % à 5 et 10 ans, respectivement, pour les patients ayant cessé le suivi (rang logarithmique P < 0,001).
La survie globale était plus élevée chez les patients dont le suivi d’imagerie avait été interrompu (rang logarithmique P < 0,001). La survie globale était de 80,3 % et 49,6 % à 5 et 10 ans pour les patients dont le suivi d’imagerie avait été interrompu, tandis qu’elle était de 58,6 % et de 35,5 % à 5 et 10 ans pour les patients dont le suivi était continu.
* Le second est le groupe à haut risque (présence d’endofuite de type II, anatomie en dehors du mode d’emploi, chevauchement ou étanchéité insuffisant <10 mm, col proximal >30 mm, zones de fixation iliaque ectatique [>20 mm] ou angulation extrême [>60°]). Ces patients pourraient être envisagés pour des examens annuels avec tomodensitométrie, angiographie ou échographie duplex. Les patients présentant un rétrécissement du sac de ≥10 mm peuvent être considérés comme à faible risque d’échec, passer au groupe à faible risque et ne répéter l’imagerie que jusqu’à 5 ans après l’opération.
* Le troisième groupe est le groupe d’échec EVAR (endofuite directe de type I ou de type III, dégradation évidente des zones d’étanchéité ou croissance du sac d’anévrisme de >10 mm) qui doit être envisagé pour une intervention secondaire.
Les programmes de dépistage AAA sont-ils toujours efficaces sur le plan clinique et rentables aujourd’hui ?
Une recommandation plus faible a été fournie pour les hommes et les femmes >75 ans en bonne santé et ayant des antécédents de tabagisme qui n’ont pas déjà été dépistés (grade 2C) et les parents au premier degré âgés de ≥65 ans de patients présentant un AAA qui sont en bonne santé (grade 2C). L’ESVS 2024
Les lignes directrices ont modifié leur recommandation par rapport à 2019, où elles recommandaient le dépistage de la population pour tous les hommes à l’âge de 65 ans (classe I ; niveau de preuve a),3 et a recommandé le dépistage par échographie pour la détection précoce de l’AAA dans les populations à haut risque afin de réduire le nombre de décès par rupture de l’AAA (classe I ; Niveau de preuve : A). La définition des populations à risque élevé varie en fonction des conditions locales, comme la prévalence de la maladie, l’espérance de vie et la structure des soins de santé.2
Une analyse des données individuelles des patients sur l’incidence de l’AAA, de la mortalité AAA et de la chirurgie de l’AAA dans une cohorte d’hommes suédois âgés de 65 ans a montré que la mortalité AAA avait considérablement diminué entre le début des années 2000 et 2015, et que le dépistage AAA n’était plus associé à une diminution significative de la mortalité liée à l’AAA.Ces données sont toutefois contredites par des études nationales de dépistage menées en Suède, qui suggèrent que le dépistage chez les hommes de 65 ans a entraîné une réduction significative de la mortalité liée à l’AAA.
En raison de la prévalence plus faible des AAA chez les femmes, il a été soutenu qu’un programme de dépistage des AAA pour les femmes pourrait ne pas être rentable.
À un seuil de volonté de payer de 50 000 $ par année, le dépistage était rentable chez 84 % des hommes et 90 % des femmes. De même, une analyse antérieure des données sur les coûts à l’aide des données du ministère des Anciens Combattants aux États-Unis a conclu que les programmes de dépistage AAA sont toujours réalisables et rentables. Une étude sur le modèle de Markov réalisée en Suède a suggéré que le dépistage des AAA chez les hommes reste rentable, même si la prévalence de la maladie est aussi faible que 0,5 %. Bien que la prévalence des AAA ait été plus faible dans les rapports récents des programmes de dépistage par rapport aux ECR originaux évaluant les avantages possibles du dépistage des AAA, la prévalence actuelle rapportée en Suède et au Royaume-Uni est supérieure à ce seuil.
Trois populations de patients sont exclues des lignes directrices, mais méritent un examen plus approfondi pour réexaminer la couverture, à savoir les non-fumeurs présentant d’autres facteurs de risque équivalents, les patients de > 75 ans et les femmes.
À l’heure actuelle, seules les femmes âgées de 65 à 75 ans ayant des antécédents familiaux d’AAA peuvent subir un dépistage. En l’absence d’antécédents familiaux positifs, même une femme présentant de multiples facteurs de risque et un risque élevé d’AAA ne serait pas admissible au dépistage.
Malgré les directives et les recommandations actuelles, <15 % des patients éligibles subissent un dépistage AAA. Il a donc été soutenu que le dépistage AAA devrait être étendu.
Pourtant, 28 % des patients subissant une réparation de l’AAA ne répondaient à aucun critère de dépistage, en particulier les patients de < 65 ans ayant des antécédents de tabagisme excessif et ceux de ≥65 ans sans antécédents de tabagisme.
* DEPISTAGE : à maintenir pour une population ciblée comme tous les dépistages.
- Les opérations de dépistage comme VESALE devraient être pérénisées
- 50% des patients qui ont un antécédent familial au premier degré d'anévrisme de l'aorte abdominale ignorent totalement qu'ils peuvent être concernés
* SUIVI des AAA : il doit être échographique, le suivi recommandé par la SFMV(2006) reste d'actualité

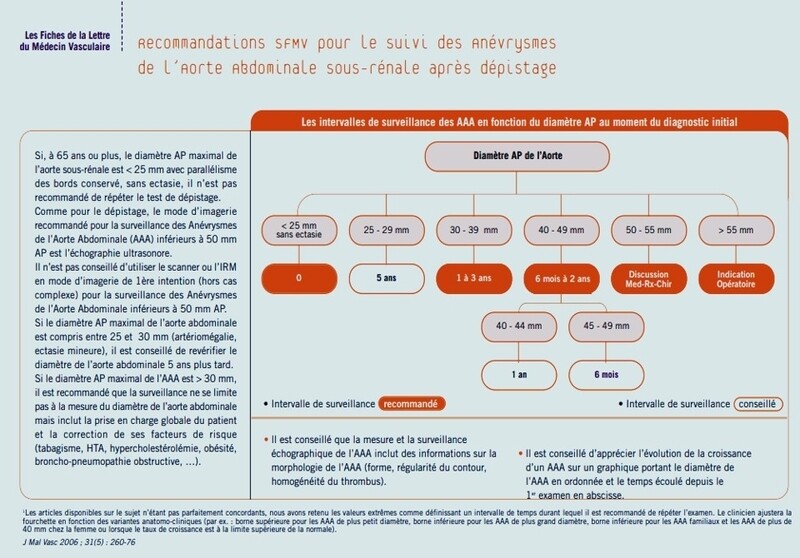
- LES SITES D'IMPLANTATION DES ENDO PROTHESES AORTIQUES
- Sites experts, avec une solide expérience à la fois pour l'endovasculaire et la chirurgie ouverte, il s'agit d'un volume minimal......> 15 /an, voire plus , le débat reste ouvert aux chirurgiens de trancher
Quelle différence entre chirurgie ouverte et endoprothése en matière d'expérience ?
Ce qui est sûr c'est qu'un nombre important de procédures réduit le taux de complications et de mortalité , une évidence......
SUIVI des ENDOPROTHESES AORTIQUES
- Nécessaire oui, par écho-Doppler oui, mais à quel rythme ?
On peut ptoposer un écho Doppler en post op avec un scanner injecté puis les contrôles devraient être strictement réalisé par les ultrasons , à 6 mois pui 12 mois, puis annuellement
- A discuter le carctère systématique d'une injection de DONOVUE au controle 1, puis en cas de problème
- En cas de rétraction rapide du sac anécrismal , il est logique d'espacer les contrôles, tous les 2 ans par exemples
* AAA chez la femme
- Dépistage OUI entre 65 et 75 ans d'autant plus qu'il; existe un antécédent familial, qu 'il s'agit de patients tabagiques et ou avec une HTA
- Attention les AAA chez les femmes sont à haut risque en cas d'endoprothèse ou de chirurgie
- Toujours tenir compte du DAP de l'aorte coeliaque, un AAA de 40 mm pour une aorte coeliaque de 10 mm doit être opéré.
- Il faut arrêter de dire que les AAA chez les femmes n'existent pas- * Prospective
- Les controverses c'est intéréssant mais la prospective c'est mieux .
L'IA devra et devrait nous permettre d'anticiper rapidement les endofuites par l'imagerie scanner ou IRM mais aussi par les ultrasons. De plus un produit de contraste écho per os révolutionnera l'écho de contraste.
Enfin quelle place pour la METFORMINE , la réponse à la fin de ce papier........
A LIRE
AAA : des conseils simples
https://medvasc.info/archives-blog/aaa-des-conseils-simples?highlight=WyJhYWEiXQ==
AAA : sa croissance
https://medvasc.info/archives-blog/aaa-et-sa-croissance?highlight=WyJhYWEiXQ==
Dépistage opportuniste des AAA
https://medvasc.info/archives-blog/d%C3%A9pistage-opportuniste-des-aaa?highlight=WyJhYWEiXQ==
AAA FEMMES/HOMMES
https://medvasc.info/archives-blog/aaa-femmes-hommes?highlight=WyJhYWEiXQ==
AAA : demain
https://medvasc.info/archives-blog/an%C3%A9vrisme-aorte-abdominale-demain?highlight=WyJhYWEiXQ==
OUI l'anévrisme de l'aorte abdominale est très grave chez la femme
https://medvasc.info/archives-blog/oui-l-an%C3%A9vrisme-de-l-aorte-est-tr%C3%A8s-grave-chez-la-femme?highlight=WyJhYWEiXQ==
Le futur lointain de la prise en charge de l'AA by PERPLEXITY/IA
Dans un futur lointain, la prise en charge de l'anévrisme de l'aorte abdominale (AAA) évoluera probablement vers des approches encore plus avancées et moins invasives.
Voici quelques perspectives sur la prise en charge future :- Traitement endovasculaire perfectionné : Les endoprothèses deviendront encore plus sophistiquées, avec des matériaux biocompatibles et des designs adaptés à des anatomies complexes. Les endoprothèses fenêtrées, déjà utilisées pour les anévrismes juxtarénaux, seront probablement plus répandues et perfectionnées
- Techniques mini-invasives améliorées : Les procédures endovasculaires continueront à s'améliorer, réduisant davantage les risques et les temps de récupération. Ces techniques pourraient devenir applicables à un plus grand nombre de patients, y compris ceux présentant des anatomies complexes
- Imagerie et planification préopératoire avancées : L'utilisation de l'intelligence artificielle et de la réalité augmentée pourrait permettre une planification plus précise des interventions et un suivi personnalisé.
- Thérapies génétiques et cellulaires : Des traitements ciblant les mécanismes moléculaires responsables de la formation et de la progression des anévrismes pourraient être développés, offrant des options préventives ou curatives non chirurgicales.
- Surveillance post-opératoire optimisée : Les protocoles de suivi seront probablement affinés, avec des techniques d'imagerie non invasives plus performantes et des dispositifs implantables pour une surveillance en temps réel.
- Traitements pharmacologiques ciblés : De nouveaux médicaments pourraient être développés pour stabiliser la paroi aortique ou prévenir la croissance des anévrismes, offrant des alternatives aux interventions invasives pour certains patients.
- Personnalisation du traitement : L'approche thérapeutique sera de plus en plus individualisée, prenant en compte les caractéristiques génétiques, les facteurs de risque spécifiques et les préférences du patient.
Un article très récent fait le point sur la METFORMINE et la croissance des AAA ++++
Wanhainen A, Dalman RL. Update on Ongoing Randomised Controlled Trials Evaluating the Protective Effect of Metformin on Abdominal Aortic Aneurysm Progression. Eur J Vasc Endovasc Surg. 2025 Jan;69(1):6-8. doi: 10.1016/j.ejvs.2024.08.042. Epub 2024 Aug 30. PMID: 39216792.
https://www.ejves.com/article/S1078-5884(24)00786-X/fulltext
Article libre d'accès
Suite aux travaux pionniers de Lederle et al. sur une association négative entre le diabète et la survenue d'anévrisme de l'aorte abdominale (AAA) et de Fujimura et al. sur l'importance de la metformine , plusieurs études observationnelles et expérimentales ont souligné un effet protecteur potentiel de la metformine dans l'AAA, mais son efficacité dans la prévention de l'expansion et des événements de l'AAA reste à démontrer clairement par des essais cliniques. En conséquence, quatre essais contrôlés randomisés ont été lancés pour confirmer ou infirmer si la metformine, le médicament antidiabétique oral le plus courant au monde, a un effet inhibiteur sur la croissance de l'anévrisme également chez les patients non diabétiques.Nous résumons ici ces efforts et fournissons un bref rapport d'étape.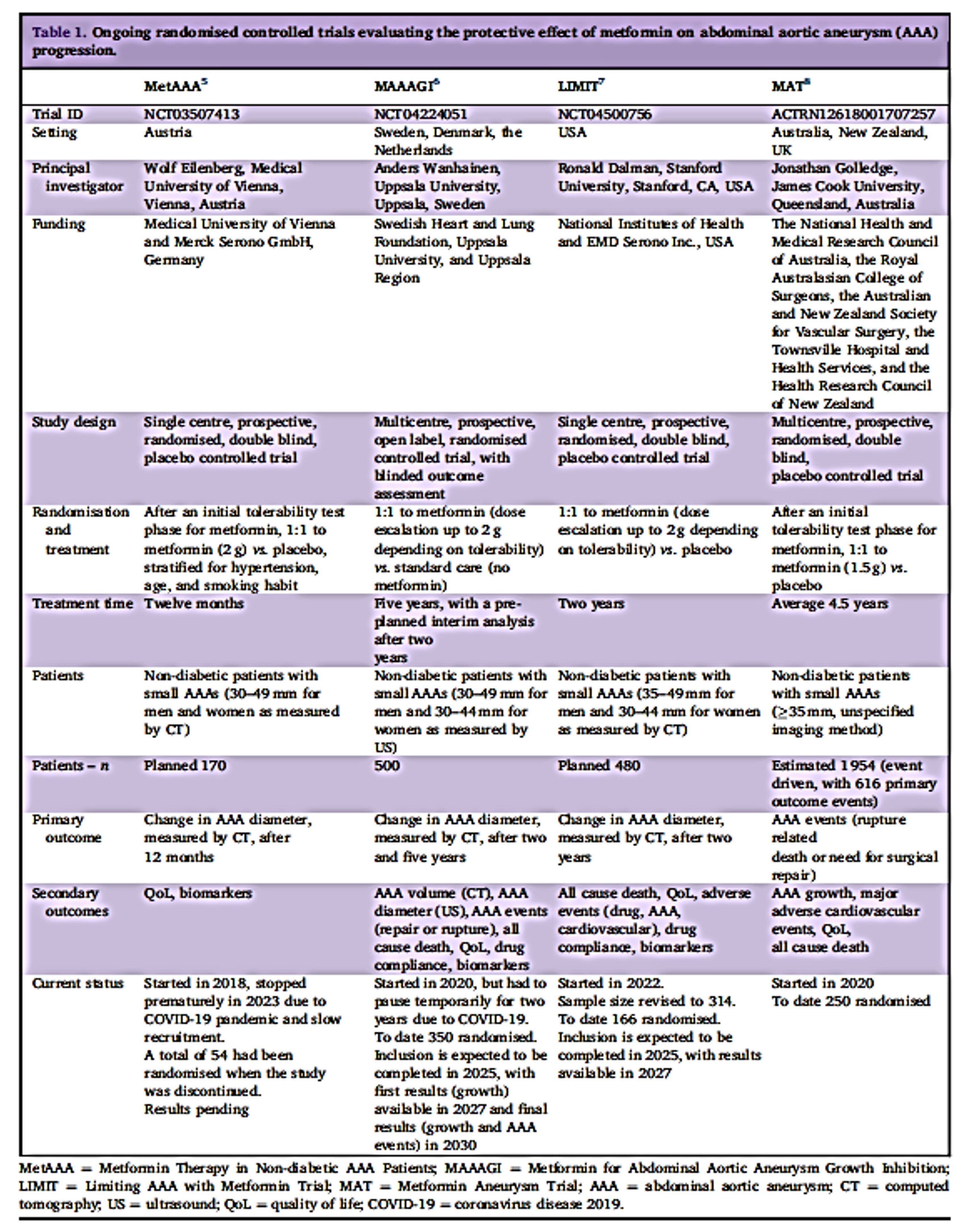
En résumé, des preuves de niveau I sur l'effet protecteur de la metformine sur la progression de l'anévrisme sont à portée de main. Si tel est le cas, cela signifierait un changement de paradigme dans la prise en charge de l'AAA. Dans le cas contraire, la recherche d'une option de traitement médical se poursuivra certainement. Quoi qu'il en soit, les spécialistes vasculaires qui soignent des patients atteints d'une maladie AAA sont encouragés à envisager de recommander des candidats éligibles pour participer à l'essai.
Il faut y croire ou pas ?
C'est de la prospective passionnante
Copyright : Dr Jean Pierre Laroche / 2025 - Traitement endovasculaire perfectionné : Les endoprothèses deviendront encore plus sophistiquées, avec des matériaux biocompatibles et des designs adaptés à des anatomies complexes. Les endoprothèses fenêtrées, déjà utilisées pour les anévrismes juxtarénaux, seront probablement plus répandues et perfectionnées

