"Quand on aime la vie, on aime le passé, parce que c'est le présent tel qu'il a survécu dans la mémoire humaine." Marguerite Yourcenar
"Si quelqu'un dit qu'il a compris la "maladie d'Alzheimer", c'est qu'on lui a mal expliqué… " Alpha Blondy
"Le nom d'Alzheimer permet aux médecins qui l'utilisent de croire qu'ils savent ce qu'ils font, même quand ils ne font rien." Christian Bobin
Dubois B , Villain N , Schneider L, et al. La maladie d'Alzheimer en tant que construction clinique et biologique - Recommandation d'un groupe de travail international. JAMA Neurol. Publié en ligne le 1er novembre 2024. doi:10.1001/jamaneurol.2024.3770
https://jamanetwork.com/journals/jamaneurology/fullarticle/2825806
Article libre d'accès
Données USA
Importance
Depuis 2018, un mouvement a émergé pour définir la maladie d'Alzheimer (MA) comme une entité purement biologique basée sur les résultats des biomarqueurs. La récente révision des critères de l'Alzheimer Association (AA) pour la MA va dans ce sens. Cependant, les inquiétudes concernant une définition purement biologique de la MA appliquée cliniquement, la compréhension de la MA par la société dans son ensemble et la traduction des biomarqueurs sanguins dans la pratique clinique ont incité le Groupe de travail international (GTI) à mettre à jour ces recommandations.
Objectif
Examiner les critères AA révisés et proposer une vision définitionnelle alternative de la MA en tant que construction clinico- biologique à usage clinique. Les recommandations des critères diagnostiques 2021 de l'IWG sont mises à jour pour élaborer davantage les états à risque et pré symptomatiques.
Examen des données probantes
PubMed a été consulté pour trouver des articles publiés entre le 1er juillet 2020 et le 1er mars 2024, en utilisant les termes « biomarqueur » OU « amyloïde » OU « tau » OU « neurodégénérescence » OU « préclinique » OU « LCR » OU « PET » OU « plasma » ET « maladie d'Alzheimer ». Les références des articles pertinents ont également été consultées.
Résultats
Selon les nouveaux critères diagnostiques de l'AA, la maladie d'Alzheimer peut être définie cliniquement comme englobant les personnes cognitivement normales présentant un biomarqueur de base 1 de la maladie d'Alzheimer.
Cependant, la littérature récente montre que la majorité des personnes cognitivement normales présentant un biomarqueur positif ne deviendront pas symptomatiques à court terme. Dans le contexte clinique, la révélation d'un diagnostic de maladie d'Alzheimer à des personnes cognitivement normales présentant uniquement des biomarqueurs de base 1 de la maladie d'Alzheimer représente l'implication la plus problématique d'une définition purement biologique de la maladie.
Conclusions et pertinence
L’objectif ultime de ce domaine était de favoriser des traitements efficaces de la MA, notamment la prévention des symptômes et de la démence. L’approche consistant à diagnostiquer la MA sans construction clinique et biologique serait injustifiée et potentiellement préoccupante sans une connaissance claire du moment où les symptômes se développeront ou non. Il est recommandé que les personnes qui sont uniquement positives à l’amyloïde et, plus généralement, la plupart des personnes cognitivement normales positives aux biomarqueurs, ne soient pas étiquetées comme atteintes de la MA. Elles devraient plutôt être considérées comme étant à risque de MA. L’expansion de la MA pré symptomatique est considérée comme une meilleure construction diagnostique pour les personnes présentant un profil spécifique de biomarqueurs, indiquant qu’elles sont proches de l’expression des symptômes dans un avenir proche.
Lexique du groupe de travail international 2024
Nous encourageons l’utilisation des termes suivants : à risque de maladie d’Alzheimer , maladie d’Alzheimer pré symptomatique et maladie d’Alzheimer selon les définitions suivantes :
Asymptomatique à risque de maladie d'Alzheimer (MA)
-
Désigne les individus cognitivement normaux présentant un risque accru de développer une déficience cognitive en raison d’un risque incertain/indéterminé associé à un profil de biomarqueur donné.
-
Avec les données actuellement disponibles, le profil du biomarqueur correspond à une amylose cérébrale isolée ou associée à une tauopathie limitée aux régions temporales médianes ou à un biomarqueur fluide tau phosphorylé positif (p-tau).
-
Le risque à vie de progression vers une déficience cognitive est accru par rapport aux individus dont les biomarqueurs sont négatifs, mais reste loin d’un taux déterministe de progression clinique.
-
Ils ne devraient pas être définis comme atteints de la maladie d’Alzheimer.
MA pré symptomatique
-
Désigne les individus cognitivement normaux avec un modèle spécifique de biomarqueurs associés à un risque de progression presque déterministe et très élevé tout au long de la vie.
-
Exemples de profils de biomarqueurs associés à des conditions pré symptomatiques :
-
Variations génétiques autosomiques dominantes hautement pénétrantes associées à un risque à vie proche de 100 % de MA clinique : APP , PSEN1 , PSEN2
-
Personnes atteintes du syndrome de Down
-
Personnes homozygotes pour l' allèle APOE e4 4 avec perte de fonction SORL1 . (Pour ces profils, l'âge et l'âge des parents sont un facteur supplémentaire à prendre en compte pour la détermination de l'âge d'apparition de l'expression clinique de la MA).
-
Modifications sporadiques des biomarqueurs de la pathologie de la MA (± contexte génétique) associées à un risque très élevé à vie de MA clinique, comme la tomographie par émission de positons (TEP) amyloïde + avec la TEP tau (+) dans les régions néocorticales.
-
Des études futures issues d’une cohorte basée sur la population pourraient identifier des profils de biomarqueurs distincts, y compris des facteurs de risque supplémentaires définissant ce sous-groupe. 
ANNONCE
-
Désigne les personnes souffrant de troubles cognitifs présentant les caractéristiques suivantes :
-
Phénotypes cliniques spécifiques : fréquents (syndrome amnésique de type hippocampique, aphasie logopénique, atrophie corticale postérieure) ou peu fréquents (syndrome cortico basal, variantes comportementales et dysexécutives)
-
Et une positivité des biomarqueurs pathophysiologiques de la MA dans le liquide céphalorachidien ou par TEP4. Les biomarqueurs plasmatiques tels que le p-tau 217 pourraient bientôt entrer dans le bilan clinique de routine.
-
-
Cela comprend les stades prodromiques (troubles cognitifs légers et aucune perte de fonction) et de démence (avec perte de fonction).
En résumé, l’approche IWG permet d’identifier deux catégories différentes d’individus cognitivement normaux avec des biomarqueurs positifs et des stratégies de gestion spécifiques différentes . Tout d’abord, les individus amyloïdes positifs (A+) et A+ et T1 positifs ont un risque accru (mais loin d’être un critère de certitude convaincant) de développer une MA clinique au cours de leur vie. Ces individus doivent être étiquetés à risque, et leur suivi dans des cohortes longitudinales permettra d’identifier les facteurs modulateurs augmentant/diminuant le risque de démence et l’apparition probable de symptômes. Le deuxième groupe est un groupe d’individus cognitivement normaux mais déjà sur le chemin de la maladie clinique. Nous anticipons un avenir réaliste où de plus en plus de ces individus pourraient être considérés comme atteints de MA pré symptomatique sur la base de modèles intégrant une multiplicité de biomarqueurs prédictifs ( encadré ).
En conclusion, l'IWG continue de défendre la MA en tant qu'entité clinique et biologique. Dans un contexte clinique, un diagnostic de MA est posé en présence d'un phénotype clinique établi avec des biomarqueurs physiopathologiques de soutien de la pathologie de la MA (biomarqueurs du LCR, PET amyloïde ou tau, ou biomarqueurs plasmatiques tels que p-tau 217 en attente de leur approbation dans la pratique clinique). Le diagnostic de MA englobe les stades prodromiques de la MA (pré démence) et de la démence de la MA, car ce ne sont que des stades de la même maladie.
Le groupe de travail déconseille l'utilisation de l'analyse de biomarqueurs chez des individus cognitivement normaux avec ou sans plaintes (par exemple, dans le groupe d'individus présentant un déclin cognitif subjectif) pour diagnostiquer la MA. Les analyses de biomarqueurs chez des individus cognitivement normaux peuvent être réalisées dans le cadre de parcours de patients non diagnostiques ad hoc visant à évaluer le risque de déficience cognitive future, à le communiquer et à mettre en place des interventions de réduction des risques. Des expériences pilotes de tels parcours de patients sont actuellement en phase de recherche et pourraient passer à la clinique après validation appropriée. Les études sur des individus cognitivement normaux avec des biomarqueurs MA positifs sont importantes pour définir des algorithmes prédictifs et des estimations du risque de progression vers des symptômes cliniques. Un nombre très limité de ces individus seront considérés comme pré symptomatiques en raison d'une variante génétique autosomique dominante ou en raison d'un risque très élevé de déficience cognitive imminente en raison d'un profil de biomarqueur particulier. Tous les autres individus positifs aux biomarqueurs, qui sont beaucoup plus nombreux, doivent être considérés comme asymptomatiques à risque.
Les recherches futures devraient étudier les personnes cognitivement normales dans deux directions principales :
(1) des études longitudinales observationnelles avec un long suivi où les facteurs de risque liés au mode de vie et les biomarqueurs sont évalués simultanément pour estimer avec précision le poids indépendant de chacun sur l'incidence des troubles cognitifs et de la démence
(2) des essais cliniques interventionnels, pour tester l'efficacité des médicaments contre la pathologie d'Alzheimer et d'autres stratégies de réduction des risques pour réduire l'incidence des troubles cognitifs et évaluer les profils risques-bénéfices thérapeutiques.
Commentaire
Une excellente mise au point qui en appellera d'autres, mais on avance à grand pas
A LIRE ++++
2024 Alzheimer's disease facts and figures.
Faits et chiffres sur la maladie d'Alzheimer en 2024
Alzheimers Dement. 2024 May;20(5):3708-3821. doi: 10.1002/alz.13809. Epub 2024 Apr 30. PMID: 38689398; PMCID: PMC11095490.
https://alz-journals.onlinelibrary.wiley.com/doi/10.1002/alz.13809
Article libre d'accès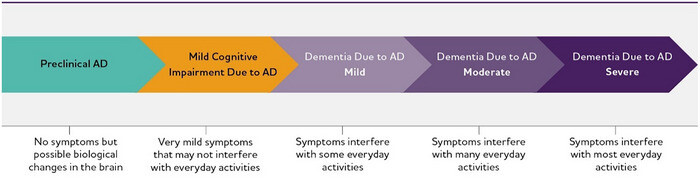
Continuum de la maladie d'Alzheimer (MA). Bien que ces flèches soient de taille égale, les composantes du continuum de la MA ne sont pas égales en durée.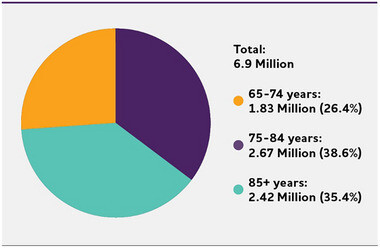
Nombre et âge des personnes de 65 ans ou plus atteintes de la maladie d'Alzheimer, 2024. Les pourcentages ne totalisent pas 100 en raison de l'arrondissement. Créé à partir des données de Rajan et al.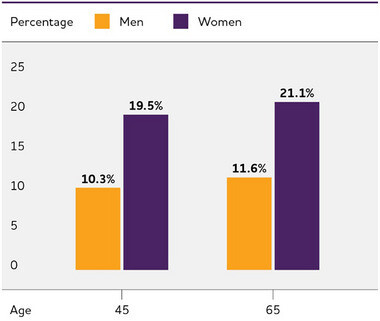
Risque estimé de démence d'Alzheimer au cours de la vie, selon le sexe, entre 45 et 65 ans. Créé à partir des données de Chene et al.
Cet article décrit l'impact de la maladie d'Alzheimer (MA) sur la santé publique, notamment sa prévalence et son incidence, sa mortalité et sa morbidité, l'utilisation et les coûts des soins, ainsi que les répercussions de la MA sur les aidants familiaux, les professionnels de la santé et la société. Le rapport spécial examine le système de santé plus large pour les personnes âgées souffrant de troubles cognitifs, en mettant l'accent sur le rôle des aidants et des professionnels de la santé non médecins. On estime que 6,9 millions d'Américains âgés de 65 ans et plus vivent aujourd'hui avec la démence d'Alzheimer. Ce nombre pourrait atteindre 13,8 millions d'ici 2060, à moins que des avancées médicales ne soient réalisées pour prévenir ou guérir la MA. Les certificats officiels de décès par MA ont enregistré 119 399 décès dus à la MA en 2021. En 2020 et 2021, lorsque la COVID-19 est entrée dans les rangs des dix principales causes de décès, la maladie d'Alzheimer était la septième cause de décès aux États-Unis. Les décomptes officiels des années les plus récentes sont toujours en cours d'élaboration. La maladie d'Alzheimer reste la cinquième cause de décès chez les Américains de 65 ans et plus. Entre 2000 et 2021, les décès dus aux accidents vasculaires cérébraux, aux maladies cardiaques et au VIH ont diminué, tandis que les décès déclarés dus à la maladie d'Alzheimer ont augmenté de plus de 140 %. Plus de 11 millions de membres de la famille et d'autres soignants non rémunérés ont fourni environ 18,4 milliards d'heures de soins aux personnes atteintes de la maladie d'Alzheimer ou d'autres démences en 2023. Ces chiffres reflètent une baisse du nombre de soignants par rapport à une décennie plus tôt, ainsi qu'une augmentation de la quantité de soins fournis par chaque soignant restant. Les soins non rémunérés aux personnes atteintes de démence ont été évalués à 346,6 milliards de dollars en 2023. Ses coûts s'étendent toutefois au risque accru de détresse émotionnelle et de résultats négatifs sur la santé mentale et physique des soignants non rémunérés. Les membres du personnel rémunéré des soins de santé et du personnel communautaire au sens large participent au diagnostic, au traitement et aux soins des personnes atteintes de démence. Cependant, les États-Unis sont confrontés à des pénuries croissantes dans différents segments de la main-d'œuvre dans le domaine des soins aux personnes atteintes de démence en raison d'une combinaison de facteurs, notamment l'augmentation absolue du nombre de personnes atteintes de démence. Par conséquent, des programmes ciblés et des modèles de prestation de soins seront nécessaires pour attirer, mieux former et déployer efficacement les travailleurs de la santé et de la communauté pour fournir des soins aux personnes atteintes de démence. Les paiements Medicare moyens par personne pour les services aux bénéficiaires âgés de 65 ans et plus atteints de la maladie d'Alzheimer ou d'autres démences sont presque trois fois plus élevés que les paiements pour les bénéficiaires sans ces conditions, et les paiements Medicaid sont plus de 22 fois plus élevés. Le total des paiements en 2024 pour les soins de santé, les soins de longue durée et les services de soins palliatifs pour les personnes âgées de 65 ans et plus atteintes de démence est estimé à 360 milliards de dollars.
Le rapport spécial examine la manière dont les soignants de personnes âgées souffrant de problèmes cognitifs interagissent avec le système de santé et examine le rôle que jouent les professionnels de la santé non médecins pour faciliter les soins cliniques et l'accès aux services et soutiens communautaires. Il comprend des enquêtes auprès des soignants et des professionnels de la santé, en se concentrant sur leurs expériences, leurs défis, leur sensibilisation et leurs perceptions de la navigation dans les soins aux personnes atteintes de démence.
ADDENDUM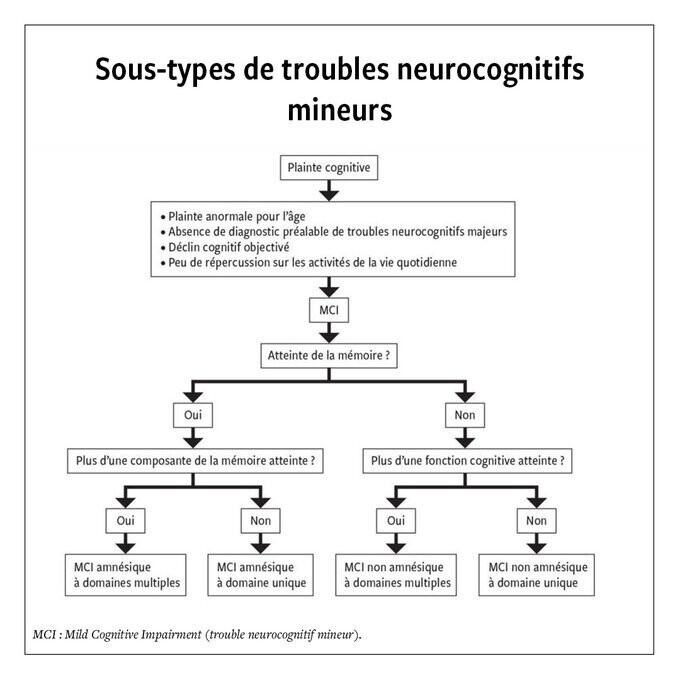
https://www.revmed.ch/revue-medicale-suisse/2024/revue-medicale-suisse-893/trouble-neurocognitif-mineur-comment-s-y-retrouver-dans-la-pratique-au-cabinet
Copyright : Dr Laroche Jean Pierre / 2024

