Le dépistage du cancer est sur le point de connaître un changement de paradigme – du moins, c’est peut-être le cas. Ces dernières années, on a assisté à une forte croissance du développement des tests dits de détection précoce multicancer (MCED), destinés à dépister simultanément différents types de cancers.
Les tests MCED mesurent les biomarqueurs sanguins, notamment les mutations, la méthylation et la fragmentation de l’ADN acellulaire.
Jusqu’à présent, les études publiées dans la phase la plus avancée de la recherche examinant ces tests ont été des essais interventionnels à grande échelle, non randomisés.
La nouvelle ère promise par les tests MCED est séduisante.
Au lieu de soumettre les gens à des scanners, des endoscopes et des frottis pour rechercher des types de cancer individuels, un test sanguin pourrait être répété régulièrement, peut-être une fois par an.
Cette approche pourrait simplifier le processus de dépistage du cancer et faciliter l'accès au dépistage. En plus d'identifier les cancers pour lesquels un dépistage est actuellement effectué, comme les cancers du sein, du col de l'utérus, du côlon et du poumon, les tests pourraient également identifier des dizaines de types de cancer pour lesquels il n'existe actuellement aucune stratégie de dépistage.
 Le coût du test Galleri ® peut varier en fonction du cabinet de soins de santé ou du prestataire qui commande le test. Le prix catalogue du test Galleri est de 949 $.
Le coût du test Galleri ® peut varier en fonction du cabinet de soins de santé ou du prestataire qui commande le test. Le prix catalogue du test Galleri est de 949 $.
En 2021 et 2022, l’étude du National Health Service (NHS)–Galleri en Angleterre a recruté plus de 140 000 participants âgés de 50 à 77 ans dans un essai contrôlé randomisé (ECR) pour évaluer l’efficacité d’un test MCED développé par GRAIL.
Ce test n’est pas conçu pour remplacer le dépistage standard mais pour être réalisé en parallèle.
L’objectif principal de l’étude est de « démontrer une réduction statistiquement significative du taux d’incidence des cancers de stade III et IV diagnostiqués dans le groupe d’intervention par rapport au groupe témoin »,et les résultats définitifs sont attendus en 2026.
https://www.science.org/doi/10.1126/science.adk1213
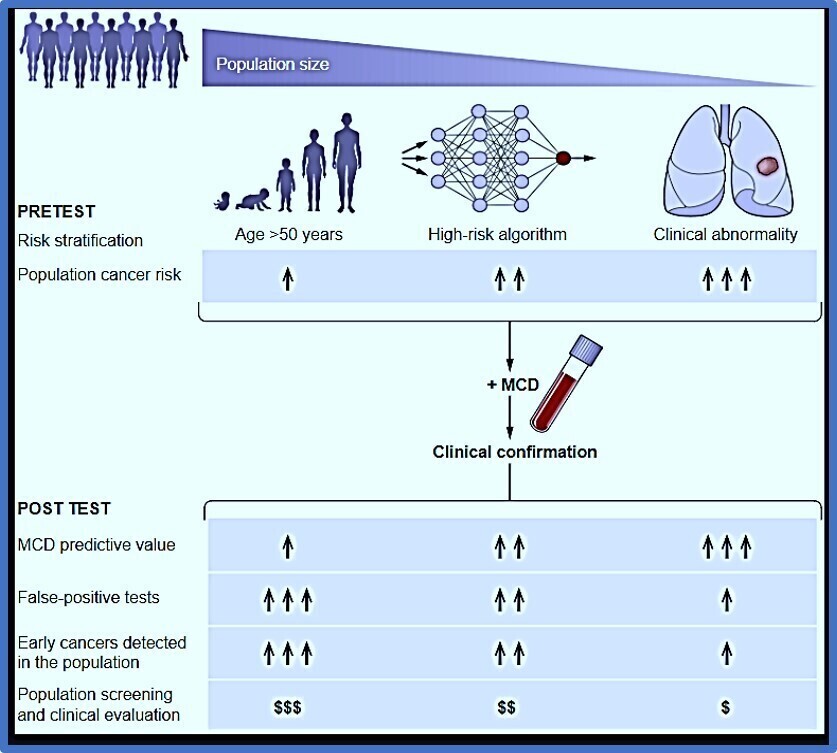
Tests de dépistage multi cancer selon le risque FIGURE A
Le dépistage basé sur la population utilisant l'âge comme seul facteur de risque pourrait avoir le plus grand bénéfice pour le nombre total de cancers précoces détectés dans la population, mais avec un nombre considérable de faux positifs compte tenu de la faible prévalence de la maladie et à un coût élevé. La stratification du risque, éventuellement à l'aide de calculateurs de risque basés sur l'IA, peut augmenter la prévalence dans la population, améliorant ainsi la valeur prédictive positive (VPP) du test. L'application de tests de détection multi cancer (MCD) pour l'évaluation de lésions radiographiques de signification incertaine peut être une autre application clinique pertinente avec une VPP élevée.
Le NHS England avait initialement prévu de déployer le test auprès d’un million de personnes en 2024 sur la base des résultats de la première année de l’essai, mais a récemment décidé de ne pas le faire, invoquant le fait que les premiers résultats n’étaient pas suffisamment convaincants. Les mesures spécifiques prises en compte n’ont pas été rendues publiques.
Cette tournure des événements a déconcerté certains experts du dépistage du cancer.
Pendant des décennies, la norme de référence pour évaluer l’efficacité des interventions de dépistage du cancer a été un ECR mesurant la mortalité spécifique au cancer.
De nombreuses autorités sanitaires utilisent cette norme rigoureuse pour recommander une intervention, car le dépistage du cancer est effectué sur des personnes en bonne santé, dont la majorité ne bénéficieront pas du dépistage et dont certaines subiront des effets néfastes. Les critères minimaux de mise en œuvre du dépistage de la maladie, tels que ceux spécifiés par Wilson et Jungner, exigent que la maladie existe sous une forme présymptomatique, qu’un test de dépistage soit capable d’identifier la maladie présymptomatique, que le traitement de la maladie présymptomatique améliore le pronostic et que le test soit réalisable à mettre en œuvre, ses avantages dépassant ses effets néfastes. Jusqu’à présent, les évaluations des tests MCED n’ont progressé que jusqu’au deuxième critère (démonstration qu’ils peuvent détecter les cancers présymptomatiques).
Les intérêts commerciaux semblent influencer les normes de preuve pour les tests MCED.
Les partisans de ces tests soutiennent que les ECR devraient être réalisés rapidement et qu'un critère d'évaluation de la mortalité par cancer ne devrait pas être exigé pour les approbations initiales, car la production de données de résultats suffisantes prendrait trop de temps.
Il existe des justifications solides pour cet argument, notamment que la technologie pertinente évolue rapidement. Il existe également des justifications moins convaincantes, notamment que les ECR sont coûteux (de tels investissements sont souvent de l'argent bien dépensé) et que des personnes meurent entre-temps (il n'y a aucune preuve que les tests puissent empêcher ce résultat).
À l'extrême opposé, certains chercheurs ont appelé à l'utilisation de la mortalité toutes causes confondues comme critère d'évaluation principal pour les essais MCED.
Cette proposition reflète à la fois l'attente que les tests MCED, s'ils sont efficaces, pourraient réduire la mortalité toutes causes confondues plus facilement que le dépistage d'un seul cancer et l'inquiétude quant aux dommages potentiels, puisqu'un test MCED positif (qu'il s'agisse d'un vrai positif ou d'un faux positif) pourrait conduire à une série de procédures de diagnostic qui, dans de rares cas, pourraient entraîner la mort.
Les partisans des tests MCED soutiennent que si un test réduit l’incidence absolue du cancer à un stade avancé, on peut raisonnablement supposer qu’il réduit la mortalité liée au cancer.
En effet, l’incidence du cancer à un stade avancé est un critère d’évaluation plus fiable que la proportion de cancers identifiés à un stade avancé, qui peut être affectée par le surdiagnostic et d’autres biais. Cependant, les recherches de mon équipe ont montré que la mesure dans laquelle l’incidence du cancer à un stade avancé peut servir d’alternative à la mortalité liée au cancer varie selon le type de cancer et ne peut pas être évaluée pour de nombreux types de cancer que les tests MCED visent à détecter.
Une inquiétude — qui est confirmée par des données commerciales — est que les tests MCED qui utilisent l’ADN acellulaire peuvent détecter de préférence des cancers apparemment à un stade précoce qui ont en fait commencé à se propager, et ces « micrométastases » ne peuvent pas être détectées lors de la stadification standard.
Dans ce cas, bien qu’un test puisse sembler réduire l’incidence des cancers de stade III et IV, de nombreux cancers qui sont apparemment identifiés au stade I ou II en raison du test sont toujours voués à l’échec. Une solution potentielle à ce problème spécifique est de mesurer le « stade actualisé de la récidive », ce qui implique de compter les participants présentant une récidive tardive d’un cancer initialement de stade I ou II comme s’ils présentaient le résultat principal d’un cancer de stade III ou IV.
Outre l’utilisation d’un critère d’évaluation basé sur le stade, un autre écart par rapport à la conception standard des ECR dans l’essai NHS-Galleri est que le statut d’aveuglement (c’est-à-dire le fait que les participants connaissent ou non le groupe auquel ils sont affectés) diffère selon le groupe d’essai et le résultat du test. Les seuls participants qui seront levés en aveugle sont les membres du groupe d’intervention qui ont un résultat positif au test MCED.
Ce choix de conception encouragera les participants à se soumettre à des prises de sang annuelles, mais il empêche d’examiner le phénomène de « fausse assurance », un inconvénient potentiel du test MCED.
Alors que les personnes ayant une mammographie négative peuvent raisonnablement croire qu’il est peu probable qu’elles aient un cancer du sein, les personnes ayant un test MCED négatif peuvent croire à tort qu’elles ne peuvent pas avoir de cancer et retarder le dépistage standard du cancer ou la recherche de soins pour des symptômes potentiels du cancer.
Pour déterminer le véritable rapport bénéfice/risque associé au test MCED, les chercheurs doivent communiquer les résultats à tous les participants, imitant ainsi les conditions du monde réel, dans lesquelles des bénéfices et des préjudices peuvent découler à la fois de résultats positifs et négatifs.
L’Institut national du cancer des États-Unis prévoit un essai contrôlé randomisé (ECR) qui pourrait évaluer plusieurs tests MCED, inclure un groupe témoin et utiliser le critère de référence de mortalité spécifique au cancer.
Une phase pilote débutera en 2024.
Cet essai pourrait être le seul à disposer de la puissance nécessaire pour déterminer si une approche basée sur le MCED peut réduire la mortalité liée au cancer. Une menace potentielle est que les tests MCED sont déjà commercialisés aux États-Unis, ce qui pourrait rendre difficile la recherche de participants disposés à être assignés au hasard et pourrait conduire à une contamination (test MCED) dans le groupe témoin.
Lors de l’évaluation des tests MCED, il sera important que les autorités sanitaires maintiennent la barre haute pour conclure qu’il existe des preuves de leur efficacité. À l’avenir, je pense que les tests MCED ne devraient pas être mis en œuvre sans preuve que ces tests peuvent réduire la mortalité liée au cancer – de préférence des preuves issues d’essais dans lesquels des entités commerciales n’influencent pas les décisions finales concernant la conception ou la conduite et ne sont pas impliquées dans la gestion ou l’analyse des données. Si au moins un test MCED s’avère efficace pour réduire la mortalité liée au cancer, il pourrait parfois être possible de mener des études comparatives rigoureusement conçues au lieu de réaliser d’autres grands ECR pour évaluer de nouveaux tests. De même, bien qu’il ne soit pas possible d’étudier l’efficacité des tests MCED dans chaque pays, l’infrastructure médicale dans un contexte géographique donné doit être suffisamment solide pour gérer les résultats des tests comme les chercheurs l’ont fait dans des ECR réussis.
À près de 1 000 dollars par personne pour certains tests, le coût des tests MCED actuellement commercialisés pourrait submerger les systèmes de santé.
Les entreprises font déjà pression sur le Congrès américain pour que les tests MCED soient couverts par Medicare. La possibilité que de tels tests puissent être largement mis en œuvre en l’absence d’ECR démontrant une réduction de la mortalité liée au cancer est inquiétante, compte tenu de la leçon durement apprise selon laquelle le dépistage du cancer doit être mis en œuvre avec prudence, en s’appuyant sur une base solide de preuves des avantages et des inconvénients.
Le surdiagnostic des cancers de la prostate et de la thyroïde et la controverse entourant les changements de directives pour le dépistage du cancer du sein en fournissent des exemples instructifs.
Néanmoins, la quête visant à traduire les récentes avancées biotechnologiques en outils de dépistage du cancer est louable.
Si et quand la promesse salvatrice des tests MCED se révèlera une réalité, il sera temps pour les scientifiques, les cliniciens, les décideurs politiques et le public de travailler ensemble pour garantir que la détection précoce de plusieurs cancers réussisse dans la pratique.



