L'artérite de Takayasu est une vascularite idiopathique rare des gros vaisseaux qui touche généralement les jeunes femmes.
Un stade précoce "sans pouls" est souvent manqué, associé à des symptômes constitutionnels non spécifiques (fièvre, malaise et perte de poids) et à des marqueurs inflammatoires élevés.
La progression incontrôlée de la maladie conduit au stade « sans pouls », qui se manifeste cliniquement par des pouls manquants, une sensibilité vasculaire et des symptômes ischémiques (claudication des membres, étourdissements, angine et hypertension rénovasculaire), et se caractérise pathologiquement par un épaississement de la paroi artérielle et des lésions sténosées/occlusives ou formation d'anévrisme.
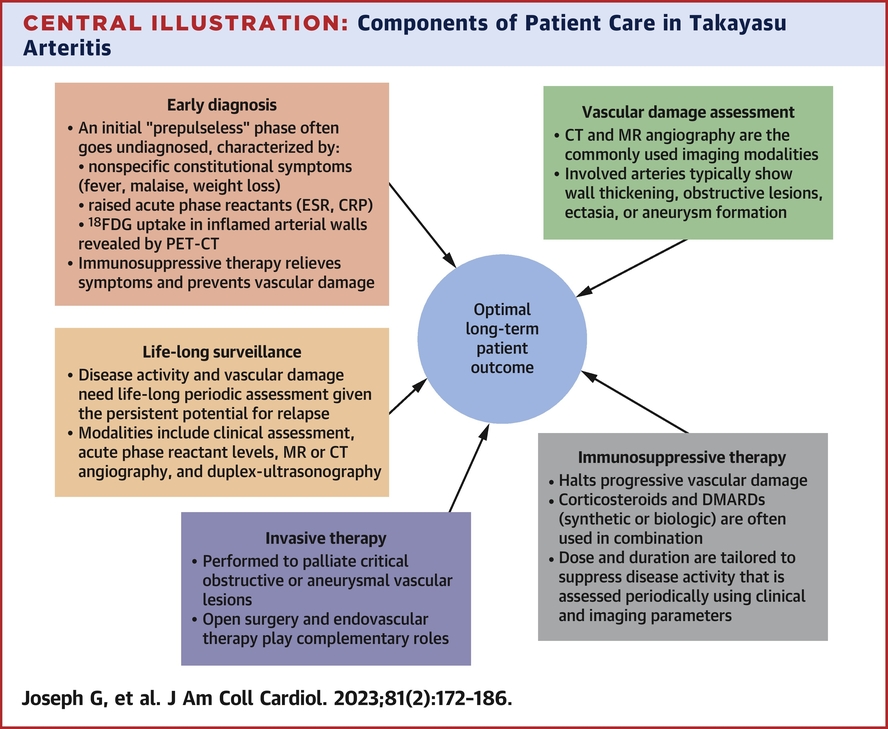
Complications vasculaires (accident vasculaire cérébral, cécité, insuffisance cardiaque, et rupture d'anévrisme) pourraient suivre à moins que la progression de la maladie ne soit stoppée par un traitement immunosuppresseur et que les lésions critiques ne soient palliées par un traitement endovasculaire opportun ou une chirurgie ouverte.
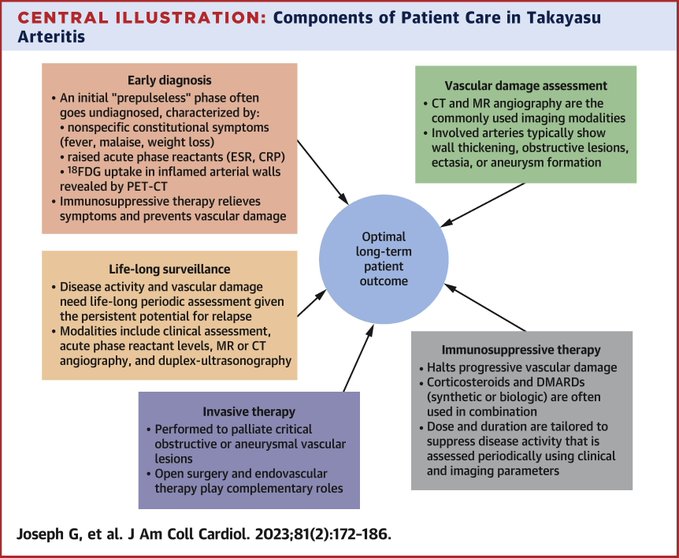
Un diagnostic précoce, un traitement efficace et une surveillance à vie des rechutes de l'activité de la maladie et de la progression de la maladie vasculaire sont essentiels pour obtenir des résultats à long terme.
Les perspectives pour les patients se sont considérablement améliorées ces dernières années avec l'établissement de critères de diagnostic et de classification, de meilleures modalités d'investigation et une thérapie médicale et invasive plus efficace.
Points forts
• L'artérite précoce de Takayasu n'est souvent pas diagnostiquée car les caractéristiques cliniques ne sont pas spécifiques, mais la progression est associée à des lésions obstructives ou anévrismales.
• Des médicaments immunosuppresseurs sont nécessaires pour arrêter la progression de la maladie, et une thérapie invasive peut être nécessaire pour pallier les lésions vasculaires critiques.
• Un diagnostic précoce, un traitement efficace et une surveillance continue sont essentiels pour obtenir des résultats à long terme.
L'artérite de Takayasu (TAK) est une vascularite granulomateuse chronique idiopathique des gros vaisseaux qui affecte l'aorte, ses principales branches et les artères pulmonaires.
Elle affecte généralement les jeunes femmes et n'est souvent diagnostiquée qu'à un stade avancé de la maladie en raison de sa rareté, de son évolution souvent indolente, de ses premiers symptômes non spécifiques et de l'absence de marqueurs diagnostiques spécifiques.
La progression incontrôlée de la maladie conduit à la formation de lésions vasculaires obstructives et anévrismales, qui peuvent entraîner des morbidités invalidantes telles que les accidents vasculaires cérébraux, la cécité, l'hypertension réfractaire, l'insuffisance cardiaque et la mort. La chronicité de la maladie et le besoin fréquent d'un traitement immunosuppresseur à long terme créent les défis de la surveillance à vie, des effets secondaires des médicaments, de la mauvaise qualité de vie et des fardeaux de la perte de productivité et des dépenses médicales récurrentes.
Néanmoins, de nombreux progrès récents ont été réalisés dans la prise en charge du TAK, et les perspectives pour les patients atteints de TAK se sont considérablement améliorées. Le but de la présente revue était de fournir un résumé de l'état actuel de TAK et de sa gestion.
Rappel historique
TAK est éponyme de Mikito Takayasu, professeur d'ophtalmologie à l'Université de Kanazawa, au Japon, qui a décrit des anastomoses en forme de couronne dans le système vasculaire rétinien d'une femme de 21 ans lors de la réunion annuelle de la Société japonaise d'ophtalmologie en 1905. Lors de la même réunion , 2 autres ophtalmologistes, Katsutomo Onishi et Tsurukichi Kagoshima, ont présenté des cas avec des résultats oculaires similaires et ont également noté des pouls radiaux manquants.
En 1940, Kunio Ohta a confirmé que le TAK est une panartérite et que la découverte fondamentale optique caractéristique résultait d'une ischémie due à des artères cervicales obstruées.
Le nom « artérite de Takayasu » pour cette maladie a été accepté lors de la conférence internationale révisée de consensus de Chapel Hill de 2012 sur la nomenclature des vascularites.
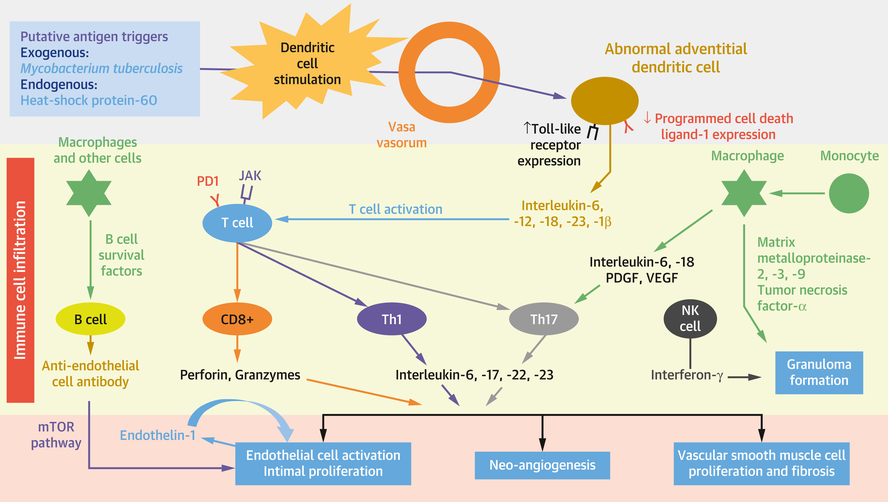
Proposition d'immunopathogenèse de l'artérite de Takayasu
L'activation par des antigènes inconnus de cellules dendritiques adventices intrinsèquement anormales provoque la libération de cytokines qui entraînent la différenciation des lymphocytes T en CD8 + cytotoxiquesCellules T, cellules T auxiliaires 1 (Th1) et cellules T auxiliaires 17 (Th17). Les cellules cytotoxiques libèrent les protéines cytotoxiques perforine et granzymes. Les cellules Th sont vasculitogènes, riches en protéine de mort cellulaire programmée-1 (PD1), avec un transducteur de signal de Janus kinase (JAK) accru et un activateur de la signalisation pro-inflammatoire de la transcription. L'infiltration des cellules immunitaires qui en résulte conduit à l'activation des cellules endothéliales, à la prolifération des cellules musculaires lisses intimales et vasculaires et à la fibrose. L'interféron-γ libéré par les cellules tueuses naturelles (NK) contribue à la formation de granulomes. Les métalloprotéinases matricielles libérées par les macrophages inflammatoires contribuent également à la formation de granulomes et provoquent la digestion et la fuite de la barrière endothéliale. Les cellules B favorisent l'activation des cellules endothéliales en sécrétant des anticorps anti-cellules endothéliales. mTOR = cible mammifère de la rapamycine ; PDGF = facteur de croissance dérivé des plaquettes ; VEGF = facteur de croissance endothélial vasculaire.
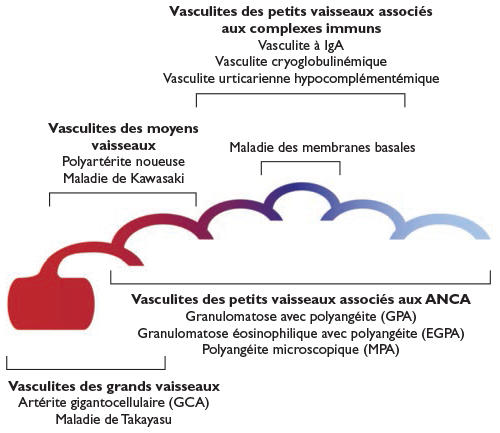
Nomenclature des vasculites proposée par la Conférence de Consensus de Chapel Hill 2012 (CHCC 2012)1
https://www.revmed.ch/revue-medicale-suisse/2014/revue-medicale-suisse-426/vascularites-systemiques-nouvelles-nomenclature-et-approches-therapeutiques
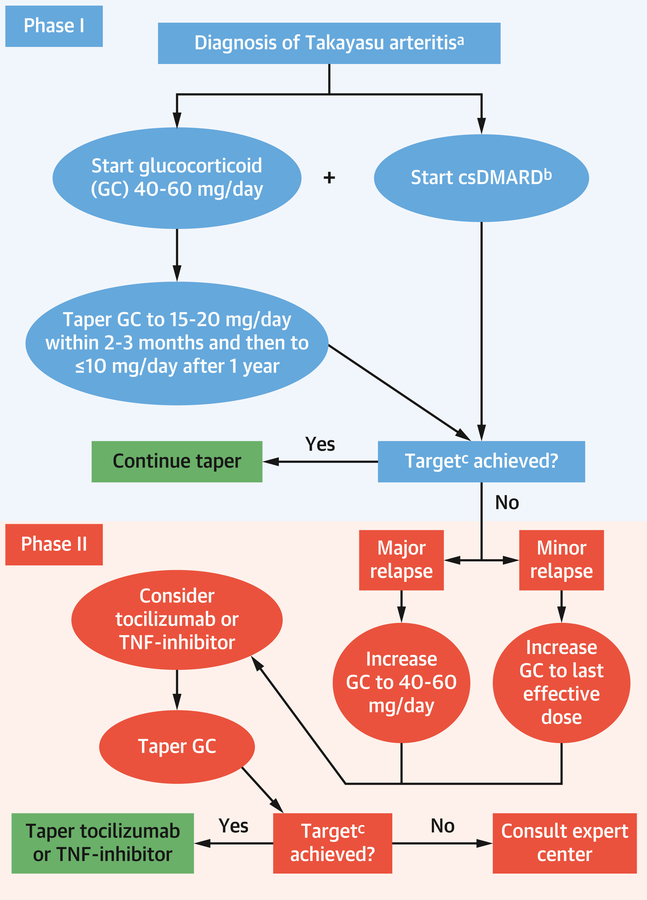
Algorithme EULAR 2018 pour le traitement pharmacologique de l'artérite de Takayasu
Proposition de protocole de traitement en 2 phases impliquant des glucocorticoïdes (GC) et des antirhumatismaux modificateurs de la maladie synthétiques conventionnels (csDMARD) en phase I, et des DMARD biologiques en cas de rechute (phase II). a Le diagnostic clinique d'artérite de Takayasu doit être confirmé par imagerie. b Le cyclophosphamide ne doit être utilisé que si tous les autres csDMARD sont inefficaces. c L'objectif du traitement est une rémission soutenue plus la possibilité de réduire les GC à l'objectif spécifié sans rechute. TNF = facteur de nécrose tumorale. Adapté avec la permission de Hellmich et all
DMARD = Disease Modifying Anti Rheumatic Drug
Le traitement médical du Takayasu : les bases
Corticothérapie
– Dose d’attaque : 1 mg/kg / jour
– Décroissance initiée à 2-4 semaines : en fonction de l’évolution clinique, de manière à obtenir une durée de traitement totale de 1-2 ans.
± Immunosuppresseurs dans les formes rebelles ou récidivantes
– Méthotrexate 20-25 mg / semaine
– Autres : azathioprine, mycophénolate mofétil, plus rarement cyclophosphamide
± Biothérapies dans les formes graves (anti-TNF ou anti-récepteur de l’IL6)
https://www.medg.fr/maladie-de-takayasu/
Article 2
La maladie de Takayasu (MT) est une forme rare de vascularite granulomateuse chronique non spécifique des gros vaisseaux qui évolue en 2 phases : une phase inflammatoire et une phase scléreuse.
Elle se manifeste généralement dans la deuxième et la troisième décennie de la vie par des signes ischémiques.
La maladie commence, généralement dans l'enfance (phase inflammatoire) mais le diagnostic est rarement posé.
Les femmes sont plus touchées que les hommes.
Les lésions inflammatoires et scléreuses peuvent coexister. le traitement est essentiellement médical, basé sur la corticothérapie à dégression lente en induction et les immunosuppresseurs comme traitement d’entretien.
La biothérapie ( anti IL6) est en cours d’évaluation .
La chirurgie vasculaire classique des lésions sténosantes a souvent été décevante.
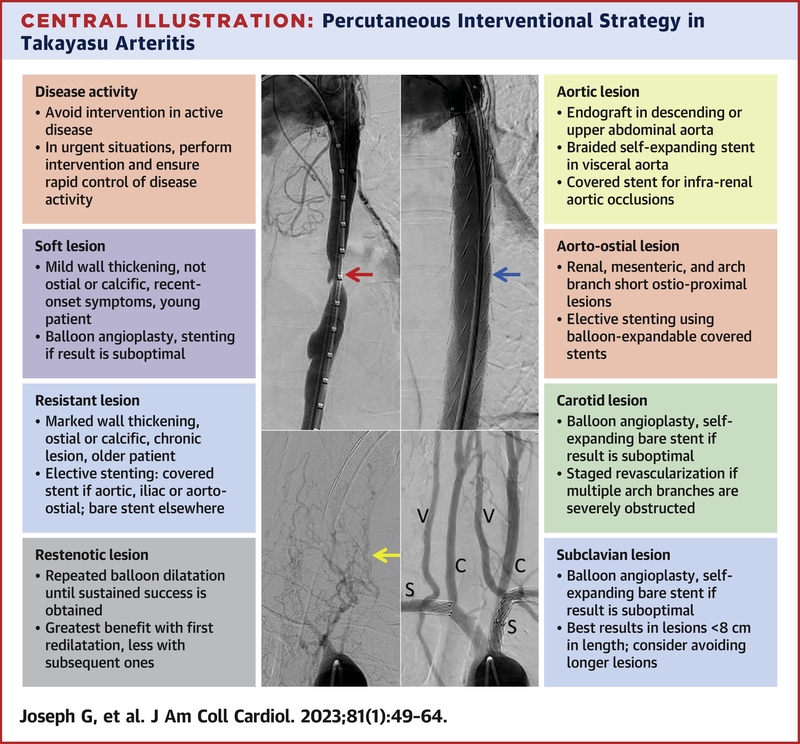
La place de l’angioplastie percutanée dans le traitement de la maladie de Takayasu ( MT) reste discutée .
Les principales indications sont l'ischémie critique avec risque de lésions des organes cibles, l'hypertension non contrôlée, la coarctation de l'aorte, l'anévrisme aortique et la régurgitation aortique.
Les interventions doivent être effectuées pendant les périodes de rémission, car le taux de complications et la mortalité sont plus élevés lorsque la maladie est active. La probabilité de complications est 7 fois plus élevée lorsque les procédures étaient réalisées en présence d'une inflammation active.
L’objectif de cette étude visait à développer des stratégies d’angioplastie transluminale appropriées pour la MT.
Il s’agit d’une étude mono centrique, rétrospective des procédures effectuées entre 1996 et 2022.
942 patients ont eu une angioplastie pour traiter 2 450 lésions artérielles (2 365 sténoses ou occlusions, 85 anévrismes ou dissections) dont 630 sous-clavières ou axillaires, 586 rénales, 463 aortiques, 333 carotidiennes, 188 mésentériques, 116 iliaques, 71 coronariennes et 63 autres artères ; 3 805 procédures ont été réalisés (1,55 par lésion ; intervalle de 1 à 7 angioplastie par lésion).
Les lésions obstructives ont été traitées par stenting électif (à l'aide de stents nus ou couverts), angioplastie par ballonnet(BA) ou angioplastie par ballonnet coupant (CBA), avec stenting d'appoint pour des résultats sous-optimaux de BA ou de CBA. Les angioplasties ont été répétées dans les resténoses jusqu'à l'obtention d'un succès durable. Les anévrismes aortiques ou périphériques et les dissections aortiques spontanées ont été traités avec des stents couverts ou des endoprothèses. Le traitement immunosuppresseur, commencé avant l'angioplastie, a été poursuivi à long terme.
Un succès immédiat a été obtenu chez 2 262 (92,3 %) et un succès tardif dans 1 460 (84,5 %) des 1 727 lésions avec une médiane de 39 mois (15-85 mois) de suivi.
Les angioplasties répétées ont augmenté le succès tardif des les lésions occlusives de 48,6 % à 83,3 %.
Les auteurs ont noté 472 complications survenues lors du traitement de 415 lésions (17 %). 375 (79%) de ces complications ont été traitées avec succès. Les angioplasties répétées ont augmenté le succès tardif dans les lésions obstructives de 48,6 % à 83,3 %.
CONCLUSION : La plupart des lésions vasculaires de la maladie de Takayasu peuvent être traitées efficacement, en toute sécurité et durablement en utilisant principalement des stratégies d’angioplasties basées sur le stent.
La maladie de Takayasu est une vascularite, relativement rare, plus fréquente en Asie en Inde, en Afrique du Nord et en Amérique Latine.
Son épidémiologie est méconnue (peu de données épidémiologiques sont disponibles dans la littérature). Les quelques études disponibles suggèrent une incidence estimée à 1.2 cas par million d’habitant par an au Suède. 2.3 Cas par million d’habitant par an aux Etats-Unis. Elle est retrouvée 33 fois sur 1000 dans une étude nécrosique japonaise.
La MT souffre de sa méconnaissance, le diagnostic est souvent fait tardivement à la phase scléreuse de la maladie . L’appellation de maladie des femmes sans pouls, asiatiques demeure dans l’esprit de
beaucoup de médecins. de ce fait, la MT est rarement évoquée quand les pouls sont présents ou quand l’homme est touché. Elle est aussi, méconnue dans les milieux pédiatriques.
A ce jour aucun marqueur de diagnostic ou d’évolutivité n’a été identifié. si le syndrome inflammatoire caractérise la phase systémique de la maladie, sa fréquence tend à diminuer à la phase occlusive.
On a souvent vu de véritables formes évolutives avec un bilan inflammatoire négatif.
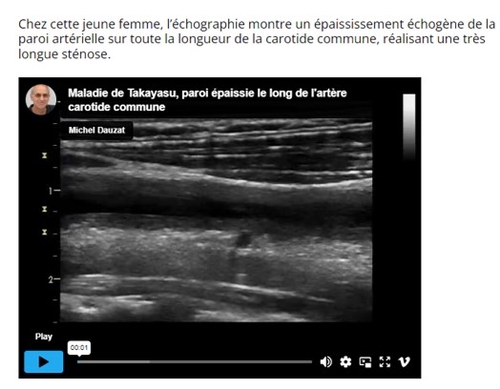
L’échographie Doppler vasculaire a bouleversé l’approche diagnostique. En effet, l’épaississement de la paroi vasculaire est un signe précoce le plus caractéristique de la maladie aboutissant à des sténoses, des thromboses et parfois au développement d’anévrismes. L’échographie-Doppler joue un rôle aussi bien dans le diagnostic que dans le suivi de la maladie. En effet l’aspect de la paroi nous renseigne
sur l’ancienneté des troubles ( calcifiée fibrineuse pour la lésion scléreuse ancienne et hypoéchogène hommogène pou la lésion récente encore inflammatoitre ). Malgré les traitements actuellement proposés, la difficulté d’un contrôle strict de l’activité de la maladie, doit nous engager dans le l’intégration de l’échodoppler comme moyen diagnostic dans les états
inflammatoires inexpliqués de l’enfant . L’examen clinique vasculaire doit avoir une place plus importante dans l’enseignement de la semiologie médicale.
Merci Ahmed, ton expérience et tes connaissances sur le sujet sont toujours précieuses
J'ajouterai que l'angioplastie est une réelle avancée thérapeutique dans cette affection
Depuis mes nombreux voyages en Algérie j'ai appris la maladie de Takayasu et surtout l'aspect typique des lésions artérielles périphériques accessibles à l'écho-Doppler avec notre ami Alain Viard.
Nous avons eu l'occasion d'examiner des dizaines et des dizaines de jeune femmes atteintes de cette affection qui reste asymptomatique longtemps avant de se décompense notamment durant et après une grossesse. Le courage de ces femmes m'a interpellé.
Leur prise en charge médical est en Algérie une référence, le Takayasu est très fréquent, trop fréquent .
https://www.sciencedirect.com/science/article/abs/pii/S024886630900770X?via%3Dihub
ARTICLE 3
TAKAYASU d'hier à demain.....
Goudot G, Jimenez A, Mohamedi N, Sitruk J, Khider L, Mortelette H, Papadacci C, Hyafil F, Tanter M, Messas E, Pernot M, Mirault T. Assessment of Takayasu's arteritis activity by ultrasound localization microscopy. EBioMedicine. 2023 Mar 7;90:104502. doi: 10.1016/j.ebiom.2023.104502. Epub ahead of print. PMID: 36893585; PMCID: PMC10017361.
Évaluation de l'activité de l'artérite de Takayasu par microscopie échographique de localisation
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10017361/
Article libre d'accés
Contexte
La microscopie ultrasonore de localisation (ULM) basée sur l'imagerie ultrasonore ultrarapide des microbulles circulantes (MB) peut imager les flux sanguins microvasculaires in vivo jusqu'à l'échelle du micron. L'artérite de Takayasu (TA) a une vascularisation accrue de la paroi artérielle épaissie lorsqu'elle est active. Nous avons cherché à réaliser des vasa vasorum ULM de la paroi carotidienne et à démontrer que l'ULM peut fournir des marqueurs d'imagerie pour évaluer l'activité TA.
Méthodes
Les patients avec TA ont été inclus consécutivement avec évaluation de l'activité par les critères du National Institute of Health : 5 avaient un TA actif (âge médian 35,8 [24,5-46,0] ans) et 11 avaient un TA quiescent (37,2 [31,7-47,3] ans). L'ULM a été réalisée à l'aide d'une sonde de 6,4 MHz et d'une séquence d'imagerie dédiée (ondes planes à 8 angles, fréquence d'images 500 Hz), couplée à l'injection intraveineuse de MB. Les MB individuels ont été localisés à une échelle de sous-longueur d'onde puis suivis, permettant la reconstruction de l'anatomie et de la vitesse du flux vasa vasorum.
Résultats
L'ULM a permis de montrer les microvaisseaux et de mesurer leur vitesse d'écoulement dans la paroi artérielle. Le nombre de MB détectés par seconde dans la paroi était de 121 [80-146] chez les cas actifs vs 10 [6-15] chez les cas quiescents (p = 0,0005), avec une vitesse moyenne de 40,5 [39,0-42,9] mm. s -1 dans les cas actifs.
Interprétation
L'ULM permet la visualisation des microvaisseaux dans la paroi carotidienne épaissie en TA, avec une densité de MB significativement plus élevée dans les cas actifs. L'ULM permet une visualisation précise in vivo des vasa vasorum et donne accès à la quantification de la vascularisation de la paroi artérielle.
Financement : Société Française de Cardiologie. Programme d'échographie biomédicale ART (Accélérateur de Recherche Technologique) de l'INSERM, France.
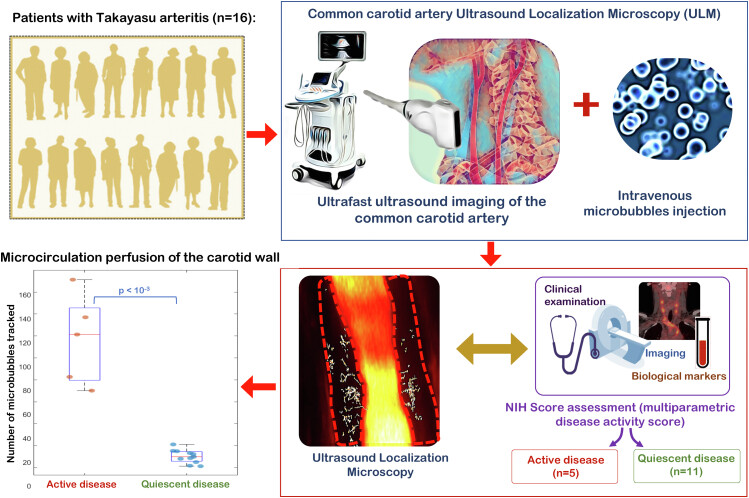
Conception expérimentale de l'étude et analyse des données de microscopie de localisation ultrasonore en comparaison avec le score d'activité de l'artérite NIH Takayasu. NIH : Institut national de la santé. Une boîte à moustaches comparant le nombre de microbulles suivies dans la paroi carotidienne est affichée en bas à gauche. Il montre une nette séparation entre les patients atteints d'une maladie active et ceux atteints d'une maladie quiescente.
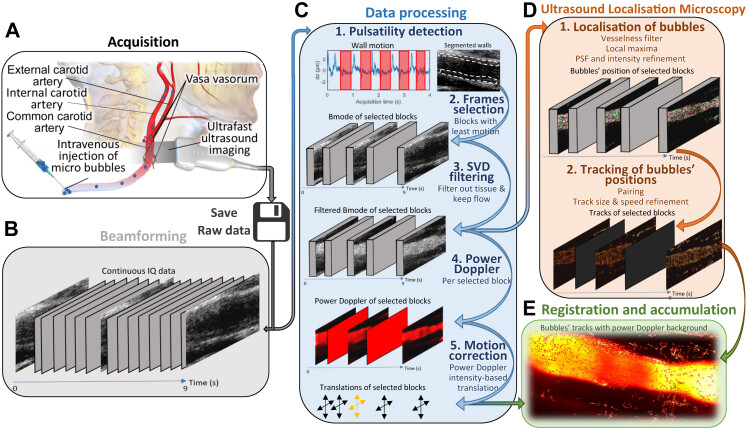
Schéma récapitulatif de la méthode de traitement. (A) Acquisition : acquisition d'imagerie par ultrasons ultrarapide couplée à l'injection intraveineuse de microbulles, les données brutes de radiofréquence (RF) sont enregistrées et traitées hors ligne. (B) Beamforming : reconstruction d'image en quadrature en phase (IQ) par ultrasons avec retard et formation de faisceaux de somme. (C) Traitement des données : 1. détection de la pulsatilité basée sur le mouvement de la paroi carotidienne ; 2. sélection de blocs de 100 trames avec moins de pulsatilité ; 3. filtrage des microbulles du signal tissulaire basé sur la décomposition en valeur singulière (SVD); 4. Power Doppler pour récupérer la lumière dans chaque bloc ; 5. correction de mouvement avec enregistrement de la lumière entre les blocs. (D) Microscopie ultrasonore de localisation sur chaque bloc de trames filtrées : 1. localisation des microbulles ; 2. suivi de leurs positions. E. Enregistrement des traces de microbulles'
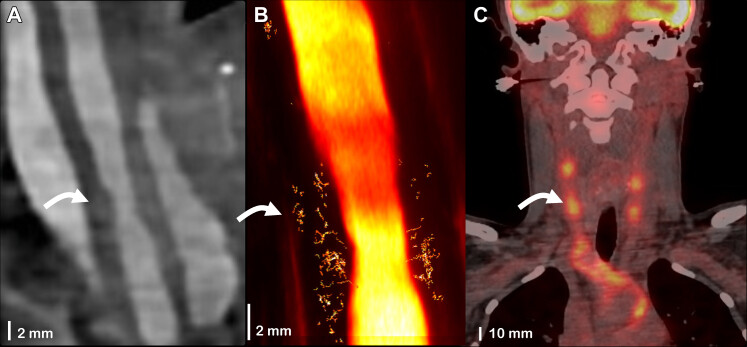
Exemple d'un cas d'artérite de Takayasu active avec reconstruction CTA en vue frontale de l'artère carotide commune droite (A). En B est adaptée l'image au même site obtenue en microscopie ultrasonore de localisation (obtenue à partir d'une acquisition longue de 8 s après correction du mouvement) avec visualisation des microvaisseaux (B). L'imagerie FDG-PET/CT montre une fixation intense localisée sur les parois carotidiennes communes (C).
Microscopie échographique de localisation de la paroi carotide commune d'un même patient atteint d'une artérite de Takayasu initialement quiescente (A), et d'une réactivation de la maladie 9 mois plus tard avec une nouvelle imagerie montrant un passage important de microbulles dans la paroi artérielle (B), dès le 8 s longue acquisition après correction de mouvement et données de microscopie de localisation par ultrasons accumulées.
Bravo à l'équipe de l'HEGP et à Guillaume GOUDOT (@GoudotG)
ARTICLE 4
Mais ce dosier ne serait pas exhaustif sans la publicati_on "princeps " de Pascla Giordana de 2011 dans CIRCULATION
Échographie de contraste de la paroi de l'artère carotide dans la maladie de Takayasu : première preuve d'application dans le diagnostic et le suivi de la réponse au traitement. Giordana P , Baqué-Juston MC, Jeandel PY, Mondot L, Hirlemann J, Padovani B, Raffaelli C.
Circulation. 12 juillet 2011;124(2):245-7. doi : 10.1161/CIRCULATIONAHA.110.006668.
Cet article est un CASE REPORT
Une femme de 35 ans atteinte de cervicalgie antérieure chronique a été adressée dans notre établissement pour une échographie cervicale. L'échographie mode B (Siemens S 2000, linear phased array probe 9 à 13 MHz) a révélé un épaississement hyperéchogène de 1,6 mm de la paroi circonférentielle de l'artère carotide commune droite, impliquant l'ensemble de l'artère, sans signe de sténose ( Figure 1 ) . Les autres artères supraaortiques semblaient normales. La tomographie par émission de positrons et la tomodensitométrie ont démontré d'autres localisations de l'épaississement de la paroi artérielle dans l'artère brachiocéphalique droite, l'arc aortique et l'aorte abdominale. Les longs antécédents médicaux du patient en matière d'hypertension, de carotidynie, d'asymétrie du pouls radial et de syndrome inflammatoire biologique ainsi que les résultats d'imagerie ont conduit au diagnostic de la maladie de Takayasu.
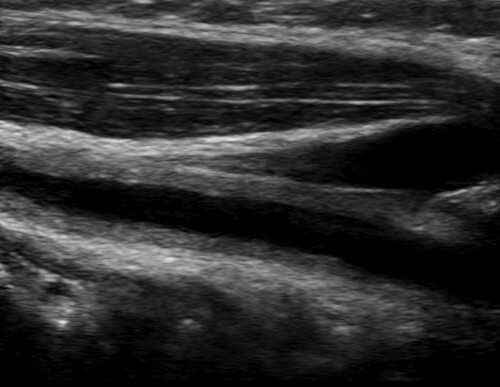
Échographie mode-B : épaississement de la paroi circonférentielle de l'artère carotide commune droite évoquant une artérite inflammatoire.
De : Giordana : Circulation, Volume 124(2).12 juillet 2011.245-247
Une échographie de contraste des artères carotides a ensuite été réalisée (T0) avant que le patient ne commence un traitement stéroïdien. Nous avons utilisé une sonde Siemens S 2000, 9 à 13 MHz, et un bolus intraveineux (IV) de 3 secondes de 1,5 ml de Sonovue (Bracco, Altana Pharma, Constance, Allemagne) rincé avec 5 ml de solution saline. Une photo a été prise 1 minute post-IV et un film de 30 secondes a été enregistré 15 secondes post-IV, au début de l'opacification artérielle. Les images ont ensuite été post-traitées par le logiciel étendu Adobe Photoshop CS4 pour mesurer la médiane de l'échelle de gris (GSM) de la paroi carotide commune droite. L'utilisation de ce logiciel pour calculer le GSM s'est avérée fournir une évaluation numérique reproductible en échelle de gris d'une zone sélectionnée, 2 allant de 0 (noir) à 255 (blanc), validée comme une mesure objective de l'échogénicité.
Le même protocole d'échographie de contraste a été réalisé 3 mois (T1) et 6 mois (T2) après le début du traitement, par le même opérateur dans des conditions techniques identiques. Pendant ce temps, sous traitement aux stéroïdes, les symptômes du patient se sont considérablement améliorés et le syndrome inflammatoire biologique s'est résolu.
Les aspects échographiques en mode B n'ont pas changé au cours des 6 mois, montrant un épaississement stable de la paroi circonférentielle hyperéchogène de 1,6 mm de l'artère carotide commune droite.
À l'échographie de contraste, cependant, l'analyse de prétraitement a montré une amélioration marquée de la paroi artérielle avec visualisation directe de plusieurs vasa vasorum opacifiés ( Figure 1 )Ces apparences ont changé progressivement à T1 (Film II dans le Supplément de données en ligne uniquement) et T2 (Film III dans le Supplément de données en ligne uniquement) avec l'impression d'une diminution marquée du rehaussement de la paroi artérielle et de l'opacification des vasa vasorum. Cela a été confirmé par les mesures GSM, qui ont significativement diminué au cours des 6 mois : GSM à T0, 80,58 ( Figure 2 ) ; à T1, 42,09 ( figure 3 ); à T2, 5,05 ( Figure 3), illustrant la diminution de l'échogénicité de la paroi artérielle pathologique sous traitement.
L'échographie en mode B et l'indice GSM sont actuellement utilisés pour évaluer la stabilité des plaques d'athérosclérose. 3 En échographie de contraste, le GSM augmente dans la maladie athéroscléreuse avec le degré de rehaussement de la paroi pariétale, qui lui-même reflète la néovascularisation et le degré d'inflammation de la plaque ; les microbulles hyperéchogènes sont captées dans les vasa vasorum du complexe intima-média sans aucune diffusion vers l'interstitium, renforçant l'échogénicité de la zone.
À notre connaissance, il n'y a pas eu d'évaluation clinique antérieure de l'échographie de contraste dans l'artérite inflammatoire dans la littérature. Cependant, en comparaison avec des études antérieures sur la maladie athéroscléreuse, nos résultats dans ce cas de maladie de Takayasu suggèrent qu'il y avait une inflammation importante de la paroi artérielle carotide au moment du diagnostic, et celle-ci diminuait progressivement sous traitement stéroïdien.
L'échographie de contraste pourrait donc s'avérer un outil très utile dans le diagnostic et le suivi de l'artérite inflammatoire en tant que mesure non invasive, peu coûteuse et facilement reproductible de l'inflammation de la paroi artérielle, étant donné que, dans la grande majorité des cas, les vaisseaux supraaortiques sont impliqués. Elle semble être la seule technique d'imagerie permettant une visualisation directe des vasa vasorum pariétaux et de la néovascularisation, fournissant ainsi des informations en temps réel sur la réponse inflammatoire au traitement
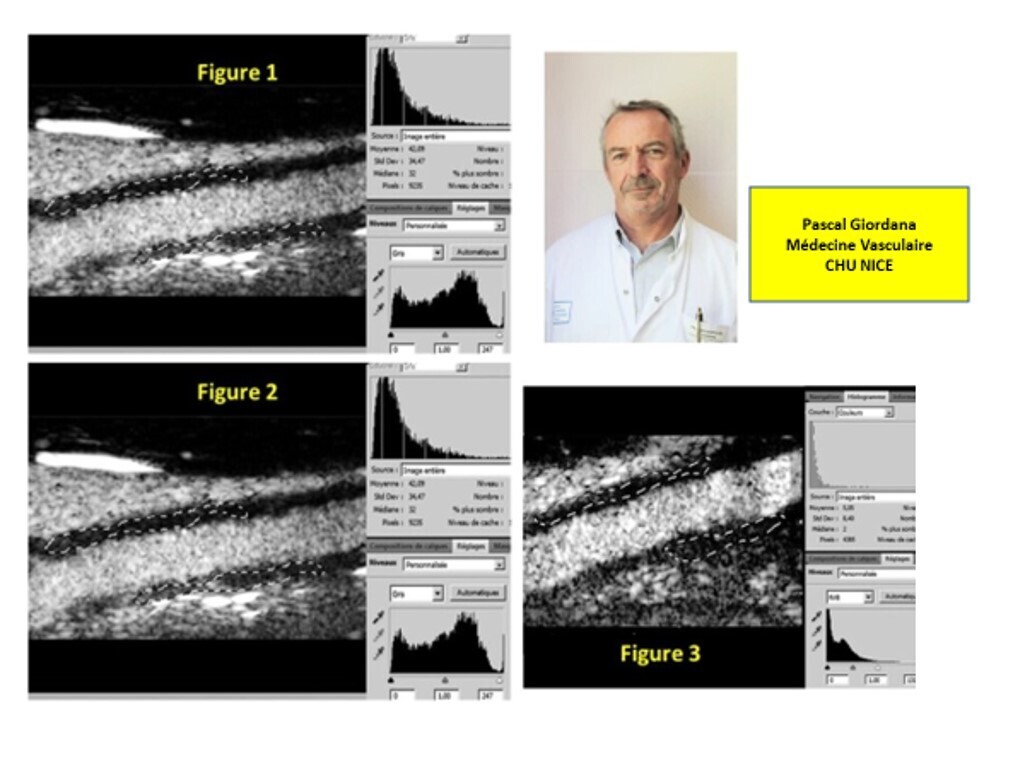
Figure 1 . Échographie de contraste (1 min post-IV) à T0 : échographie avant traitement. Mesure GSM, 80,58. IV indique un bolus intraveineux ; GSM, médiane de l'échelle de gris.
De : Giordana : Circulation, Volume 124(2).12 juillet 2011.245-247
Figure 2. Échographie de contraste (1 min post-IV) à T1 : échographie à 3 mois post-traitement. Mesure GSM, 42.09. IV indique un bolus intraveineux ; GSM, médiane de l'échelle de gris.
De : Giordana : Circulation, Volume 124(2).12 juillet 2011.245-247
Figure 3 . Échographie de contraste (1 min post-IV) à T2 : échographie post-traitement à 6 mois. Mesure GSM, 5.05. IV indique un bolus intraveineux ; GSM, médiane de l'échelle de gris.
De : Giordana : Circulation, Volume 124(2).12 juillet 2011.245-247
Suite à cette étude noius avions convenu avecd Pascal Gioradana et Ahmed Hatri de réunir sur 3 à J à Alger, de 20 à 30 patienytes présentant un TAKAYASU et de les étudier avec le SONOVUE. Malheureusement impossible . La laboratoire qui commercialise la SONOVUE ne nous a pas suivi de plus le SONVUE ne posséde auvun agtément en Algérie...dommage
Commentaire sur produit de contraste, échographie et TAKAYASU