“Toute science a pour but la prévoyance.” Auguste Comte
Inflammasome : définition
"L'inflammasome est un complexe multimérique intracellulaire de différentes protéines et est un acteur clé de l'immunité innée. Les inflammasomes sont des complexes multi-composants critiques pour la reconnaissance des formes et la signalisation en réponse aux toxiques environnementaux.
"L'inflammasome est un complexe multimérique intracellulaire de différentes protéines et est un acteur clé de l'immunité innée. Les inflammasomes sont des complexes multi-composants critiques pour la reconnaissance des formes et la signalisation en réponse aux toxiques environnementaux.
L'inflammasome est une voie complexe qui est régulée à plusieurs niveaux pour orchestrer une signalisation optimale et éviter une activation aberrante de la réaction inflammatoire. L'activité dérégulée de l'inflammasome NLRP3 est à la base de nombreux états inflammatoires chroniques."
https://www.aquaportail.com/definition-14611-inflammasome.htmlInflammasone par CliniSciences
"L'inflammasome est un oligomère multiprotéique responsable de l'activation des réponses inflammatoires. L'inflammasome favorise la maturation et la sécrétion des cytokines pro-inflammatoires Interleukine 1β (IL-1β) et Interleukine 18 (IL-18). La sécrétion de ces cytokines entraîne une pyroptose, une forme de mort cellulaire pro-inflammatoire programmée distincte de l'apoptose. En cas de dysrégulation de l'inflammasome, un assortiment de maladies majeures peut survenir. Il est exprimé dans les cellules myéloïdes et est un composant du système immunitaire inné. Le complexe inflammasome peut être constitué de caspase 1, de PYCARD, de NALP et parfois de caspase 5 (également appelée caspase 11 ou ICH-3). Les NLR (domaine d'oligomérisation se liant aux nucléotides et les récepteurs contenant des séquences riches en leucine) et les ALR (récepteurs de type AIM2) peuvent également former un inflammasome. La composition exacte d'un inflammasome dépend de l'activateur qui initie l'assemblage de l'inflammasome, par ex. ARNdb déclenchera une composition inflammasome tandis que l'amiante va assembler un variant différent. Parce que la voie pro-inflammatoire n'a pas besoin de récepteurs Toll-like (TLR), les inflammasomes avec AIM2 peuvent détecter l'ADN cytoplasmique, un signal de danger, qui peut être menaçant et renforcer leur réponse innée."
https://www.clinisciences.com/lire/inflammasome-1183.html
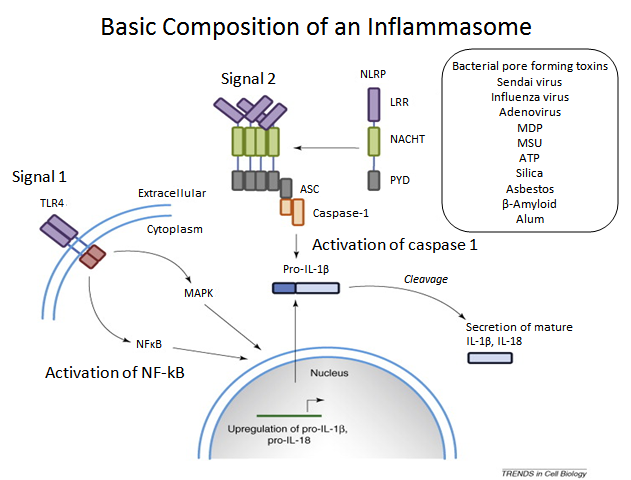
https://www.actuscimed.com/2015/02/trendsincellbiology-inflammasome.html
Bacterial pore forming toxins = Toxines bactériennes formant des pores
Activation of activation de NF-kB = Activation de NF-kB
Activation of caspase1 = Activation de caspase1
Cleavage = Clivage
Secretion of mature IL-1β, IL-18 = Sécrétion de IL-1β, IL-18
Extracellular = Extracellulaire
Cytoplasm = Cytoplasme
Nucleus = Noyau
Upregulation = Régulation positive, activation
Source iconographique et légendaire: http://depts.washington.edu/galelab/host_defense.html
"Les inflammasomes sont des plateformes multiprotéiques assemblées en réponse à une invasivité de pathogènes et d’autres signaux de danger. Typiquement, les complexes inflammasomes contiennent une protéine capteur, une protéine adaptatrice, et un zymogène – procaspase-1. La formation des inflammasomes est un processus lié à la maturation de la procaspase-1 inactive en un enzyme cystéine-protéase, la caspase-1, qui ensuite active les cytokines proinflammatoires, les interleukines IL-1β et IL-18, et qui induit la pyroptose, forme inflammatoire hautement pyrogène de mort cellulaire. Des études effectuées au cours de l’année précédente ont dévoilé de nouveaux acteurs de ce processus et des voies de régulation impliquées dans la signalisation inflammasome traditionnelle ; certaines d’entre elles remettant même en cause le dogme en vigueur. Cette revue de littérature met l’accent sur ces nouveaux éclairages relatifs à la recherche et discute de domaines nécessitant de futures investigations. Sivapriya K. Vanaja, Vijay A. K. Rathinam, Katherine A. Fitzgerald et al, dans Trends in Cell Biology, publication en ligne en avant – première, 29 janvier 2015"
Potere N, Abbate A, Kanthi Y, et al. Inflammasome Signaling,
Thromboinflammation, and Venous Thromboembolism.
Signalisation de l'inflammasome, thromboinflammation et thromboembolie veineuse
J Am Coll Cardiol Basic Trans Science. null2023, 0 (0) .
https://doi.org/10.1016/j.jacbts.2023.03.017
Composition de base d'un inflammasome.

https://www.actuscimed.com/2015/02/trendsincellbiology-inflammasome.html
Bacterial pore forming toxins = Toxines bactériennes formant des pores
Activation of activation de NF-kB = Activation de NF-kB
Activation of caspase1 = Activation de caspase1
Cleavage = Clivage
Secretion of mature IL-1β, IL-18 = Sécrétion de IL-1β, IL-18
Extracellular = Extracellulaire
Cytoplasm = Cytoplasme
Nucleus = Noyau
Upregulation = Régulation positive, activation
Source iconographique et légendaire: http://depts.washington.edu/galelab/host_defense.html
"Les inflammasomes sont des plateformes multiprotéiques assemblées en réponse à une invasivité de pathogènes et d’autres signaux de danger. Typiquement, les complexes inflammasomes contiennent une protéine capteur, une protéine adaptatrice, et un zymogène – procaspase-1. La formation des inflammasomes est un processus lié à la maturation de la procaspase-1 inactive en un enzyme cystéine-protéase, la caspase-1, qui ensuite active les cytokines proinflammatoires, les interleukines IL-1β et IL-18, et qui induit la pyroptose, forme inflammatoire hautement pyrogène de mort cellulaire. Des études effectuées au cours de l’année précédente ont dévoilé de nouveaux acteurs de ce processus et des voies de régulation impliquées dans la signalisation inflammasome traditionnelle ; certaines d’entre elles remettant même en cause le dogme en vigueur. Cette revue de littérature met l’accent sur ces nouveaux éclairages relatifs à la recherche et discute de domaines nécessitant de futures investigations. Sivapriya K. Vanaja, Vijay A. K. Rathinam, Katherine A. Fitzgerald et al, dans Trends in Cell Biology, publication en ligne en avant – première, 29 janvier 2015"

Potere N, Abbate A, Kanthi Y, et al. Inflammasome Signaling,
Thromboinflammation, and Venous Thromboembolism.
Signalisation de l'inflammasome, thromboinflammation et thromboembolie veineuse
J Am Coll Cardiol Basic Trans Science. null2023, 0 (0) .
https://doi.org/10.1016/j.jacbts.2023.03.017
La thromboembolie veineuse (MTEV) reste un fardeau sanitaire majeur malgré les progrès de l'anticoagulation, suggérant une prise en charge incomplète des mécanismes pathogènes.
L'inflammasome NLRP3 (protéine 3 contenant le domaine NACHT, LRR et pyrine), l'interleukine (IL)-1 et la pyroptose sont des contributeurs émergents à la pathogenèse inflammatoire de la MTEV.
L'activation de la voie de l'inflammasome se produit chez les patients atteints de MTEV.
Dans les modèles précliniques, le blocage de la signalisation de l'inflammasome réduit la thrombogenèse veineuse et les lésions vasculaires, suggérant que cette approche thérapeutique peut potentiellement maximiser les avantages de l'anticoagulation, protégeant de l'apparition, de la récidive et du syndrome post-thrombotique qui en résulte.
La colchicine, un inhibiteur non sélectif de NLRP3, et le canakinumab, un agent anti-IL-1β, réduisent l'athérothrombose sans augmenter les saignements. La rosuvastatine réduit les événements thrombotiques veineux primaires au moins en partie grâce à des mécanismes indépendants d'abaissement des lipides, ouvrant la voie à des stratégies anti-inflammatoires ciblées dans la MTEV.
L'activation de la voie de l'inflammasome se produit chez les patients atteints de MTEV.
Dans les modèles précliniques, le blocage de la signalisation de l'inflammasome réduit la thrombogenèse veineuse et les lésions vasculaires, suggérant que cette approche thérapeutique peut potentiellement maximiser les avantages de l'anticoagulation, protégeant de l'apparition, de la récidive et du syndrome post-thrombotique qui en résulte.
La colchicine, un inhibiteur non sélectif de NLRP3, et le canakinumab, un agent anti-IL-1β, réduisent l'athérothrombose sans augmenter les saignements. La rosuvastatine réduit les événements thrombotiques veineux primaires au moins en partie grâce à des mécanismes indépendants d'abaissement des lipides, ouvrant la voie à des stratégies anti-inflammatoires ciblées dans la MTEV.
Cette revue décrit les preuves précliniques et cliniques récentes soutenant le rôle de la voie de l'inflammasome dans la thrombose veineuse et discute du potentiel thérapeutique, encore inexploré, de la modulation de la signalisation de l'inflammasome pour prévenir et gérer la MTEV
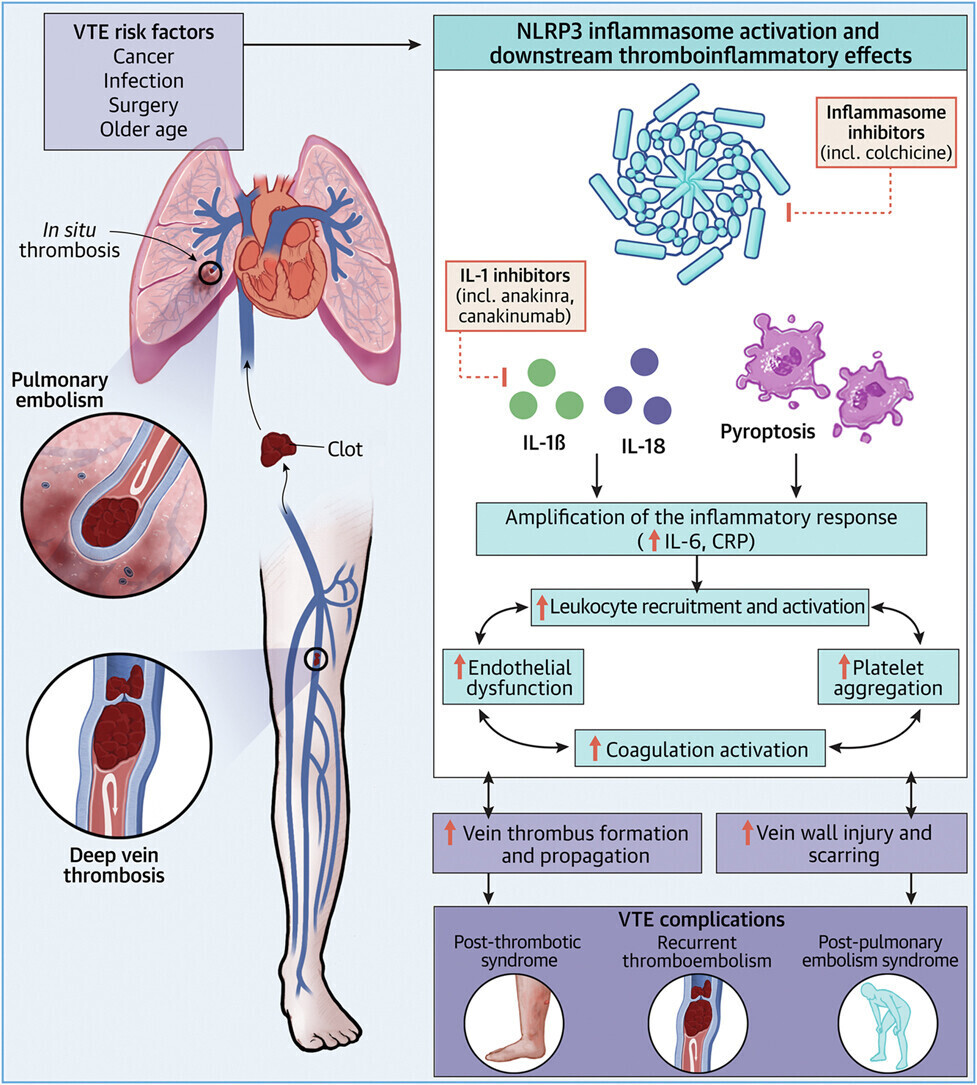
Activation de la voie de l'inflammasome NLRP3 et effets thrombo-inflammatoires en aval dans la TEV
Créé avec BioRender.com. CRP = protéine C-réactive ; IL = interleukine; NLRP3 = protéine 3 contenant les domaines NOD, LRR et pyrine ; ETEV = thromboembolie veineuse.
Créé avec BioRender.com. CRP = protéine C-réactive ; IL = interleukine; NLRP3 = protéine 3 contenant les domaines NOD, LRR et pyrine ; ETEV = thromboembolie veineuse.
Points forts
• L'inflammation est intimement liée à la coagulation et joue un rôle essentiel dans la thrombogenèse veineuse.
• L'activation de l'inflammasome NLRP3, la pyroptose et l'IL-1 sont des contributeurs émergents à la thromboinflammation et à la MTEV.
• Cette revue fournit un aperçu des preuves précliniques et cliniques soutenant l'IL-1 et l'inflammasome NLRP3 en tant que cibles thérapeutiques potentielles dans la MTEV.
• Des études explorant le blocage de la signalisation de l'inflammasome pour la prévention et la gestion de la MTEV et des complications qui en découlent sont justifiées.
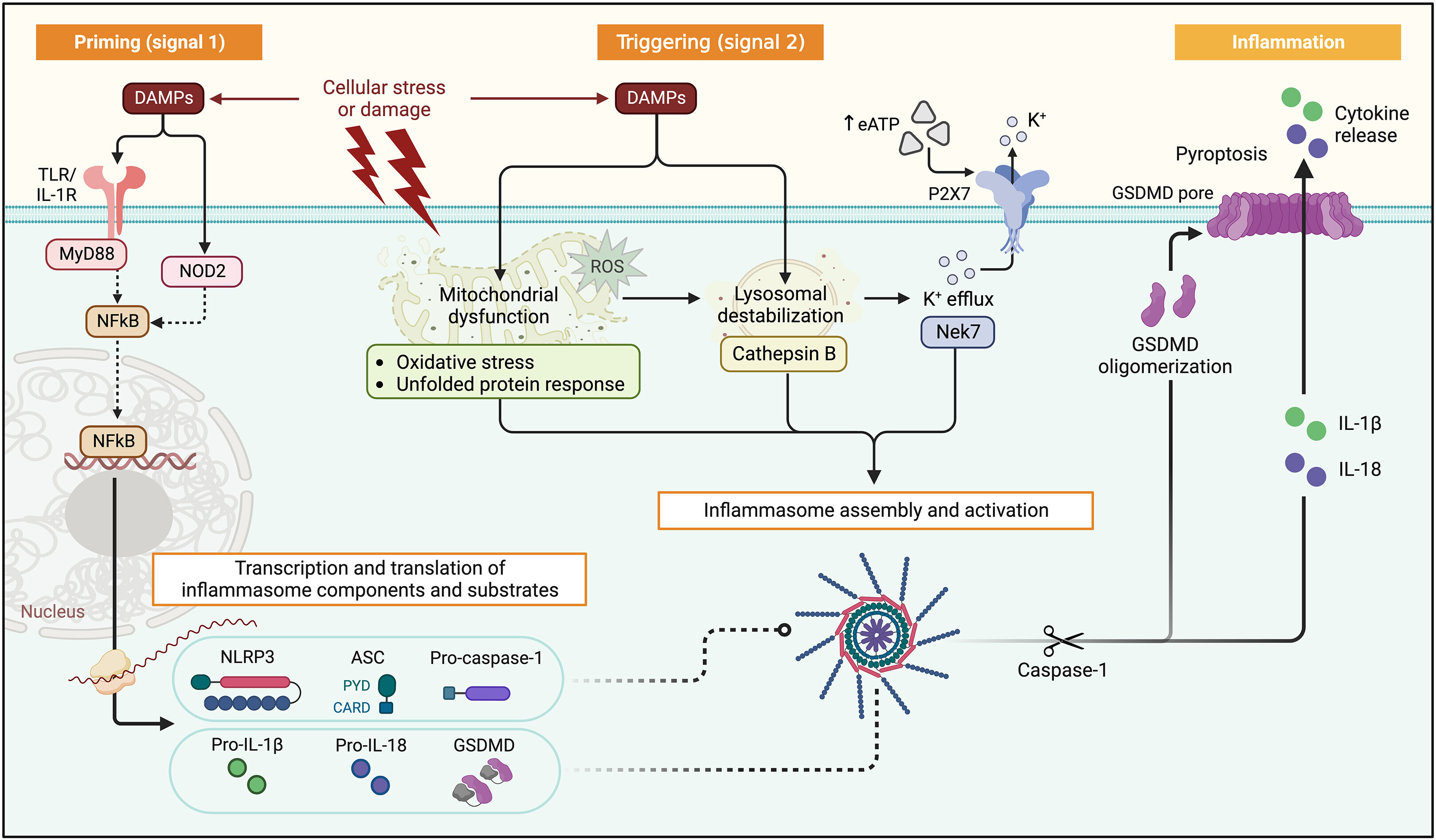 Schéma de la voie de l'inflammasome NLRP3
Schéma de la voie de l'inflammasome NLRP3
L'activation de l'inflammasome NLRP3 nécessite 2 signaux. L'amorçage (signal 1) est induit par les DAMP, y compris l'IL-1β/(pro)–IL-1α ou l'ATP extracellulaire libéré lors d'une lésion tissulaire. Les DAMP activent les récepteurs membranaires, y compris les TLR et l'IL-1R, entraînant la translocation de NF-κB dans le noyau, ainsi que la transcription et la traduction des composants de l'inflammasome et des précurseurs de l'IL-1β et de l'IL-18, qui s'accumulent dans le cytoplasme. Le déclenchement (signal 2) induit l'assemblage et l'activation de l'inflammasome, favorisés par l'ATP extracellulaire (via le récepteur purinergique P2X7R) ou d'autres DAMP intracellulaires (par exemple, les protéines mitochondriales ou lysosomales, comme les ROS et la cathepsine B). Ceux-ci induisent K +efflux avec activation de NLRP3. En réponse, NLRP3 oligomérise et lie l'ASC et la procaspase-1, entraînant une activation autocatalytique de la procaspase-1 en caspase-1. La caspase-1 clive la pro–IL-1β et la pro–IL-18 en leurs formes actives. La caspase-1 clive également GSDMD, produisant des fragments N-terminaux qui oligomérisent et forment des pores de la membrane cellulaire, qui permettent la libération extracellulaire d'IL-1β et d'IL-18. Les pores de la caspase-1 et du GSDMD interviennent également dans la mort cellulaire pyroptotique. Créé avec BioRender.com. ASC = protéine speck-like associée à l'apoptose contenant un domaine de recrutement de caspase ; ATP = adénosine triphosphate ; CARD = domaine de recrutement caspase ; DAMP = modèles moléculaires associés aux dommages ; GSDMD = gasdermine D ; IL = interleukine; IL-1RA = antagoniste des récepteurs de l'interleukine-1 ; IL-1R = récepteur de l'interleukine-1 ; MyD88 = facteur de différenciation myéloïde 88 ; NLRP3 = NACHT-, LRR-, et la protéine 3 contenant le domaine pyrine ; NF-kB = facteur nucléaire-kappa B ; NOD2 = protéine 2 contenant le domaine d'oligomérisation de liaison aux nucléotides ; P2X7R = récepteur P2X7.
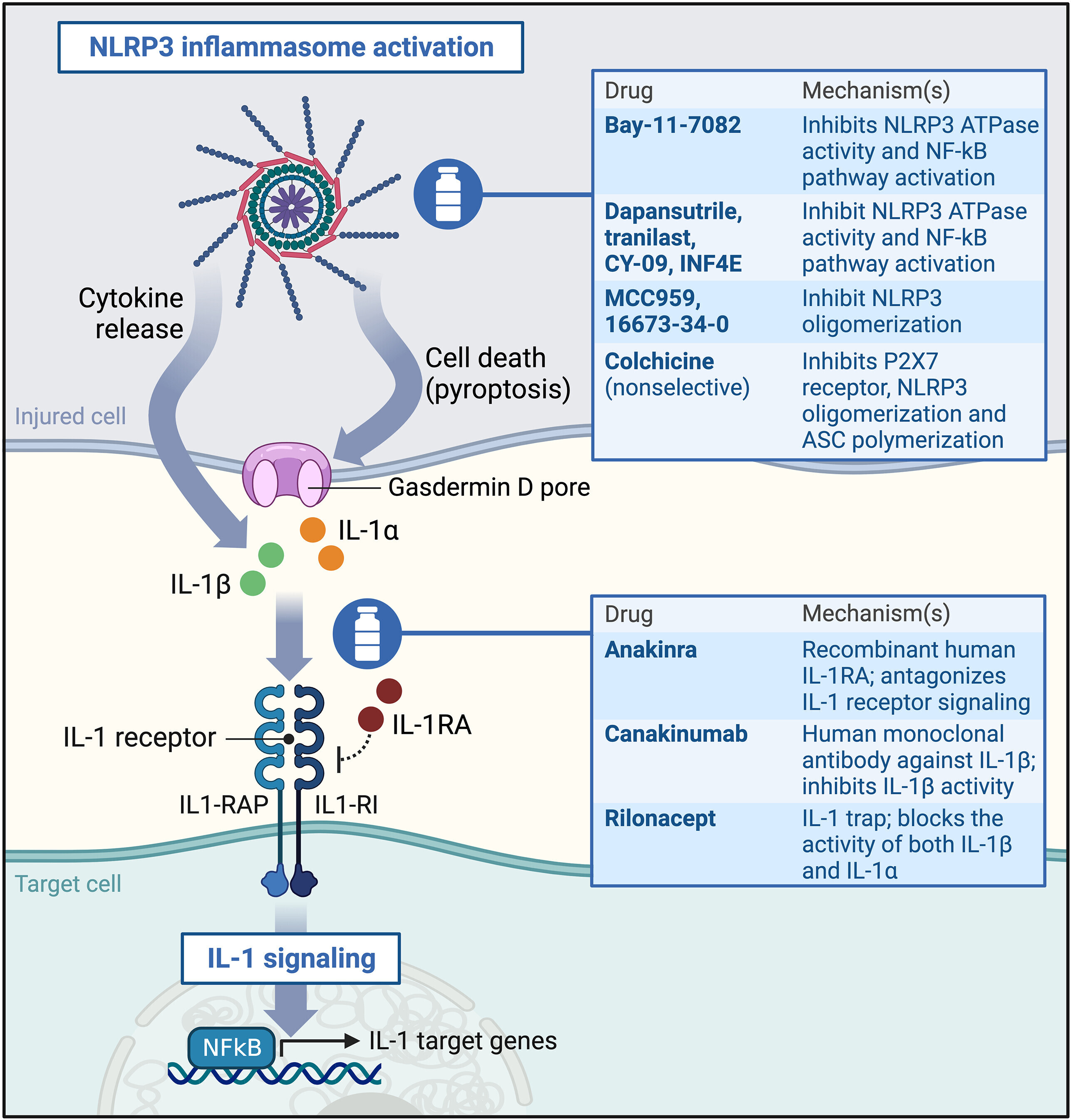
Agents pharmacologiques ciblant l'inflammasome NLRP3 et l'IL-1, et leur mécanisme d'action
• L'inflammation est intimement liée à la coagulation et joue un rôle essentiel dans la thrombogenèse veineuse.
• L'activation de l'inflammasome NLRP3, la pyroptose et l'IL-1 sont des contributeurs émergents à la thromboinflammation et à la MTEV.
• Cette revue fournit un aperçu des preuves précliniques et cliniques soutenant l'IL-1 et l'inflammasome NLRP3 en tant que cibles thérapeutiques potentielles dans la MTEV.
• Des études explorant le blocage de la signalisation de l'inflammasome pour la prévention et la gestion de la MTEV et des complications qui en découlent sont justifiées.
 Schéma de la voie de l'inflammasome NLRP3
Schéma de la voie de l'inflammasome NLRP3L'activation de l'inflammasome NLRP3 nécessite 2 signaux. L'amorçage (signal 1) est induit par les DAMP, y compris l'IL-1β/(pro)–IL-1α ou l'ATP extracellulaire libéré lors d'une lésion tissulaire. Les DAMP activent les récepteurs membranaires, y compris les TLR et l'IL-1R, entraînant la translocation de NF-κB dans le noyau, ainsi que la transcription et la traduction des composants de l'inflammasome et des précurseurs de l'IL-1β et de l'IL-18, qui s'accumulent dans le cytoplasme. Le déclenchement (signal 2) induit l'assemblage et l'activation de l'inflammasome, favorisés par l'ATP extracellulaire (via le récepteur purinergique P2X7R) ou d'autres DAMP intracellulaires (par exemple, les protéines mitochondriales ou lysosomales, comme les ROS et la cathepsine B). Ceux-ci induisent K +efflux avec activation de NLRP3. En réponse, NLRP3 oligomérise et lie l'ASC et la procaspase-1, entraînant une activation autocatalytique de la procaspase-1 en caspase-1. La caspase-1 clive la pro–IL-1β et la pro–IL-18 en leurs formes actives. La caspase-1 clive également GSDMD, produisant des fragments N-terminaux qui oligomérisent et forment des pores de la membrane cellulaire, qui permettent la libération extracellulaire d'IL-1β et d'IL-18. Les pores de la caspase-1 et du GSDMD interviennent également dans la mort cellulaire pyroptotique. Créé avec BioRender.com. ASC = protéine speck-like associée à l'apoptose contenant un domaine de recrutement de caspase ; ATP = adénosine triphosphate ; CARD = domaine de recrutement caspase ; DAMP = modèles moléculaires associés aux dommages ; GSDMD = gasdermine D ; IL = interleukine; IL-1RA = antagoniste des récepteurs de l'interleukine-1 ; IL-1R = récepteur de l'interleukine-1 ; MyD88 = facteur de différenciation myéloïde 88 ; NLRP3 = NACHT-, LRR-, et la protéine 3 contenant le domaine pyrine ; NF-kB = facteur nucléaire-kappa B ; NOD2 = protéine 2 contenant le domaine d'oligomérisation de liaison aux nucléotides ; P2X7R = récepteur P2X7.

Agents pharmacologiques ciblant l'inflammasome NLRP3 et l'IL-1, et leur mécanisme d'action
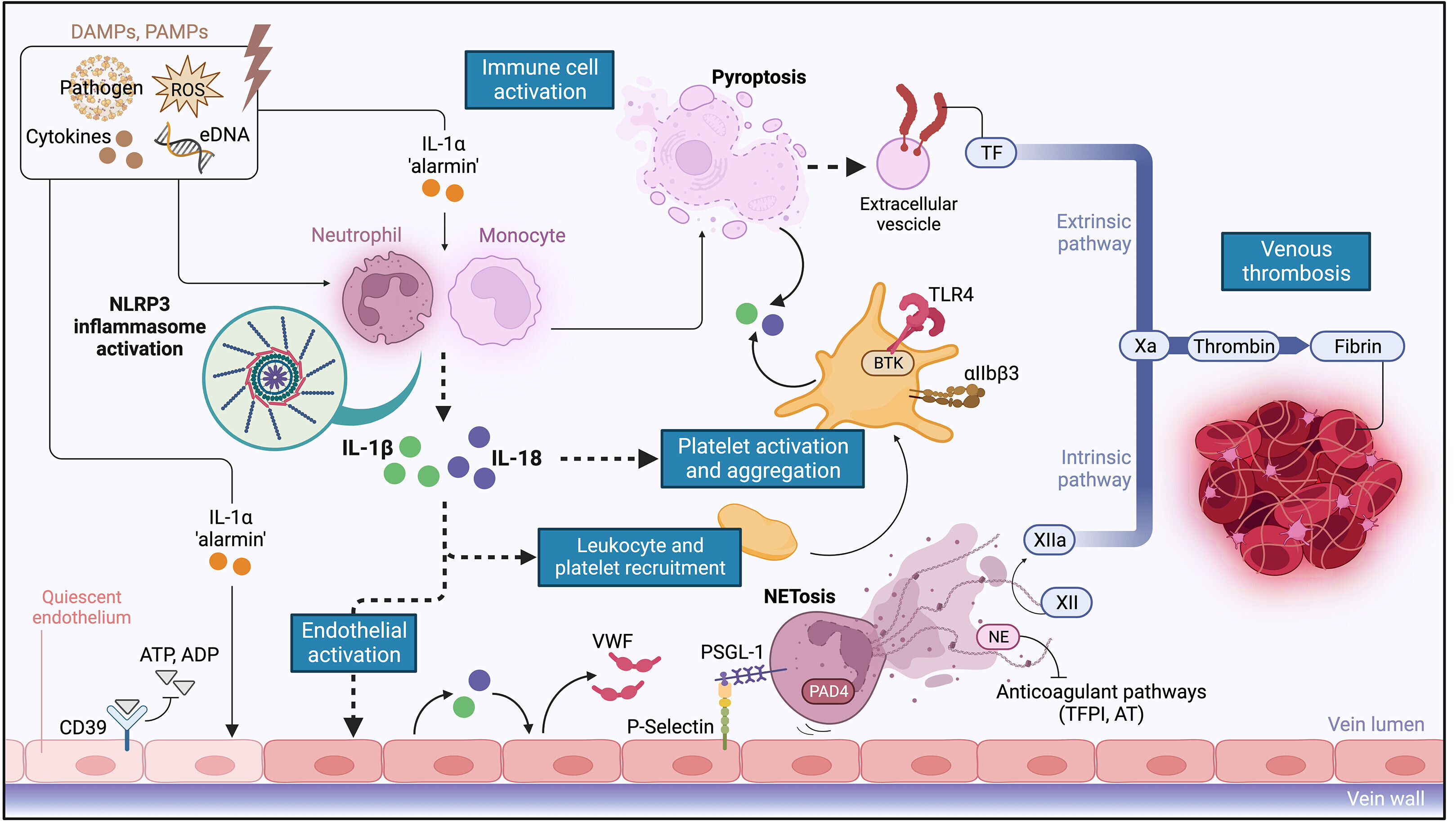
Rôle proposé de l'inflammasome NLRP3 et de l'IL-1 dans la thrombogenèse veineuse
À leur tour, les NET soutiennent l'activation de NLRP3 et la production d'IL-1. Les NET et les enzymes dérivées des neutrophiles favorisent l'autoactivation du facteur XII et perturbent les voies anticoagulantes endogènes (TFPI, AT), stimulant ainsi la génération de thrombine. Le noyau d'ADN des NET interagit avec le VWF et la fibrine, fournissant un échafaudage résistant à la fibrinolyse, pour la stabilité et la croissance du thrombus. Créé avec BioRender.com. AT = antithrombine ; BTK = tyrosine kinase de Bruton; eATP = ATP extracellulaire ; GSDMD = gasdermine D ; DAMP = modèles moléculaires associés aux dommages ; eATP = ATP extracellulaire ; IL = interleukine; NE = élastase neutrophile ; NET = pièges extracellulaires de neutrophiles ; NLRP3 = protéine 3 contenant les domaines NACHT, LRR et pyrine ; NF-kB = facteur nucléaire-kappa B ; PAD4 = peptidylarginine déiminase 4 ; PAMP = modèles moléculaires associés aux agents pathogènes ; PSGL-1 = P-sélectine glycoprotéine ligand-1 ; P2X7R = récepteur P2X7 ; ROS = espèces réactives de l'oxygène ; TF = facteur tissulaire ; TFPI = inhibiteur de la voie du facteur tissulaire ; TLR4 = récepteur de type Toll 4 ; VWF = facteur de von Willebrand
À leur tour, les NET soutiennent l'activation de NLRP3 et la production d'IL-1. Les NET et les enzymes dérivées des neutrophiles favorisent l'autoactivation du facteur XII et perturbent les voies anticoagulantes endogènes (TFPI, AT), stimulant ainsi la génération de thrombine. Le noyau d'ADN des NET interagit avec le VWF et la fibrine, fournissant un échafaudage résistant à la fibrinolyse, pour la stabilité et la croissance du thrombus. Créé avec BioRender.com. AT = antithrombine ; BTK = tyrosine kinase de Bruton; eATP = ATP extracellulaire ; GSDMD = gasdermine D ; DAMP = modèles moléculaires associés aux dommages ; eATP = ATP extracellulaire ; IL = interleukine; NE = élastase neutrophile ; NET = pièges extracellulaires de neutrophiles ; NLRP3 = protéine 3 contenant les domaines NACHT, LRR et pyrine ; NF-kB = facteur nucléaire-kappa B ; PAD4 = peptidylarginine déiminase 4 ; PAMP = modèles moléculaires associés aux agents pathogènes ; PSGL-1 = P-sélectine glycoprotéine ligand-1 ; P2X7R = récepteur P2X7 ; ROS = espèces réactives de l'oxygène ; TF = facteur tissulaire ; TFPI = inhibiteur de la voie du facteur tissulaire ; TLR4 = récepteur de type Toll 4 ; VWF = facteur de von Willebrand
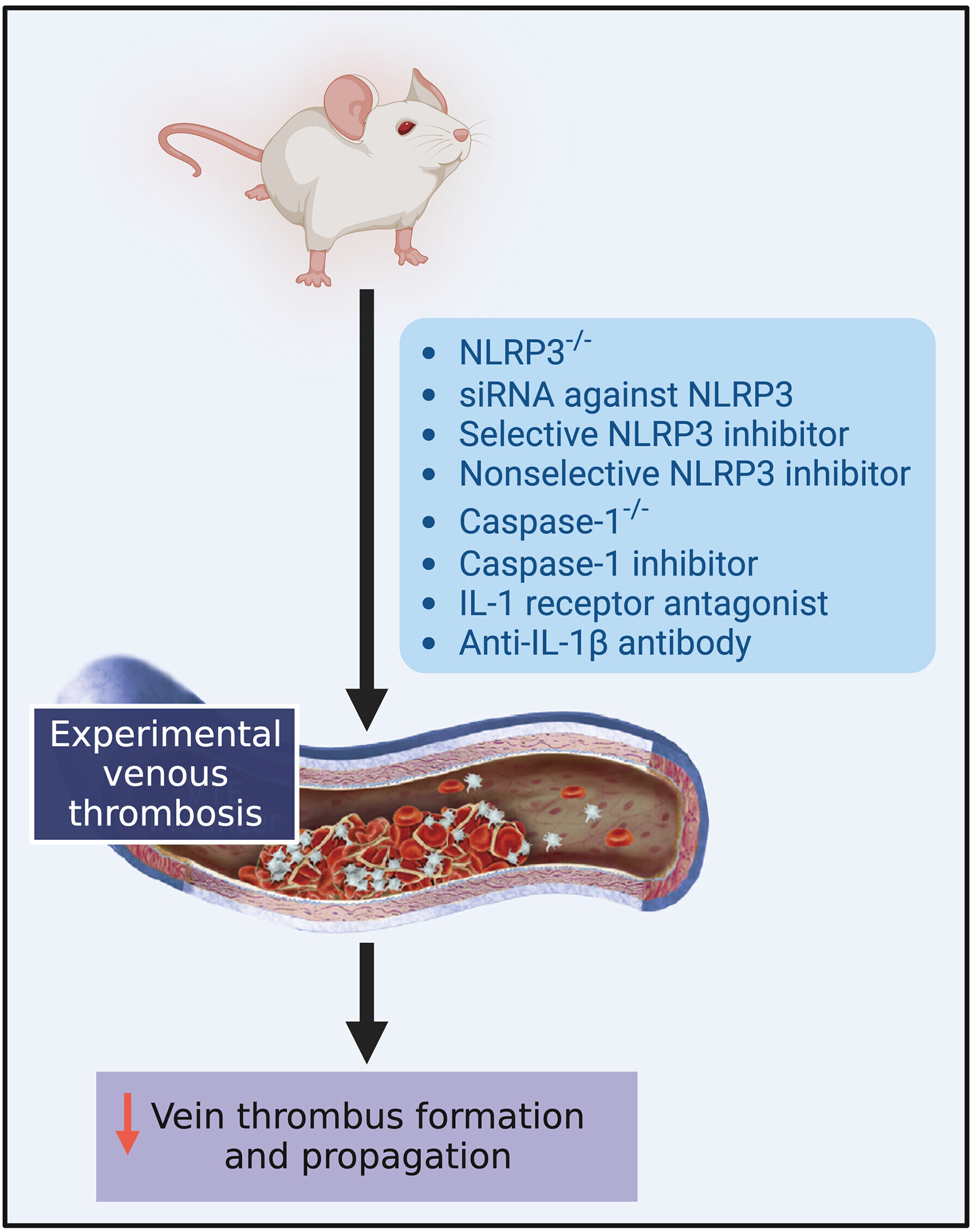
Stratégies ciblant la signalisation de l'inflammasome pour réduire la thrombose veineuse dans les modèles précliniques Créé avec BioRender.com. NLRP3 = protéine 3 contenant les domaines NACHT, LRR et pyrine ; TVP = thrombose veineuse profonde ; siARN = petit ARN interférant ;
Remarques finales et perspectives d'avenir
L'activation de la voie de l'inflammasome NLRP3 et des niveaux accrus d'IL-1β et d'IL-18 sont observés chez les patients atteints de MTEV.
Des études précliniques récentes ont fourni des preuves solides de preuve de concept indiquant que la suppression génétique ou l'inhibition pharmacologique de NLRP3, caspase-1, GSDMD, IL-1β ou IL-18 réduit considérablement la formation et la propagation de thrombus veineux.
Le traitement de l'inflammation sans opposition peut également favoriser la clairance du thrombus et réduire les cicatrices et le dysfonctionnement veineux après la MTEV, protégeant ainsi potentiellement du SPT et de la thromboembolie récurrente.
Ce grand nombre de preuves qui s'accumulent rapidement peut suggérer que le ciblage de la voie de l'inflammasome NLRP3 peut représenter une stratégie thérapeutique intéressante pour prévenir et gérer la MTEV, maximisant finalement les avantages de l'anticoagulation sans augmenter le risque de saignement.
Des essais cliniques bien conçus pour évaluer ces hypothèses sont nécessaires.
Des études in vivo supplémentaires sont également nécessaires pour élucider la contribution exacte des cytokines IL-1 distinctes et de la pyroptose à la thrombose veineuse et à la pathologie de la paroi veineuse, et pour déterminer les effets, avec les fenêtres thérapeutiques correspondantes, d'agents distincts bloquant la signalisation de l'inflammasome.
Enfin, comme de multiples thérapies basées sur l'inflammasome et l'IL-1 sont à l'horizon pour le traitement d'un large éventail de troubles inflammatoires qui comportent un risque thrombotique accru, l'évaluation de l'impact clinique de ces interventions sur la MTEV est de la plus haute importance. et pour déterminer les effets, avec les fenêtres thérapeutiques correspondantes, d'agents distincts bloquant la signalisation de l'inflammasome.
Enfin, comme de multiples thérapies basées sur l'inflammasome et l'IL-1 sont à l'horizon pour le traitement d'un large éventail de troubles inflammatoires qui comportent un risque thrombotique accru, l'évaluation de l'impact clinique de ces interventions sur la MTEV est de la plus haute importance.
Pour en savoir plus : inflammasone et thrombose veineuse
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8270666/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8270666/
"L'interaction entre la coagulation et l'immunité innée contribue à la progression de nombreuses maladies, notamment les infections et les maladies cardiovasculaires. La thromboembolie veineuse (TEV), y compris l'embolie pulmonaire et la thrombose veineuse profonde (TVP), est l'une des causes les plus courantes de décès cardiovasculaire. Ici, nous montrons que l'activation de l'inflammasome et la pyroptose subséquente jouent un rôle important dans le développement de la thrombose veineuse. En utilisant un modèle de thrombose veineuse induite par la restriction du débit chez la souris dans la veine cave inférieure (VCI), nous montrons que le déficit en caspase-1, mais pas en caspase-11, protège contre la thrombose induite par la restriction du débit. L'expression de l'interleukine-1β a augmenté dans la VCI après la ligature, indiquant que l'inflammasome est activé pendant la blessure. Déficit en gasdermine D (GSDMD), médiateur essentiel de la pyroptose, protégé contre la thrombose veineuse induite par la restriction. Après induction de la thrombose veineuse, de la fibrine s'est déposée dans les veines de souris de type sauvage, détectée par immunotransfert avec un anticorps monoclonal qui reconnaît spécifiquement la fibrine de souris, mais pas chez les souris déficientes en caspase-1 ou déficientes en GSDMD. La déplétion des macrophages par le chlorure de gadolinium ou le déficit en facteur tissulaire protège également contre la thrombose veineuse. Nos données révèlent que le facteur tissulaire libéré par les monocytes et les macrophages pyroptotiques suite à l'activation de l'inflammasome déclenche la thrombose. La déplétion des macrophages par le chlorure de gadolinium ou le déficit en facteur tissulaire protège également contre la thrombose veineuse. Nos données révèlent que le facteur tissulaire libéré par les monocytes et les macrophages pyroptotiques suite à l'activation de l'inflammasome déclenche la thrombose. La déplétion des macrophages par le chlorure de gadolinium ou le déficit en facteur tissulaire protège également contre la thrombose veineuse. Nos données révèlent que le facteur tissulaire libéré par les monocytes et les macrophages pyroptotiques suite à l'activation de l'inflammasome déclenche la thrombose."
Commentaire
Enfin de nouvelles pistes pour traiter et mieux comprendre la MTEV et ses conséqences, la piste INFLAMMASOME
Un article récent : Marston NA, Gurmu Y, Melloni GEM, Bonaca M, Gencer B, Sever PS, Pedersen TR, Keech AC, Roselli C, Lubitz SA, Ellinor PT, O'Donoghue ML, Giugliano RP, Ruff CT, Sabatine MS. The Effect of PCSK9 (Proprotein Convertase Subtilisin/Kexin Type 9) Inhibition on the Risk of Venous Thromboembolism. Circulation. 2020 May 19;141(20):1600-1607. doi: 10.1161/CIRCULATIONAHA.120.046397. Epub 2020 Mar 29. PMID: 32223429; PMCID: PMC7469753.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7469753/pdf/nihms-1584993.pdf
Un article récent : Marston NA, Gurmu Y, Melloni GEM, Bonaca M, Gencer B, Sever PS, Pedersen TR, Keech AC, Roselli C, Lubitz SA, Ellinor PT, O'Donoghue ML, Giugliano RP, Ruff CT, Sabatine MS. The Effect of PCSK9 (Proprotein Convertase Subtilisin/Kexin Type 9) Inhibition on the Risk of Venous Thromboembolism. Circulation. 2020 May 19;141(20):1600-1607. doi: 10.1161/CIRCULATIONAHA.120.046397. Epub 2020 Mar 29. PMID: 32223429; PMCID: PMC7469753.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7469753/pdf/nihms-1584993.pdf
Cet article faite le lien entre la Lp(a) et la MTEV : L'inhibition de PCSK9 réduit significativement le risque de MTEV. La réduction de la Lp(a) peut être un médiateur important de cet effet, une découverte particulièrement intéressante compte tenu du développement en cours de puissants inhibiteurs de la Lp(a). Alors que les thérapies d'interférence ARN (ARNi) et d'oligonucléotide antisens (ASO) contre la Lp(a) progressent vers des essais cliniques de phase 3, l'évaluation de la MTEV peut être justifiée.
Un autre article fait le lien entre Lp(a) et inflammaosome :
Un autre article fait le lien entre Lp(a) et inflammaosome :
Lorey, Martina & Borelli, M. & Äikäs, Lauri & Youssef, A. & Hermansson, M. & Kemppainen, A. & Ruhanen, Hanna & Ruuth, Maija & Matikainen, S. & Kovanen, Petri & Käkelä, R. & Boffa, Michael & Koschinsky, M.L. & Oörni, Katariina. (2021). Lp(a) induces inflammasome activation in human macrophages. Atherosclerosis. 331. e19. 10.1016/j.atherosclerosis.2021.06.061.
"Nos données montrent que les taux plasmatiques de Lp(a) sont directement corrélés à l'activation de l'inflammasome dans les macrophages, que la Lp(a) isolée induit une activation de la caspase-1 dose-dépendante plus forte que celle des LDL, et que les LDL et la Lp(a) présentent des différences structurelles claires en plus de apo(a)."
INFLAMMASOME, MTEV, LP(a), des pistes de recherche à suivre, ne restons pas figé par les anticoagulants ... existe-t-il autre chose que l'anticoagulation pour combattre la MTEV ? La Covid-19 nous a ouvert des portes, l'endothélite, l'inflammation, sont à prendre en considération....pour demain ou après demain.
"Nos données montrent que les taux plasmatiques de Lp(a) sont directement corrélés à l'activation de l'inflammasome dans les macrophages, que la Lp(a) isolée induit une activation de la caspase-1 dose-dépendante plus forte que celle des LDL, et que les LDL et la Lp(a) présentent des différences structurelles claires en plus de apo(a)."
INFLAMMASOME, MTEV, LP(a), des pistes de recherche à suivre, ne restons pas figé par les anticoagulants ... existe-t-il autre chose que l'anticoagulation pour combattre la MTEV ? La Covid-19 nous a ouvert des portes, l'endothélite, l'inflammation, sont à prendre en considération....pour demain ou après demain.

