MÉTHODES :
Cette étude rétrospective a utilisé des données de santé électroniques US Optum De-Identified du 1er janvier 2013 au 31 décembre 2020. Pour être inclus, les patients devaient être âgés de plus de 18 ans, avoir reçu un diagnostic de maladie active (primaire oumétastatique) à l'exclusion des cancers de l'œsophage, de l'estomac, colorectaux non réséqués, de la vessie, de la leucémie ou du système nerveux central (à l'exception du cancer du cerveau, qui était inclus) (c'est-à-dire une cohorte de patients atteints de CAT pour lesquels les AOD sont approuvés par les lignes directrices comme alternatives aux héparine de poids); avez été admis à l'hôpital, au service des urgences ou à l'unité d'observation pour thromboembolie veineuse (TEV); a reçu une dose thérapeutique VTE de rivaroxaban ou d'apixaban, et était sous rivaroxaban ou apixaban le jour 7 après la qualification VTE ; et ont été activement enregistrés dans l'ensemble de données ≥ 12 mois avant de subir le CAT. Le cancer actif a été défini comme un cancer activement traité, diagnostiqué dans les 6 mois précédant le CAT index ou associé à une maladie métastatique, quel que soit le délai écoulé depuis le diagnostic du cancer. Les patientes étaient exclues si elles avaient une indication alternative à l'anticoagulation, si elles étaient anticoagulées dans les 12 mois précédents ou si elles étaient enceintes. La puissance de l'étude était d'évaluer le délai jusqu'au premier événement composite de TEV récurrent ou de tout saignement entraînant une hospitalisation à un suivi maximal de 3 mois. Les autres critères de jugement évalués comprenaient le composite de la TEV récurrente ou de tout saignement d'organe critique, la TEV récurrente, tout saignement entraînant une hospitalisation et tout saignement d'organe critique à 3 et 6 mois. La probabilité inverse stabilisée de pondération du traitement (IPTW) a été utilisée pour équilibrer les cohortes d'anticoagulants pour les covariables de base. Les rapports de risque (HR) avec des intervalles de confiance (IC) à 95 % pour tous les critères de jugement ont été calculés à l'aide de la régression de Cox avec des estimateurs robustes. ou étaient enceintes. La puissance de l'étude était d'évaluer le délai jusqu'au premier événement composite de TEV récurrent ou de tout saignement entraînant une hospitalisation à un suivi maximal de 3 mois. Les autres critères de jugement évalués comprenaient le composite de la TEV récurrente ou de tout saignement d'organe critique, la TEV récurrente, tout saignement entraînant une hospitalisation et tout saignement d'organe critique à 3 et 6 mois. La probabilité inverse stabilisée de pondération du traitement (IPTW) a été utilisée pour équilibrer les cohortes d'anticoagulants pour les covariables de base. Les rapports de risque (HR) avec des intervalles de confiance (IC) à 95 % pour tous les critères de jugement ont été calculés à l'aide de la régression de Cox avec des estimateurs robustes. ou étaient enceintes. La puissance de l'étude était d'évaluer le délai jusqu'au premier événement composite de TEV récurrent ou de tout saignement entraînant une hospitalisation à un suivi maximal de 3 mois. Les autres critères de jugement évalués comprenaient le composite de la TEV récurrente ou de tout saignement d'organe critique, la TEV récurrente, tout saignement entraînant une hospitalisation et tout saignement d'organe critique à 3 et 6 mois. La probabilité inverse stabilisée de pondération du traitement (IPTW) a été utilisée pour équilibrer les cohortes d'anticoagulants pour les covariables de base. Les rapports de risque (HR) avec des intervalles de confiance (IC) à 95 % pour tous les critères de jugement ont été calculés à l'aide de la régression de Cox avec des estimateurs robustes. Les autres critères de jugement évalués comprenaient le composite de la TEV récurrente ou de tout saignement d'organe critique, la TEV récurrente, tout saignement entraînant une hospitalisation et tout saignement d'organe critique à 3 et 6 mois. La probabilité inverse stabilisée de pondération du traitement (IPTW) a été utilisée pour équilibrer les cohortes d'anticoagulants pour les covariables de base. Les rapports de risque (HR) avec des intervalles de confiance (IC) à 95 % pour tous les critères de jugement ont été calculés à l'aide de la régression de Cox avec des estimateurs robustes. Les autres critères de jugement évalués comprenaient le composite de la TEV récurrente ou de tout saignement d'organe critique, la TEV récurrente, tout saignement entraînant une hospitalisation et tout saignement d'organe critique à 3 et 6 mois. La probabilité inverse stabilisée de pondération du traitement (IPTW) a été utilisée pour équilibrer les cohortes d'anticoagulants pour les covariables de base. Les rapports de risque (HR) avec des intervalles de confiance (IC) à 95 % pour tous les critères de jugement ont été calculés à l'aide de la régression de Cox avec des estimateurs robustes.A priori , nous avons calculé qu'il fallait 958 patients/groupe pour démontrer la non-infériorité du rivaroxaban pour le composite de la TEV récurrente ou de tout saignement entraînant une hospitalisation avec une puissance de 80 %, en supposant un taux d'incidence de 7 % dans les deux groupes et une limite supérieure de l'IC à 95 % pour la non-infériorité de 1,50 ( précédemment utilisé dans l'essai HOKUSAI VTE Cancer) .
RÉSULTATS :
Nous avons identifié un total de 2437 patients (1344 apixaban et 1093 rivaroxaban). Parmi ceux-ci, 29,0 % avaient ≥ 75 ans, 56,9 % étaient des femmes, 20,6 % avaient un indice de masse corporelle ≥ 35 kg/m 2, et 19,4 % avaient un débit de filtration glomérulaire estimé < 60 mL/min au départ. L'événement CAT était une embolie pulmonaire ± thrombose veineuse profonde chez 45,6 % des patients, 37,8 % avaient une maladie métastatique et 57,8 % avaient reçu un traitement anticancéreux actif dans les 4 semaines suivant l'événement CAT. Les types de cancer les plus courants (> 10 % de prévalence) comprenaient le sein (23,5 %), le poumon (20,1 %), la prostate (14,9 %) et l'hépatobiliaire (12,1 %). Après l'IPTW, les caractéristiques des patients recevant du rivaroxaban et de l'apixaban étaient similaires pour toutes les covariables incluses dans le modèle de score de propension (différence standardisée absolue ≤ 0,07 pour tous). À 3 mois, le rivaroxaban s'est avéré au moins aussi efficace et sûr que l'apixaban pour le composite d'hospitalisations liées à une TEV récurrente ou à une hémorragie (5,3 % contre 6,0 % ; RR = 0,87, IC à 95 % 0,60-1,27)( Figure). Aucune différence significative n'a été observée entre les groupes pour ce résultat à 6 mois ou pour d'autres résultats à 3 ou 6 mois.
CONCLUSIONS :
Le rivaroxaban est apparu au moins aussi efficace et sûr que l'apixaban, avec une non-infériorité démontrée pour le résultat composite de la récidive de TEV ou de tout saignement entraînant une hospitalisation à 3 mois. Aucune différence statistique dans aucun autre résultat n'a été observée après 3 ou 6 mois de suivi.
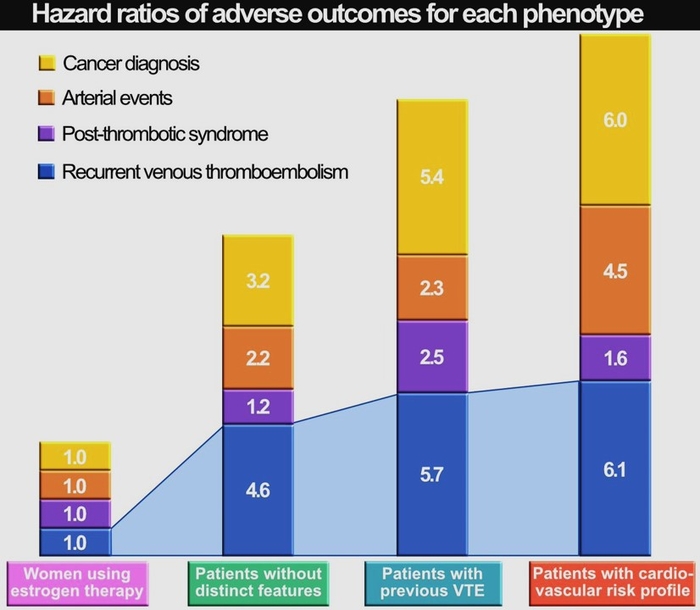
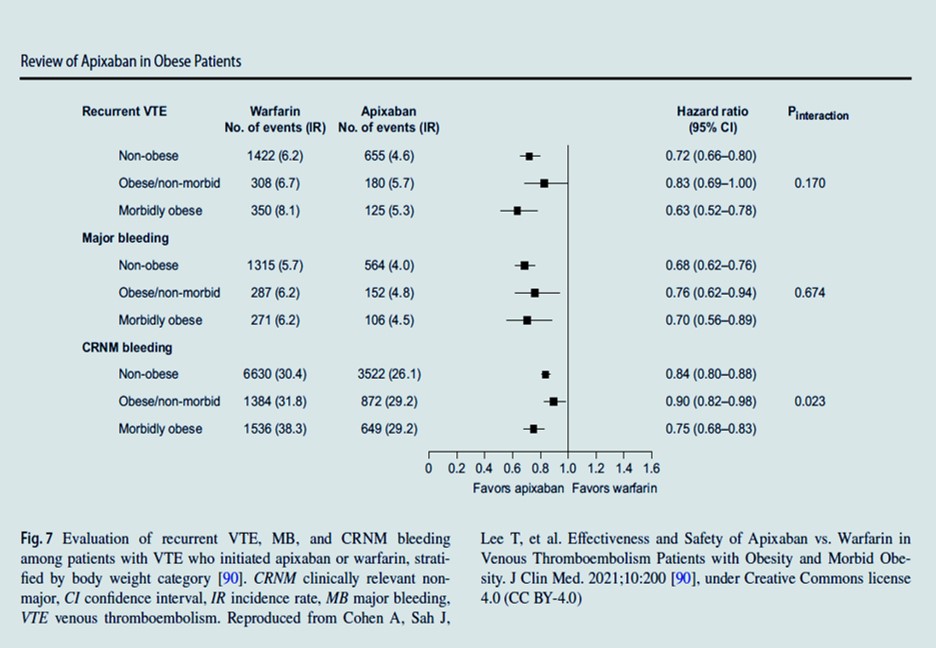
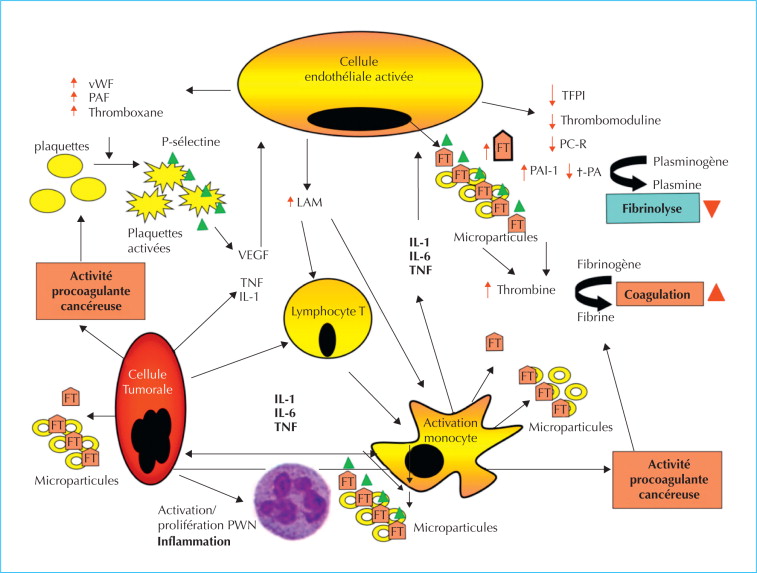
 Cancer et MTEV
Cancer et MTEV
https://www.worldthrombosisday.org/issue/cancer/associated/thrombosis/Commentaire
Rivaroxaban / Apixaban match nul pour le traitement d'une MTEV au cous d'un cancer à 3 mois et 6 mois sur tous les objectifs de l'étude. Pas de sur risque hémorragique pour l'un et pour l'autre.Dans cette étude pas de cancer de la sphère digestive ni urolthélial, cancesr à sur risque hémorragique.Certaines études ont montré un sur risque hémorragique du rivaroxaban (FA).
Pour l'instant il faut prescrire l'un ou l'autre de ces 2 AOD selon votre expérience, le type de cancer, les traitements associés du cancer, l'âge, les atcds hémorragiques du patiuent etc. Faire confiance à la fois à son expérience et tenir compte des souhaits du patient. L'apixaban est délivré en deux cp /j et le rivaroxaba, en un comp/j
Ce sont deux Anti Xa avec les mêmes propriétés et les mêmes résultats sur la récidive de la MTEV et sur la protection des patients en FA.
Tout d'abord la monoprise évite plus les erreurs de prise à priori que la "bi-prise", mais on peut aussi considérer que les patients concernés par l'anticoagulation ont d'autres traitements souvent en 2 prises.
On retrouve sur le plan pharmacodynamique des variations de concentrations mais avec un impact faible.
Donc peu de différences excepté le risque hémorragique. Il semble que ce risque diminue avec la bi prise. notamment chez les sujets âgés avec une fonction rénale altérée. L'apixaban ferait mieux à priori avec les réserves de l'absence de comparaison directe entre ces 2 molécules.
L'idéal pour comparer ces deux molécules c'est le "head to head" , étude prospective, comparative à l'aveugle avec tirage au sort des patients rivaroxaban ou apixaban dans la FA , la MTEV et MTEV et cancer.
Qui relévera le défit ?
PS 1 : à noter dans les auteurs de la communication la présence de Bayer
PS 2 : nous attendons la publication de cette étude avec impatience