"60 % des patients atteints de cancer ignorent le risque de thromboembolie veineuse liée au cancer" reférence
Jean Pierre LAROCHE
Clics : 1415
CANCER/MTEV : les liens
"60 % des patients atteints de cancer ignorent le risque de thromboembolie veineuse liée au cancer" reférence
« L’infarctus, le cancer, la lèpre ? J’ai peur d’une autre maladie : l’insignifiance. » Anatole Bisk
« Et pourtant je crois profondément en l’humanité. Je sais que ce cancer aurait dû depuis longtemps être guéri. Mais le bon sens des hommes est systématiquement corrompu. Et les coupables se nomment: école, presse, monde des affaires, monde politique. » Albert Einstein
« Et pourtant je crois profondément en l’humanité. Je sais que ce cancer aurait dû depuis longtemps être guéri. Mais le bon sens des hommes est systématiquement corrompu. Et les coupables se nomment: école, presse, monde des affaires, monde politique. » Albert Einstein
Falanga A, Marchetti M. Cancer-Associated Thrombosis: Enhanced awareness and pathophysiologic complexity. J Thromb Haemost. 2023 Mar 15:S1538-7836(23)00231-3. doi: 10.1016/j.jtha.2023.02.029. Epub ahead of print. PMID: 36931602.
Thrombose associée au cancer : sensibilisation accrue et complexité physiopathologique
https://www.jthjournal.org/article/S1538-7836(23)00231-3/fulltext
Thrombose associée au cancer : sensibilisation accrue et complexité physiopathologique
https://www.jthjournal.org/article/S1538-7836(23)00231-3/fulltext
La thrombose, à la fois veineuse et artérielle, est une cause majeure de morbidité et de mortalité chez les patients atteints de cancer.
Les études sur les bases moléculaires de la thrombophilie associée au cancer ont une longue histoire à partir de la première observation de la présence de cellules tumorales dans les microthrombus circulants il y a 2 siècles.
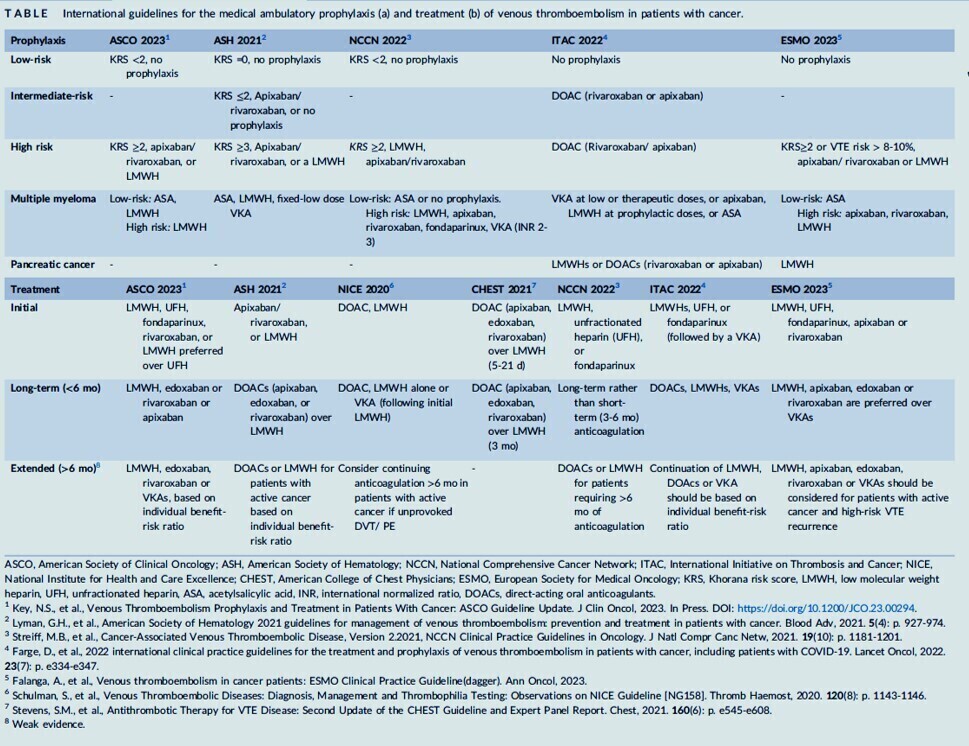
Le lien profond entre les voies de la coagulation sanguine et la biologie tumorale est de plus en plus décrypté et de nouveaux acteurs de cette interaction complexe ont été identifiés. L'impact défavorable de la thrombose chez un patient atteint de cancer, sur lequel pèse également un risque hémorragique élevé par rapport à la population non cancéreuse, a conduit pendant des années à la réalisation d'études cliniques d'envergure pour adopter les meilleures stratégies de prophylaxie et de traitement desthromboembolie veineuse dans différents contextes médicaux et chirurgicaux, désormais intégrés dans des recommandations internationales dédiées.
Ce domaine représente cependant encore un défi ouvert en raison de la variabilité intrinsèque du patient atteint de cancer avec ses antécédents médicaux personnels et ses facteurs de risque cardiovasculaire, ainsi que le type, le site et le stade de la tumeur, et l'utilisation d'un large éventail de nouveaux médicaments anticancéreux sophistiqués .
Cette revue vise à mettre en évidence certaines des nombreuses observations clés dans le domaine du cancer et de la thrombose, allant de la biologie fondamentale des tumeurs aux essais cliniques avancés de nouveaux anticoagulants. Nous espérons que certains des exemples que nous avons inclus inciteront les lecteurs à explorer et à discuter de ces sujets, augmentant ainsi la sensibilisation à la thrombose liée au cancer chez les médecins et les patients.
Les études sur les bases moléculaires de la thrombophilie associée au cancer ont une longue histoire à partir de la première observation de la présence de cellules tumorales dans les microthrombus circulants il y a 2 siècles.
Le lien profond entre les voies de la coagulation sanguine et la biologie tumorale est de plus en plus décrypté et de nouveaux acteurs de cette interaction complexe ont été identifiés. L'impact défavorable de la thrombose chez un patient atteint de cancer, sur lequel pèse également un risque hémorragique élevé par rapport à la population non cancéreuse, a conduit pendant des années à la réalisation d'études cliniques d'envergure pour adopter les meilleures stratégies de prophylaxie et de traitement desthromboembolie veineuse dans différents contextes médicaux et chirurgicaux, désormais intégrés dans des recommandations internationales dédiées.
Ce domaine représente cependant encore un défi ouvert en raison de la variabilité intrinsèque du patient atteint de cancer avec ses antécédents médicaux personnels et ses facteurs de risque cardiovasculaire, ainsi que le type, le site et le stade de la tumeur, et l'utilisation d'un large éventail de nouveaux médicaments anticancéreux sophistiqués .
Cette revue vise à mettre en évidence certaines des nombreuses observations clés dans le domaine du cancer et de la thrombose, allant de la biologie fondamentale des tumeurs aux essais cliniques avancés de nouveaux anticoagulants. Nous espérons que certains des exemples que nous avons inclus inciteront les lecteurs à explorer et à discuter de ces sujets, augmentant ainsi la sensibilisation à la thrombose liée au cancer chez les médecins et les patients.
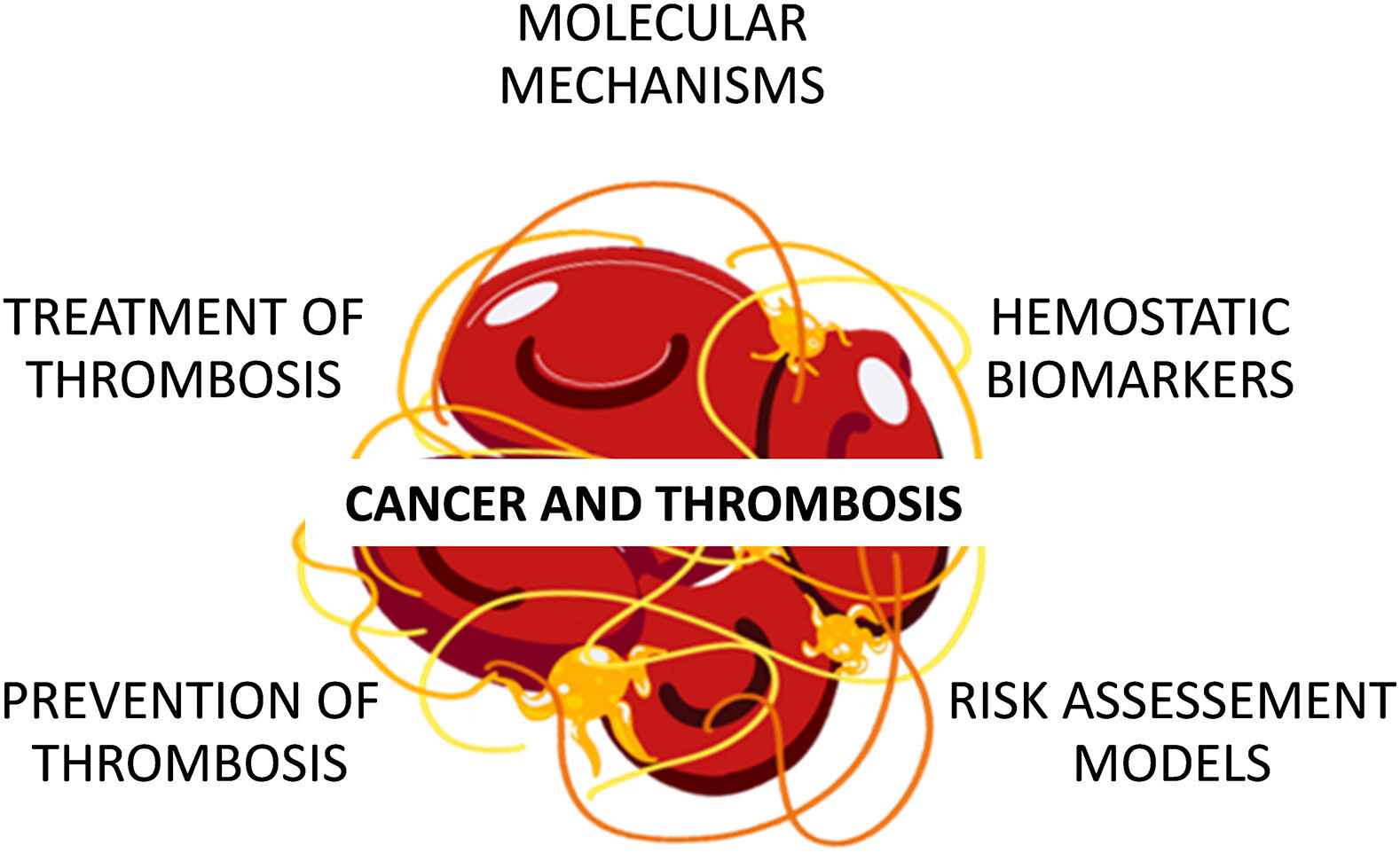
Cancer et thrombose. Les problèmes de thrombose et de cancer couvrent de nombreux domaines de recherche tels que les mécanismes moléculaires à la base de la diathèse prothrombotique, les études de biomarqueurs hémostatiques en relation avec les résultats de la thrombose ou du cancer, le développement de modèles d'évaluation des risques conçus pour calculer le risque thrombotique individuel, et la prophylaxie et le traitement des thrombose associée au cancer.
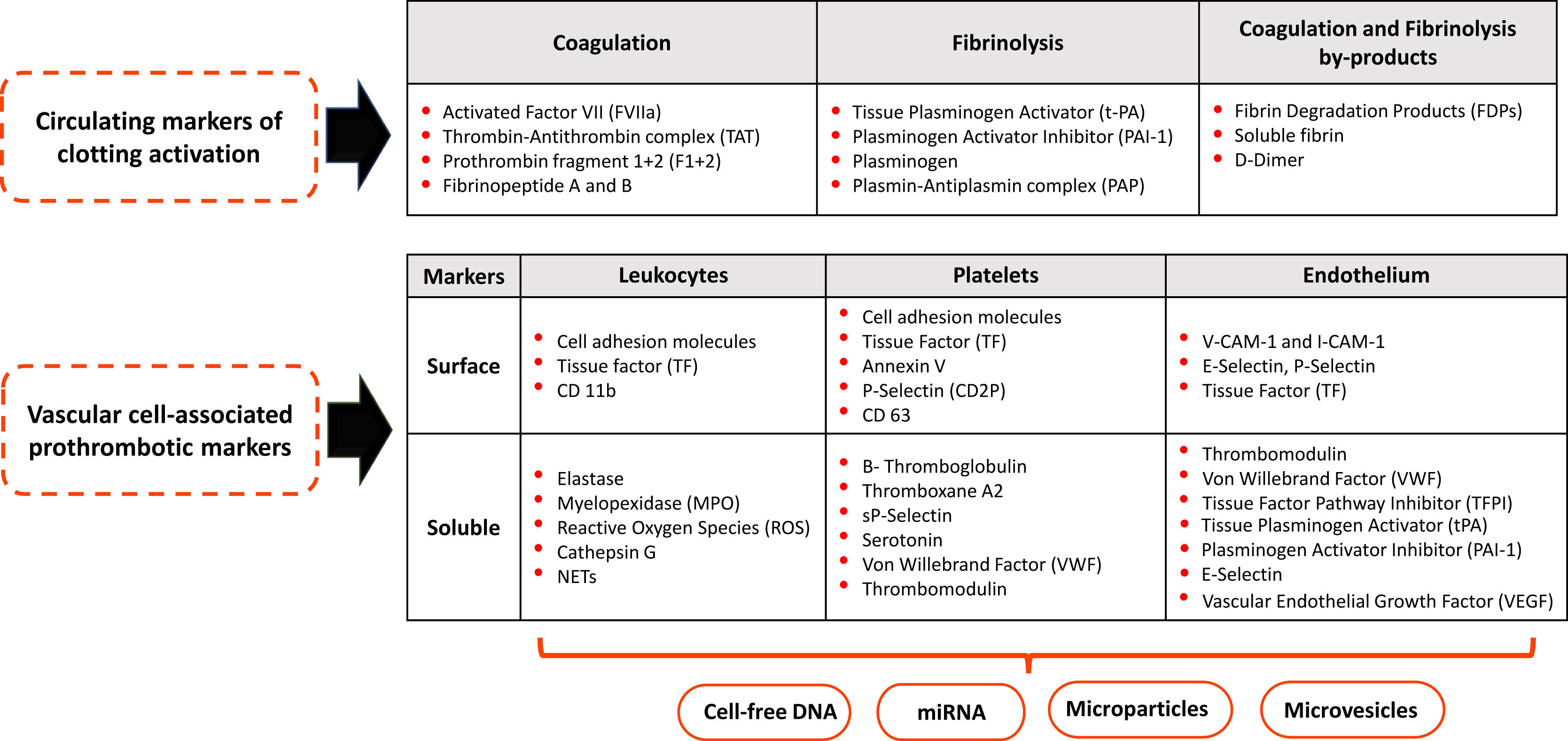
Mesure de l'activation du système hémostatique. Aujourd'hui, de nombreux tests sont disponibles pour la mesure des biomarqueurs de l'activation du système hémostatique à la fois dans le plasma et sur les cellules vasculaires circulantes. Une autre classe de biomarqueurs est représentée par les microvésicules, les microparticules (MPs), les MP-encapsulées ou les macromolécules libres telles que l'ADN acellulaire circulant (cfDNA) et les micro-ARN (miARN) libérés par les cellules vasculaires.
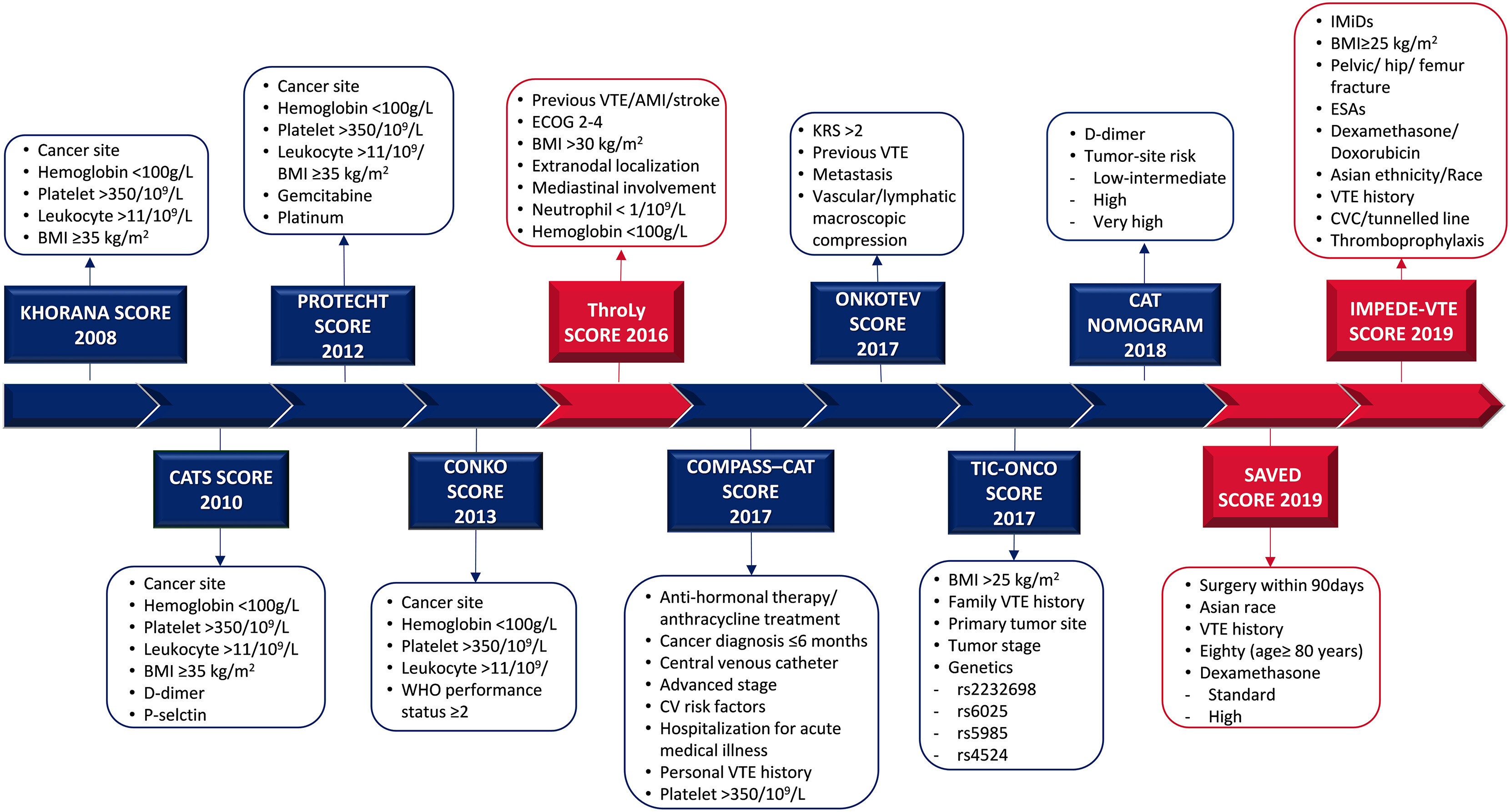
Évolution des modèles d'évaluation des risques. Des modèles d'évaluation des risques (RAM) ont été développés dans les tumeurs malignes solides (bleu) et hématologiques (rouge) pour identifier et guider la thromboprophylaxie chez les patients ambulatoires à haut risque atteints de cancer pendant la chimiothérapie. Le score de risque de Khorana (KRS) a été le premier modèle prédictif de thrombose associée à la chimiothérapie. Au fil du temps, plusieurs modifications du KRS ont été proposées pour améliorer ses performances discriminatoires avec la génération de différentes RAM, notamment les scores CATS, PROTECHT, CONKO, ONKOTEV et TiC-Onco. Plus précisément, le score CATS ajoute les D-dimères et la P-sélectine au KRS ; le PROTECHT ajoute cisplatine/carboplatine ou chimiothérapie à base de gemcitabine ;l'ONKOTEV inclut la compression, les antécédents de TEV et la présence de métastases, le TIC-ONCO prend également en compte les facteurs de risque génétiques , tandis que le score CONKO substitue l'IMC au statut de performance. Entre-temps, des modèles de nouvelle génération, les nomogrammes COMPASS-CAT et CAT, ont été validés. Le score COMPASS-CAT, développé pour les cancers du côlon, du poumon, de l'ovaire et du sein, montre les meilleures performances chez les patients atteints de cancer du poumon . Le nomogramme CAT est un modèle très simple basé sur le type de tumeur et les valeurs de D-dimères avant la chimiothérapie. Pour les hémopathies malignes, le score ThroLy est conçu pour prédire la thrombose dans le lymphome, tandis que les scores IMPEDE-VTE et SAVED concernent les patients atteints de myélome multiple.
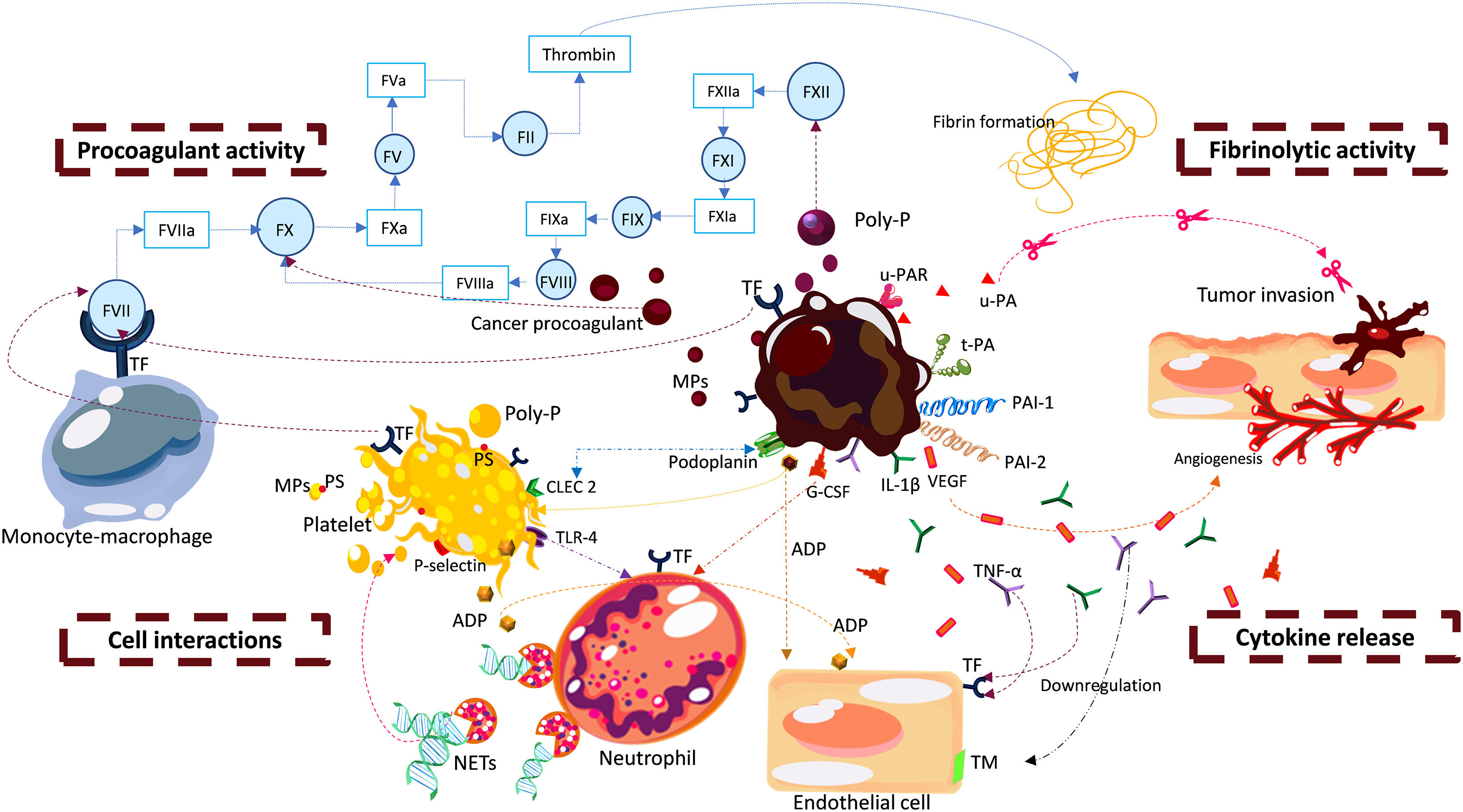
Propriétés prothrombotiques des cellules tumorales. Les cellules tumorales expriment différentes propriétés prothrombotiques et sont capables d'activer la coagulation par des voies directes et indirectes. Les mécanismes directs comprennent l'expression du facteur tissulaire (TF), qui, en complexe avec le FVII/FVIIa, active le FX ; un procoagulant anticancéreux , une protéase à cystéine capable d'activer le FX en l'absence de FVII ; et les polyphosphates (Poly-p) qui se lient et activent le FXII. D'autres procoagulants associés aux cellules tumorales comprennent une activité de type FXIII qui favorise la réticulation de la fibrine et de l'héparanase , capable d'augmenter l'activité TF de surface cellulaire en interagissant avec l' inhibiteur de la voie TF(TFPI). L'expression tumorale de plusieurs protéines impliquées dans le processus fibrinolytique est tout aussi importante, notamment l' activateur du plasminogène de l'urokinase (u-PA) et son récepteur (uPAR), l'activateur tissulaire du plasminogène (t-PA), l'inhibiteur de l'activateur du plasminogène-1 et 2 (PAI-1, PAI-2), et annexine 2 . Les mécanismes indirects d'activation de la coagulation sont liés aux activités des cytokines pro-inflammatoires, telles que le facteur de nécrose tumorale-α (TNF-α) et l'interleukine-1β (IL-1β), qui, au niveau de l'endothélium vasculaire, régulent négativement le système anticoagulant (c'est-à- dire la thrombomoduline , TM), et induisent l'expression de TF, PAI-1 et du facteur von Willebrand(VWF). De plus, les cellules tumorales libèrent une variété de facteurs de croissance, y compris le facteur de croissance endothélial vasculaire (VEGF), impliqué dans la régulation à la hausse du TF endothélial, et le G-CSF responsable de la formation accrue de pièges extracellulaires de neutrophiles (NET). Les NET peuvent stimuler la coagulation en activant le FXII et en dégradant le TFPI, et favoriser le recrutement de plaquettes, de globules rouges, de vésicules extracellulaires et de molécules procoagulantes, telles que le VWF et le TF. De plus, les cellules tumorales activent les plaquettes en libérant de l'adénosine diphosphate (ADP). Une fois activées, les plaquettes deviennent procoagulantes et proadhésives en raison de l'exposition à la phosphatidylsérine(PS) sur leur surface externe, la sécrétion de poly-P et d'autres molécules à partir de granules intracellulaires, et la régulation à la hausse des molécules d'adhésion de surface , y compris la P-sélectine. La thrombine générée par l'activation de la coagulation induite par la tumeur contribue en outre à l'activation plaquettaire. Dans ce scénario, les microvésicules/microparticules (MP) portant des activités procoagulantes (c.-à-d. TF et PS) libérées par la tumeur et les cellules normales circulantes peuvent favoriser la génération d'activation de la coagulation locale et systémique. Les molécules d'adhésion cellule-cellule sont d'autres acteurs de la complexité de la biologie du système hémostatique-cancer, permettant l'interaction directe des cellules tumorales avec les cellules endothéliales, les leucocytes, les érythrocytes et les plaquettes, ce qui contribue à la génération d'un agent prothrombotique, pro-inflammatoire et adhésif.microenvironnement . CLEC-2 = récepteur de type lectine de type C 2.
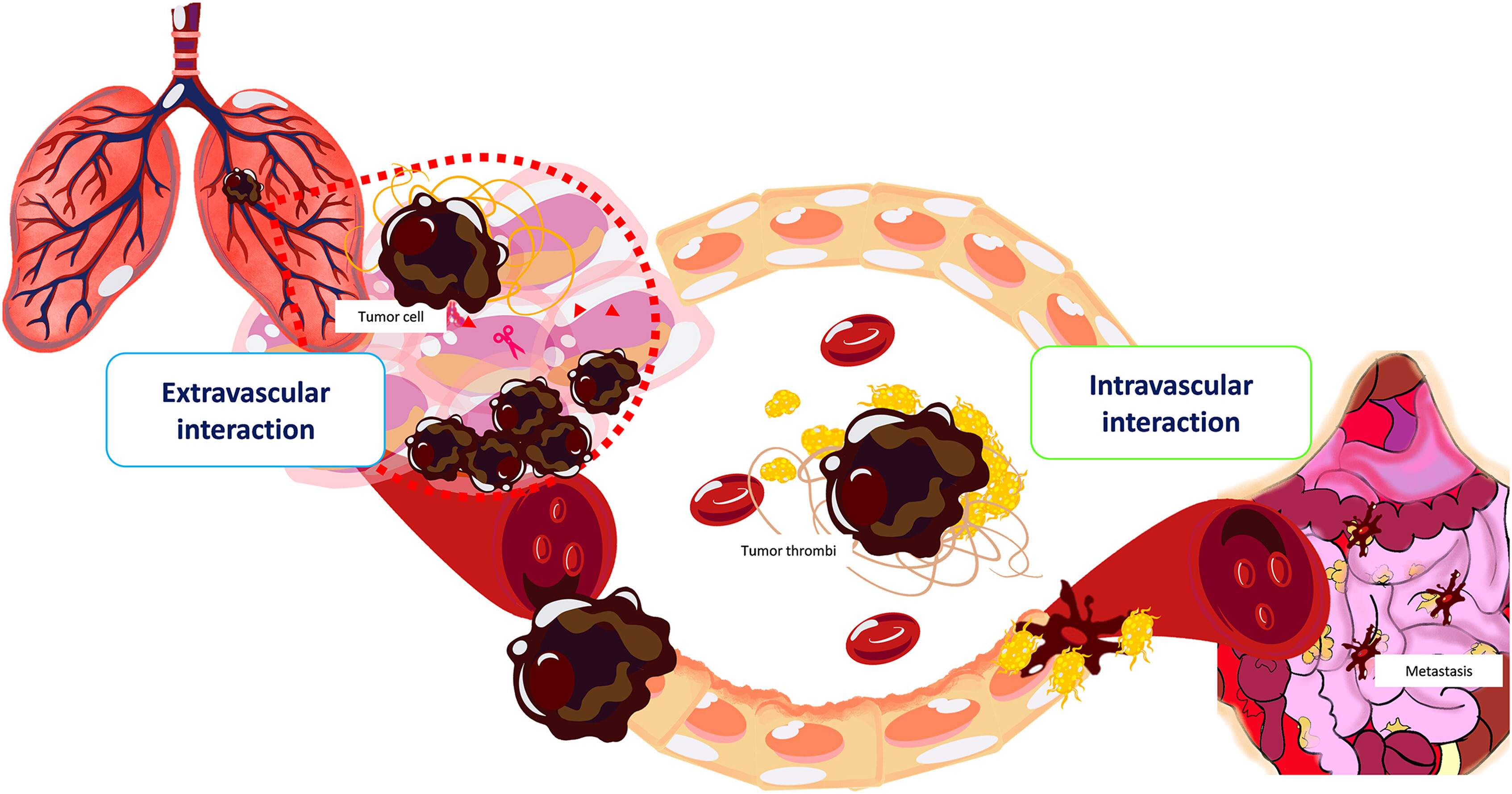
Interactions du système hémostatique des cellules tumorales extravasculaires et intravasculaires. L'endothélium associé à la tumeur se caractérise par une perméabilité accrue qui permet l'extravasation des facteurs de coagulation dans le microenvironnement tumoral . L'interaction des protéines de coagulation avec les procoagulants tumoraux provoque l'activation locale de la cascade de coagulation sanguine, qui est potentialisée par le MP porteur de TF libéré par les cellules tumorales, et les faibles niveaux de TFPI. La fibrine formée autour des cellules tumorales fournit une matrice temporaire pour la migration des cellules tumorales facilitée par les protéines fibrinolytiques exprimées par les tissus tumoraux (c'est-à-dire uPA, tPA, uPAR et PAI-1). La thrombine est un mitogènequi peuvent également contribuer à la formation de stroma tumoral. Au niveau du site intravasculaire, les cellules tumorales entrant dans la circulation sanguine favorisent la génération de microthrombus composés de fibrine et de plaquettes. Les cytokines pro-inflammatoires libérées par les cellules tumorales induisent les caractéristiques adhésives de l'endothélium et de la NETosis par les neutrophiles. La fibrine et les plaquettes autour des cellules tumorales entravent leur reconnaissance par les cellules immunitaires , favorisent leur arrêt au niveau de l'endothélium avec piégeage dans la microvasculature , la survie et l'extravasation avec l'établissement de métastases.
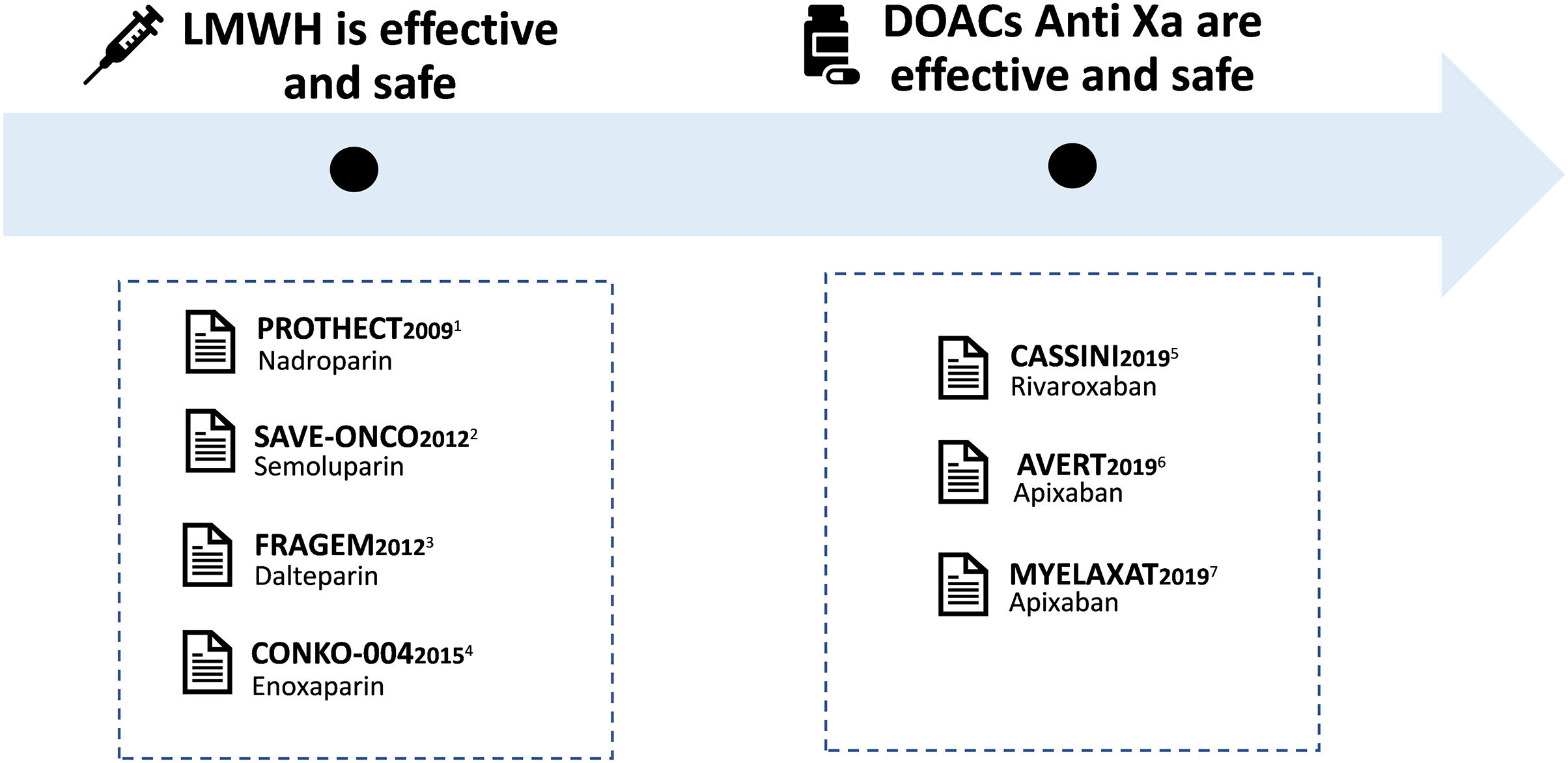
Prophylaxie de la thromboembolie veineuse (TEV) chez les patients ambulatoires atteints de cancer au fil du temps. Chronologie de la prophylaxie de la TEV chez les patients ambulatoires atteints de cancer basée sur des preuves d'essais cliniques. 1 Agnelli, G., et al., Lancet Oncol, 2009. 2 Agnelli, G., et al., N Engl J Med, 2012. 3 Maraveyas, A., et al., Eur J Cancer, 2012. 4 Pelzer , U., et al., J Clin Oncol, 2015. 5 Khorana, AA, et al., N Engl J Med, 2019. 6 Carrier, M., et al., N Engl J Med, 2019. 7 Pegourie, B., et al., Am J Hematol, 2019.
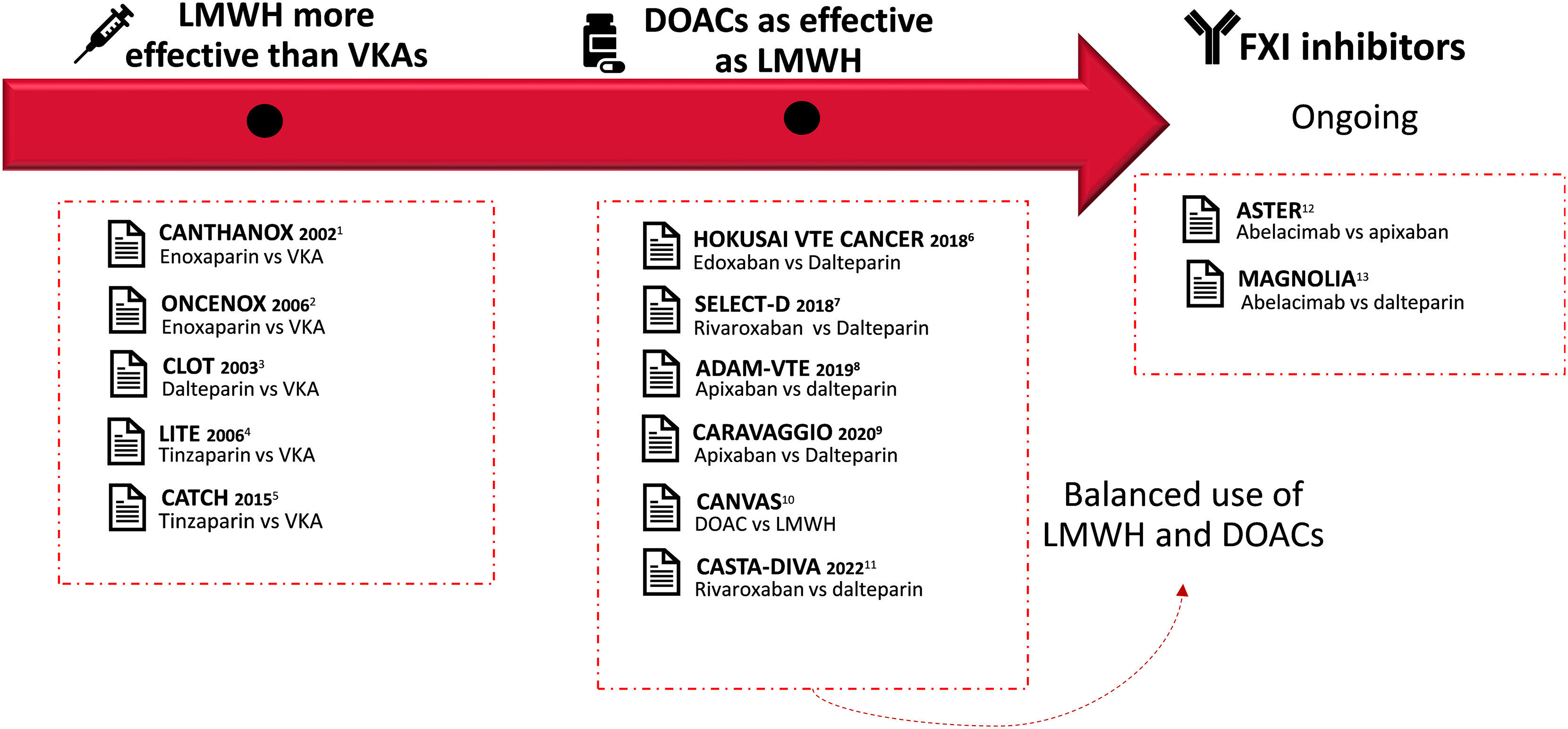
Traitement de la thromboembolie veineuse (TEV) dans le cancer au fil du temps. Chronologie du traitement de la TEV basée sur les preuves des essais cliniques. 1 Meyer, G., et al., Arch Intern Med, 2002. 2 Deitcher, SR, et al., Clin Appl Thromb Hemost, 2006. 3 Lee, AY, et al., N Engl J Med, 2003. 4 Hull , RD, et al., Am J Med, 2006. 5 Lee, AYY, et al., JAMA, 2015. 6 Raskob, GE, et al., N Engl J Med, 2018. 7 Young, AM, et al. , J Clin Oncol, 2018. 8 McBane, RD, 2nd, et al., J Thromb Haemost, 2020. 9 Agnelli, G., et al., N Engl J Med, 2020. 10Planquette, B., et al., Chest, 2022. 11 Planquette, B., et al., Chest, 2022. 12 Essai clinique NCT05171049. 13 Essai clinique NCT05171075
 Commentaire
Commentaire
Bravo pour cette revue exhaustive sur une thématique majeure THROMBOSE et CANCER
La MTEV et la thrombose artérielle compliquent le cancer
D'un autre côté la LTEV et la thrombose artérielle peuvent faire découvrir le cancer en cas d'épiosde sans facteur déclenchant.
 Commentaire
CommentaireBravo pour cette revue exhaustive sur une thématique majeure THROMBOSE et CANCER
La MTEV et la thrombose artérielle compliquent le cancer
D'un autre côté la LTEV et la thrombose artérielle peuvent faire découvrir le cancer en cas d'épiosde sans facteur déclenchant.
La MTEV fait découvrir le cancer dabs 5% des cas , donc attention aux bilans étiologiques en tout genre , attention aux excés qui se révéleront initile dans 95% des cas
Etudes en cours
https://www.sciencedirect.com/science/article/abs/pii/S004938482030390X
Etudes en cours
https://www.sciencedirect.com/science/article/abs/pii/S004938482030390X
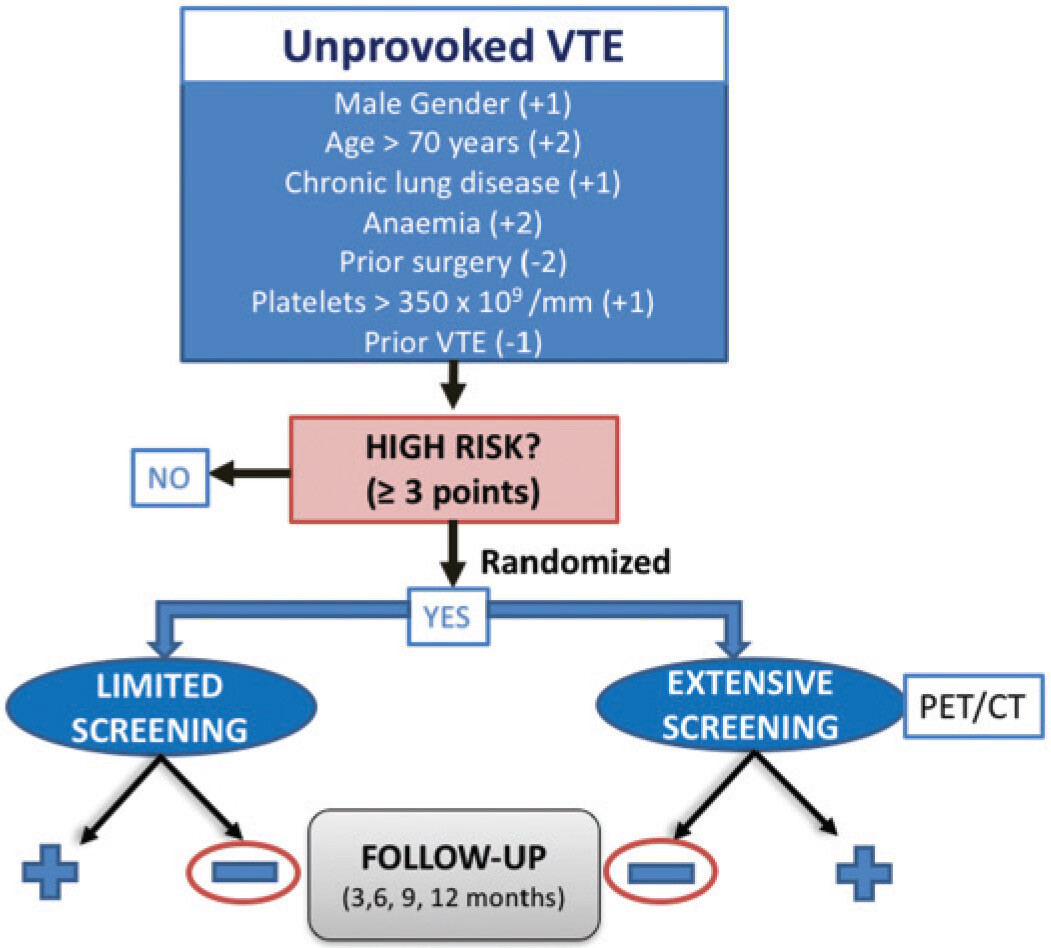
. Conception de l'essai SOME RIETE. PET/CT, tomographie par émission de positrons/ tomodensitométrie ; TEV , thromboembolie veineuse.
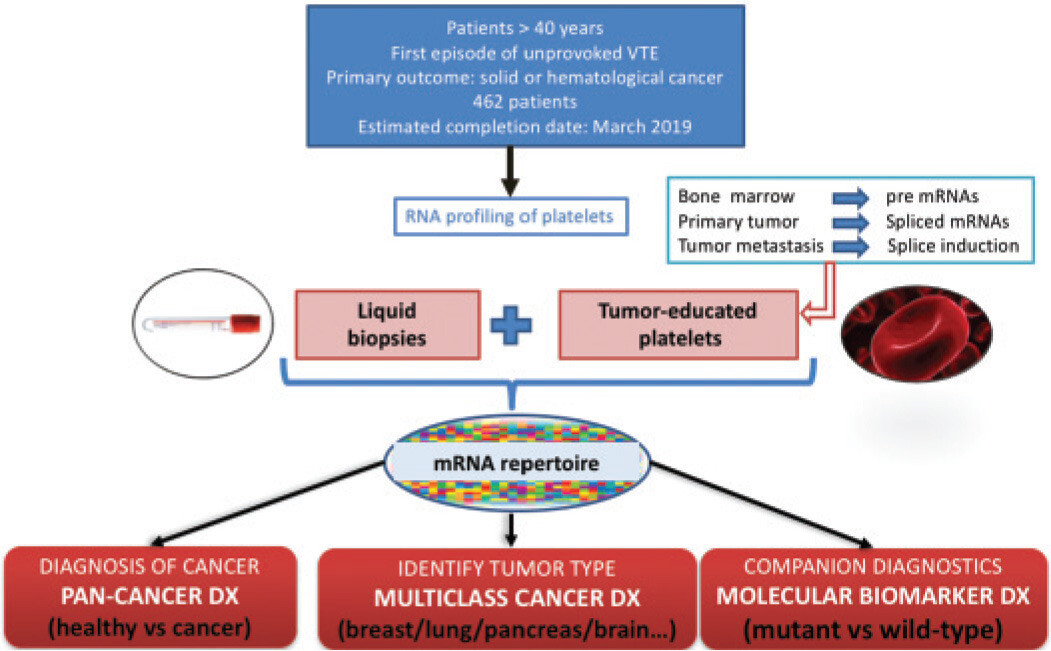
Conception de l'essai sur les plaquettes éduquées par tumeur dans la thromboembolie veineuse . DX, diagnostic ; TEV, thromboembolie veineuse.

Conception de l'essai sur les plaquettes éduquées par tumeur dans la thromboembolie veineuse . DX, diagnostic ; TEV, thromboembolie veineuse.

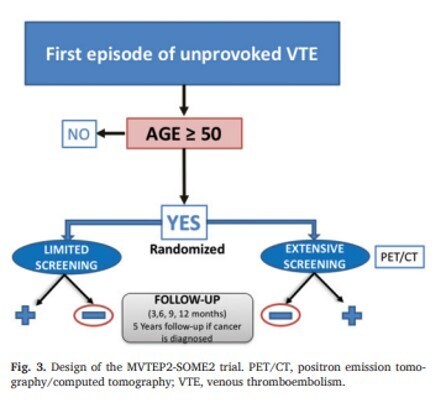
Conception de l'essai MVTEP2-SOME2. PET/CT, tomographie par émission de positrons/tomodensitométrie ; TEV, thromboembolie veineuse.
Les patients atteints de MTEV non provoquée présentent un plus grand risque de détection de cancer occulte par rapport à la population générale, et les médecins devraient avoir un indice de suspicion de cancer dans cette population de patients. Le dépistage prolongé n'est actuellement pas recommandé chez les patients atteints de TEV non provoquée.
Conformément aux directives internationales, nous devons nous assurer que les recommandations de dépistage sont appliquées en fonction de l'âge et du sexe des patients. Les résultats des études en cours pourraient identifier une population à plus haut risque de présenter un cancer au cours du suivi, et ce groupe de patients pourrait bénéficier d'un dépistage prolongé.

Les patients atteints de MTEV non provoquée présentent un plus grand risque de détection de cancer occulte par rapport à la population générale, et les médecins devraient avoir un indice de suspicion de cancer dans cette population de patients. Le dépistage prolongé n'est actuellement pas recommandé chez les patients atteints de TEV non provoquée.
Conformément aux directives internationales, nous devons nous assurer que les recommandations de dépistage sont appliquées en fonction de l'âge et du sexe des patients. Les résultats des études en cours pourraient identifier une population à plus haut risque de présenter un cancer au cours du suivi, et ce groupe de patients pourrait bénéficier d'un dépistage prolongé.

Ce qu'il faut retenir
Recherche CANCER en cas de MTEV
Recherche CANCER en cas de MTEV
* Pas de facteur déclenchant
* MTEV proximale unilatérale, ou ,bilatérale ou distale bilatérale
* Screening clinique +++, si + , scanner TAP (récidive MTEV)....excepetionnellementy PETSCAN
* Femmes : examens gynécologiques
* Hommes : PSA
* Biologie de base sans marqueurs
* Radiographie pulmonaire chez les fumeurs (scanner basse énergie ?)
* MTEV proximale unilatérale, ou ,bilatérale ou distale bilatérale
* Screening clinique +++, si + , scanner TAP (récidive MTEV)....excepetionnellementy PETSCAN
* Femmes : examens gynécologiques
* Hommes : PSA
* Biologie de base sans marqueurs
* Radiographie pulmonaire chez les fumeurs (scanner basse énergie ?)
* Découverte cancer dans l'année
* Réalisation des tests de dépistage du cancer conseillés et non pratiqués
* Réalisation des tests de dépistage du cancer conseillés et non pratiqués
* En cas cancer "guéri" ne jamais oublier le second cancer (poumon 18%, Colla 12%, prostate 9% et Vésisie 8%
(DoninN et all, CIRCULATION 2016, dpi:10.1002/cncr.30164.)
* Demain la BIOPSIE LIQUIDE.....
(DoninN et all, CIRCULATION 2016, dpi:10.1002/cncr.30164.)
* Demain la BIOPSIE LIQUIDE.....
* MTEV sans facteur déclenchant = 5 à 7% de cancer diagnostiqués en fonctiuon sexe, âge

La MTEV se complique le cancer connu
* Incidence MTEV : 1 patient sur 200 patients avec cancer
* Risque X 7 de MTEV et X 3 d’ EP fatale
* 10 % de patients avec cancer décèdent d’ ETE
* 20,7% de récidive sous traitement anticoagulant dans les 12 mois suivant le 1er ETE
* Risque X 7 de MTEV et X 3 d’ EP fatale
* 10 % de patients avec cancer décèdent d’ ETE
* 20,7% de récidive sous traitement anticoagulant dans les 12 mois suivant le 1er ETE
* MTEV : marqueur et facteur de mauvais pronostic chez le patient cancéreux
* MTEV au décours du cancer risque de récidive et risque hémorragique augmentés
* Moiun sde 40% des patients avec cancer ont une fonction rébale normale (attention anticoagulation)
* Intercatiions anticoagulants avec les thérapeutiques du cancer ( https://www.drugs.com/)
* Prise de 5 à 9 médocaments par patient + compléments et alicaments
* La différence de mortalité est très différente : haut risque de mortalité par EP en cas d'EP et haut risque de mortalité par hémorragie en cas de TVP
* MTEV au décours du cancer risque de récidive et risque hémorragique augmentés
* Moiun sde 40% des patients avec cancer ont une fonction rébale normale (attention anticoagulation)
* Intercatiions anticoagulants avec les thérapeutiques du cancer ( https://www.drugs.com/)
* Prise de 5 à 9 médocaments par patient + compléments et alicaments
* La différence de mortalité est très différente : haut risque de mortalité par EP en cas d'EP et haut risque de mortalité par hémorragie en cas de TVP
* Différents types de cancer = différents types de risque en cas de MTEV
* Importance des RCP ONCO THROMBOSE

Le point commun entre MTEV précède le cancer ou le cancer se complique de MTEV : le cancer une thrombophilie acquise, l'anticoagulation un traitement commun. Continuer de travailler sur l'un et l'autre en synergie, ne pourra qu'être efficcae à moyen terme.
L'avenir, un test prédictif pour la recherche d'un cancer en cas de MTEV devrait bénéficier de l'IA. Lanticoagulation apr un AntiX1a devrait être bénéfique pour l'anticoagulation au cours du cancer.
* Importance des RCP ONCO THROMBOSE

Le point commun entre MTEV précède le cancer ou le cancer se complique de MTEV : le cancer une thrombophilie acquise, l'anticoagulation un traitement commun. Continuer de travailler sur l'un et l'autre en synergie, ne pourra qu'être efficcae à moyen terme.
L'avenir, un test prédictif pour la recherche d'un cancer en cas de MTEV devrait bénéficier de l'IA. Lanticoagulation apr un AntiX1a devrait être bénéfique pour l'anticoagulation au cours du cancer.
« Le scandale n’est pas de dire la vérité, c’est de ne pas la dire tout entière, d’y introduire un mensonge par omission qui la laisse intacte au dehors, mais lui ronge, ainsi qu’un cancer, le coeur et les entrailles. » Georges Bernanos

