MTEV
-
Cancer/MTEV/HBPM/AOD
 Prespectives
Prespectives -
Cancer/MTEV/Qualité de Vie
 Etre présent !
Etre présent ! -
Cancer/Radiothérapie/ MTEV
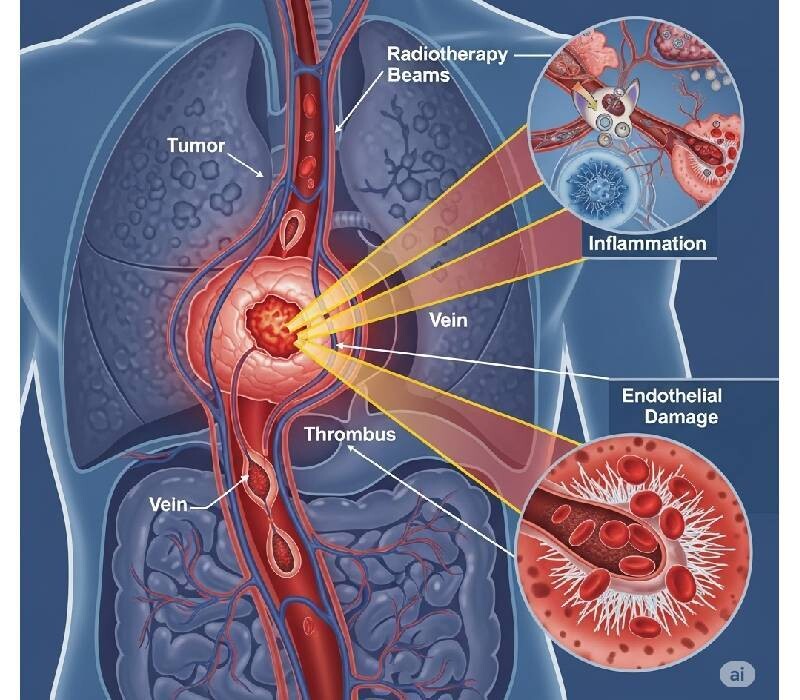 Atteinte rare mais qui existe
Atteinte rare mais qui existe -
CAT et les AOD

CAT : cancer associated thrombosis
-
COMMAND VTE Registry
 Command VTE Registre le "Riete Japonais"
Command VTE Registre le "Riete Japonais" -
Compass/Voyager, réduction MTEV ?
 icongraphie : SUBLIMINAL
icongraphie : SUBLIMINAL
“Chaque crime est un noyau atomique et les éléments récurrents ses électrons, oscillant autour de lui et dessinant une vérité subliminale.”Jean-Christophe Grangé“Le militant qui ne lit que "sa presse" m'exaspère.” Michel Polac
" Les stastitiques avouent toujours sous la torture" Alfred SauvyRivaroxaban 2.5 mg Twice Daily Plus Aspirin Reduces Venous Thromboembolism in Patients With Chronic Atherosclerosis Pogosova, Nana MD; Bosch, Jacqueline PhD; Bhatt, Deepak L. MD; Fox, Keith A.A. MBChB; Connolly, Stuart J. MD; Alings, Marco MD; Verhamme, Peter MD; Muehlhofer, Eva MD; Shestakovska, Olga MSc; Yusuf, Salim MBBS; Eikelboom, John W. MBBS Circulation. 1876 2022;145:1875–1877.Le rivaroxaban 2,5 mg deux fois par jour plus l'aspirine réduit la thromboembolie veineuse chez les patients atteints d'athérosclérose chronique
L'essai COMPASS (Cardiovascular Outcomes for People using Anticoagulation Strategies) a démontré que, chez les patients atteints de maladie coronarienne chronique et de maladie artérielle périphérique (MAP), l'association de rivaroxaban 2,5 mg deux fois par jour et d'aspirine 100 mg une fois par jour par rapport à l'aspirine 100 mg une fois une réduction quotidienne des décès cardiovasculaires, des accidents vasculaires cérébraux ou des infarctus du myocarde de 24 % et de la mortalité de 18 %, et une augmentation des saignements de 70 %. le Rivaroxaban 5 mg deux fois par jour n'était pas supérieur à l'aspirine.
Nous rapportons ici les effets sur la maladie thromboembolique veineuse (MTEV).
Le protocole d'étude a été approuvé par tous les comités d'examen institutionnels concernés, et tous les patients ont fourni un consentement éclairé écrit. Les données à l'appui des conclusions de cette étude sont disponibles auprès de l'auteur correspondant sur demande raisonnable.
Nous avons comparé les caractéristiques de base parmi ceux qui ont subi une TEV et ceux qui n'en ont pas eu en utilisant un test [chi] pour les variables catégorielles et un test de Wilcoxon à 2 échantillons pour les variables continues. Pour comparer les résultats dans les groupes rivaroxaban plus aspirine et rivaroxaban seul par rapport aux groupes aspirine seule, nous avons utilisé une régression stratifiée des risques proportionnels de Cox pour estimer les risques relatifs et les IC à 95 %, ainsi qu'un test de log-rank stratifié pour tester la signification statistique de toute différence.
Sur les 27 395 patients assignés au hasard, 102 ont subi une TEV. Comparativement aux patients qui n'ont pas subi de TEV, ceux qui ont subi une TEV au cours de l'essai étaient significativement plus âgés (71,2 contre 68,2 ans, P = 0,004), avaient un indice de masse corporelle plus élevé (29,9 contre 28,3 kg/m 2 , P = 0,01), avaient une pression artérielle basse (133/75 contre 136/78, P pour la pression artérielle diastolique = 0,01), étaient plus susceptibles d'être un fumeur actuel ou ancien (78,4 % contre 68,0 %, P = 0,02) et étaient plus susceptibles d'être prendre un diurétique (39,2% versus 29,7%, P=0,04).
L'association de rivaroxaban 2,5 mg deux fois par jour et d'aspirine 100 mg une fois par jour par rapport à l'aspirine 100 mg une fois par jour a réduit le risque de MTEV de 39 % (25 [0,3 %] versus 41 [0,4 %] ; risque relatif, 0,61 [IC à 95 % , 0,37-1,00] ; P = 0,05), avec des estimations similaires de l'effet du traitement pour la thrombose veineuse profonde et l'embolie pulmonaire, ainsi que sur les décès dans les 30 jours suivant la TEV . Les effets étaient constants dans tous les sous-groupes (c.-à-d. aucune interaction significative) définis par l'âge (<=65 contre >65 ans), les antécédents de cancer (oui contre non), les lits vasculaires impliqués (1 contre >=2), le taux de filtration glomérulaire estimé ( <60 versus >=60 mL[point du milieu]min -1 [point du milieu]1,73 m -2), une insuffisance cardiaque (oui versus non) ou un diabète (oui versus non). Le rivaroxaban 5 mg deux fois par jour n'a pas réduit la TEV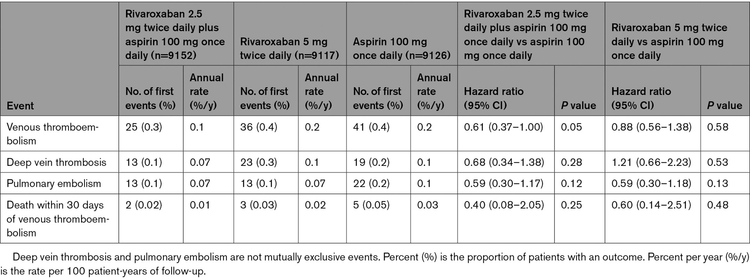
Aucun essai n'a été conçu spécifiquement pour évaluer le rivaroxaban 2,5 mg deux fois par jour pour la prévention de la MTEV. Cependant, l'étude VOYAGER PAD (Vascular Outcomes Study of ASA [acetylsalicylic acid] Along with Rivaroxaban in Endovascular or Surgical Limb Revascularization for PAD) portant sur 6564 patients ayant récemment subi une revascularisation pour PAD a démontré que le rivaroxaban 2,5 mg deux fois par jour par rapport au placebo sur un traitement antiplaquettaire a réduit la MTEV de 39 % (25 [0,8 %] contre 41 [1,3 %] ; risque relatif, 0,61 [IC à 95 %, 0,37-1,00]).
Pris ensemble, les résultats de COMPASS et de VOYAGER PAD indiquent que l'association de rivaroxaban 2,5 mg deux fois par jour et d'aspirine réduit la MTEV chez les patients atteints de maladie coronarienne et de MAP.
Les taux d'événements de MTEV chez les patients atteints de maladie coronarienne chronique et d'AOMI inscrits à l'essai COMPASS étaient [presque égaux à] 5 fois inférieurs aux taux d'événements vasculaires artériels.
Dans COMPASS, nous avons recruté 32,5 % des patients (8912/27 395) de 10 pays à revenu intermédiaire ; cela peut expliquer en partie les faibles taux d'événements, car la TEV semble être moins fréquente dans les pays à revenu faible et intermédiaire que dans les pays à revenu élevé. 4Il est également probable que l'utilisation généralisée du traitement antithrombotique (tous les patients ont reçu de l'aspirine, du rivaroxaban ou leur association) dans l'essai COMPASS a contribué au faible taux d'événements.
Dans l'essai VOYAGER PAD, les taux d'événements de Kaplan-Meier à 3 ans pour la TEV étaient de 0,8 % chez les patients assignés au hasard à l'association de rivaroxaban et d'aspirine, contre 1,7 % chez ceux assignés au hasard au traitement antiplaquettaire seul, 3 ce qui est considérablement plus élevé que les taux d'événements de Kaplan-Meier à 3 ans observés dans COMPASS (combinaison 0,56 %, aspirine 0,69 %). Cependant, VOYAGER PAD a inclus des patients dans les 10 jours suivant la revascularisation périphérique qui présentent un risque plus élevé de MTEV que les patients inscrits dans COMPASS, dont la plupart étaient ambulatoires au moment de l'inscription.
Des études antérieures ont démontré que l'aspirine seule réduit le risque de MTEV de 20 % à 30 % chez les patients médicaux et chirurgicaux, et les données présentées ici indiquent que le rivaroxaban 2,5 mg deux fois par jour offre une réduction du risque relatif de 39 % lorsqu'il est ajouté à l'aspirine. Si les bénéfices de ces 2 thérapies sont additifs, on peut s'attendre à ce que l'association du rivaroxaban 2,5 mg deux fois par jour et de l'aspirine 100 mg une fois par jour réduise le risque deMTEV de 60 à 70 %.......ET SI ! ET SI ! ET SI !
Commentaire: BAYER à la commande de cet article (l'un des auteurs travaille chez Bayer).......ou comment nous faire pendre des vessies pour des lanternes !!!!!!......Je n'en dirai pa plus......mais ça m'exaspère ce genre d'article !!!!!! Et cela démontre une fois de plus que les statistiques avouent toujours sous la torture. L'industrie ne doit pas anticiper les résultats d'études en cours. Par conre faites en sorte que le rivaroxaban soit disponible en France. -
Contraception et Risque Cardio Vasculaire
 Contraception : attention !
Contraception : attention !
Contraception orale et MTEV
 Faire le bon choix de la contraception
Faire le bon choix de la contraceptionCovid-19 : complications thrombotiques artérielles et veineuses
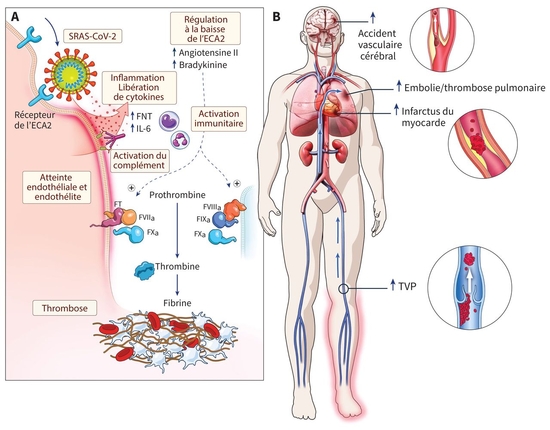 iconographie : Thrombose"Au milieu de chaque crise, se trouve une grande opportunité" -Albert Einstein
iconographie : Thrombose"Au milieu de chaque crise, se trouve une grande opportunité" -Albert Einstein
Covid-19: «Jamais je n'aurais cru que la crise durerait aussi longtemps», confiait Jean-François Delfraissy
Association of COVID-19 With Major Arterial and Venous Thrombotic Diseases: A Population-Wide Cohort Study of 48 Million Adults in England and Wales,
Association de COVID-19 avec les maladies thrombotiques artérielles et veineuses majeures : une étude de cohorte à l'échelle de la population de 48 millions d'adultes en Angleterre et au Pays de Galles, Knight, Rochelle et Coll, Circulation Numéro : Volume 146(12), 20 September 2022, p 892-906Article libre d'accésContexte
L'infection par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) induit un état prothrombotique, mais les effets à long terme du COVID-19 sur l'incidence des maladies vasculaires ne sont pas clairs.Méthodes
Nous avons étudié les maladies vasculaires après le diagnostic de COVID-19 dans des dossiers de santé électroniques anonymisés en anglais et en gallois liés à l'échelle de la population du 1er janvier au 7 décembre 2020. Nous avons estimé les rapports de risque ajustés comparant l'incidence des thromboses artérielles et des événements thromboemboliques veineux (MTEV) après le diagnostic de COVID-19 avec l'incidence chez les personnes sans diagnostic de COVID-19. Nous avons effectué des analyses de sous-groupes selon la gravité de la COVID-19, les caractéristiques démographiques et les antécédents.Résultats
Parmi 48 millions d'adultes, 125 985 ont été hospitalisés et 1 319 789 n'ont pas été hospitalisés dans les 28 jours suivant le diagnostic de COVID-19.
En Angleterre, il y a eu 260 279 premières thromboses artérielles et 59 421 premières MTEV pendant 41,6 millions de personnes-années de suivi.
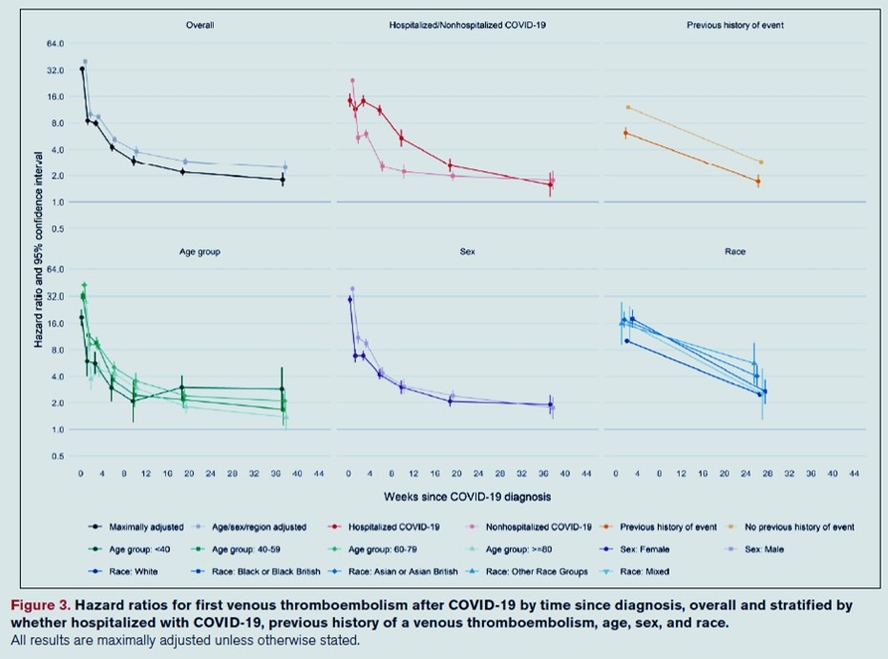
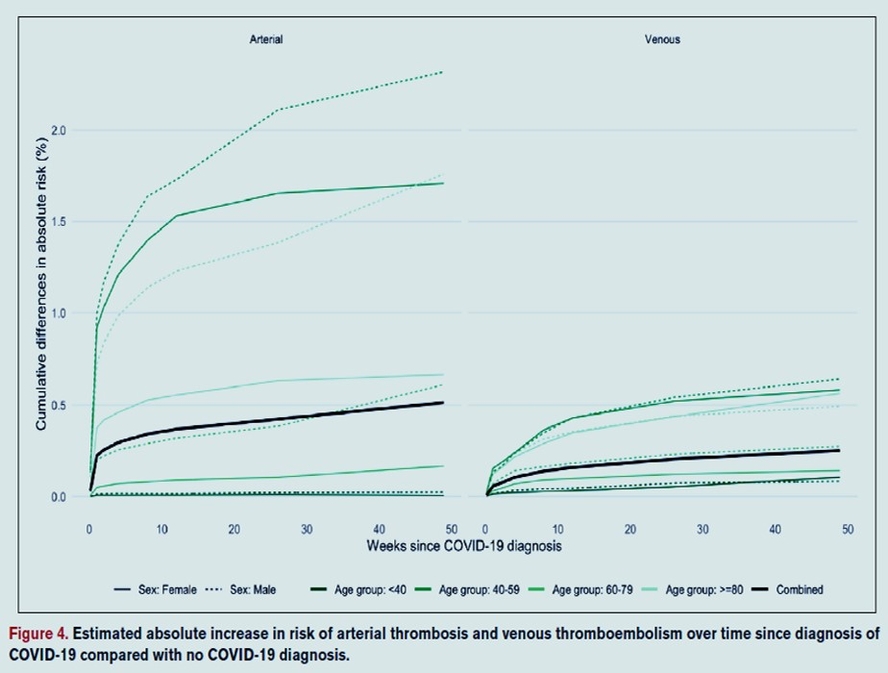
Les rapports de risque ajustés pour la première thrombose artérielle après le diagnostic de COVID-19 par rapport à l'absence de diagnostic de COVID-19 ont diminué de 21,7 (IC à 95 %, 21,0-22,4) la semaine 1 après le diagnostic de COVID-19 à 1,34 (IC à 95 %, 1,21-1,48) au cours des semaines 27 à 49. Les rapports de risque ajustés pour le premier MTEV après le diagnostic de COVID-19 ont diminué de 33,2 (IC à 95 %, 31,3-35,2) à la semaine 1 à 1,80 (IC à 95 %, 1,50-2,17) au cours des semaines 27 à 49. Ajusté les rapports de risque étaient plus élevés, plus longtemps après le diagnostic, après un COVID-19 hospitalisé par rapport à un COVID-19 non hospitalisé, chez les Noirs ou les Asiatiques par rapport aux Blancs, et parmi les personnes sans versus avec un événement précédent. Les augmentations estimées pour l'ensemble de la population du risque de thromboses artérielles et de MTEV 49 semaines après le diagnostic de COVID-19 étaient de 0,5 % et 0,25 %, respectivement, correspondant à 7200 et 3500 événements supplémentaires, respectivement, après 1,4 million de diagnostics de COVID-19.
Conclusions
L'incidence relative élevée d'événements vasculaires peu après le diagnostic de COVID-19 diminue plus rapidement pour les thromboses artérielles que pour les MTEV. Cependant, l'incidence reste élevée jusqu'à 49 semaines après le diagnostic de COVID-19. Ces résultats soutiennent les politiques de prévention de la COVID-19 grave au moyen de vaccins contre la COVID-19, d'un examen précoce après la sortie, du contrôle des facteurs de risque et de l'utilisation d'agents préventifs secondaires chez les patients à haut risque.
Ce qui est nouveau ?
- Dans une étude de cohorte de 48 millions d'adultes en Angleterre et au Pays de Galles, le COVID-19 a été associé à une incidence excessive substantielle de thromboses artérielles et de thromboembolie veineuse, qui a diminué avec le temps à partir du diagnostic de COVID-19.
- L'incidence excessive était plus élevée, pendant une plus longue période, après COVID-19 hospitalisé que non hospitalisé.
- Il y a eu environ 10 500 thromboses artérielles et événements thromboemboliques veineux en excès après 1,4 million de diagnostics de COVID-19.
Quelles sont les implications cliniques ?
- Les stratégies de prévention des événements vasculaires après le COVID-19 sont particulièrement importantes après un COVID-19 sévère entraînant une hospitalisation et doivent inclure un examen précoce des soins primaires et de la gestion des facteurs de risque.
- Après un COVID-19 sévère, les personnes à haut risque d'événements vasculaires doivent se voir prescrire des thérapies préventives et être conseillées sur l'importance de les respecter.
- De nouvelles stratégies de traitement simples pour réduire la thromboembolie veineuse associée à l'infection et les thromboses artérielles sont nécessaires.
L'infection par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2), qui cause le COVID-19, induit un état prothrombotique et pro-inflammatoire qui peut augmenter le risque de troubles thrombotiques graves.
La plupart des études antérieures suggèrent des augmentations marquées immédiates des événements thromboemboliques artériels (en grande partie infarctus du myocarde [IM] et AVC) et veineux (MTEV), bien que les chiffres puissent être exagérés en raison du dépistage universel du COVID-19 dans toutes les admissions à l'hôpital (y compris pour la thrombose), de la surveillance de la thrombose veineuse dans les cohortes COVID-19 ou de la sous-utilisation de la thromboprophylaxie.
Cependant, peu d'études ont quantifié les risques vasculaires à long terme après le diagnostic de COVID-19 ou ont exploré comment ces risques diffèrent selon des caractéristiques clés telles que l'âge, le sexe, la race ou des comorbidités préexistantes.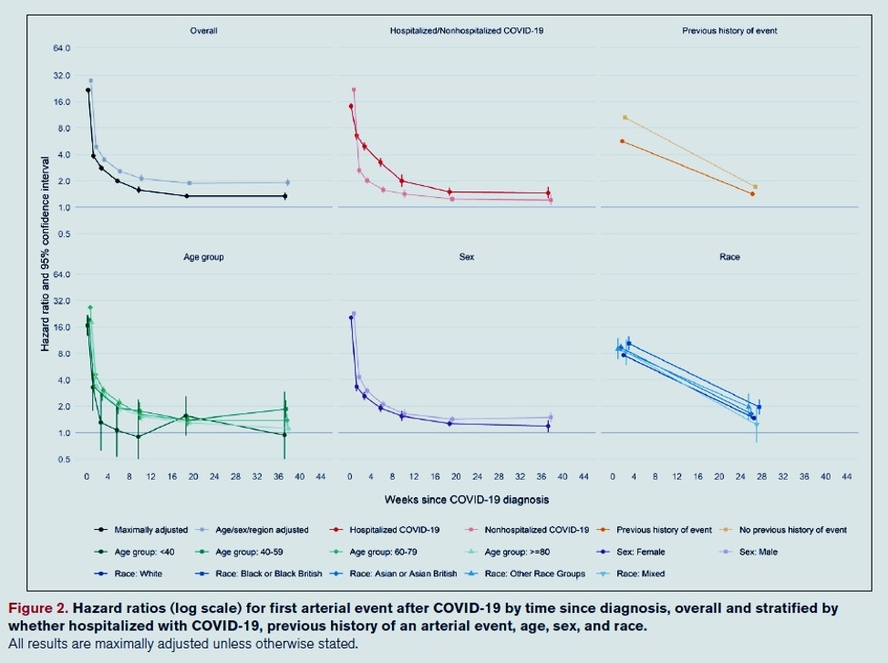
Commentaire
Les complications thrombotiques artérielles et veineuses post Covid-19 ont été fréquentes et multiples et le sont encore mais à degré moindre. Il faut noter ce qui est important pour la pratique, l'incidence reste élevée jusqu'à 49 semaines après le diagnostic de COVID-19, soit 1 an. C'est à partir de " mois que nle risque thrombotique décline. Mail il n'est pas rare d'être confronté avec des patients qui présentent une MTEV sans facteur déclenchant et qui font état d'une infection Covid-19 il y a 3 mois, 6 mois, 9 mois. Au delà de 3 mois peux t'-on mettre en relation la MTEV avec la Covid-19 ? Cette étude a plusieurs limites citées par les auteurs, néanmoins elle apporte des messages importants.
Récemment en RCP THROMBOSE nous avons examiné différents cas de MTEV (TPV/EP) survenues à distance la Covid-19, à chaque fois des cas Covid étiquetés graves mais non sévères. La question était la suivante : ces patients ne présentaient aucun facteur déclenchant autre que la Covid-19 avec des délais de 1 mois à 6 mois. Doit on considérer ces MTEV liées uniquement à la Covid-19 ? Quels marqueurs pourraient permettre de les relier ? Existe - t-il une stratification de la gravité de la Covid-19 qui pourrait expliquer des complications thrombotiques au delà de 3 mois ?
Bien entendu la vaccination limite considérablement le risque de Covid-19 et notamment de Covid-19 grave de plus nombre de traitements sont maintenant efficaces comme le Paxlovid et d'autres.
La prévention de la MTEV n'est toujours pas complétement réglée mais on y parvient progressivement.Cet article : Helms, J., Middeldorp, S. & Spyropoulos, A.C. Thromboprophylaxis in critical care. Intensive Care Med (2022). https://doi.org/10.1007/s00134-022-06850-7 nous donne des recommandations claires en réanimation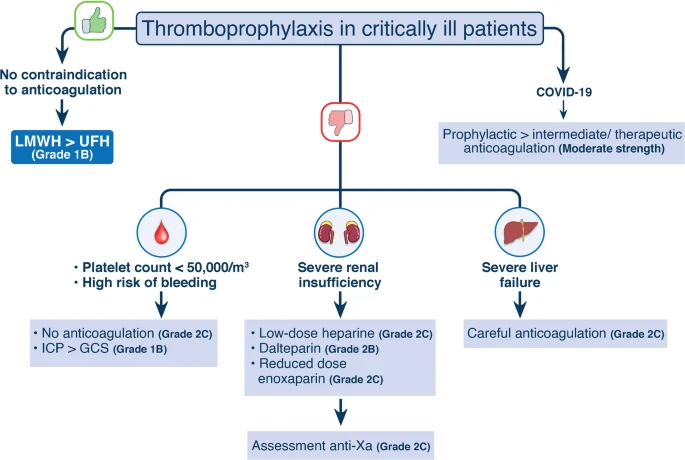

Dans l'attente de Covi-Dose, l'Arlésienne finra-t-elle par se dévoiler , le plus tôt possible, on l'espère. C'est au Congrès de la SFMV de Cannes , il ya 1 an , que l'on nous a promis que la publication était iminente. L'est-elle encore à l'approche du Congrès de la SFMV à Toulouse?
Une 8° vague arrive, saurons nous la juguler rapidement et avec efficacité ? On l'espère car nous avons appris des 7 vagues précédentes.....exact ????D Dimères : come back !
 MTEV D Dimères Récidive
MTEV D Dimères RécidiveD Dimères à la rescousse
 D Dimères et risque de récidive MTEV !
D Dimères et risque de récidive MTEV !D DIMERES et âge
 D-DIMERES : actu 2026
D-DIMERES : actu 2026De la durée de l'anticoagulation en cas de MTEV

Une décision partagée
De quoi meurent les patients atteints d'un cancer ?
 La doulreuse question, fin de vie et cancer
La doulreuse question, fin de vie et cancerDébat AOD et VTE/CANCER
 Un débat justifié
Un débat justifiéDu code au thrombus
 MTEV et Machine Learning
MTEV et Machine LearningEndométriose et MTEV
 Un facteur de risque.....de plus !
Un facteur de risque.....de plus !Entretien : les TVP distales

Nouvelle rubrique :" les entretiens de #MedVascInfo", avec......
"La connaissance, c'est partager le savoir qui nous fait grandir." Olivier Lockert
"Savoir, c’est pouvoir ! C’est l’action qui détermine si la connaissance est certaine." Swâmi Prâjnanpad
"Le savoir que l’on ne complète pas chaque jour diminue tous les jours." Proverbe ChinoisIl s'agira d'entretiens sur des questions sur la THROMBOSE (Veineuse et Artérielle), sur la PANDEMIE, avec des experts, dont l'expertise est unanimement reconnue.Le but est d'avoir leur vision sur des sujets qui font débat, voire qui sont à l'origine de controverses.Ces entretiens s'inscrivent dans le "PARTAGE du SAVOIR" , si important et si utile, avec le respect de la SCIENCE. Il s'agira d'interviews écrites, tout en laissant à l'expert la liberté totale de ses propos. L'interview classique orale sera pour un peu plus tard quand les problèmes techniques seront résolus
C'est le Dr Jean Philippe Galanaud , Médecin Vasculaire, qui inaugure cette nouvelle rubrique.
Entretien Thrombose veineuse distale avec le Dr. Jean Philippe Galanaud, Département de Médecine Sunnybrook Health Sciences Centre, Université de Toronto, Toronto, Canada
Rappelons que le Dr Jean Philippe Galanaud a beaucoup travaillé et publié sur les TV Distales, il est donc le mieux placé pour répondre aux questions de #MedVascInfo . Crette thématique a été à l'origine de controverses, mais aujourd'hui cette question est consensuelle.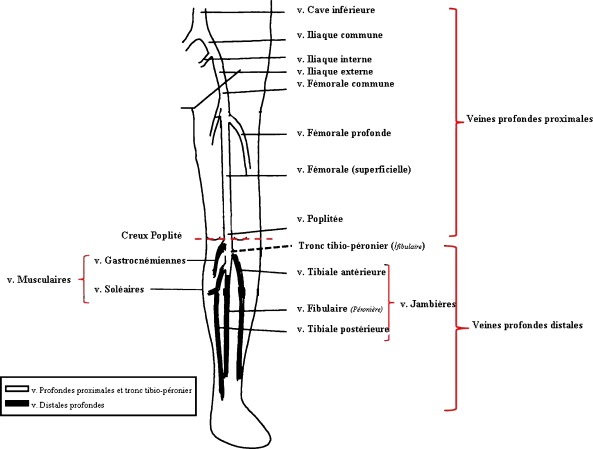
Question 1
Jean Philippe peux-tu nous définir sur le plan anatomique les thromboses veineuses distales des membres inférieurs, de plus pourcentage entre TVP distale vs proximale
D'un point de vue strictement anatomique, les veines distales englobent les veines jambières (tibiale postérieure, péronière, tibiale antérieure (Les thrombose tibiales antérieures sont exceptionnelles) et musculaires (soléaires et gastrocnémiennes) ainsi que le tronc tibio péronier. D'un point de vue pratique, les TVP du tronc tibio péronier sont généralement considérées comme des TVP poplitées. Un peu plus de 50% des TVP isolées (sans embolie pulmonaire) des membres inférieurs sont des TVP distales
Question 2
Existe t il une différence quant à l histoire naturelle des TV musculaires et des TV jambières (hors cancer) , sexe, facteur déclenchant ou non, survenue d'une embolie pulmonaire
Voilà une question à laquelle il est difficile de répondre. Des études cliniques, ont retrouvé un taux d’extension proximal très faible à trois mois (inférieur à 3 %) des TVP musculaires (vs. un taux généralement admis de 10% en cas de tvp distale tout venant), suggérant que le potentiel thrombo-embolique de celles-ci était inférieur à celui des thromboses jambières. Un essai thérapeutique publié par Schwartz en 2010 ne retrouvait pas de bénéfice à un traitement anticoagulant par HBPM pendant 10 jours, par rapport à une compression élastique seule en cas de TVP musculaire. Dans l’étude Cactus, en revanche, il n’y avait pas de différence significative entre le taux d’extension des thromboses jambières et musculaires, même si les thromboses jambières semblaient s’étendre un peu plus. Dans l’étude Optimev, le risque de récidive thrombo-embolique à l’arrêt du traitement ac était similaire entre thromboses jambières et musculaires. En pratique, dans les recommandations Inter sociétés, il n’est pas fait de distinction entre thromboses jambières et musculaires en terme de nécessité de traiter et de durée de traitement. Question 3
Question 3
Le traitement anticoagulant des TVP distales symptomatiques (en dehors du cancer) est il différent selon leur localisation anatomique : molécule, dose, duréeComme mentionné précédemment, il n’est pas fait de distinguo entre les thromboses jambières et musculaire en terme de traitement dans les recommandations Inter sociétés. En revanche, le nombre de segments veineux thrombosés semble influencer le risque de récidive, et, en cas de thrombose multiples, il est suggéré de traiter trois mois plutôt que six semaines par anticoagulants. Les thromboses du tronc tibio-péronier, devraient quant à elle être traitées comme des thromboses poplités en raison de leur risque de récidive similaire à celui des thromboses poplités.Concernant le choix de la molécule, les anticoagulants oraux direct, à dose curative, même s’ils n’ont pas fait encore l’objet d’une évaluation par le biais d’un essai thérapeutique dédié, constituent le traitement de première intention.Question 4
Le traitement anticoagulant des TVP distales symptomatiques au décours d'un cancer actif est il différent selon leur localisation anatomique : molécule, dose, durée
L’étude Optimev a mis en évidence qu'en l absence de cancer le risque de récidive des thromboses distales était deux fois moindre qu’en cas de thrombose proximale et la majorité des récidives etaient de thromboses distales. En revanche, lorsque la thrombose distale survient au décours d’un cancer, le pronostic, en terme de récidive, de type de récidive et de mortalité est comparable à celui des TVP proximales chez les patients cancéreux. Aussi, en cas de thrombose distale chez un patient cancéreux, lorsque la thrombose survient en dehors de tout facteur transitoire surajouté, un traitement anticoagulant prolongé peut/doit être proposé si le risque hémorragique le permet et si c’est en accord avec le choix du patient. Le choix de la molécule est identique à celui que l’on prescrirait chez le même patient présentant une thrombose proximale. En cas de risque hémorragique, l’intensité du traitement anticoagulant peut et doit être adaptée de façon plus souple qu’en cas de TVP proximale.Question 5
Quelle est la prise en charge des TVP distales asymptomatiques ?
Dans la pratique clinique, en cas de découverte d’une thrombose distale asymptomatique, en l’absence de risque hémorragique, les patients sont généralement traités de la même manière que pour une thrombose symptomatique. L’élément modulateur principal du traitement des thromboses distales est le risque hémorragique. En cas de risque hémorragique élevé, une surveillance par écho-Doppler à une semaine plus ou mois 2 semaines doit être proposée. Un traitement à dose prophylactique, peut aussi être proposé, si le risque hémorragique le permet. Enfin, il ne faut pas déployer de filtre cave en cas de thrombose veineuse profonde distale et proposer une surveillance écho-Doppler
Merci Jean Philippe pour avoir accepté de participé à ce premier entretien sur #MedVascinfo avec des réponses claires et précises.Bibliographie
Galanaud JP, Quenet S, Rivron-Guillot K, Quere I, Sanchez Muñoz-Torrero JF, Tolosa C, Monreal M; RIETE INVESTIGATORS.
Comparison of the clinical history of symptomatic isolated distal deep-vein thrombosis vs. proximal deep vein thrombosis in 11 086 patients J Thromb Haemost . 2009 Dec;7(12):2028-34.
JP Galanaud ,MA Sevestre, C Genty, JP Laroche, V Zizka, I Quéré, JL Bosson, OPTIMEV SFMV investigators, Comparison of the clinical history of symptomatic isolated muscular calf vein thrombosis versus deep calf vein thrombosis, J Vasc Surg 2010;52:932-8.
JP Galanaud, JL Bosson, I Quéré, Risk factors and early outcomes of patients with symptomatic distal vs. proximal deep-vein thrombosis,Curr Opin Pulm Med, 2011 Sep;17(5):387-91.
J-P Galanaud, S R Kahn, A Khau Van Kien, J-P Laroche, I Quéré, Epidemiology and management of isolated distal deep venous thrombosis, Rev Med Interne,2012 Dec;33(12):678-85.
Righini M, Galanaud JP, Guenneguez H, Brisot D, Diard A, Faisse P, Barrellier MT, Hamel-Desnos C, Jurus C, Pichot O, Martin M, Mazzolai L, Choquenet C, Accassat S, Robert-Ebadi H, Carrier M, Le Gal G, Mermilllod B, Laroche JP, Bounameaux H, Perrier A, Kahn SR, Quere I, Anticoagulant therapy for symptomatic calf deep vein thrombosis (CACTUS): a randomised, double
blind, placebo-controlled trial, Lancet Haematol . 2016 Dec;3(12):e556-e562.
Robert-Ebadi H, Righini M.Should we diagnose and treat distal deep vein thrombosis?Hematology Am Soc Hematol Educ Program
2017 Dec 8;2017(1):231-236.
Kirkilesis G, Kakkos SK, Bicknell C, Salim S, Kakavia K Treatment of distal deep vein thrombosis, Cochrane Database Syst Rev2020 Apr 9;4(4):CD013422.
Quéré I, Glanaud JP, Sanchez O, Quelle est la prise en charge des thromboses veineuses profondes sous-poplitées ? Revue des Maladies Respiratoires 2021,38, e164-e170
Entretien avec Francis Couturaud : MTEV , durée du traitement
 “Quand les mouettes ont pied, il est temps de virer.” Proverbe Breton
“Quand les mouettes ont pied, il est temps de virer.” Proverbe Breton
“C'était la Bretagne et seule cette province leur semblait capable de rivaliser avec la beauté sauvage de leurs îles.” Hervé Jaouen
"L'essentiel est l'emploi de la vie, non sa durée." Sénèque
Thème : MTEV et durée du traitement anticoagulantLa durée du traitement après un épisode de MTEV (EP/TVP) est un problème quotidien en médecine vasculaire. Nous devons l'envisager en évaluant la balance bénéfice-risque, le risque de récidive et le risque hémorragique. Mais aussi on doit tenir compte des souhaits du patient. Il fallait donc avoir l'avis d'un expert sur cette question. Un grand merci à Francis Couturaud d'avoir accepté cet entretien afin de "baliser" cette décision.
Pr Francis Couturaud
Département de Médecine Interne et Pneumologie, Centre Hospitalo-Universitaire de Brest, Brest, France
EA 3878, INSERM CIC 1412, Université de Bretagne Occidentale, Brest, France
FCRIN INNOVTE, France
Question 1
La durée du traitement anticoagulant en cas de MTEV (TVP et ou EP), est toujours une question difficile. De plus les patients sont soit pressés de stopper ou au contraire de poursuivre l’anticoagulation. Quels sont les circonstances où le traitement peut être stoppé rapidement de 6 semaines à 3/ 6 mois.
Il s’agit des circonstances dans lesquelles le facteur déclenchant est majeur et transitoire : transitoire veut dire réversible, et majeur signifie que la « disparition » du facteur de risque dans le temps est associée à un risque de récidive si faible qu’il justifie un arrêt du traitement anticoagulant (maximum 6 mois). Ces facteurs sont : la chirurgie (avec anesthésie générale > 30 minutes), les traumatismes avec fracture ou plâtre, les alitements de plus de 3 jours pour affection médicale aiguë, le tout dans les 3 mois précédent la MTEV. En outre, en France, dans nos recommandations, nous avons aussi classé les facteurs hormonaux (pilule oestro-progestative, grossesse et post-partum, et traitement hormonal de la ménopause, dans les 3 mois précédent la MTEV) comme facteurs majeurs transitoires : en effet, si le risque d’un premier épisode de MTEV est modéré, en revanche, en termes de récidives, les conséquences sont MAJEURES. Les études sont abondantes sur le très faible risque de récidive dans ces contextes une fois l’exposition hormonale stoppée. Nos recommandations diffèrent ainsi du consensus européen (ESC/ERS).
Question 2
En cas de TVP proximale avec facteur déclenchant, en dehors des circonstances cliniques qui expliquent la TVP, dispose-t'on d’autres d’arguments pour prolonger la durée des anticoagulants : obstruction résiduelle, grosse jambe, D Dimères, thrombophilie, pathologie inflammatoire ?
Ces facteurs ne sont pas associés à un risque indépendant accru de récidive et ils ne sauraient supplanter l’information déterminante apportée par la présence d’un facteur majeur transitoire ; ils ne peuvent donc pas conduire à prolonger le traitement au-delà de 3 ou 6 mois dans le contexte d’une TVP proximale provoquée par un facteur majeur transitoire. Pour mémoire, la recherche d’une thrombophilie n’est pas indiquée dans le cadre d’une TVP provoquée.
Question 3En cas d’EP proximale avec facteur déclenchant, en dehors des circonstances cliniques qui expliquent l’EP, dispose-t-on d’autres d’arguments pour prolonger la durée des anticoagulants obstruction résiduelle, D Dimères, thrombophilie, pathologie inflammatoire, HTAP ou autres ?
Excepté l’hypertension pulmonaire thrombo-embolique chronique, qui justifie formellement un traitement anticoagulant par AVK pour une durée non limitée (en plus de la prise en charge médicale ou chirurgicale spécifique), les autres facteurs (obstruction résiduelle, D-dimères, pathologie inflammatoire) ne sont pas associés à un risque suffisamment élevé pour justifier de prolonger le traitement dans le cadre d’une EP provoquée par un facteur majeur transitoire. Pour mémoire, la recherche d’une thrombophilie n’est pas indiquée dans le cadre d’une EP provoquée.
Question 4
La tentation de l’extension de l’anticoagulation par un AOD en cas de MTEV « idiopathique » ou « plus ou moins idiopathique » est une réalité. Bientôt les « LOW DOSE » vont supplanter les « FULL DOSE ». Peux tu préciser à la fois les indications possibles et les contre-indications de cette « LOW attitude thérapeutique »
L’essai « RENOVE » (randomisation low- versus full-dose d’AOD), dont le recrutement est presque achevé (2500 patients inclus) adresse directement cette question majeure d’une LOW-DOSE chez des patients à haut risque de récidive. Dans l’attente de ces résultats, il faut bien se rappeler des critères d’inclusion dans les études EINSTEIN-CHOICE et AMPLIFY-extension : patients pour lesquels l’indication à prolonger le traitement au-delà de 6 mois est incertaine (en gros, 50/50 en faveur ou défaveur). Il ne s’agit donc pas de patients à très haut risque de récidive dans ces essais. En pratique, les patients éligibles à un traitement LOW-DOSE pour une durée non limitée sont ceux ayant un premier épisode de MTEV non provoquée par un facteur majeur transitoire, en l’absence de cancer, et sans critères de sévérité (EP à risque faible ou intermédiaire faible, TVP proximale jusqu’en fémorale) sont éligibles. Par contre, ne sont pas éligibles, car non inclus dans ces essais industriels, les patients avec EP à haut risque de décès, les MTEV non provoquées récidivantes ni les MTEV avec thrombophilie majeure (antithrombine, et encore moins les antiphospholipides où le recours aux AVK est à discuter notamment pour les triples positifs); de même, les patients avec EP à risque intermédiaire élevé ou thromboses ilio-caves sont sous représentés dans ces essais, dans ma pratique (hors essai thérapeutique), je ne leur propose pas la demi-dose.
Question 5
Quelles est la durée de l’anticoagulation en cas de CANCER et MTEV ?
Sur la base des recommandations françaises, on poursuit le traitement tant que le cancer est actif (non en rémission ou cancer évolutif) et/ou tant qu’un traitement anticancéreux est nécessaire.
Question 6
En cas d’EP asymptomatique découverte sur un scanner au décours d’un cancer doit-on traiter ? Quel est le risque ? En cas de TVP de site inhabituelle (splanchnique, VS, VC…) découverte sur un scanner au décours d’un cancer adopte-t-on les mêmes recommandations pour l’anticoagulation. Enfin quelle anticoagulation pour les mêmes découvertes de MTEV asymptomatique mais en dehors du cancer
Les EP fortuites (= EP non suspectées, qu’elles soient asymptomatiques ou non) dans le cancer sont traités de la même manière qu’une EP suspectée symptomatique dans le contexte du cancer ou hors cancer. Pour les thromboses veineuses profondes de localisation atypique, on traite selon les mêmes modalités qu’une thrombose de localisation « classique » (TVP membres inférieurs ou EP). Ceci dit, nous ne disposons d’aucune bonne étude sur le sujet. Dans ces situations, il est plus que jamais crucial de peser le risque thrombotique au regard du risque hémorragique (ex : thrombose ovarienne : il faut se concerter). Maître mot : décider à plusieurs !
Enfin une MTEV asymptomatique hors cancer est traitée de la même façon qu’une MTEV symptomatique hors cancer.
Question 7
La durée de l’anticoagulation en termes de bénéfice risque tient compte du risque hémorragique et du risque de récidive. Ces deux risques sont différents selon les localisations de la MTEV, selon l’existence d’un cancer ou non. Selon toi peux-tu résumer les caractéristiques des patients à risque hémorragique majeur et ceux à risque de récidives majeurs ?
Point crucial et difficile car certains facteurs sont à la fois des facteurs de récidive de MTEV et aussi des facteurs hémorragiques (ex : cancer, sujet âgé)
Les patients à risque majeur de récidivesont les patients avec MTEV non provoquée récidivante, les EP non provoquées à haut risque de décès (on craint surtout le risque de décès par récidive ici), les MTEV non provoquées avec thrombophilie majeure (antiphospholipides et déficit en antithrombine) et les MTEV dans le contexte d’un cancer actif ou sous traitement anticancéreux.
Les patients à très haut risque hémorragique sont les patients avec anémie (facteur majeur), les insuffisants rénaux, le cancer, les antécédents d’hémorragie sous traitement anticoagulant, l’âge (>75 ans notamment). D’autres paramètres sont à risque hémorragique grave comme l’hypertension artérielle non contrôlée. Dans le cancer, qui est aussi une circonstance à très haut risque de récidive de MTEV, certaines localisations saignent plus, quel que soit le type d’anticoagulant d’ailleurs (HBPM ou AOD) : cancer digestif haut (oeso-gastrique) et urologique (vessie), métastases cérébrales. Enfin certaines associations médicamenteuses augmentent le risque hémorragique : les antiagrégants, certaines chimiothérapies (anti-angiogéniques, anti-tyrosine kinase notamment).
Merci Francis de tes réponses, toujours fondées sur les preuves. Merci aussi article après article, congrès après congrès d'accompagner la Médecine Vasculaire et de toujours répondre présent.Entretien avec Grégoire Le Gal : la MTEV veineuse fait découvrir le cancer

“Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire.” A Kirwan
“Si il n'y avait pas la Science, combien d'entre nous pourraient profiter de leur cancer pendant plus de cinq ans ?” Pierre Desproges
Thème : la MTEV veineuse fait découvrir le cancer
Dans la pratique, la recherche d'un cancer en cas de MTEV sans facteur déclenchant pose toujours de nombreux problèmes.
Doit-on,trop en faire ou pas assez ?Quel est le juste milieux ?
J'ai donc demandé à Grégoire Le Gal , "un de nos cousins canadiens" de nous éclairer sur ce sujet.
Merci d'avoir accepté Grégoire. Dr. Grégoire Le Gal MD PHD
Dr. Grégoire Le Gal MD PHD
ProfessorDepartment of Medicine, University of Ottawa
Physician, Thrombosis Unit, Division of Hematology
The Ottawa Hospital - General Campus
Senior Scientist, Clinical Epidemiology Program
Ottawa Hospital Research InstituteQUESTION 1
Grégoire pourrais-tu définir ce qu’est exactement une MTEV sans facteur déclenchant ?
Malheureusement non, pas ‘exactement’. Certaines situations sont faciles à identifier. Une fracture de hanche récente traitée chirurgicalement est un facteur déclenchant évident, mais quid d’une arthroscopie en ambulatoire par exemple ? Par ailleurs, certains facteurs déclenchants telle que la période post-opératoire sont transitoires et réversibles, mais d’autres peuvent être persistants, comme un cancer ou une maladie inflammatoire chronique de l’intestin (MICI).
L’ISTH propose de classer les évènements thrombotiques en trois catégories :
1) provoqués par un facteur déclenchant transitoire « majeur » (chirurgie avec anesthésie générale de plus de 30 minutes, hospitalisation avec alitement d’au moins trois jours, césarienne), « mineur bien qu’important »(chirurgie avec anesthésie de moins de 30 minutes, hospitalisation courte, estrogénothérapie, grossesse ou post-partum, alitement à domicile, traumatisme des membres inférieurs avec mobilité réduite) ;
2) provoqués par un facteur déclenchant persistant : cancer, MICI, anticorps antiphospholipides ; 3) les évènements non provoqués, sans facteur déclenchant.
Mais comme vous le voyez, tout n’est pas noir ou blanc, et si certaines thromboses sont clairement non provoquées (« le coup de tonnerre dans un ciel bleu »), un jugement au cas par cas est indispensable.QUESTION 2
Quel est le % de cancer retrouvé en cas de MTEV sans aucun facteur déclenchant ?
On a longtemps pensé que le risque était de 10% à un an. Les essais randomisés récents ont rapporté des chiffres plus bas, de l’ordre de 5% de cancers occultes. Il est probable que dans les études de cohorte anciennes étaient comptabilisés des cancers qui étaient d’emblée apparents au moment du diagnostic de la thrombose.
QUESTION 3
La recherche d’un cancer dans le contexte de MTEV sans facteur déclenchant crée sas cesse la polémique. Il existe une grande distorsion entre les recommandations et la réalité du terrain. La tentation du scanner Thoraco Abdomino Pelvien est grande. Alors chez qui proposer cette recherche de cancer et comment ?
L’essai randomisé canadien SOME (https://www.nejm.org/doi/full/10.1056/NEJMoa1506623) n’a pas montré de bénéfice du scanner abdomino-pelvien par rapport à un dépistage limité (examen clinique, biologie de routine, mise à jour des examens de dépistage recommandés pour l’âge et le sexe), ni sur le nombre de cancers diagnostiqués au moment du diagnostic, ni sur le risque de cancer au suivi. L’essai français MVTEP (https://clinicaltrials.gov/ct2/show/NCT04304651) a montré qu’un PET-scanner augmentait, mais de façon non statistiquement significative, le nombre de cancers diagnostiqués initialement. En revanche, le risque de cancer au cours du suivi était significativement plus faible dans le groupe des patients ayant eu un PET-scanner par rapport à ceux du groupe ayant eu un dépistage limité. Nous avons entrepris un nouvel essai clinique de plus grande ampleur pour évaluer l’intérêt du PET-scanner dans cette indication.
Dans l’attente des résultats, les guides de pratique français et internationaux préconisent de réaliser un interrogatoire et un examen clinique complets, une biologie de routine et une analyse d’urine, une radiographie pulmonaire, et de mettre à jour les examens de dépistage habituels pour les cancers du sein, du col, de la prostate ou du colon.
Un message important pour finir sur cette question : en pratique, nous sommes souvent très inquiets du risque de cancer chez les patients jeunes présentant une thrombose non provoquée (« pourquoi lui, sportif, en santé etc… »), alors que dans les études récentes, nous avons pu montrer que le risque de cancer était très faible chez les patients jeunes atteints de thrombose (moins de 1%), augmentait de façon assez nette à partir de 50 ans pour atteindre 9% chez les patients de plus de 80 ans. Nous devons donc être particulièrement vigilants chez les patients de plus de 50 ans.
QUESTION 4
En cas de cancer à l’origine d’une MTEV, ce cancer est-il évolué ou au stade occulte, en dehors des tableaux cliniques évolués de cancer.
Dans les essais cités plus hauts, un tiers des cancers solides étaient diagnostiqués à un stage précoce (stade I/II) et deux tiers à un stade plus avancé (III/IV) sans différence significative entre les bras dépistage limité ou intensif. Il faut toutefois noter que quand bien même un dépistage intensif permettrait de diagnostiquer les cancers à un stade plus précoce, le bénéfice sur le pronostic resterait à démontrer. En effet, les études épidémiologiques montrent que la maladie thromboembolique est associée à une mortalité accrue chez les patients avec cancer, et que ceci est particulièrement vrai chez les patients avec un cancer localisé. Même en cas de cancer localisé, la thrombose est probablement la manifestation d’une maladie plus agressive.
QUESTION 5
Existe-t-il une valeur prédictive de cancer en fonction de la localisation initiale de la MTEV : TVP distale versus TVP proximale, EP proximale versus EP distale voire sous segmentaire
Des études antérieures ont montré une association entre thrombose distale bilatérale et diagnostic ultérieur de cancer. Dans les essais de dépistage cités plus haut, le risque de cancer occulte était le même chez les patients avec TVP isolée, TVP et EP ou EP isolée. A noter toutefois que la plupart de ces études avaient exclu les patients avec thromboses distales isolées, et que l’information sur le caractère unilatéral ou bilatéral de la TVP, le caractère sous-segmentaire ou plus proximal de l’EP, n’était pas collectée. Ces points précis n’ont donc pas pu être analysés.
QUESTION 6
Une fois le cancer découvert, le patient est anticoagulé pour sa MTEV. Doit-on envisager alors une modification de ce traitement anticoagulant, selon le type de cancer, selon son évolution ?
Oui. Sans rentrer dans les détails, car cela pourrait faire l’objet d’un entretien complet, la prise en charge de la maladie thromboembolique est bien sûr différente chez les patients avec cancer.
Même si de plus en plus de patients peuvent être traités par AOD, le traitement par héparine de bas poids moléculaire au long cours est toujours indiqué dans certaines situations. Il existe aussi une indication à la poursuite du traitement anticoagulant tant que le cancer est actif et/ou que des traitements sont poursuivis (hormonothérapie…).
Dans l’attente des résultats de l’essai français APICAT,nous manquons de données sur la réduction de la dose d’AOD après 6 mois chez les patients avec cancer.
Etude APICAT : https://clinicaltrials.gov/ct2/show/NCT03692065?cond=API-CAT&draw=2&rank=1
Etude MVPT : https://www.em-consulte.com/article/1029759Merci Grégoire pour la clarté ,la justesse de ton analyse et la pertinence de tes réponses.

