"La clé est que les cliniciens ne dictent pas un traitement mais aident à faire des choix informés"Pr Krumholz, MedScape 2017 et JAMA
A position paper by the European Society of Vascular Medicine
Prise en charge des patients atteints de maladie artérielle périphérique chronique avec indication de revascularisation endovasculaire
file:///E:/Downloads/0301-1526_a000998.pdf , article LIBRE d'ACCES
Un document de prise de position de la Société Européenne de Médecine vasculaire...commenté

Dommage pas de Médecins Vasculaires Français !
Résumé
Avec un nombre croissant de patients atteints de maladie artérielle périphérique chronique (AOMI) , l'indication sûre et efficace d'une revascularisation des membres inférieurs est un besoin médical croissant. Les procédures endovasculaires pour le traitement de l'AOMI sont devenues une pierre angulaire de la médecine vasculaire moderne et l'approche de revascularisation de première intention si cela est techniquement faisable et prend en compte le choix du patient.
Avec l'âge croissant des patients atteints d'AOMI et le nombre croissant de comorbidités, la chirurgie vasculaire ouverte est également souvent impossible. Nous décrivons un cadre de messages clés, approuvé par le conseil d'administration de la Société européenne de médecine vasculaire pour la prise en charge pré-, péri- et post-procédurale des patients nécessitant des procédures artérielles endovasculaires des membres inférieurs.
RAPPELS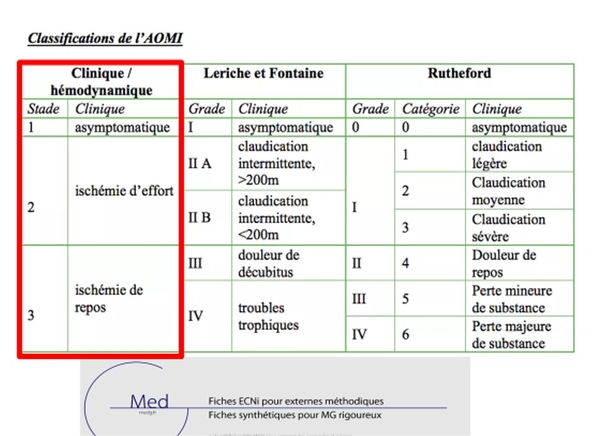
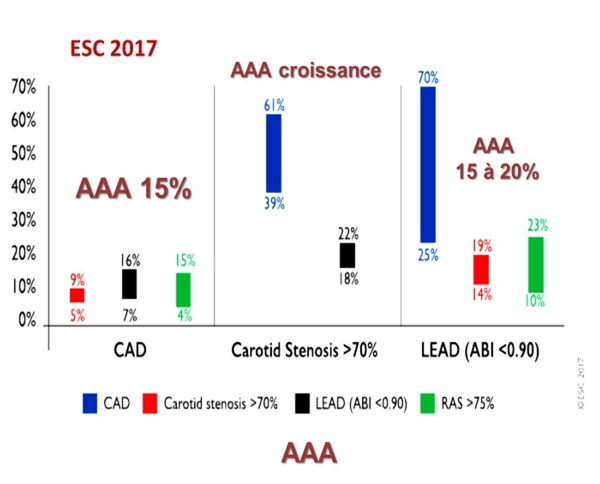
Introduction
Cette prise position fournit un cadre fondé sur des données probantes pour les médecins spécialisés impliqués dans la prise en charge des patients atteints de maladie artérielle périphérique symptomatique (AOMI), ayant une indication potentielle pour la revascularisation artérielle endovasculaire des membres inférieurs.
Il a été approuvé par le conseil d'administration de la Société européenne de médecine vasculaire et examiné par l'organisation caritative vasculaire basée au Royaume-Uni, la Circulation Foundation .
Il vise à optimiser la prise en charge pré-, péri- et post-interventionnelle en réduisant les variations injustifiées des soins au profit de cette population croissante et vulnérable de patients soulignant le rôle clé des médecins vasculaires .
L'importance de l'AOMI augmente régulièrement dans le monde. Alors qu'il était estimé qu'en 2010, 202 millions de personnes vivaient avec une AOMI, ce nombre est passé à 237 millions en 2015 et cela peut être dû en partie à la pandémie mondiale de diabète et également au vieillissement de la population . L'AOMI est très fréquente chez les personnes atteintes de diabète et augmente le risque d'ulcères non cicatrisés, d'amputation et de mortalité. Ainsi, le nombre croissant d'AOMI est probablement dû au nombre croissant de personnes atteintes de diabète, qui était estimé à 422 millions en 2014 et augmentera à 578 millions d'ici 2030 selon l'OMS. L'AOMI est la manifestation initiale la plus courante des maladies cardiovasculaires dans le diabète de type 2 . La mortalité après amputation liée au diabète dépasse 70 % à 5 ans. Les admissions à l'hôpital pour les ulcères du pied diabétique sont plus élevées que celles pour l'insuffisance cardiaque congestive, les maladies rénales, la dépression et la plupart des formes de cancer .
Au Royaume-Uni, les coûts des soins des pieds diabétiques augmentent. En 2010-2011, ils étaient estimés à 580 millions de livres sterling (~0,6 % des dépenses du NHS), dont plus de la moitié étaient consacrées aux soins des ulcères dans les soins communautaires primaires et ont augmenté à 837 - 946 millions de livres sterling (0,8-9 % des dépenses du NHS) en 2014-2015. Une thérapie optimale et l'arrêt du tabac peuvent réduire le risque de 40 %, et une revascularisation rapide favorise la cicatrisation des plaies et prévient l'amputation . La revascularisation est un énorme potentiel inexploité pour réduire les coûts de santé et améliorer le bien-être.
Commentaire : AOMI , la VIE REELLE !!!!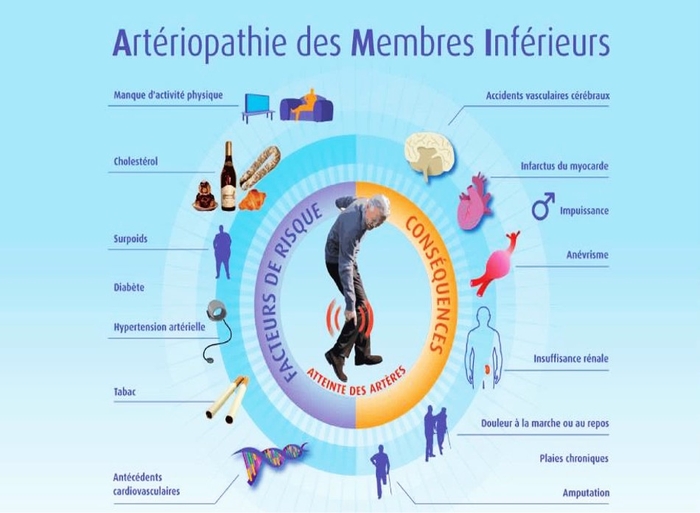
Le profil des patients d'âge croissant, la prévalence élevée de comorbidités et la grande variété de morphologies de lésions vasculaires souvent complexes font de la revascularisation endovasculaire dans la plupart des cas le premier et parfois aussi le seul choix, choisi par rapport à l'option chirurgicale plus invasive. La mortalité en période postopératoire est d'environ 4 % avant la sortie de l'hôpital et de 5,5 % la première année. La probabilité de décès augmente avec l'âge, une intervention chirurgicale majeure, des comorbidités graves et si des complications postopératoires surviennent. Alors que beaucoup appellent à des essais contrôlés randomisés comparant les résultats après une revascularisation chirurgicale à une revascularisation endovasculaire comme l'essai BASIL, cela devient de plus en plus difficile car pour un nombre croissant de patients, les procédures chirurgicales complexes ne sont pas possibles, ne reflètent souvent pas le choix du patient et ne peuvent pas être réalisées à l'échelle requise .
Dans l'ensemble, la revascularisation endovasculaire est intrinsèquement moins invasive que la chirurgie, moins coûteuse et associée à des taux de complications péri-opératoires inférieurs avec une survie sans amputation similaire ou meilleure .
Cependant, des procédures plus répétées, en particulier chez les patients atteints de diabète ou d'insuffisance rénale sévère, peuvent être nécessaires.
Dans la plupart des cas, les procédures endovasculaires ne compromettent pas les options chirurgicales futures.
- Importance mondiale croissante de l'AOMI
- Nécessité de fournir une revascularisation rapide, sûre et efficace à grande échelle
- La revascularisation endovasculaire est dans la plupart des cas le premier choix (d'un point de vue patient, médical et économique)
Entendu récemment dans un congrès en France, l'angioplastie des artères des MI est LE TRAITEMENT MEDICAL de l'AOMI. Attention danger !
Enfin l'ESVM oublie les femmes, nous y reviendrons à la fin de cet article, l'AOMI chez la femme est polus grave que chez l'homme, un point à retenir.
Pré-intervention
Considérations générales sur les indications, les risques et les bénéfices
Les progrès techniques du matériel et des techniques interventionnelles et le savoir-faire croissant des interventionnistes rendent les procédures endovasculaires même complexes dans la majorité des cas sûres et efficaces .
Néanmoins, les patients vieillissent et la fréquence de l'obésité, de l'hypertension et du diabète augmente. Parallèlement à cela, les comorbidités, y compris la maladie polyvasculaire et l'insuffisance rénale cliniquement pertinente, sont plus fréquentes et les patients suivent souvent un régime médicamenteux complexe. Tous ces facteurs doivent être pris en compte pour permettre des procédures sûres et efficaces.
La perspective sociale et l'importance de prendre en compte le choix du patient doivent également être reconnues.
Avant toute intervention, il doit y avoir une discussion précise et informative avec le patient, évaluant toutes les possibilités de revascularisation. Les facteurs de risque individuels doivent être identifiés et atténués et les risques doivent être clairement mis en balance avec les avantages attendus et la faisabilité technique de l'intervention. Dans tous les cas, la médication doit être revue et les modifications périopératoires de la médication doivent être expliquées au patient et documentées dans les notes. Cette discussion doit être documentée en détail au cours du processus de consentement éclairé, qui doit à la fin être signé par le patient et l'interventionniste, qui effectuera la procédure.
Dans les cas électifs, cette discussion doit être effectuée au moins 24 heures avant l'intervention.
De nos jours, les procédures endovasculaires périphériques peuvent également être réalisées en ambulatoire. Les avantages sont le rapport coût-efficacité et la préférence du patient. Les principales préoccupations concernent la sécurité, car les patients atteints d'AOMI sont généralement une population à risque plus élevé. Bien qu'il n'existe aucun score de risque de complications, plusieurs études ont montré que les taux de complications chez certains patients sont faibles / Les critères d'inclusion typiques pour l'angioplastie en ambulatoire sont un indice de masse corporelle <35 kg/m 2, faible risque périopératoire (par exemple ASA <4), fonction rénale suffisante (par exemple maladie rénale chronique <4), taille de gaine ≤7F nécessaire pour la procédure, pas d'isolement social avec <1 h de route jusqu'à l'hôpital, téléphone disponible avec un adulte responsable présent pendant la nuit, et pas d'anticoagulation nécessitant un pontage. Alors que l'utilisation de systèmes d'occlusion artérielle doit être utilisée, si possible, l'hémostase avec compression manuelle n'empêche pas la sortie le jour même .En conséquence, le traitement de jour doit être réservé aux patients à faible risque, et des soins post-opératoires efficaces, une prise en charge médicale et un suivi optimaux doivent être mis en place.
- Les interventions par cathéter sont entre des mains expérimentées de plus en plus sûres et efficaces pour de nombreux patients
- Les attentes des patients individuels augmentent, parallèlement aux possibilités techniques et au savoir-faire médical dans les interventions par cathéter et doivent être prises en compte (choix du patient)
- Les procédures de revascularisation endovasculaire sont dans la plupart des cas réalisables et efficaces mais doivent être réalisées dans des conditions clairement définies et nécessitent une planification individuelle en temps opportun
- La communication personnelle entre le patient et l'interventionniste (avec des informations sur tous les aspects de la procédure prévue) au moins 24 h avant la procédure est, outre les aspects médico-légaux, cruciale pour une bonne relation patient-médecin et contribue au succès thérapeutique+++++.
Parmi les FDRCV , un des principaux aujkurd'hui la POLLUTION est absent. C'est une facteur de RCV majeur et reconnu par toutes les Sociétés Savantes.
Bilan pré-interventionnel et bilan
Évaluation de la gravité du cas
Comme l'objectif principal de la revascularisation est d'améliorer le flux sanguin vers le pied, il est important d'évaluer la gravité de l'AOMI, y compris le degré d'ischémie, le type et l'étendue des lésions, la gravité des symptômes, la probabilité d'amélioration des symptômes et le sauvetage du membre . Il convient de noter que si l'ischémie critique chronique des membres inférieurs (ICM) a été définie comme une ischémie mettant en danger la jambe, il n'y a pas de consensus sur sa définition en termes d'hémodynamique et la plupart des classifications existantes ne sont pas fondées sur des preuves . Par conséquent, les tests de diagnostic tels que l'ABI ou la pression des orteils (TBI) ne peuvent aider à évaluer le degré d'ischémie que dans une certaine mesure et les valeurs absolues doivent être évaluées avec les symptômes. Dans ce contexte, il est important de comprendre que la physiopathologie vasculaire de l'AOMI est complexe, en particulier chez les patients diabétiques et atteints d'IRC, car celles-ci conduisent non seulement à l'athérosclérose macrovasculaire (plaques intimales) qui peut être traitée par angioplastie, mais également à l'artériosclérose (sclérose de la média). ) et maladie microvasculaire. De plus, les calcifications vasculaires rendent les revascularisations plus difficiles et peuvent limiter la perméabilité à long terme . La probabilité d'obtenir un succès technique avec des résultats à long terme acceptables et les avantages symptomatiques ou pronostiques attendus doivent être mis en balance avec le risque procédural potentiel associé à la complexité particulière de la lésion et aux comorbidités. Bien qu'aucun cadre de notation des risques dédié n'existe, il est clair que les revascularisations endovasculaires présentent un risque moindre d'événements péri-procéduraux coronariens ou cérébrovasculaires et de complications liées au site d'accès, par rapport à la chirurgie.
L'équipe de médecine vasculaire doit décider en fonction de la gravité clinique de l'AOMI de l'indication de revascularisation, évaluer les risques globaux et cardiovasculaires péri-procéduraux et proposer une méthode de revascularisation. Une discussion conjointe au sein d'une équipe pluridisciplinaire incluant des chirurgiens vasculaires est souvent utile au cours de ce processus. L'évaluation pré-procédurale du patient porte sur l'AOMI elle-même, les conditions cliniques coronariennes et cérébrovasculaires, le risque global du patient, mais se concentre également sur la faisabilité technique, y compris le meilleur choix du site d'accès artériel, et les risques potentiels spécifiques au patient liés à la procédure de diagnostic et à la thérapie interventionnelle.
L'évaluation de la revascularisation par angioplastie doit également être entièrement étayée par une évaluation clinique complète (antécédents et examen physique). Cela aidera également à définir l'objectif clinique d'une procédure et à gérer les attentes, car seuls les symptômes liés à l'ischémie sont susceptibles d'être améliorés par la revascularisation. Par conséquent, les symptômes liés à la maladie veineuse, à la neuropathie ou aux problèmes musculo-squelettiques doivent être pris en compte pour la prise de décision finale. Lorsqu'un débridement ou des amputations mineures sont prévus, une revascularisation doit être effectuée avant cela pour favoriser une cicatrisation optimale de la plaie. L'histoire du patient révélera la date de début de la claudication, l'évolution du périmètre de marche, la durée depuis le début de la douleur de repos, la durée depuis l'apparition des changements trophiques et leur évolution, besoin d'analgésiques pour soulager la douleur et répondre aux médicaments antérieurs. L'anamnèse doit également se concentrer sur les événements coronariens et cérébrovasculaires antérieurs, principalement l'angine de poitrine, l'arythmie, les syndromes coronariens aigus, les accidents ischémiques cérébraux transitoires, les accidents vasculaires cérébraux et les séquelles neurologiques. L'évaluation physique doit inclure l'inspection, la palpation du pouls et l'auscultation artérielle. Cela permet non seulement de classer la sévérité de l'ischémie de l'AOMI et de confirmer la présence d'une sténose artérielle associée dans des zones éloignées (p. ex., carotides, artères sous-clavières), mais aide également à identifier les sites disponibles pour l'accès artériel (p. ex., fémoral ou radial). L'étendue complète des facteurs de risque cardiovasculaire (p. ex., hypertension, diabète, dyslipidémie, obésité, tabagisme) et le degré de contrôle sous traitement doivent être évalués,
Messages clés
- Les patients atteints d'AOMI ont en général un risque cardiovasculaire élevé
- Mais le risque cardiovasculaire péri-procédural est faible
- L'évaluation pré-interventionnelle de la faisabilité technique, des risques individuels, des objectifs de traitement et du choix du patient fait partie intégrante de la prise de décision
Examens diagnostiques pré-interventionnels standards
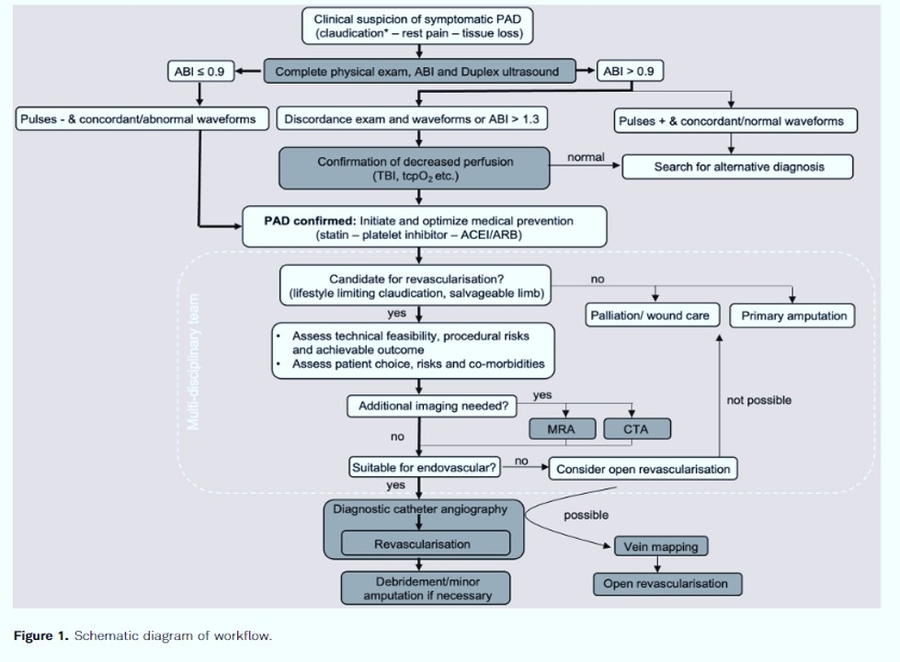
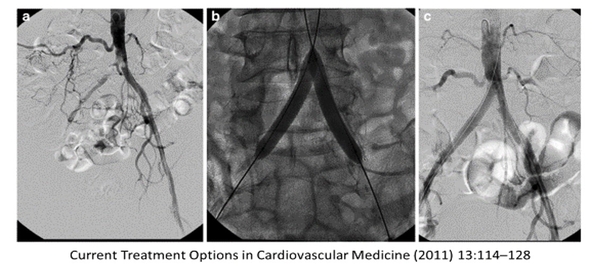
S'il existe une suspicion clinique d'AOMI symptomatique, y compris une claudication typique, une perte de tissu (ulcères ou gangrène) ou une douleur au repos, un examen physique complet avec l'état du pouls périphérique, la mesure de l'index cheville-bras (IPS) et une échographie-doppler de l'aorte, des muscles pelviens et les artères des membres doivent être réalisées ( Figure 1). Si l'ABI est inférieur ou égal à 0,9 avec des symptômes typiques et des formes d'ondes pathologiques concordantes telles que des signaux monophasiques, le diagnostic de l'AOMI est confirmé. En cas de discordance des résultats de l'examen, une évaluation non invasive supplémentaire de la gravité de l'ischémie doit être effectuée. Chez les personnes atteintes de diabète et d'insuffisance rénale, la sclérose médiale peut entraîner une fausse normale ou une augmentation de l'IPS en raison de la sclérose médiale. La pression brachiale de l'orteil (TBI), la pression d'oxygène transcutanée ou la mesure oscillométrique de l'IPS peuvent aider à confirmer ou à rejeter un diagnostic d'AOMI. La mesure de l'étendue de l'ischémie est utile pour la décision de revascularisation. Si possible, il doit être évalué par TBI en particulier lorsqu'il existe des examens discordants. L'échographie, réalisée par un médecin spécialiste en médecine vasculaire. L'analyse de la forme d'onde Doppler distale pendant l'examen duplex et également pendant la mesure de l'IPS peut être utilisée pour détecter les caractéristiques de débit sanguin altérées. Dans certains centres, l'angiographie par tomodensitométrie (CTA) ou l'angiographie par résonance magnétique (ARM) sont la norme de soins avant l'angiographie intra-artérielle, car des échographistes qualifiés ne sont pas disponibles, ce qui peut apporter des informations anatomiques supplémentaires utiles, par exemple pour la planification de la procédure et peut révéler des résultats cliniques pertinents. les découvertes fortuites extravasculaires, en particulier les tumeurs malignes .
Commentaire : les "échographistes qualifiés" très mauvais terme, inadéquate en 2022. Ce sont les médecins vasculaires en France qui réalisent l'écho Doppler dans une démarche clinico-anatomique et hémodynamique. En fait il s'agit d'une démarche diagnostique et thérapeutique en un temps, tout au moins c'est ce que nous réalisons chaque jour.
Si une décision de revascularisation est prise on peut passer au préalable par un angioscanner ou directement à l'angiographie thérapeutique. Et dans certains cas ont peut (pourrait) aller directement d'un écho-Doppler de niveau 3, sans passer par la case imagerie radiologique.
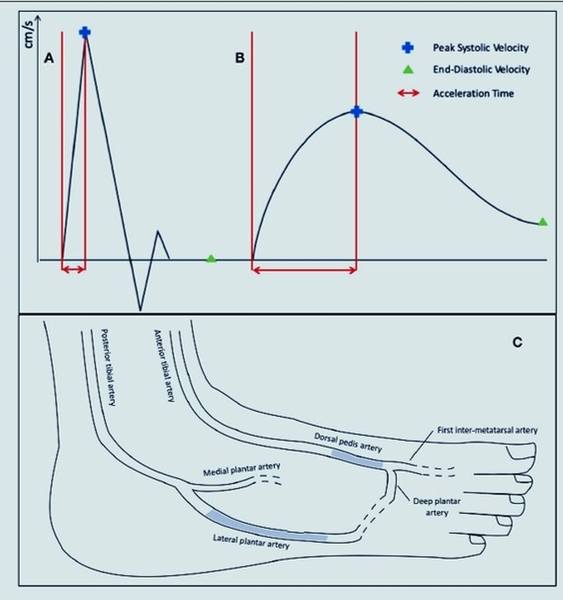
La TCPO2 est réservée au stade de l'ischémie de repos mais jamais au stade l'ischémie d'effort. De plus il est impératif de connaître actuellement l'étude écho-Doppler de la vascularisation plantaire décrite par J Sommerset avec la mesure du temps d'ascension systolique qui est évalué en msec (https://medvasc.info/1508-temps-d-ascension-systolique), c'est important en cas de troubles trophiques. Une fois le diagnostic d'AOMI posé , que la claudication est > 200 m, aucune précipitation à avoir. Il faut donner au patient du temps au patient pour comprendre ce que signifie le daignostic, se donner, le temps de corriger les FDRCV, le temps de marcher, le temps de changer de vie. Il faut se donner entre 3 et 6 mois, si pas d'évolution favorable voire une aggravtaion le recours à la revascularisation s'impose.
Bilan cardiologique chez les patients à haut risque
L'état cardiaque d'un patient porteur d'une AOMI avec une indication de revascularisation est idéalement évalué avant l'intervention. Des antécédents de syndrome coronarien aigu, d'insuffisance cardiaque ou d'arythmies ventriculaires, ainsi que des signes cliniques d'athérosclérose multisite justifient encore plus une telle approche. Chez ces patients à haut risque, un ECG et une échocardiographie peuvent être obligatoires notamment si une revascularisation chirurgicale est envisagée. Comme la thérapie endovasculaire comporte un faible risque procédural, une procédure de sauvetage de membre doit être réalisée dès que possible, en particulier chez les patients CLI. Les patients CLI subissant une revascularisation présentent de meilleurs résultats à court et à long terme que sans . Si l'angiographie conduit à une indication de revascularisation chirurgicale, le risque chirurgical doit être évalué plus avant. Avant la revascularisation artérielle chirurgicale, l'identification de l'ischémie myocardique nécessite un ECG, qui est de routine, même chez les patients coronariens asymptomatiques. Chez les patients à haut risque, un Holter ECG ou des tests d'effort comme la scintigraphie myocardique ou l'échocardiographie de stress à la dobutamine peuvent être indiqués pour évaluer l'ischémie myocardique. Les patients ayant des antécédents de syndromes coronariens aigus ou d'infarctus du myocarde antérieurs à l'ECG peuvent nécessiter une évaluation par angiographie coronarienne de leur risque cardiaque, car ils peuvent bénéficier d'une revascularisation coronarienne, en particulier si une revascularisation chirurgicale est nécessaire. L'échocardiographie apporte des données sur la structure et la fonction cardiaque (systolique et diastolique), les troubles valvulaires ou la pression pulmonaire. Une faible fraction d'éjection, la présence de signes cliniques d'insuffisance cardiaque et d'hypertension pulmonaire, des anomalies segmentaires de la contractilité myocardique et une cardiopathie valvulaire importante représentent des marqueurs de risque chirurgical. Ces conditions doivent être traitées et améliorées, autant que possible, avant la revascularisation chirurgicale. La priorité et le calendrier des procédures cardiaques et périphériques doivent être évalués à un niveau individualisé et une décision prise en collaboration avec une équipe multidisciplinaire et le patient. les anomalies segmentaires de la contractilité myocardique et les cardiopathies valvulaires importantes représentent des marqueurs de risque chirurgical. Ces conditions doivent être traitées et améliorées, autant que possible, avant la revascularisation chirurgicale. La priorité et le calendrier des procédures cardiaques et périphériques doivent être évalués à un niveau individualisé et une décision prise en collaboration avec une équipe multidisciplinaire et le patient. les anomalies segmentaires de la contractilité myocardique et les cardiopathies valvulaires importantes représentent des marqueurs de risque chirurgical. Ces conditions doivent être traitées et améliorées, autant que possible, avant la revascularisation chirurgicale. La priorité et le calendrier des procédures cardiaques et périphériques doivent être évalués à un niveau individualisé et une décision prise en collaboration avec une équipe multidisciplinaire et le patient.
Messages clés
- Plus les procédures interventionnelles ou chirurgicales prévues sont électives et risquées, plus le bilan diagnostique du risque cardiovasculaire doit être effectué à l'avance et les éventuels facteurs de risque de l'intervention doivent être exclus ou au moins atténués.
Analyses de laboratoire pré-interventionnelles
Les tests de laboratoire préopératoires ont principalement pour but d'identifier les risques afin de permettre l'atténuation des risques et l'optimisation de la prévention médicale ainsi que la modification des facteurs de risque cardiovasculaire. Les tests comprennent l'identification d'une anémie potentielle (hémoglobine, hématocrite), d'une inflammation (numération des leucocytes, CRP), d'un déséquilibre de la coagulation et de la thrombose (INR, aPTT, numération plaquettaire), d'une insuffisance rénale (urée, créatinine), de changements électrolytiques (sodium, potassium), fonction thyroïdienne (TSH), glucose (HbA1c, glycémie à jeun) et bilan lipidique. Comme exigence minimale, l'INR, l'eGFR et la numération globulaire doivent être obtenus dans les 3 semaines précédant la procédure, idéalement dans les 72 dernières heures avant l'intervention.
Les interventions endovasculaires peuvent être considérées comme des procédures ambulatoires en l'absence d'anémie significative, d'insuffisance rénale ou de déséquilibre de la coagulation et de la thrombose. L'étiologie d'une anémie importante ou récemment aggravante doit être recherchée dans tous les cas avant la revascularisation, faute de quoi l'anticoagulation péri-procédurale à l'héparine et l'inhibition plaquettaire simple ou surtout double post-procédurale peuvent entraîner des risques hémorragiques supplémentaires. Une faible numération plaquettaire peut inciter à des procédures et à une surveillance à l'hôpital, ainsi qu'à un traitement antiplaquettaire unique après la procédure. Un faible eGFR doit conduire à l'utilisation d'agents de contraste avec une néphrotoxicité plus faible et dans des volumes plus faibles,
Messages clés
- Les analyses de laboratoire chimiques et hématologiques donnent des informations importantes sur l'état de santé général du patient et offrent des moyens d'améliorer l'état du patient avant l'intervention
- Les tests sanguins minimum requis dans la plupart des centres comprennent l'INR, l'eGFR, (TSH), l'Hb et la numération globulaire complète obtenue dans les 3 semaines, idéalement dans les 72 h avant la procédure
Prise en charge péri-interventionnelle de l'anticoagulation
Les anticoagulants oraux peuvent dans la plupart des cas être arrêtés avant les interventions. Dans ce contexte, l'indication de l'anticoagulation chronique doit être revue. Les décisions individuelles sont prises avec le patient et impliquent idéalement une équipe multidisciplinaire sur la sécurité de l'interruption de l'anticoagulation et fournissent un plan sur la façon d'arrêter, de redémarrer et, si nécessaire, de combler .
Dans la plupart des cas, les interventions peuvent et doivent être effectuées sans transition, car les risques de saignement augmentent sans réduire de manière significative le risque d'embolie/d'AVC/d'EP .
L'INR est utilisé pour surveiller l'anticoagulation orale avec les antagonistes de la vitamine K (AVK). Selon l'intervention envisagée, l'indication et le degré d'anticoagulation, l'AVK doit être arrêté 2 à 3 jours et la revascularisation effectuée lorsqu'un INR cible (typiquement 1,5 à 2,0) défini par l'équipe est atteint.
Les AOD doivent être arrêtés avant les interventions en fonction de la cinétique des médicaments individuels, de l'âge et de la fonction rénale pour obtenir des réductions de 3 à 4 fois la demi-vie de l'activité de l'AOD. L'évaluation de l'INR sous AOD n'est en aucun cas fiable et déconseillée.
Une transition vers les anticoagulants oraux peut être nécessaire chez une minorité de patients, en particulier chez les patients à haut risque (p. ex., valves mécaniques ou événements thromboemboliques récents). Ceci est généralement réalisé avec de l'héparine intraveineuse et chez les patients présentant une thrombocytopénie induite par l'héparine avec la lépirudine, l'argatroban, le fondaparinux ou le danaparoïde De nombreuses procédures peuvent être réalisées en toute sécurité sous anticoagulation thérapeutique en utilisant des techniques adéquates.
- Dans la plupart des cas, l'anticoagulation "bridgée" n'est pas nécessaire
- Dans certaines situations avec une forte indication d'anticoagulation, des stratégies de transition doivent être envisagées et planifiées en respectant le risque individuel et la préférence du patient
Considérations sur l'inhibition plaquettaire pré-interventionnelle
Il existe un accord sur le fait que les patients atteints d'AOMI symptomatique doivent être traités avec des médicaments antiplaquettaires. Il doit s'agir, de préférence, de clopidogrel ou, en cas de faible risque hémorragique, d'une inhibition de la double voie (DPI) avec de l'aspirine et du rivaroxaban à 2,5 mg BID (étude COMPASS) . Un traitement antiplaquettaire doit être mis en place pour prévenir les événements cardiovasculaires majeurs et les événements majeurs des membres (voir plus loin la discussion ci-dessous sous la rubrique
Stratégie de médication post-opératoire
La thérapie antiplaquettaire ne doit pas être arrêtée pour effectuer des interventions, sur la base de moins de données et d'extrapolation à partir d'études en cardiologie, il est également convenu qu'après les interventions, la double thérapie antiplaquettaire (DAPT) doit être installée temporairement (1 à 3 mois) afin pour améliorer la perméabilité.
La DAPT à plus long terme peut avoir des avantages mais comporte un risque hémorragique accru . Il existe une incertitude quant aux patients susceptibles de bénéficier du DAPT ou du DPI, pendant combien de temps il doit être maintenu pour quels dispositifs, à quel moment le DAPT doit être initié et si une dose de charge de clopidogrel de 300 mg ou 600 mg doit être administrée. Alors que la plupart conviennent que le DES ou les stents couverts nécessitent plutôt 3 mois de DAPT et 1 mois pour le DCB et le BMS est suffisant, certains pensent que l'angioplastie par ballonnet ordinaire ne nécessite que le SAPT. Certaines études commencent DAPT dès 1 semaine avant une intervention planifiée, certains commencent après l'intervention. L'un des avantages de commencer DAPT avant la procédure est que cela laisse le temps de tester si DAPT bloque efficacement la réactivité plaquettaire. Une réactivité plaquettaire élevée sous traitement s'est avérée être un déterminant majeur de l'échec tardif de la procédure qui pourrait être surmonté en adaptant le traitement . Les inconvénients potentiels peuvent être liés à un risque plus élevé de complication hémorragique si les procédures sont effectuées sur DAPT efficace. Si la DAPT est mise en place notamment pour d'autres indications comme l'infarctus du myocarde ou des interventions coronariennes antérieures, elle ne doit pas être arrêtée .
Plus récemment et sur la base de l'étude VOYAGER PAD, le DPI peut être initié après des interventions pour améliorer les résultats . Dans cette étude, le rivaroxaban était arrêté si des réinterventions étaient réalisées tout en poursuivant l'aspirine. Par conséquent, si les patients sont sous DPI avant la procédure, le rivaroxaban à faible dose mais pas l'aspirine doit être interrompu en péri-intervention.
Messages clés
- Au minimum, une inhibition plaquettaire unique avec de l'aspirine ou de préférence du clopidogrel doit être mise en place avant l'intervention
- Le rivaroxaban (2,5 mg BID) doit être interrompu en péri-intervention tout en poursuivant l'aspirine
- L'inhibition de la DAPT ne doit pas être arrêtée pour les interventions en particulier s'il y a une indication cardiologique
Prise en charge des patients présentant une insuffisance rénale pertinente
Chez les patients dont la fonction rénale est réduite, l'exposition à des produits de contraste iodés peut entraîner ce que l'on appelle une lésion rénale aiguë associée au contraste (CA-AKI). Bien que le risque réel de CA-AKI demeure incertain pour les patients atteints d'insuffisance rénale sévère, la prophylaxie avec une solution saline normale intraveineuse est indiquée pour les patients qui ont une IRA ou un débit de filtration glomérulaire estimé inférieur à 30 mL/min/1,73 m 2 qui ne sont pas en cours d'entretien dialyse. Dans des circonstances individuelles à haut risque, la prophylaxie peut être envisagée chez les patients ayant un taux de filtration glomérulaire estimé de 30 à 44 ml/min/1,73 m 2 à la discrétion du clinicien prescripteur . Le moment idéal, le volume et le taux d'expansion du volume sont incertains. Les régimes d'expansion de volume typiques commencent 1 heure avant et se poursuivent 3 à 12 heures après l'administration du produit de contraste, avec des doses typiques allant de volumes fixes (par exemple, 500 ml avant et après) à des volumes basés sur le poids (1 à 3 ml/kg par heure). La quantité de chlorure de sodium chargée par la perfusion ne doit pas être négligée, car elle peut rendre la gestion de la pression artérielle plus difficile et peut ne pas être bien tolérée chez les patients présentant une insuffisance cardiaque concomitante. Ainsi, un volume d'infusion limité combiné à un apport d'eau par voie orale suffisant semble plus raisonnable. De plus, l'arrêt des médicaments néphrotoxiques non essentiels peut diminuer le risque de CA-AKI et est recommandé lorsque cela est possible.
Pour diminuer ou éviter l'utilisation de produit de contraste iodé chez les patients insuffisants rénaux . et beaucoup plus rarement l'intolérance au contraste d'iode Le gaz CO 2 peut être utilisé comme adjuvant ou seul agent de contraste pour l'angiographie intra-artérielle En général, les jambes doivent être positionnées légèrement vers le haut pour éviter que le CO 2 n'atteigne les vaisseaux abdominaux ou cérébraux. Sous forme de CO2gaz peut entraîner des lésions cérébrales permanentes, un foramen ovale perméable ou un important shunt droite-gauche doit être exclu avant l'application de cette technique. Pour améliorer la qualité de l'image, la butylscopolamine iv peut diminuer les selles. Pour ces procédures, l'accès antégrade est favorable. Surtout le groupe avec une fonction rénale gravement altérée mais pas préterminale est bon pour le CO 2technique. Ce groupe tolère encore beaucoup mieux l'injection de gaz, car leur pouvoir tampon sanguin est encore suffisant pour que l'acide carbonique produit ne provoque pas de douleur plus durable dans la paroi vasculaire. Chez les patients présentant une fonction rénale préterminale, nous recommandons la procédure sous sédation et anesthésie en raison de la douleur forte et plus durable causée par l'acide carbonique.
Messages clés
- La prophylaxie CA-AKI avec perfusion de chlorure de sodium chez les patients avec < 30 ml/1,73 m 2 est recommandée et doit être envisagée dans la constellation à haut risque (CAVE : surcharge volumique avec risque d'insuffisance cardiaque)
- L'angiographie au dioxyde de carbone est une option pour les patients présentant une fonction rénale altérée et/ou des contre-indications aux produits de contraste iodés. En cas d'insuffisance rénale très sévère, la douleur causée par l'effet persistant de l'acide carbonique sur la paroi vasculaire doit être prise en compte et éventuellement réalisée sous anesthésie générale.
Prise en charge péri-interventionnelle
Les données factuelles sur la prise en charge péri-interventionnelle sont rares. Par conséquent, la section suivante est en partie basée sur les recommandations d'experts en intervention.
Imagerie
Avant chaque procédure de revascularisation artérielle périphérique, une imagerie vasculaire complète doit être réalisée, y compris l'aorte abdominale, les artères iliaques des deux membres et les artères sous-inguinales du membre cible. Les modalités d'imagerie pré-interventionnelles comprennent l'échographie duplex (DUS), le CTA et l'ARM . Chez les patients atteints d'AOMI devant subir une revascularisation, le DUS doit être considéré comme la première approche d'imagerie non invasive, tandis que sa fiabilité dépend de l'expertise de l'échographiste individuel . Appliquées par des échographistes expérimentés, les modalités d'imagerie pré-interventionnelles supplémentaires ne sont pas obligatoires . Cependant, chez les patients atteints d'une maladie multisegmentaire complexe, en particulier lorsqu'elle implique les artères aorto-iliaques, une CTA ou une ARM complémentaire doit être envisagée pour la planification de la procédure .
Accès vasculaire
Les considérations d'innocuité et d'efficacité doivent être prises en compte au cours de la procédure. En toutes circonstances, il faut toujours équilibrer les risques et les avantages des différentes stratégies procédurales. Les complications péri-interventionnelles découlent souvent de complications hémorragiques liées au site d'accès. Les principaux facteurs de risque de complication au site de ponction chez les patients ayant subi des procédures endovasculaires des membres inférieurs sont la compression manuelle, l'âge, la durée de la procédure > 45 minutes, les procédures crurales, l'hypertension non contrôlée et une coagulation altérée, mais l'obésité peut également être difficile, en particulier lors de la planification d'un accès antérograde à l'aine . Pour réduire le risque de saignement, le plus petit diamètre de gaine suffisant pour la procédure prévue doit être utilisé.
L'imagerie duplex pré-interventionnelle des sites de ponction possibles doit être envisagée pour la planification de la procédure. En cas d'obstruction de l'artère fémorale commune, d'autres sites de ponction doivent être envisagés.
Pour les procédures aortoiliaques, un accès rétrograde ipsilatéral, un accès croisé rétrograde controlatéral, un accès artériel transbrachial ou transradial, ou une combinaison de ces sites d'accès est approprié. Pour les interventions sous-inguinales, soit un accès antérograde ipsilatéral, soit un accès croisé rétrograde controlatéral – en particulier pour le traitement combiné des lésions aortoiliaques et sous-inguinales ou même des lésions crurales pour établir un flux rectiligne vers le pied – peut être appliqué. Dans les procédures complexes, en particulier dans les occlusions chroniques, des sites d'accès supplémentaires, tels qu'un accès pédieux, tibial, poplité ou fémoral distal, peuvent être nécessaires.
La ponction de l'artère guidée par échographie doit être utilisée dans la mesure du possible pour réduire le risque de complications associées au site de ponction .
Concernant l'accès fémoral inguinal le plus couramment utilisé, le niveau de ponction recommandé est le milieu de la tête fémorale ce qui garantit l'efficacité optimale de la compression et de l'hémostase après retrait de la gaine . Surtout chez les patients âgés ainsi que chez les patients après une chirurgie orthopédique de la hanche, le site de ponction préféré doit être dans la moitié inférieure de la tête du fémur pour réduire le risque de saignement.
Les dispositifs de fermeture vasculaire ont montré une nette amélioration du confort et de la satisfaction des patients ainsi que du temps d'hémostase et de déambulation après les procédures vasculaires percutanées. Cependant, les interventionnistes doivent s'assurer de l'adéquation du déploiement du dispositif (non calcifié, pas de plaque, diamètre du vaisseau> 5 mm), être conscients de la défaillance potentielle du dispositif et des complications spécifiques liées au dispositif . En particulier, en cas d'accès vasculaire transbrachial, fémoral distal ou poplité, les options de fermeture du vaisseau et d'hémostase doivent être envisagées lors de la planification de la procédure.
- Les considérations sur le site d'accès approprié et la technique de ponction correcte sont cruciales pour une procédure réussie et sûre
- La ponction guidée par l'image est recommandée dans tous les cas
- Les dispositifs de fermeture sont des outils très utiles dans la pratique quotidienne, mais ils peuvent présenter des limites et des complications
- Le taux de complications de ces dispositifs peut être réduit en tenant compte de l'application et du site d'accès approprié lors de la planification de la procédure
À jeun ou non ?
Classiquement, le jeûne strict était conseillé pour prévenir une éventuelle aspiration en cas d'urgence et permettait un transfert direct vers le bloc opératoire. Cependant, comme ces complications sont rares entre les mains des spécialistes, insister sur le jeûne strict se fait plus rare mais demandez plutôt un petit déjeuner au moins 4 h avant les interventions. Indépendamment de cela, les médicaments habituels, en particulier les antihypertenseurs, à l'exception des diurétiques et des analgésiques, doivent être pris comme d'habitude. Chez les patients diabétiques, il faut tenir compte d'une éventuelle gastroparésie diabétique et d'un temps de vidange gastrique prolongé, ainsi que des médicaments associés à un risque d'hypoglycémie . Bien que la metformine ne soit pas directement néphrotoxique, il a été postulé qu'elle peut altérer la gluconéogenèse à partir du lactate, ce qui peut entraîner une accumulation de lactate dans des circonstances telles qu'une lésion rénale aiguë associée au contraste. Néanmoins, alors que le risque de développer une acidose lactique associée à la metformine est faible lorsque le DFG est > 60 ml/min/1,73 m 2 , de nombreux interventionnistes l'ont interrompu avant une exposition au produit de contraste . La suspension de l'insuline à action prolongée le jour de l'intervention doit être envisagée pour prévenir l'hypoglycémie.
Messages clés
- Le jeûne strict n'est pas nécessaire et en particulier les médicaments antihypertenseurs et analgésiques habituels doivent être pris le jour de l'intervention.
- Les médicaments susceptibles de provoquer une hypoglycémie doivent être arrêtés le jour de l'intervention
- L'arrêt de la metformine doit être envisagé en particulier chez les patients présentant une insuffisance rénale
Gestion de l'anesthésie et de la sédation
La grande majorité des interventions peuvent être réalisées sous anesthésie locale du site d'accès, par exemple par injection locale de 10 ml de lidocaïne à 2% lors d'une ponction guidée par échographie ou fluoroscopie sur la face antérieure de l'artère et sédation à la demande par des benzodiazépines iv. Les patients souffrant d'insuffisance rénale sévère ou avec des aines déjà souvent perforées ou traitées chirurgicalement ont besoin d'une dose plus élevée d'anesthésie locale en raison d'une propagation altérée du médicament ou d'une efficacité réduite causée par l'acidité tissulaire plus élevée chez les patients souffrant d'insuffisance rénale sévère. Les procédures qui durent plus d'une heure peuvent nécessiter une dose supplémentaire d'anesthésie locale avant le retrait de la gaine car l'effet de la dose initiale peut s'estomper. Patients souffrant de douleurs incontrôlables. Celle-ci peut être soit assurée par un interventionniste formé, soit déléguée à l'équipe d'anesthésiologie, ce qui augmente potentiellement la sécurité des patients puisqu'elle permet à l'interventionniste d'accorder toute son attention à la procédure elle-même .
Message-clé
- La grande majorité des interventions peuvent se faire sous anesthésie locale du site d'accès
Surveillance et pharmacologie
Anticoagulation
La surveillance sur table de l'anticoagulation chez les patients atteints d'AOMI n'est pas une pratique courante. Dans la plupart des cas, il y aura une seule dose intra-artérielle d'héparine au début de la procédure (3 000 à 5 000 U d'héparine non fractionnée) . En cas de thrombocytopénie induite par l'héparine (TIH), des médicaments alternatifs tels que le fondaparinux peuvent être utilisés . Lorsque des cathéters de guidage sont utilisés dans le cadre de la procédure, le rinçage de l'héparine via le cathéter de guidage offre un avantage potentiel, car la surface interne du cathéter est alors également recouverte d'héparine et réduit le risque d'activation de la coagulation pendant la procédure.
Une option pour contrôler l'héparinisation intra-interventionnelle est la mesure au lit du patient du temps de coagulation activée (ACT). Dans les procédures interventionnelles plus longues, l'administration répétée d'héparine non fractionnée, y compris les mesures d'ACT avec un ACT cible de 200 à 250 secondes, doit être envisagée .
Surveillance cardiovasculaire par oxymétrie de pouls ou ECG continu
Nous recommandons l'oxymétrie de pouls en plus de l'ECG continu pour la surveillance non invasive, car l'oxymétrie de pouls contrôle non seulement la fréquence cardiaque, mais également le flux sanguin et la respiration. La détérioration de l'état cardiorespiratoire des patients sera reconnue plus tôt en oxymétrie de pouls qu'à l'ECG. La surveillance ECG est cependant utile, en particulier dans les procédures qui risquent de provoquer des arythmies, par exemple les procédures transbrachiales avec passage de l'aorte. Dans ces cas, un dispositif de défibrillation doit également être disponible.
Surveillance de la tension artérielle et gestion de l'hypertension
Les patients ont besoin d'une surveillance de la pression artérielle pendant la procédure. Cela peut être accompli par des brassards de bras réglés à des intervalles de 5 min ou en connectant la pression artérielle invasive avec un élément statham à la gaine. En général, les patients doivent prendre leurs médicaments antihypertenseurs habituels le matin de l'intervention. Néanmoins, la situation inhabituelle dans la salle d'angio et l'intervention à venir pourraient augmenter la tension artérielle. Une sédation à faible dose avec des benzodiacépines iv pourrait avoir un effet positif sur l'anxiété et la tension artérielle. La surveillance sur table de la pression artérielle par des techniques non invasives est recommandée et particulièrement utile en fin d'intervention pour diagnostiquer un éventuel saignement notamment si une compression manuelle du site de ponction est nécessaire.
Sédation sur table et gestion de la douleur
Beaucoup de patients encore plus jeunes se plaignent de maux de dos lorsqu'ils sont allongés sur la table de fluoroscopie. Une faible dose de benzodiazépine comme 1 à 2 mg de midazolam iv est souvent suffisante pour contrôler cette situation pendant environ 45 minutes. Passé ce délai, une même dose supplémentaire est souvent nécessaire. Pour les maux de dos, 1 g iv de paracétamol est un autre bon choix initial.
Chez les patients CLI, les benzodiazépines sont souvent insuffisantes. Les patients souffrant de douleurs au repos sur la table ont besoin d'un contrôle suffisant de la douleur (p. ex., fentanyl par paliers de 25 ug iv ou morphine avec une dose initiale de 3 à 5 mg iv.) pour pouvoir coopérer ou ils ont besoin d'une anesthésie générale pour la procédure interventionnelle.
Messages clés
- Dans la plupart des cas, les procédures peuvent être effectuées sans surveillance de la coagulation sur table
- L'oxymétrie de pouls, l'ECG et la surveillance non invasive de la pression artérielle sont adéquats pour la surveillance hémodynamique péri-procédurale
- Un défibrillateur doit être disponible en cas de risque accru d'arythmie
- Envisagez la sédation pour affecter positivement l'anxiété et l'hypertension artérielle
- Envisagez une baisse prudente de la pression artérielle, en particulier si une compression manuelle est nécessaire
Procédure interventionnelle
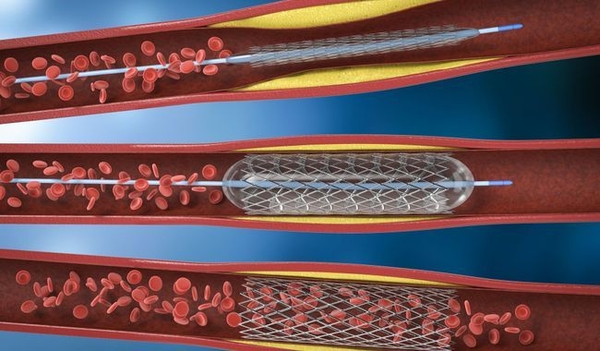
Stent
Dans le traitement des lésions aorto-iliaques, l'implantation de stent est supérieure à l'angioplastie par ballonnet . La décision entre les stents auto-expansibles et expansibles par ballonnet doit être prise en fonction des caractéristiques de la lésion . Les stents couverts peuvent réduire le risque procédural de rupture de vaisseau et le risque à moyen terme de resténose . 
La question de savoir si et dans quelle mesure les stents couverts affectent les résultats cliniques est encore sujet à discussion.
Les lésions communes de l'artère fémorale sont généralement traitées par chirurgie ouverte. Chez les patients fragiles et à haut risque chirurgical, une thérapie endovasculaire par pose de stent ou un traitement combiné d'athérectomie et d'angioplastie par ballonnet enrobé de médicament (DCB) pourrait être une alternative adéquate .
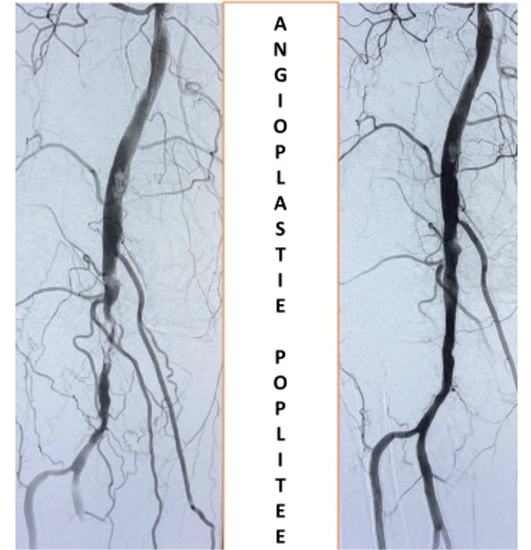
Dans le segment fémoropoplité, l'application d'agents antiprolifératifs à l'aide de ballonnets enrobés de médicament (DCB) ou de stents à élution médicamenteuse (DES) contribue potentiellement à réduire le risque de resténose . La calcification des vaisseaux lourds altère potentiellement la transmission et l'efficacité des médicaments antiprolifératifs ainsi que le gain de lumière pendant les procédures interventionnelles
Différentes stratégies interventionnelles, telles que l'athérectomie ou la lithotripsie, pourraient être utiles pour la préparation intra-procédurale des vaisseaux . Le placement du stent doit être minimisé, cependant, il ne doit pas être refusé si nécessaire .
La maladie sous-poplitée est souvent caractérisée par des lésions complexes et fortement calcifiées. Jusqu'à présent, la stratégie endovasculaire la plus efficace pour les artères sous-poplitées est sujette à discussion. La mise en place du semble être supérieure à l'angioplastie par ballonnet simple et à l'implantation d'un stent en métal nu Le rôle du DCB dans ce segment reste discutable faute de données suffisantes . Selon les limites potentielles à l'obtention d'une perméabilité à long terme, les procédures de revascularisation des artères infrapoplitées doivent être réservées aux patients ayant une indication claire pour un traitement infrapoplité, tels que les patients atteints d'ICM. Chez les patients avec CLI, la revascularisation directe orientée vers l'angiosome semble être bénéfique par rapport à la revascularisation indirecte . Cependant, selon la complexité des lésions, la notion d'angiosome ne peut pas toujours être prise en compte en pratique quotidienne . L'objectif global est de créer un flux direct et droit vers le pied .
Messages clés
- L'indication de revascularisation ainsi que la décision sur les techniques de revascularisation spécifiques doivent être basées sur le stade de l'AOMI, la morphologie de la lésion et le profil de risque individuel des patients
- Une approche « endovasculaire d'abord » est souvent la plus appropriée en fonction de la fragilité des patients atteints d'AOMI avancée ou d'ICM si cela est techniquement faisable
Exposition aux radiations
Les interventionnistes doivent accorder une attention particulière à l'exposition aux rayonnements pendant les procédures de revascularisation vasculaire périphérique, tant pour le patient que pour l'interventionniste. Le degré d'exposition aux rayonnements des interventionnistes dépend de la région anatomique traitée des patients (dose estimée plus élevée de rayonnement diffusé dans les interventions aorto-iliaques), de l'habitus des patients (exposition aux rayonnements plus élevée chez les patients obèses), des temps de fluoroscopie, de l'angulation ainsi que des interventions des intervenants. l'expérience et l'utilisation de vêtements et d'appareils de protection .
Période d'observation en angio-suite
La période d'observation dans la salle d'angio est influencée par de multiples facteurs variant d'un patient à l'autre et des installations/pratiques de l'établissement . Le séjour dans la salle d'angio doit durer jusqu'à ce que l'hémostase au site de ponction soit atteinte et que le patient soit dans un état hémodynamiquement stable. Dans ces circonstances, la surveillance supplémentaire peut également être effectuée dans un service de soins de jour ou dans des options de surveillance comparables qui offrent un contrôle régulier de l'hémodynamique et du site de ponction pour la suite du séjour du patient. Avant le retour à domicile, il doit y avoir une dernière vérification du site de ponction et une brève évaluation de la perfusion générale du membre traité par l'interventionniste.
Message clé
- La surveillance de l'hémodynamique et du site de ponction par du personnel expérimenté au début de la période post-opératoire est obligatoire
Évaluation avant la sortie
Pour évaluer le succès clinique, exclure les complications et idéalement assurer le succès hémodynamique, il est recommandé que des examens ciblés soient effectués avant la sortie des patients après l'angioplastie. Cela devrait inclure un examen physique et une échographie duplex du site d'accès, ainsi que la ou les lésions cibles. L'examen physique doit inclure les pouls périphériques, la palpation abdominale, la sensation et la force motrice des jambes, car les saignements rétropéritonéaux entraînent généralement des douleurs abdominales et des symptômes neurologiques des jambes. Idéalement, un ABI/TBI doit être réalisé pour documenter le succès hémodynamique immédiat et détecter les premiers signes d'échec de la revascularisation, ainsi qu'une échographie duplex de la lésion cible pour documenter le résultat précoce de la lésion cible.
Les complications hémorragiques liées au site d'accès, y compris les hématomes et les faux anévrismes, sont les complications les plus fréquentes . De plus, des complications rares comme la thrombose précoce, la thromboembolie, les dissections sont possibles. Les saignements actifs, les hématomes et les faux anévrismes doivent être traités en premier lieu par une compression manuelle prolongée avec ou sans guidage échographique suivi d'un alitement avec surveillance de l'hémoglobine/hématocrite, des signes vitaux, de la sensation et de la fonction motrice des jambes. L'injection de thrombine guidée par ultrasons est une stratégie sûre et efficace pour fermer les faux anévrismes si l'anatomie s'y prête. Le volume de shunt des fistules AV doit être estimé par échographie. Les petites fistules AV (<500 ml/min) se ferment généralement spontanément, les plus grandes peuvent nécessiter une réparation interventionnelle ou ouverte pour éviter une ischémie de la jambe (vol) ou le développement d'une insuffisance cardiaque à haut débit
Messages clés
- Avant la sortie du patient, un contrôle de l'état physique général et une brève évaluation du succès de la procédure (impulsions de la pédale, échographie du site d'accès et du segment vasculaire traité, ABI) doivent être effectués
- Les complications les plus fréquentes sont les saignements liés au site d'accès ou un faux anévrisme et doivent être traitées avec succès avant la sortie du patient.
Surveillance post-interventionnelle et médication
Considérations pour la surveillance à moyen et à long terme
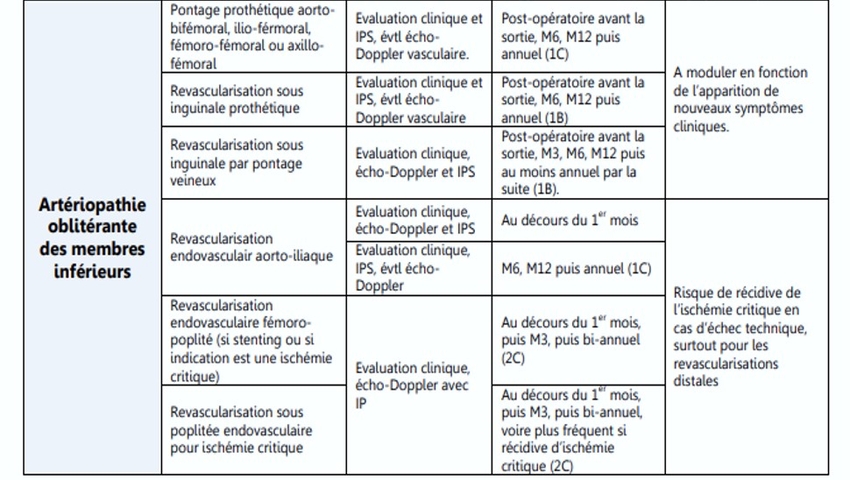
Alors que le taux de succès technique précoce des interventions périphériques en termes de perméabilité angiographique est généralement supérieur à 95 %, l'efficacité/le bénéfice à moyen et à long terme des procédures peut être limité par des complications liées à la procédure, des lésions restantes limitant le débit, une resténose/re- l'occlusion et la progression de la maladie athéroscléreuse. La surveillance post-interventionnelle vise à aborder ces points pour optimiser les résultats, en prévenant à la fois le MALE et le MACE . La fréquence et l'étendue du suivi peuvent différer selon l'indication et le type de revascularisation ainsi que l'état physique du patient. La surveillance doit inclure l'évaluation du site d'accès, de l'ensemble du membre revascularisé ainsi que du membre controlatéral. Un examen physique général et vasculaire, ainsi que des examens vasculaires spécifiques comprenant des tests Duplex et Doppler sont recommandés lors du suivi ( Figure 2 ).
 Commentaire : je rajouterai un suivi tels qu'il a été publié dans l'EJVES, Editor’s Choice e Follow-up of Patients After Revascularisation for Peripheral Arterial Diseases: A Consensus Document From the European Society of Cardiology Working Group on Aorta and Peripheral VascularDiseases and the European Society for Vascular Surgery, Eur J Vasc Endovasc Surg (2019) 58, 641e653
Commentaire : je rajouterai un suivi tels qu'il a été publié dans l'EJVES, Editor’s Choice e Follow-up of Patients After Revascularisation for Peripheral Arterial Diseases: A Consensus Document From the European Society of Cardiology Working Group on Aorta and Peripheral VascularDiseases and the European Society for Vascular Surgery, Eur J Vasc Endovasc Surg (2019) 58, 641e653 Suite : le suivi des patients "dilatés" est protocolisé dans chaque équipe. De plus la pertinence des soins (le choose wisely à la française ) a déterminé en accord avec les société savantes concernées, de réaliser un suivi optimal , pour le bon patient, au bon moment et en tenant compte du profil du patient. Il faut se limiter à l'utile et erradiquer l'inutile, qui n'apporte rien. Si le suivi de base est codifié , le cas par cas existe aussi en fonction de l'état du patient. Attention le suivi post revascularisation endovasculaire ne doit pas se limiter à l'écho-Doppler. Le suivi réalisé par le médecin vasculaire est un suivi CLINQUE et PARACLINIQUE. Il est important de s'assurer que le patient continue de contrôler des FDRCV, qu'il marche, qu'il prend son traitement etc.
Suite : le suivi des patients "dilatés" est protocolisé dans chaque équipe. De plus la pertinence des soins (le choose wisely à la française ) a déterminé en accord avec les société savantes concernées, de réaliser un suivi optimal , pour le bon patient, au bon moment et en tenant compte du profil du patient. Il faut se limiter à l'utile et erradiquer l'inutile, qui n'apporte rien. Si le suivi de base est codifié , le cas par cas existe aussi en fonction de l'état du patient. Attention le suivi post revascularisation endovasculaire ne doit pas se limiter à l'écho-Doppler. Le suivi réalisé par le médecin vasculaire est un suivi CLINQUE et PARACLINIQUE. Il est important de s'assurer que le patient continue de contrôler des FDRCV, qu'il marche, qu'il prend son traitement etc.
 Source : https://cnpmv.fr/
Source : https://cnpmv.fr/La fréquence des examens de suivi dépend de l'état médical et vasculaire individuel du patient. En général, les patients revascularisés doivent être suivis à 2–6 semaines, 3–6 mois, 1 an, puis annuellement pour évaluer la perméabilité vasculaire, détecter la resténose-occlusion et assurer une prise en charge optimale de l'AOMI. Au cours des visites de suivi, le traitement médical est encore ajusté et le besoin continu de DAPT est évalué. En cas d'échec de la revascularisation, une nouvelle procédure peut être planifiée en fonction de la présentation clinique et des besoins cliniques du patient. Les visites de suivi doivent être effectuées par des médecins vasculaires. Toutefois, dans certains systèmes de santé, la surveillance est effectuée par des médecins de premier recours. Néanmoins, en particulier chez les patients souffrant d'ulcères, ceux-ci doivent être vus par un spécialiste vasculaire au moins jusqu'à ce que les plaies soient cicatrisées. C'est un sujet de débat si des tests de diagnostic vasculaire sont nécessaires pendant 6 mois, 1 an et un suivi annuel si les plaies sont cicatrisées et les symptômes résolus. Nous proposons qu'une histoire spécifique en ce qui concerne la réapparition ou de nouveaux symptômes, la médication actuelle et le statut tabagique, un examen physique pour détecter de nouvelles pertes de tissus et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et le glucose, suffisent car cela déclencherait un changement dans la prise en charge. 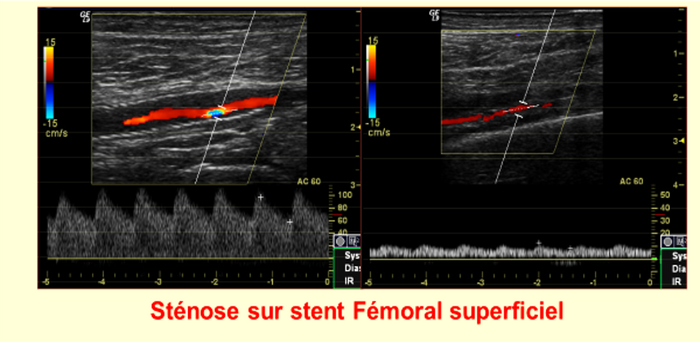
La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif [ C'est un sujet de débat si des tests de diagnostic vasculaire sont nécessaires pendant 6 mois, 1 an et un suivi annuel si les plaies sont cicatrisées et les symptômes résolus. Nous proposons qu'une histoire spécifique en ce qui concerne la réapparition ou de nouveaux symptômes, la médication actuelle et le statut tabagique, un examen physique pour détecter de nouvelles pertes de tissus et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et le glucose, suffisent car cela déclencherait un changement dans la prise en charge.
La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif [ C'est un sujet de débat si des tests de diagnostic vasculaire sont nécessaires pendant 6 mois, 1 an et un suivi annuel si les plaies sont cicatrisées et les symptômes résolus. Nous proposons qu'une histoire spécifique en ce qui concerne la réapparition ou de nouveaux symptômes, la médication actuelle et le statut tabagique, un examen physique pour détecter de nouvelles pertes de tissus et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et le glucose, suffisent car cela déclencherait un changement dans la prise en charge. . La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif [ 1 an et suivis annuels si les plaies sont cicatrisées et les symptômes résolus. Nous proposons qu'une histoire spécifique en ce qui concerne la réapparition ou de nouveaux symptômes, la médication actuelle et le statut tabagique, un examen physique pour détecter de nouvelles pertes de tissus et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et le glucose, suffisent car cela déclencherait un changement dans la prise en charge. . La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif [ 1 an et suivis annuels si les plaies sont cicatrisées et les symptômes résolus. Nous proposons qu'une histoire spécifique en ce qui concerne la réapparition ou de nouveaux symptômes, la médication actuelle et le statut tabagique, un examen physique pour détecter de nouvelles pertes de tissus et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et le glucose, suffisent car cela déclencherait un changement dans la prise en charge. . La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif [ un examen physique pour détecter une nouvelle perte de tissu et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et la glycémie, est suffisant car cela déclencherait un changement de prise en charge. La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif [ un examen physique pour détecter une nouvelle perte de tissu et une évaluation des facteurs de risque, en particulier la pression artérielle, le cholestérol et la glycémie, est suffisant car cela déclencherait un changement de prise en charge. La réapparition ou l'apparition de nouveaux symptômes peuvent déclencher d'autres examens vasculaires tels que l'IPS ou l'imagerie. Pour déterminer une sténose intra-stent > 80 %, combiner un PSV > 275 cm/s et un ratio > 3,5 est hautement spécifique et prédictif . Chez les patients présentant un risque élevé d'amputation, y compris les personnes atteintes de diabète et celles nécessitant une hémodialyse, des intervalles plus courts de 3 à 6 mois peuvent être nécessaires. Alors que la surveillance peut améliorer la détection précoce de l'échec de la revascularisation, l'hyperplasie intimale progressive permettant une réintervention précoce, l'efficacité et le rapport coût-efficacité de tels programmes n'ont pas encore été systématiquement évalués. Cependant, l'AOMI étant une maladie chronique avec des comorbidités sévères fréquentes et une mortalité CV élevée, le suivi des patients est nécessaire pour assurer une prise en charge appropriée de la maladie et une prévention CV secondaire.
Messages clés
- Après la revascularisation, les patients doivent être suivis 2 à 6 semaines, 3 à 6 et 12 mois après la procédure, puis annuellement. Les patients diabétiques et ceux nécessitant une hémodialyse doivent être suivis à des intervalles plus courts de 3 à 6 mois
- Après la revascularisation, les patients présentant des plaies ont également besoin d'une surveillance intensifiée avec une fréquence toutes les 2 à 4 semaines jusqu'à ce que les plaies soient cicatrisées.
- Les visites de suivi doivent être standardisées comprenant des examens vasculaires et une optimisation du traitement médical (pharmacologique et mode de vie)
Stratégie médicamenteuse post-interventionnelle
 In La Check-List de la Médecine Vasculaire, Ed Doin 2020, JP Laroche et P Henneton
In La Check-List de la Médecine Vasculaire, Ed Doin 2020, JP Laroche et P Henneton

Position SFMV : Annals Vasc Surg 2020
Double anti agrégatiopn plaquettaire de 1 mois puis anti agrégation plaquettaire simple, mais discussion conseillée si nécessaire au cas par cas.
Le traitement médical vise la prévention secondaire des événements CV chez les patients atteints d'AOMI symptomatique en général et l'amélioration de la perméabilité après intervention .Il devrait inclure un traitement antithrombotique, une modification des lipides, un contrôle de la pression artérielle et de la glycémie, mais également faciliter l'arrêt du tabac, une alimentation saine, la gestion du poids et l'exercice]. Malheureusement, l'adhésion à un traitement médical optimal fondé sur des données probantes est encore sous-optimale dans cette population de patients . Néanmoins, la thérapie doit être revue et optimisée avant la sortie. Les patients doivent quitter l'hôpital avec un traitement médical optimisé, des instructions sur ce qu'il faut faire en cas de complication et un rendez-vous de suivi dans 2 à 6 semaines. À ce stade, le succès de l'optimisation des médicaments peut être confirmé et potentiellement désamorcé par la DAPT.
Thérapie antithrombotique. Il existe un accord sur le fait que les patients atteints de MAP symptomatique doivent être traités avec un seul médicament antiplaquettaire, de préférence le clopidogrel, ou s'il y a un faible saignement et un risque CV élevé (maladie polyvasculaire), un traitement antithrombotique double avec de l'aspirine et du rivaroxaban à 2,5 mg deux fois par jour ( COMPASS) doit être mis en place pour prévenir les événements cardiovasculaires majeurs et les événements majeurs des membres . Une méta-analyse récente indique qu'un traitement antithrombotique plus intense réduit le risque d'amputation et de revascularisation d'un membre ainsi que d'accident vasculaire cérébral, mais avec une augmentation du risque d'événements hémorragiques . Comme les interventions endovasculaires s'accompagnent de lésions vasculaires, de dénudation endothéliale et d'exposition au facteur tissulaire, les directives thérapeutiques actuelles recommandent une double thérapie antiplaquettaire temporaire pendant 1 à 3 mois après les interventions, suivie d'une désescalade vers une thérapie antiplaquettaire unique avec une préférence pour le clopidogrel par la suite . Les données soutenant la pratique courante de prescrire une double inhibition plaquettaire avec de l'aspirine et du clopidogrel sont rares et sont historiquement basées sur des données d'interventions coronariennes . Il n'y a eu qu'un seul ECR comparant l'aspirine seule à l'aspirine et au clopidogrel après angioplastie du membre inférieur (étude MIRROR) Alors qu'à 6 mois, le taux de revascularisation de la lésion cible était plus faible chez les patients atteints de DAPT, après la désescalade vers une monothérapie à l'aspirine après ce point, le TLR à 12 mois n'était pas significativement différent]. Il convient de noter que 32 % des patients présentaient une résistance au clopidogrel et que le TLR n'était pas le critère d'évaluation principal sur lequel l'étude était alimentée. Cependant, plusieurs études dans le monde réel indiquent que la DAPT post-procédurale temporelle est efficace pour améliorer la perméabilité sans augmenter les saignements . Par exemple, le registre vasculaire national suédois suggère que les sous-groupes de personnes telles que les personnes atteintes de diabète recevant des stents pour CLI peuvent bénéficier d'une double inhibition plaquettaire .Cela peut être dû au taux plus élevé de faible réactivité à l'aspirine, au clopidogrel ou aux deux dans l'AOM Iavec une réactivité plaquettaire élevée sous traitement associée à des événements indésirables majeurs des membres (MALE) . En effet, une réactivité plaquettaire élevée pendant le traitement, y compris la résistance au clopidogrel et à l'aspirine, est fréquente chez les patients atteints d'AOMI et est associée à un pronostic plus défavorable, soutenant indirectement l'efficacité chez les patients ayant une réponse adéquate à la DAPT .
Un régime personnalisé d'inhibition plaquettaire pourrait être la voie à suivre à l'avenir pour prévenir l'échec précoce de la revascularisation dû à la thrombose.
Plus récemment, l'étude VOYAGER PAD a montré que chez les patients atteints d'AOMI, le rivaroxaban à une dose de 2,5 mg deux fois par jour plus de l'aspirine commencé après une revascularisation des membres inférieurs de la région principalement fémoro-poplitée était associé à une incidence modérée mais significativement plus faible du résultat composite d'ischémie aiguë des membres, d'amputation majeure pour causes vasculaires, d'infarctus du myocarde, d'AVC ischémique ou de décès de causes cardiovasculaires que l'aspirine seule (19,9 % vs 17,3 % à 3 ans) .
Cela était principalement dû à une diminution significative de l'ischémie aiguë des membres (6,9 % contre 4,7 %). L'incidence des hémorragies majeures TIMI ne différait pas significativement entre les groupes. L'incidence des hémorragies majeures ISTH était significativement plus élevée avec le rivaroxaban et l'aspirine qu'avec l'aspirine seule (5,9 % vs 4,1 % à 3 ans). Chez la moitié des patients, le clopidogrel a également été administré et une analyse récente a montré que cela n'affectait pas l'efficacité ou la sécurité s'il n'était administré que moins de 30 jours après la procédure index . Pris ensemble, les patients doivent recevoir un traitement anti-thrombotique après revascularisation endovasculaire, soit DAPT pendant 1 à 3 mois, soit DPI à long terme. Le DAPT n'est généralement installé que pendant 1 mois après l'angioplastie, les ballonnets enrobés de médicament ou les stents en métal nu. Les stents à élution médicamenteuse, les recanalisations de segments longs ou les réocclusions peuvent nécessiter une DAPT plus longue pendant au moins 3 mois avec la justification que la réendothélialisation peut prendre plus de temps. Le ticagrélor doit être donné en alternative en cas de résistance au clopidogrel . La DAPT à plus long terme peut avoir des avantages mais comporte un risque hémorragique accru
Le DPI est une alternative actuellement réservée aux patients à faible risque hémorragique et sans contre-indication pouvant être aussi faible que 10%
Réduction du cholestérol. Le traitement par statine a un impact significatif sur le résultat. Une revue systématique complète et une méta-analyse récentes ont étudié l'impact des statines sur la MACCE, y compris les décès toutes causes confondues, les paramètres CV composites, les décès CV, les accidents vasculaires cérébraux et les MALE, y compris l'amputation et l'occlusion/revascularisation du greffon chez les patients atteints de MAP, y compris les patients avec une claudication stable, CLI , et les patients subissant une revascularisation des membres inférieurs .
Un total de 51 études avec 138 060 patients atteints d'AOMI ont été inclus, dont 48 459 (35,1 %) ont été traités avec des statines. L'analyse comprenait 2 essais contrôlés randomisés, 20 études prospectives et 29 études rétrospectives. Dans l'ensemble, 21 624 décès, 4 852 paramètres CV composites, 4 609 décès CV, 860 accidents vasculaires cérébraux et 11 396 événements MALE ont été utilisés pour l'analyse. Les statines ont réduit la mortalité toutes causes confondues de 39 %, les décès CV de 41 %, les paramètres CV composites de 34 %, les AVC ischémiques de 28 %, l'incidence HOMME de 30 % et les amputations de 35 %. Une autre revue systématique et méta-analyse portant sur l'ICM a inclus dix-neuf études incluant 26 985 patients atteints d'ICM . Parmi les patients disposant de données connues sur le statut des statines, 12 292 (49,6 %) étaient sous statines contre 12 513 (50,4 %) non sous statines. Les patients traités avec des statines étaient 25 % moins susceptibles de subir une amputation et 38 % moins susceptibles d'avoir un événement mortel. Le traitement par statine était également associé à des taux de perméabilité globaux accrus et à une incidence plus faible de MACE. Dans l'analyse groupée des sept études qui ont rapporté tout type de perméabilité, les patients traités avec des statines présentaient des taux de perte de perméabilité inférieurs de 20 %. En résumé, tous les patients atteints d'AOMI symptomatique devraient recevoir des statines à la dose tolérable la plus élevée. L'objectif de cholestérol LDL est une diminution d'au moins 50 % ou une valeur absolue de 1,4 mmol/l. L'ézétimibe peut être ajouté pour atteindre cet objectif.
Les inhibiteurs de PCSK9 sont indiqués si les cibles ne peuvent pas être atteintes avec cela
Contrôle de la pression artérielle. Le contrôle optimal de la pression artérielle est la pierre angulaire de la prise en charge de l'AOMI et une méta-analyse confirme que l'abaissement de la pression artérielle peut améliorer la distance de marche . Peu d'études existent qui ont évalué l'effet de la baisse de la pression artérielle spécifiquement sur la mortalité . Un essai récent indique que les interventions en particulier sur les sténoses ou les occlusions limitant le débit proximal peuvent réduire de manière significative la pression artérielle centrale et périphérique . Cela souligne un rôle important potentiel de la revascularisation sur le contrôle de la pression artérielle et justifie que la pression artérielle soit contrôlée avant la sortie et que la médication soit adaptée. L'objectif tensionnel recommandé est de 130 / 80 mmHg.
Contrôle de la glycémie. Plusieurs essais ont démontré qu'une diminution intensive de la glycémie peut réduire les MACE et MALE chez les patients diabétiques. Un mauvais contrôle glycémique péri-interventionnel est associé à une incidence plus élevée de resténose après revascularisation sous-poplitée .
Il a été démontré que de nouveaux médicaments appartenant aux classes d'inhibiteurs du cotransporteur sodium-glucose (SGLT)-2 et d'agonistes des récepteurs du peptide analogue au glucagon (GLP)-1 réduisent les événements cardiovasculaires et la mortalité chez les patients à haut risque atteints de diabète de type 2 . Ces médicaments offrent une vasculoprotection au-delà de leurs effets sur le glucose ou d'autres facteurs de risque cardiovasculaires classiques . Cependant, les avantages relatifs et les risques possibles des inhibiteurs du SGLT-2 et des agonistes du GLP-1 sur l'AOMI ne sont actuellement pas clairs. Un taux accru d'amputation - principalement au niveau des orteils et du métatarse - a été rapporté dans un essai sur la canagliflozine, un inhibiteur du SGLT-2 . Les facteurs de risque d'amputation dans CANVAS comprenaient des antécédents d'amputation, une maladie vasculaire périphérique et une neuropathie . Un avertissement encadré de la Food & Drug Administration sur le risque accru d'amputation des jambes et des pieds imposé en 2017 a été supprimé en 2020 en réponse aux informations de sécurité provenant d'essais cliniques supplémentaires. En annulant l'avertissement encadré, la FDA a déclaré que le risque d'amputation, bien qu'il soit encore accru avec la canagliflozine, était inférieur à celui décrit précédemment, en particulier lorsque les patients étaient surveillés de manière appropriée ( https://www.fda.gov/drugs/drug-safety- et-disponibilité/la-fda-supprime-l'avertissement-encadré-sur-le-risque-d'amputations-de-la-jambe-et-du-pied-diabète-médicament-canagliflozine). L'Agence européenne des médicaments a émis un avertissement de sécurité pour la canagliflozine et le risque d'amputation qui s'étendait à tous les inhibiteurs du SGLT-2, reflétant l'incertitude quant à savoir si le risque accru d'amputation des membres inférieurs avec la canagliflozine constituait un effet de classe . Le Résumé des Caractéristiques du Produit de la canagliflozine indique :
« Dans une [autre] étude clinique à long terme chez des patients atteints de diabète de type 2 et d'insuffisance rénale diabétique [CREDENCE ], aucune différence de risque d'amputation des membres inférieurs n'a été observée chez les patients traités par la canagliflozine 100 mg par rapport au placebo. Dans l'étude [CREDENCE], des mesures de précaution ont été appliquées. Comme un mécanisme sous-jacent n'a pas été établi, les facteurs de risque, à l'exception des facteurs de risque généraux, d'amputation sont inconnus » .
Les données observationnelles suggèrent des réductions de MALE, principalement dues à la réduction des amputations, chez les patients atteints de diabète de type 2 traités avec des agonistes du GLP-1 par rapport aux inhibiteurs de la dipeptidyl peptidase (DPP)-4 .
Exercice physique. Une méta-analyse récente a confirmé que les programmes d'exercices fournissaient des avantages importants par rapport au placebo ou aux soins habituels pour améliorer à la fois la distance de marche sans douleur et la distance de marche maximale chez les personnes souffrant de douleurs aux jambes dues à la claudication et considérées comme aptes à l'intervention d'exercice . L'exercice n'a pas amélioré l'IPS, et il n'y avait aucune preuve d'un effet de l'exercice sur l'amputation ou la mortalité. L'exercice peut améliorer la qualité de vie par rapport à un placebo ou aux soins habituels. Une méta-analyse de 7 essais incluant 987 patients a montré que ceux qui ont suivi une thérapie endovasculaire combinée à un entraînement physique supervisé, par rapport à ceux qui ont suivi un entraînement physique supervisé seul, avaient une distance de marche maximale significativement plus grande, ainsi qu'un risque plus faible de revascularisation ou d'amputation sur un suivi médian de 12,4 mois . Chez les patients souffrant d'ulcères, la décharge est certainement indiquée, interdisant l'entraînement physique impliquant les jambes. L'entraînement à l'ergométrie des bras pourrait être une option. À l'avenir, ces patients pourraient bénéficier de traitements expérimentaux qui imitent l'exercice sans exercer de pression sur les plaies, tels que l'occlusion à distance répétitive ou les bioactifs alimentaires
En résumé, les patients atteints d'AOMI sans perte de tissu nécessitant une décharge ayant subi une revascularisation doivent être inscrits dans un programme d'exercice supervisé et d'arrêt du tabac, si nécessaire, car il existe un avantage supplémentaire en combinaison avec la revascularisation .
Soins des plaies et déchargement. Pour faciliter la cicatrisation des plaies en CLI, des pansements réguliers et un déchargement doivent être organisés .
Messages clé
- Un programme de traitement personnalisé à la sortie est crucial pour le taux de réussite à court et à moyen terme des procédures et le résultat général du patient
- En gardant à l'esprit le risque cardiovasculaire élevé des patients atteints de MAP, un traitement médical optimal des facteurs de risque CV individuels, y compris le contrôle des lipides, un contrôle suffisant de la pression artérielle, de préférence par des IEC ou des ARA et au moins une inhibition antiplaquettaire simple ou une inhibition à double voie, doit être initié et traité pour cibler
- L'arrêt du tabac doit être fortement encouragé et des médicaments appropriés prescrits
- Les interventions sur le mode de vie sont également importantes, en particulier un programme d'exercices supervisés, un contrôle du poids
Attention aux patients chez lesquels l'angioplastie a levé un obstacle avec succés avec la disparition de la claudication.Le patient se dit "guéri" et arrête le traitement médical : NON , la maladie demeure, le traitement médical ne doit jamais être stoppé. Lever un obstacle en regard d'une artère n'a aucun impact sur l'atéhrothrombose.L'observance des traitements, le maintien de la correction des FDCV, l'activité physique permettent d'éviter ou de limiter la récidive.
Questions ouvertes et domaines à développer
- Scores de risque pour les complications du site d'accès local, en particulier en ce qui concerne la voie d'accès, la taille de la gaine, l'âge, le sexe et l'IMC
- Score de risque de complications thrombotiques - degré élevé d'activation des thrombocytes et du système plasmatique, et qui est la meilleure façon d'évaluer l'état d'activation
- Scores de risque de resténose/réocclusion précoce
- Score de risque pour l'évaluation du risque de saignement
- Évaluation et meilleure stratégie de traitement de la maladie veineuse concomitante dans les ulcères mixtes
- Stratégie de médication pré-interventionnelle optimale en fonction de la gravité du cas, en particulier pour le DCB, les stents et en cas de thrombectomie par cathéter planifiée avec une charge thrombotique élevée
- Impact et intervalle de durée optimal du traitement préopératoire aux statines
- Prise en charge antithrombotique personnalisée (inhibition plaquettaire)
- Prise en charge anti-thrombotique pré-procédurale/Post-procédure/Place du rivaroxaban/autres AOD
- Identification des groupes de patients postopératoires optimaux (après une intervention par cathéter) pour le DAPT ou l'inhibition de la double voie avec l'aspirine et le rivaroxaban (2,5 mg BID)
- Impact socio-économique des programmes de surveillance structurés dans différents sous-groupes de patients (différentes ethnies, fumeurs, diabétiques, patients hémodialysés, patients atteints de maladies vasculaires inflammatoires), avec des analyses de rentabilité individuelles
- Stratégies optimales pour la prévention des lésions rénales aiguës associées au contraste
- J'ajouterai l'étude de l'intercation POLLUTION/AOMI, la PERTINENCE des SOINS, l'AOMI chez les femmes.

Or l'AOMI chez la femme existe, elle est potentiellement plus grave que chez l'homme.La revascularisation endovasculaire peut poser des problèmes en cas d'exiguité artérielle avec une tendance spastique
Voici quelques données concernant l'AOMI chez les femmes, document Pr Alessandra Bura Rivière
https://vimeo.com/showcase/7482226/video/682919233




Mais un autre oubli dans les FDRCV : LA POLLUTION
Society for Vascular Medicine
View all recommendations from this societyReleased February 21, 2013
Refrain from percutaneous or surgical revascularization of peripheral artery stenosis in patients without claudication or critical limb ischemia.
Patients without symptoms will not benefit from attempts to improve circulation. No evidence exists to support improving circulation to prevent progression of disease. There is no proven preventive benefit, only symptomatic benefit.
On doir parler simplement de Médecine Vasculaire pratiquée par un médecin vasculaire, spécialité en France depuis 2015 ! La consultation du médecine vasculaire intégre en un temps, la CLINIQUE, la PARACLINIQUE (écho-Doppler), un DIAGNOSTIC; la THERAPEUTIQUE et la programmation d'un SUIVI
« La durée de vie des vérités scientifiques est plus courte que celle des patients »
Sur l'AOMI nous disposons de recommandations, de consensus, de prise de position et de discordances dans les recommandations internationales ! Est-ce bien sérieux ? la multiplication des ces articles est- elle jusitifiée ? NON, faisons simple, avec du bon sens, sans aucune surenchère car a trop vouloir dire la même chose de façon différente, c'est pas l'idéal. Le Médecin plie sous les recommandations en tout genre, à trop vouloir être prolixe on rate la cible, celle de la formation continue des médecins et surtout celle des connaissances qui ne doivent pas s'opposer les unes aux autres...elles doivent se compléter.
A quand des recommandations sur l'AOMI (mais aussi la MTEV) entre l'Europe, la Grande Bretagne, les USA et le Canada, avec une actualisation tous les deux ans .



