“L'espoir est le pilier du monde.” Proverbe Africain
Vikash Jaiswal, Vibhor Agrawal, Song Peng Ang, Marina Saleeb, Angela Ishak, Maha Hameed, Kripa Rajak, Kriti Kalra, Akash Jaiswal, Post-diagnostic statin use and its association with cancer recurrence and mortality in breast cancer patients: a systematic review and meta-analysis, European Heart Journal - Cardiovascular Pharmacotherapy, 2023;, pvad057, https://doi.org/10.1093/ehjcvp/pvad057
Utilisation post-diagnostique des statines et son association avec la récidive du cancer et la mortalité chez les patientes atteintes d'un cancer du sein : une revue systématique et une méta-analyse
Contexte
Les statines sont largement reconnues pour leur application chez les patients souffrant d'hypercholestérolémie afin de réduire la morbidité et la mortalité cardiovasculaires. Plus récemment, leur potentiel à exercer des effets pléiotropes, notamment en empêchant la prolifération des cellules néoplasiques, a attiré une attention considérable. Des études antérieures ont démontré que les statines peuvent atténuer la progression du cancer et les micrométastases. Cependant, les bénéfices des statines dans le cancer du sein ne sont pas concluants.
Objectif
Le but de cette méta-analyse était d'évaluer l'impact de l'utilisation de statines suite à un diagnostic de cancer du sein sur la récidive et la mortalité du cancer du sein.
Méthodes
Nous avons effectué une recherche documentaire systématique à l'aide de PubMed, Embase et Scopus pour les articles pertinents depuis leur création jusqu'au 30 mai 2023. Les rapports de risque (HR) ont été regroupés à l'aide d'un modèle à effets aléatoires. Le principal critère de jugement intéressant était le risque de récidive du cancer du sein. Les critères de jugement secondaires comprenaient la mortalité spécifique au cancer du sein et la mortalité toutes causes confondues.
Résultats
Au total, 15 études portant sur 156 448 patients ont été incluses dans l'analyse finale.
L'âge moyen des patients utilisateurs et non-utilisateurs de statines était respectivement de 64,59 et 59,15 ans.
L'utilisation de statines était associée à une réduction de la récidive du cancer du sein [HR 0,76, intervalle de confiance (IC) à 95 % : 0,67 à 0,87] par rapport aux non-utilisatrices de statines. Cette tendance était similaire chez les utilisateurs de statines lipophiles (HR 0,73, IC à 95 % : 0,63 à 0,85), mais pas chez les utilisateurs de statines hydrophiles (HR 1,17, IC à 95 % : 0,82 à 1,68).
De plus, les utilisatrices de statines présentaient un risque plus faible de mortalité par cancer du sein (HR 0,80, IC à 95 % : 0,66-0,96), mais la mortalité toutes causes confondues (HR 0,82, IC 95 % : 0,66-1,02) était comparable entre les deux groupes de patientes. À l’inverse, les statines lipophiles ont démontré une réduction à la fois de la mortalité toutes causes confondues (HR 0,84, IC à 95 % : 0,75-0,93) et de la mortalité par cancer du sein (HR 0,85, IC à 95 %
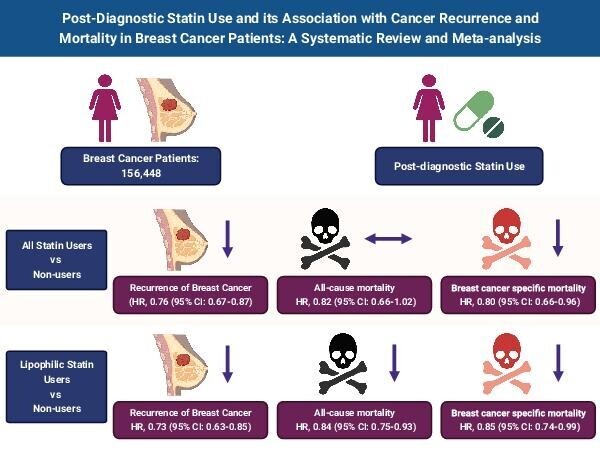
Illustration centrale montrant l’association de l’utilisation de statines après le diagnostic chez les patientes atteintes d’un cancer du sein sur les résultats cliniques. (Figure originale créée par VA & VJ utilisant BioRender.com )
Conclusion
Chez les patientes atteintes d'un cancer du sein, l'utilisation de statines après le diagnostic diminue le risque de récidive du cancer du sein et de mortalité par cancer du sein. De plus, les statines lipophiles présentent un avantage supplémentaire en matière de réduction de la mortalité toutes causes confondues.
Complément d'enquête
1
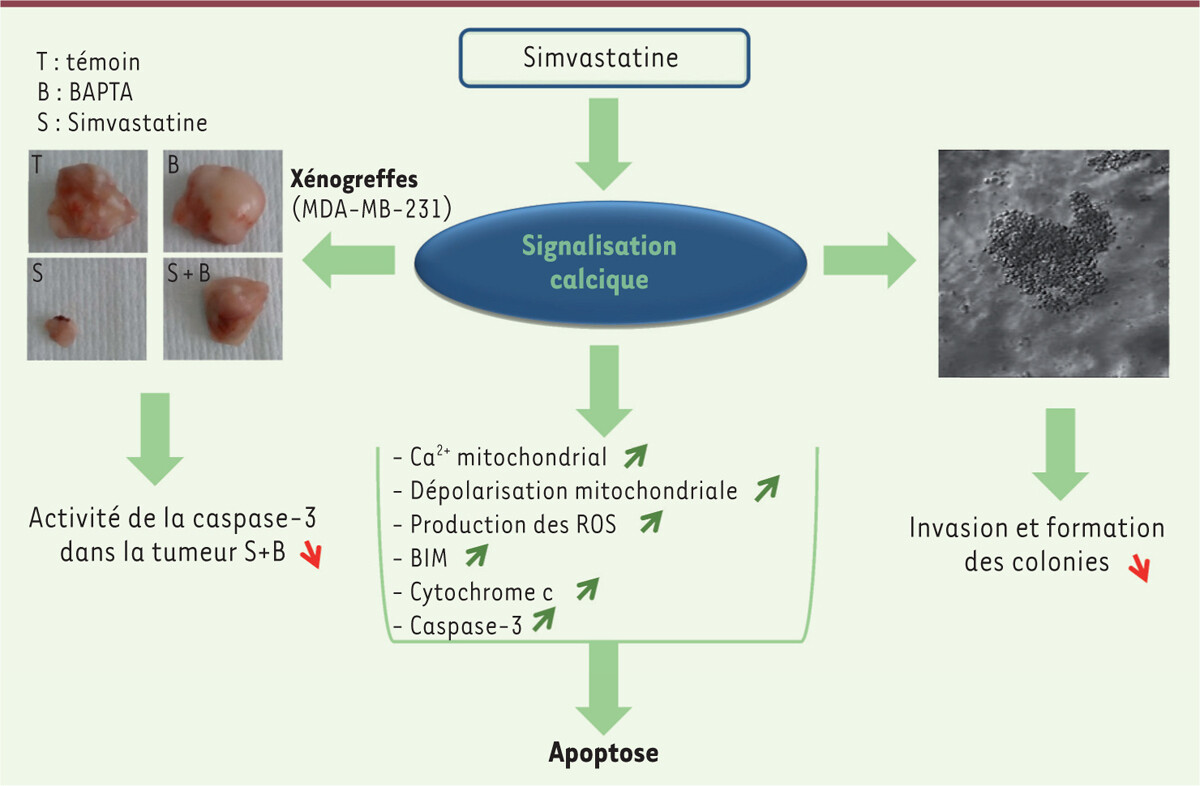 Représentation schématique du mode d’action de la simvastatine dans les cellules tumorales du cancer du sein. Le traitement des cellules tumorales du cancer du sein par la simvastatine provoque une élévation de la concentration cytoplasmique de l’ion Ca2+ via la libération des réserves intracellulaires, à laquelle s’ajoute une entrée de Ca2+ provenant de l’espace extracellulaire impliquant les canaux calciques TRPC1 et TRPC3 [7]. L’augmentation de la concentration cytosolique de Ca2+ induit l’activation de la protéine BIM, une augmentation de la concentration mitochondriale de Ca2+, suivie par une dépolarisation de la membrane mitochondriale et la surproduction de dérivés réactifs de l’oxygène (reactive oxygen species, ROS), qui permet notamment la libération du cytochrome c et l’activation de la caspase-3. L’activation de ces voies de signalisation contrôlées par la concentration cytosolique de Ca2+ est impliquée dans l’apoptose, l’invasion tumorale et la formation des colonies de cellules cancéreuses. Chez les souris porteuses de xénogreffes tumorales, la chélation du Ca2+ intracellulaire par le BAPTA diminue considérablement la capacité de la simvastatine à réduire le volume tumoral. BAPTA : acide aminopolycarboxylique qui fixe le calcium ; MDA-MB-231 : cellules de cancer du sein établies en lignée.
Représentation schématique du mode d’action de la simvastatine dans les cellules tumorales du cancer du sein. Le traitement des cellules tumorales du cancer du sein par la simvastatine provoque une élévation de la concentration cytoplasmique de l’ion Ca2+ via la libération des réserves intracellulaires, à laquelle s’ajoute une entrée de Ca2+ provenant de l’espace extracellulaire impliquant les canaux calciques TRPC1 et TRPC3 [7]. L’augmentation de la concentration cytosolique de Ca2+ induit l’activation de la protéine BIM, une augmentation de la concentration mitochondriale de Ca2+, suivie par une dépolarisation de la membrane mitochondriale et la surproduction de dérivés réactifs de l’oxygène (reactive oxygen species, ROS), qui permet notamment la libération du cytochrome c et l’activation de la caspase-3. L’activation de ces voies de signalisation contrôlées par la concentration cytosolique de Ca2+ est impliquée dans l’apoptose, l’invasion tumorale et la formation des colonies de cellules cancéreuses. Chez les souris porteuses de xénogreffes tumorales, la chélation du Ca2+ intracellulaire par le BAPTA diminue considérablement la capacité de la simvastatine à réduire le volume tumoral. BAPTA : acide aminopolycarboxylique qui fixe le calcium ; MDA-MB-231 : cellules de cancer du sein établies en lignée.Ces résultats indiquent que la combinaison de simvastatine et de doxorubicine pourrait être efficace pour traiter le cancer du sein, notamment son sous-type triple-négatif.
https://www.medecinesciences.org/en/articles/medsci/full_html/2022/07/msc220117/msc220117.html
2
Scott OW, TinTin S, Harborg S, Kuper-Hommel MJJ, Lawrenson R, Elwood JM. Post-diagnostic statin use and breast cancer-specific mortality: a population-based cohort study. Breast Cancer Res Treat. 2023 May;199(1):195-206. doi: 10.1007/s10549-022-06815-w. Epub 2023 Mar 17. PMID: 36930345; PMCID: PMC10147735.
Utilisation de statines après le diagnostic et mortalité spécifique au cancer du sein : une étude de cohorte basée sur la population
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10147735/
Article libre d'accés
Contexte
Dans cette étude, l'utilisation de statines était associée à une diminution statistiquement significative du risque de décès par cancer du sein, les analyses de sous-groupes révélant un effet plus protecteur chez les patientes ER+, les femmes ménopausées et les femmes atteintes d'une maladie à un stade avancé. Des recherches plus approfondies sont nécessaires pour déterminer si ces associations sont reproduites dans d'autres contextes cliniques.
3
Takada K, Kashiwagi S, Iimori N, Kouhashi R, Yabumoto A, Goto W, Asano Y, Tauchi Y, Morisaki T, Ogisawa K, Shibutani M, Tanaka H, Maeda K. Impact of oral statin therapy on clinical outcomes in patients with cT1 breast cancer. BMC Cancer. 2023 Mar 9;23(1):224. doi: 10.1186/s12885-023-10631-w. PMID: 36894884; PMCID: PMC9999569.
Impact du traitement oral par statine sur les résultats cliniques chez les patientes atteintes d'un cancer du sein cT1
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9999569/
lipophilie : l'atorvastatine, la lovastatine et la simvastatine sont plus lipophiles que la fluvastatine ; la pravastatine n'est pas lipophile.

https://slideplayer.fr/amp/520248/
Les statines sont les médicaments hypocholestérolémiants les plus largement prescrits et ont été associées à des résultats à la fois améliorés et inchangés pour le cancer du sein dans des études antérieures. Cette étude examine l'association entre l'utilisation post-diagnostique de statines et les résultats du cancer du sein (décès et récidive) dans un large échantillon représentatif de femmes néo-zélandaises (NZ) atteintes d'un cancer du sein.
Méthodes
Les femmes diagnostiquées avec un premier cancer du sein primitif entre 2007 et 2016 ont été identifiées à partir de quatre registres régionaux du cancer du sein de Nouvelle-Zélande basés sur la population et liées aux données pharmaceutiques nationales, aux sorties d'hôpital et aux dossiers de décès. Des modèles à risque proportionnel de Cox ont été utilisés pour estimer le risque de décès spécifique au cancer du sein (BCD) associé à toute utilisation de statines après le diagnostic.
Les femmes diagnostiquées avec un premier cancer du sein primitif entre 2007 et 2016 ont été identifiées à partir de quatre registres régionaux du cancer du sein de Nouvelle-Zélande basés sur la population et liées aux données pharmaceutiques nationales, aux sorties d'hôpital et aux dossiers de décès. Des modèles à risque proportionnel de Cox ont été utilisés pour estimer le risque de décès spécifique au cancer du sein (BCD) associé à toute utilisation de statines après le diagnostic.
Résultats
Sur les 14 976 femmes incluses dans les analyses, 27 % ont utilisé une statine après le diagnostic et la durée médiane de suivi était de 4,51 ans. L'utilisation de statines (par rapport à la non-utilisation) était associée à une diminution statistiquement significative du risque de BCD (rapport de risque ajusté : 0,74 ; 0,63 à 0,86). L'association a été atténuée lorsque l'on considère un sous-groupe de « nouveaux » utilisateurs de statines (HR : 0,91 ; 0,69-1,19), cependant d'autres analyses ont révélé que l'effet protecteur des statines était plus prononcé chez les patients positifs aux récepteurs des œstrogènes (HR : 0,77 ; 0,63-0,94). ), les femmes ménopausées (HR : 0,74 ; 0,63-0,88) et chez les femmes atteintes d'une maladie à un stade avancé (HR : 0,65 ; 0,49-0,84).
Sur les 14 976 femmes incluses dans les analyses, 27 % ont utilisé une statine après le diagnostic et la durée médiane de suivi était de 4,51 ans. L'utilisation de statines (par rapport à la non-utilisation) était associée à une diminution statistiquement significative du risque de BCD (rapport de risque ajusté : 0,74 ; 0,63 à 0,86). L'association a été atténuée lorsque l'on considère un sous-groupe de « nouveaux » utilisateurs de statines (HR : 0,91 ; 0,69-1,19), cependant d'autres analyses ont révélé que l'effet protecteur des statines était plus prononcé chez les patients positifs aux récepteurs des œstrogènes (HR : 0,77 ; 0,63-0,94). ), les femmes ménopausées (HR : 0,74 ; 0,63-0,88) et chez les femmes atteintes d'une maladie à un stade avancé (HR : 0,65 ; 0,49-0,84).

Conclusion
Dans cette étude, l'utilisation de statines était associée à une diminution statistiquement significative du risque de décès par cancer du sein, les analyses de sous-groupes révélant un effet plus protecteur chez les patientes ER+, les femmes ménopausées et les femmes atteintes d'une maladie à un stade avancé. Des recherches plus approfondies sont nécessaires pour déterminer si ces associations sont reproduites dans d'autres contextes cliniques.
3
Takada K, Kashiwagi S, Iimori N, Kouhashi R, Yabumoto A, Goto W, Asano Y, Tauchi Y, Morisaki T, Ogisawa K, Shibutani M, Tanaka H, Maeda K. Impact of oral statin therapy on clinical outcomes in patients with cT1 breast cancer. BMC Cancer. 2023 Mar 9;23(1):224. doi: 10.1186/s12885-023-10631-w. PMID: 36894884; PMCID: PMC9999569.
Impact du traitement oral par statine sur les résultats cliniques chez les patientes atteintes d'un cancer du sein cT1
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9999569/
Article libre d'accés
Une méta-analyse précédente examinant la relation entre l'utilisation des statines et le cancer du sein a révélé que l'effet inhibiteur des statines sur le cancer du sein pourrait être plus prononcé dans les cas à un stade précoce. Dans cette étude, nous avions pour objectif d'étudier les effets du traitement de l'hyperlipidémie au moment du diagnostic du cancer du sein et d'examiner sa corrélation avec les métastases aux ganglions lymphatiques axillaires chez les patientes atteintes d'un cancer du sein dit cT1 dont la lésion primaire mesurait 2 cm ou moins et était pathologiquement évalué par biopsie du ganglion sentinelle ou dissection du ganglion lymphatique axillaire. Nous avons également étudié les effets des médicaments hyperlipidémiants sur le pronostic des patientes atteintes d'un cancer du sein à un stade précoce.
Après avoir exclu les cas ne répondant pas aux critères, nous avons analysé les données de 719 patientes ayant reçu un diagnostic de cancer du sein, présentant une lésion primaire de 2 cm ou moins identifiée par imagerie préopératoire et ayant subi une intervention chirurgicale sans chimiothérapie préopératoire.
Concernant les médicaments contre l'hyperlipidémie, aucune corrélation n'a été trouvée entre l'utilisation de statines et les métastases ganglionnaires ( p = 0,226), bien qu'une corrélation ait été trouvée entre l'utilisation de statines lipophiles et les métastases ganglionnaires ( p = 0,042). De plus, les périodes de survie sans maladie ont été prolongées après le traitement de l'hyperlipidémie ( p = 0,047, risque relatif : 0,399) et l'administration de statines ( p = 0,028, risque relatif : 0,328).
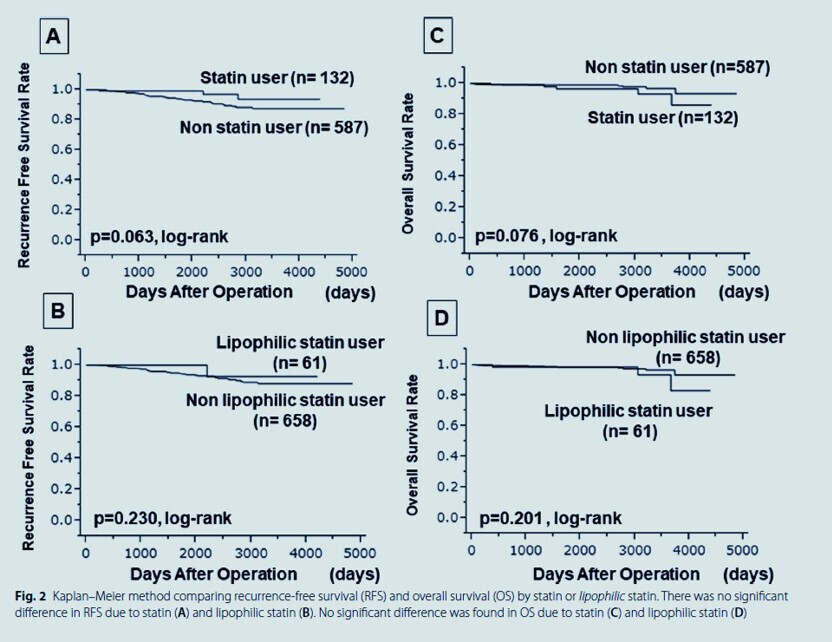
Dans le cancer du sein cT1, les résultats suggèrent que le traitement par statine par voie orale pourrait contribuer à des résultats favorables.
But
Une méta-analyse précédente examinant la relation entre l'utilisation des statines et le cancer du sein a révélé que l'effet inhibiteur des statines sur le cancer du sein pourrait être plus prononcé dans les cas à un stade précoce. Dans cette étude, nous avions pour objectif d'étudier les effets du traitement de l'hyperlipidémie au moment du diagnostic du cancer du sein et d'examiner sa corrélation avec les métastases aux ganglions lymphatiques axillaires chez les patientes atteintes d'un cancer du sein dit cT1 dont la lésion primaire mesurait 2 cm ou moins et était pathologiquement évalué par biopsie du ganglion sentinelle ou dissection du ganglion lymphatique axillaire. Nous avons également étudié les effets des médicaments hyperlipidémiants sur le pronostic des patientes atteintes d'un cancer du sein à un stade précoce.
Méthodes
Après avoir exclu les cas ne répondant pas aux critères, nous avons analysé les données de 719 patientes ayant reçu un diagnostic de cancer du sein, présentant une lésion primaire de 2 cm ou moins identifiée par imagerie préopératoire et ayant subi une intervention chirurgicale sans chimiothérapie préopératoire.
Résultats
Concernant les médicaments contre l'hyperlipidémie, aucune corrélation n'a été trouvée entre l'utilisation de statines et les métastases ganglionnaires ( p = 0,226), bien qu'une corrélation ait été trouvée entre l'utilisation de statines lipophiles et les métastases ganglionnaires ( p = 0,042). De plus, les périodes de survie sans maladie ont été prolongées après le traitement de l'hyperlipidémie ( p = 0,047, risque relatif : 0,399) et l'administration de statines ( p = 0,028, risque relatif : 0,328).

Conclusion
Dans le cancer du sein cT1, les résultats suggèrent que le traitement par statine par voie orale pourrait contribuer à des résultats favorables.
Compléments d'informations
lipophilie : l'atorvastatine, la lovastatine et la simvastatine sont plus lipophiles que la fluvastatine ; la pravastatine n'est pas lipophile.

https://slideplayer.fr/amp/520248/

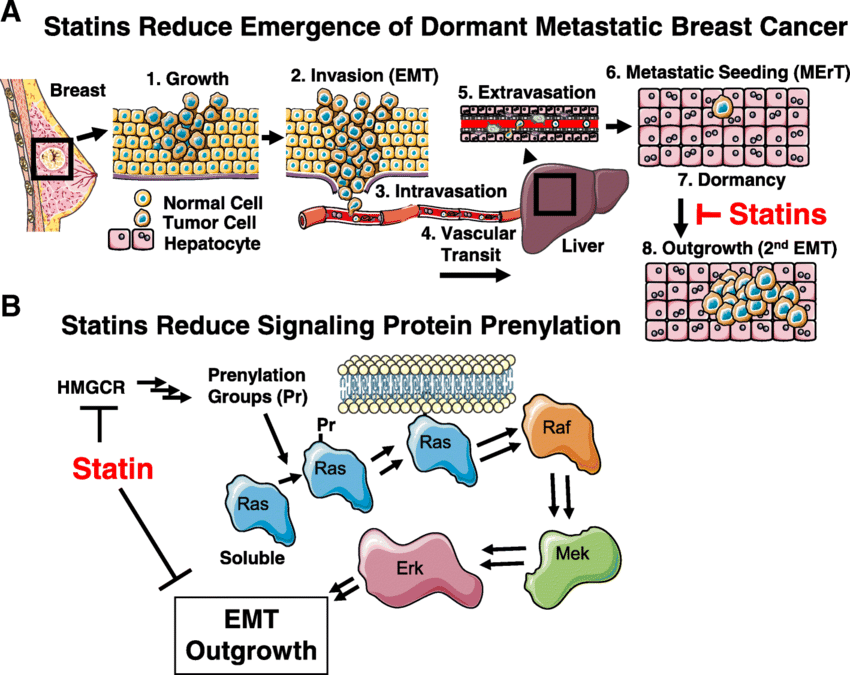
Modèle proposé pour l’action des statines dans le cancer du sein. a La cascade métastatique du cancer du sein. Les statines (rouges) bloquent l’émergence des cellules dormantes du cancer du sein au niveau du site de micrométastase pour empêcher leur émergence et former des métastases cliniquement évidentes. b Les statines (rouges) bloquent l'HMG-CoA réductase (HMGCR) pour diminuer le nombre de groupes de prénylation (Pr), tels que le farnésyl pyrophosphate et le géranylgéranyl pyrophosphate, disponibles pour la prénylation des petites protéines G, telles que Ras (illustré), Rac et RhoA. . La diminution de la prénylation réduit l'attachement membranaire de ces protéines G, ce qui réduit la signalisation proliférative et pro-EMT en aval. Dessin réalisé à partir d'images de Servier Medical Art
https://www.researchgate.net/figure/Proposed-model-for-statin-action-in-breast-cancer-a-The-breast-cancer-metastatic_fig2_329083183
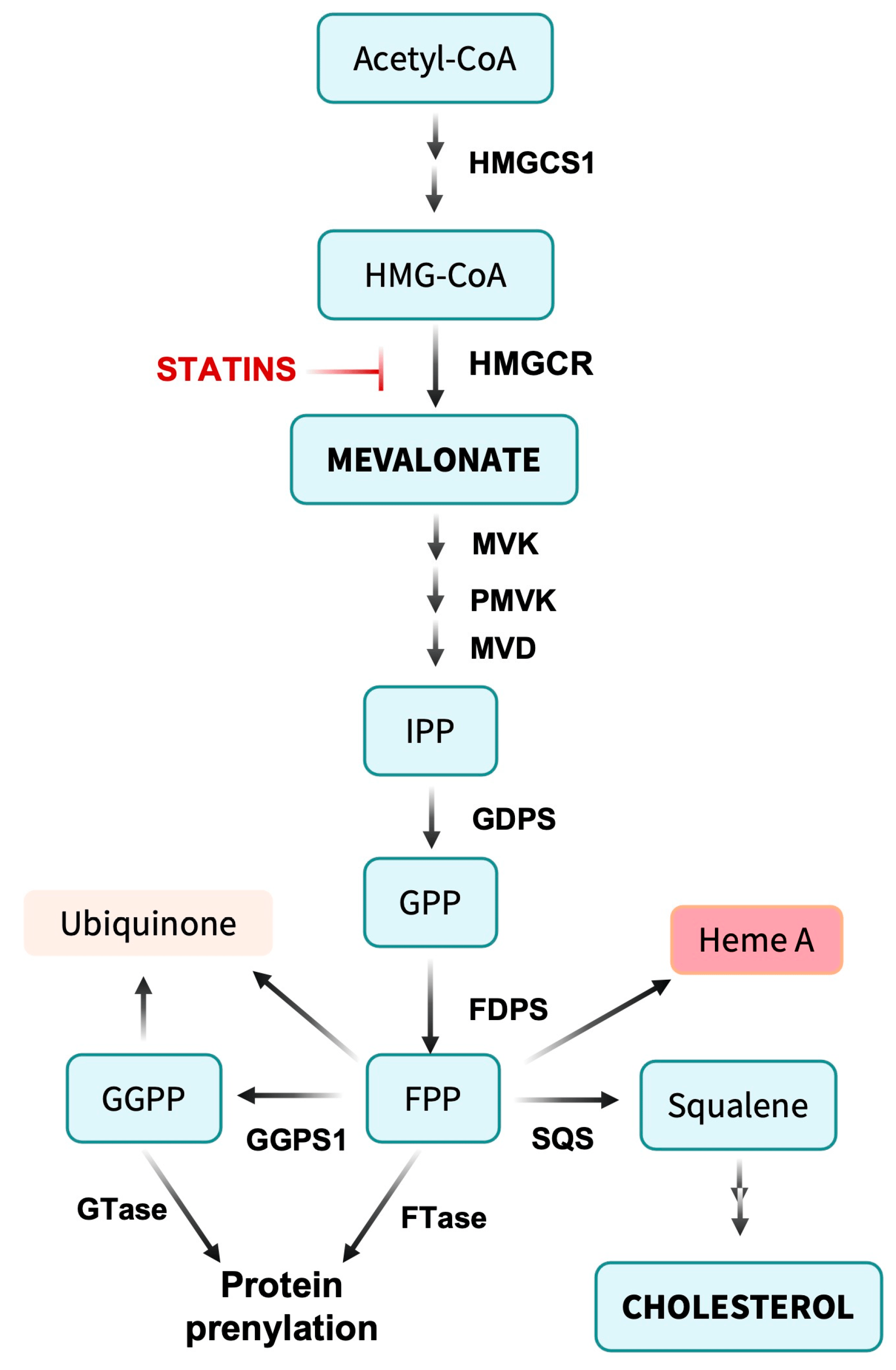
Aperçu de la voie du mévalonate. L'acétyl-CoA est condensé pour former le 3-hydroxy-3-méthylglutaryl-CoA (HMG-CoA). L'étape limitante de la voie implique la conversion de l'HMG-CoA en mévalonate par l'HMG-CoA réductase (HMGCR). Le mévalonate subit un métabolisme ultérieur par la mévalonate kinase (MVK), la phosphomévalonate kinase (PMVK) et la mévalonate décarboxylase (MVD) pour produire du pyrophosphate d'isopentényle (IPP). L'IPP est converti en farnésyl pyrophosphate (FPP) par la farnésyl diphosphate synthase (FDPS) et en géranyl géranyl pyrophosphate (GGPP) par la géranyl géranyl diphosphate synthase (GGPPS1), fournissant des intermédiaires pour la prénylation des protéines. Alternativement, deux molécules FPP sont liées par la squalène synthase (SQS) pour former le squalène isoprénoïde C30, un précurseur limitant la synthèse du cholestérol. Le FPP peut être directement ajouté aux biomolécules lors de la formation de l'ubiquinone (coenzyme Q10) et de l'hème A de la cytochrome c oxydase, soutenant le métabolisme mitochondrial. Les voies allant de l’IPP à l’isopenténylation de l’ARNt ne sont pas représentées.

Aperçu de la voie du mévalonate. L'acétyl-CoA est condensé pour former le 3-hydroxy-3-méthylglutaryl-CoA (HMG-CoA). L'étape limitante de la voie implique la conversion de l'HMG-CoA en mévalonate par l'HMG-CoA réductase (HMGCR). Le mévalonate subit un métabolisme ultérieur par la mévalonate kinase (MVK), la phosphomévalonate kinase (PMVK) et la mévalonate décarboxylase (MVD) pour produire du pyrophosphate d'isopentényle (IPP). L'IPP est converti en farnésyl pyrophosphate (FPP) par la farnésyl diphosphate synthase (FDPS) et en géranyl géranyl pyrophosphate (GGPP) par la géranyl géranyl diphosphate synthase (GGPPS1), fournissant des intermédiaires pour la prénylation des protéines. Alternativement, deux molécules FPP sont liées par la squalène synthase (SQS) pour former le squalène isoprénoïde C30, un précurseur limitant la synthèse du cholestérol. Le FPP peut être directement ajouté aux biomolécules lors de la formation de l'ubiquinone (coenzyme Q10) et de l'hème A de la cytochrome c oxydase, soutenant le métabolisme mitochondrial. Les voies allant de l’IPP à l’isopenténylation de l’ARNt ne sont pas représentées.
https://www.mdpi.com/2072-6694/15/15/3948
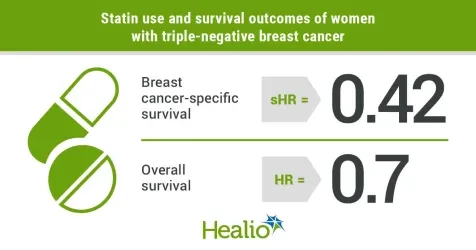 https://www.healio.com/news/hematology-oncology/20210915/statins-may-extend-survival-for-certain-women-with-triplenegative-breast-cancer
https://www.healio.com/news/hematology-oncology/20210915/statins-may-extend-survival-for-certain-women-with-triplenegative-breast-cancerCommentaire
Une nouvelle voie pour le tritement du cancer du sein ?
A préciser rapidement .

