
François Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire

Medical Management and Revascularization for Asymptomatic Carotid Stenosis. Brott T.G., Howard G., Lal B.K. et al, for the CREST-2 Investigators. The New England Journal of Medicine January 15, 2026
Managing Asymptomatic Carotid Stenosis. Editorial. Brown M.M., Bonati L.H. The New England Journal of Medicine, January 15, 2026
Le traitement médical intensif/optimal (TMO) de prévention des complications de l’athérosclérose est devenu la base du traitement des sténoses carotides extracrâniennes (bifurcation carotide et/ou origine de la carotide interne, Saci). La question est de savoir si la chirurgie carotide (en règle
endartériectomie, EAC) ou le stenting carotidien apporte un plus par rapport au TMO seul.
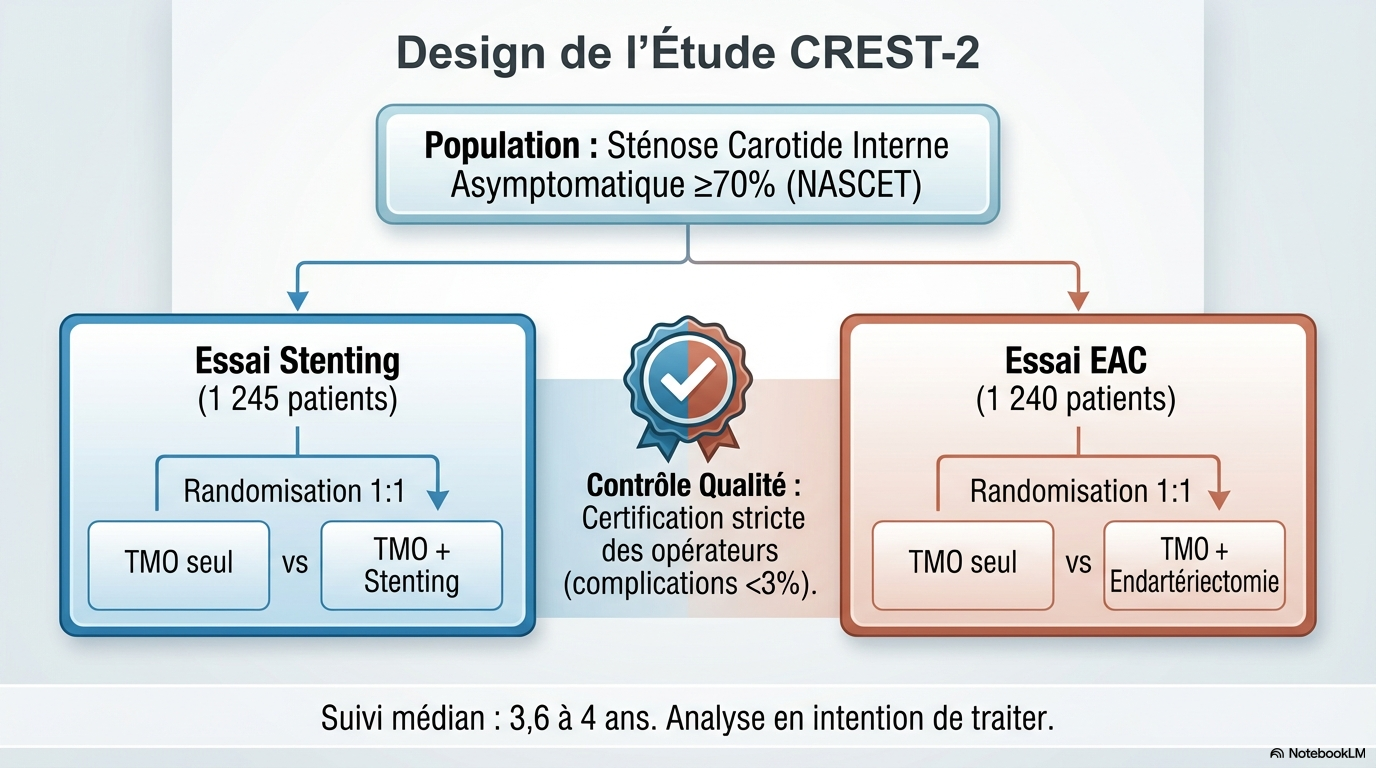
1245 patients ont été randomisés soit TMO soit TMO + stenting carotidien (essai « Stenting »)
1240 patients ont été randomisés soit TMO soit TMO + endartériectomie carotide (essai « EAC »).
L’étude a été menée dans 155 centres en Australie, au Canada, en Israel, en Espagne et aux USA.
Les opérateurs (chirurgie, pose de stent) devaient avoir été certifiés selon une procédure stricte validée (Les praticiens interventionnels ont soumis leurs cas d'angioplastie carotidienne des 12 mois précédents, voire plus en fonction des résultats. Les chirurgiens ont soumis leurs 50 derniers cas consécutifs et devaient justifier d'un taux d'AVC et de mortalité péri-interventionnels inférieur à 3 %).
Protocole
Les patients étaient éligibles s’ils avaient une Saci supérieure ou égale à 70% NASCET et s’ils étaient
totalement asymptomatiques neurovasculaires ou s’ils n’avaient pas d’antécédent d’AVC, d’AIT ou de CMOT dans le territoire de cette carotide dans les 180 jours précédents.
Les critères ultrasoniques de Saci ≥ 70% NASCET étaient : PSV ≥ 230 cm/sec et au moins l’un des critères suivants EDV ≥ 100 cm/sec ou SVR ≥ 4. L’angiographie n’était pas indispensable, il pouvait s’agir d’un angio-CT, d’une angio-MR ou d’une artériographie par cathéter confirmant la sténose ≥ 70% NASCET.
Critères d’exclusion.
Patients avec antécédent d’AVC invalidant, avec angor instable, avec FA sous anticoagulant.
Traitement médical intensif/optimal.
Le protocole de prise en charge médicale était identique pour tous les patients, à l'exception de la période d'utilisation d'antiagrégants plaquettaires avant et après la pose d'un stent carotidien ou
l'endartériectomie carotidienne.
Les objectifs principaux étaient : pression artérielle systolique inférieure à 130 mmHg (l'objectif initial de < 140 mmHg a été abaissé en 2018 suite à la modification des recommandations) et un cholestérol LDL inférieur à 70 mg/dL (1,80 mmol/L).
La glycémie, l’HbA1c, le tabagisme, le poids et l’activité physique devaient être contrôlés au mieux sous surveillance d’un coach santé. Si nécessaire, la prise en charge des médicaments était assurée par l’étude.
Interventions.
Le stenting carotidien était réalisé sous anesthésie locale par voie fémorale, avec protection embolique (NB le stenting par voie transcarotide s’est répandu à la moitié des inclusions et n’a pas pu être retenu). 48h avant la procédure, le patient recevait 325 mg d’Aspirine /j. et 75 mg de Clopidogrel 2 fois /j. Dans le mois postprocédure, il recevait 75 mg de clopidogrel et 75 à 325 mg d’Aspirine / jour. Par la suite, il recevait 70 à 325 mg d’Aspirine / jour.
Les patients du bras endartériectomie recevait 325 mg d’Aspirine / j. 48h avant l’intervention et par la suite 70 à 325 mg d’Aspirine / j.
Suivi.
Les patients ont été suivis à 12h, 36h et 44 j. post-procédure, puis à 4 mois, 8 mois et 12 mois puis tous les 6 mois jusqu’à 48 mois. Il s’agissait d’un suivi clinique appuyé sur un questionnaire, le score de Rankin modifié et l’échelle NIHSS. Un écho-Doppler devait être réalisé annuellement. Une imagerie cérébrale était réalisée en cas d’aggravation. Une angiographie carotidienne pouvait également être réalisée (CTA ou MRA). Ce suivi paraclinique a été perturbé durant la pandémie de Covid Les derniers patients inclus n’ont été suivis que 1 an.
Critères de jugement.
Le critère principal était un critère composite à 4 ans incluant tout AVC (ischémique ou hémorragique) ou décès durant la période allant de la randomisation à 44 jours (période péri-interventionnelle), ou un AVC ischémique ipsilatéral durant la période de suivi restante de j45 jusqu’à 4 ans (période post-interventionnelle).
Les critères secondaires incluaient schématiquement tout type d’accident cérébral ischémique ou
hémorragique, clinique ou découvert en imagerie cérébrale, associé ou non au critère principal.
A l’inverse des patients et des médecins traitants, le comité d’adjudication était en aveugle des
traitements attribués.
Population étudiée.
Le recrutement a été similaire dans les deux essais
1245 patients dans l’essai « stenting », 1 re inclusion le 10/12/2014, dernier suivi le 31/0/2025, suivi médian 3.6 ans (IQR : 1.6 – 4.0). 616 patients dans le bras Stenting + TMO, 629 dans le bras TMO.
1240 patients dans l’essai « EAC », 1 ère inclusion le 09/12/2014, dernier suivi le 30/09/2024, suivi
médian 4.0 ans (IQR : 2.0 – 4.0). 617 patients dans le bras EAC + TMO, 623 dans le bras TMO.
Les cohortes dans les deux essais étaient similaires au plan des données générales (âge moyen 70 ans, 63%H et 37%F) et des facteurs de risque, ces profils étant eux-mêmes similaires à ceux des patients porteurs de Saci asymptomatique.
Comme souvent, un nombre relativement important de patients n’ont pas eu le traitement alloué : 282 / 2485 = 11% (Cf Figures S1a et S1B in Supplément)
* dans l’essai « Stenting », 106 patients assignés au bras TMO (17%) ont une revascularisation (78
Stenting, 28 EAC) et 41 patients assignés au bras Stenting + TMO (7%) n’ont pas eu de
revascularisation pour diverses raisons.
* dans l’essai « EAC », 111 patients assignés au bras TMO (18%) ont eu une revascularisation (94 EAC, 17 stenting) et 24 patients assignés au bras TMO + EAC (4%) n’ont pas eu d’endartériectomie mais le TMO seul (n=22) ou un stenting (n=2).
L’usage d’antiplaquettaire ou d’anticoagulant a été similaire dans les 4 groupes de traitement.
Aucun patient n’a été exclu de l’analyse finale.
Critère principal de jugement.
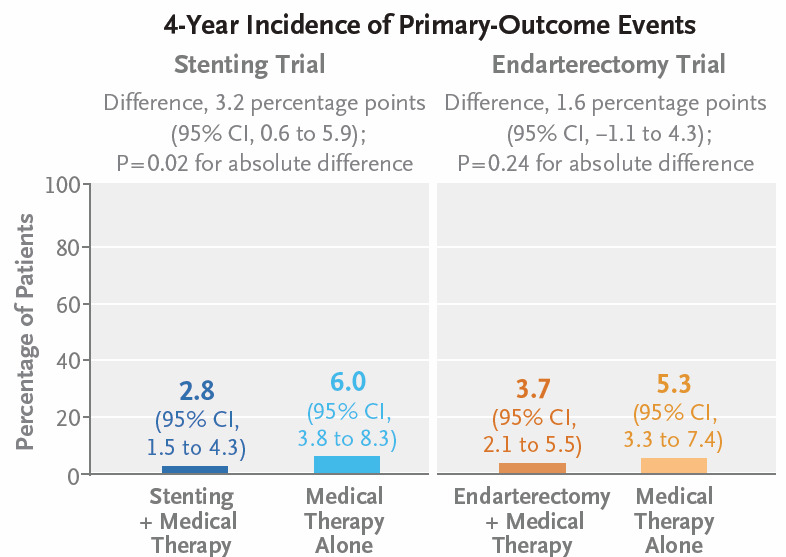
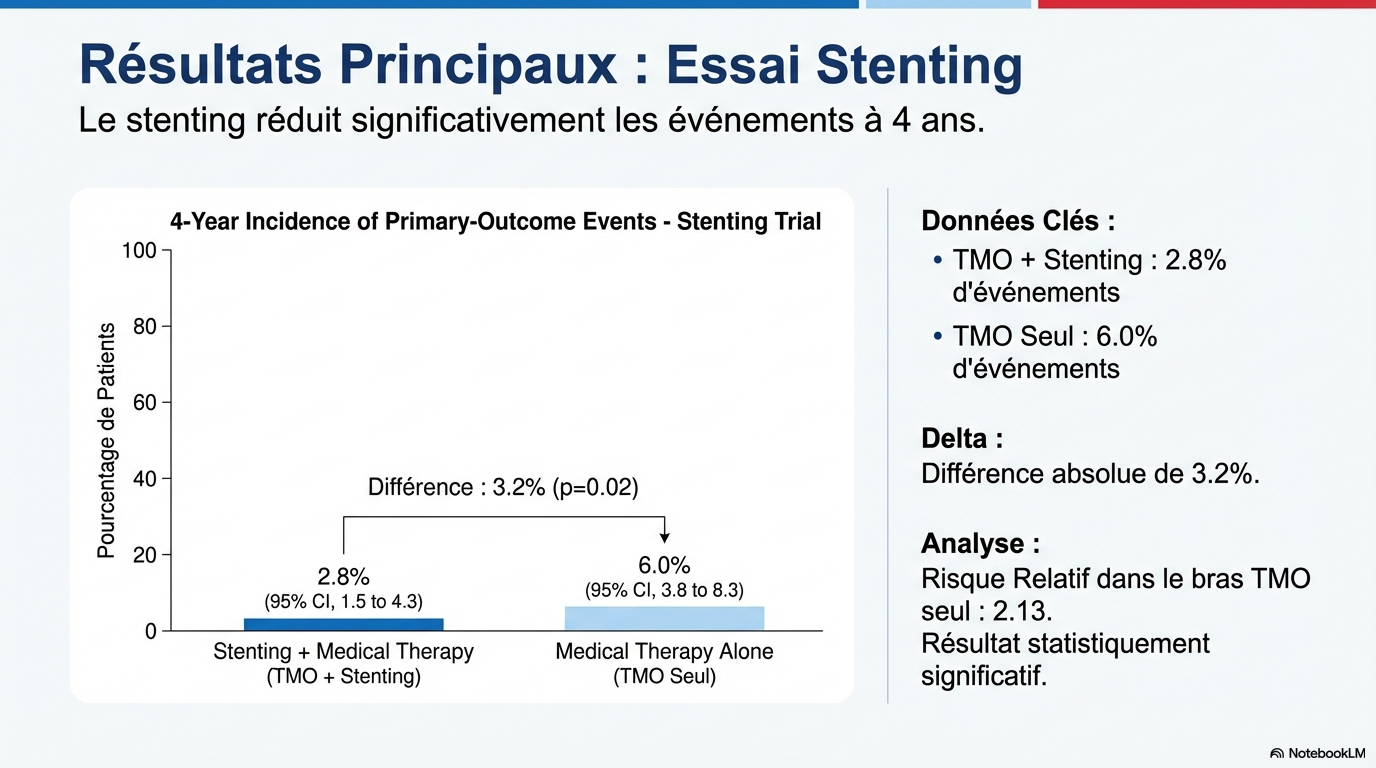
1- Essai « Stenting », le taux d’événements à 4 ans a été de 6% (95 % IC : 3,8–8,3) dans le bras TMO seul et 2.8% (95 % IC : 1,5–4,3) dans le bras Stenting + TMO. La différence de risque absolue était donc de 3.2% (95 % IC : 0.6 – 5.9, p = 0.02) et le risque relatif dans le bras TMO seul était de 2.13 (95 % IC 1,15 – 4,39) par rapport au bras Stenting + TMO. La différence est significative.
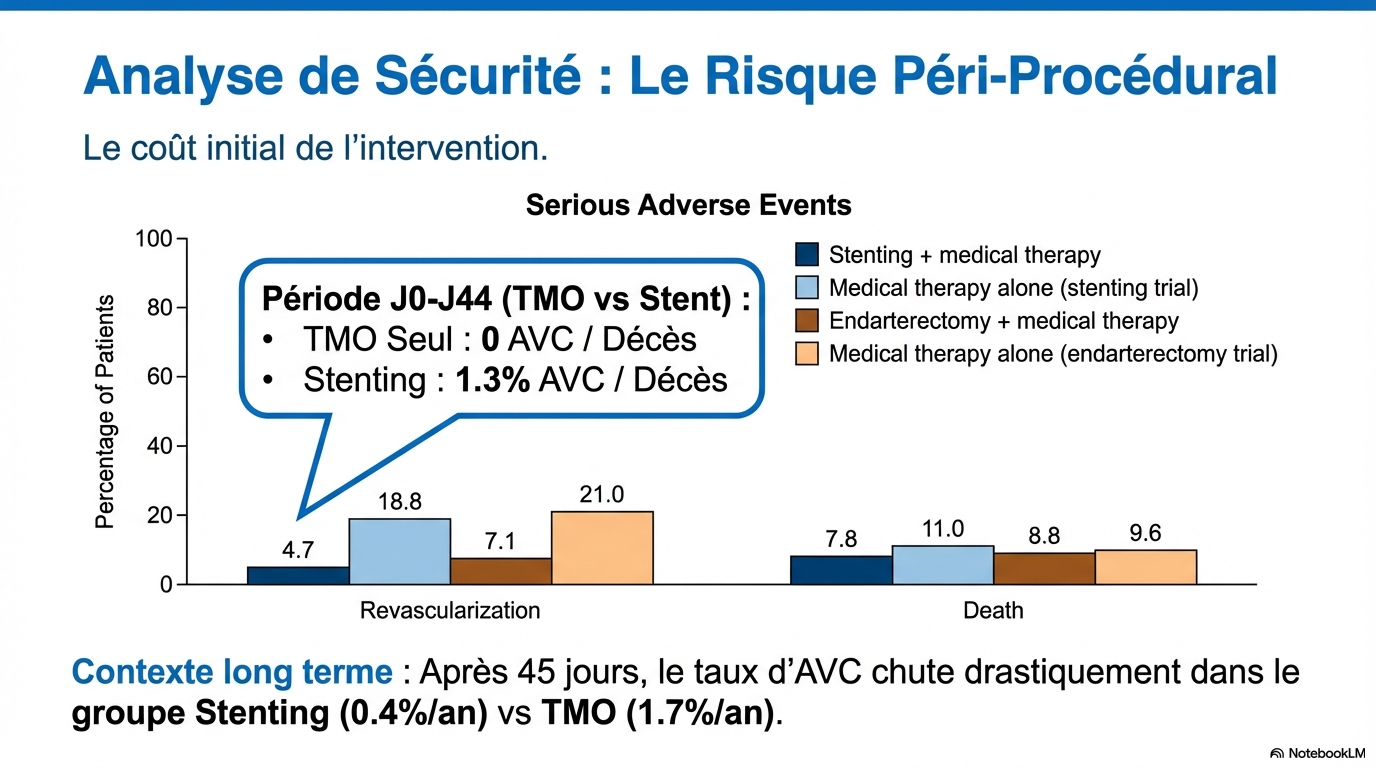
Entre j0 et j44, il n’y eut ni AVC ni décès dans le bras TMO seul alors qu’il y a eu 7 AVC et 1 décès dans le bras Stenting + TMO. (1.3%, 95%IC 0.6 – 2.5).
Ultérieurement dans le bras TMO seul, 28 AVC homolatéraux sont survenus chez 600 patients (1686
patient-années) soit un taux annuel de 1,7 % (95 % IC : 1.1 – 2.4) ; dans le bras Stenting + TMO 7 AVC
homolatéraux sont survenus chez 582 patients (1714 patient-années) soit un taux annuel de 0.4%
(95 % IC : 0,2 – 0,9). Le risque relatif d’AVC ipsilatéral était donc de 4,07 (95 % IC : 1.78 – 9,31) dans le bras TMO seul.
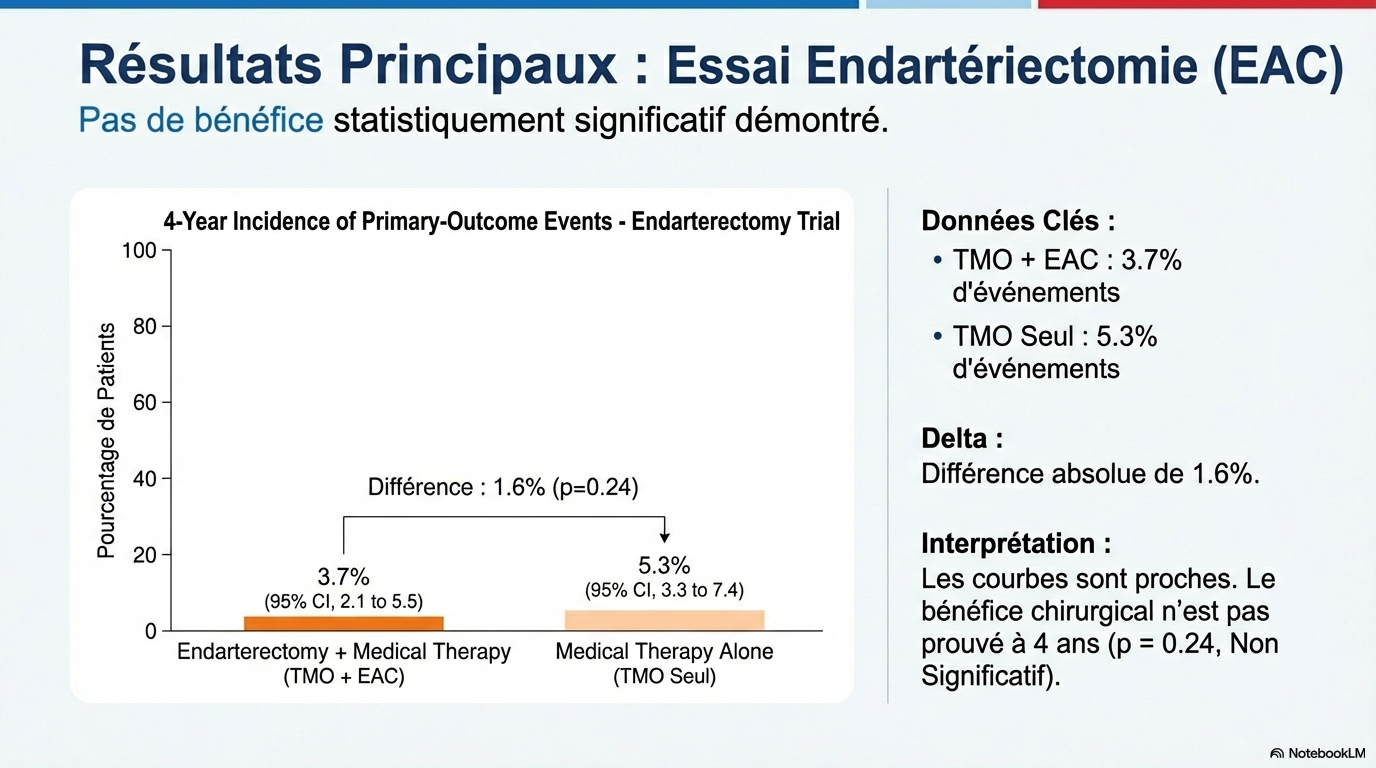
2- Essai « EAC », le taux d’événements à 4 ans a été de 5.3% (95 % IC : 3,3–7,4) dans le bras TMO seul et de 3,7 % (95 % IC : 2,1–5,5) dans le bras EAC + TMO. La différence de risque absolue était donc de 1.6%
(95 % IC : -1.1 – 4.3, p = 0.24) et le risque relatif dans le bras TMO seul était de 1.43 (95%IC : 0.78 – 2.72) par rapport au bras EAC + TMO. La différence n’est pas significative.
Ultérieurement dans le bras TMO seul, 23 AVC homolatéraux sont survenus chez 600 patients (1761
patient-années) soit un taux annuel de 1.3% (95%IC : 0.9 – 2.0) ; dans le bras EAC + TMO 10 AVC
homolatéraux sont survenus chez 596 patients (1823 patient-années) soit un taux annuel de 0.5%
(95 % IC : 0,3 – 1,0). Le risque relatif d’AVC ipsilatéral était donc de 2.38 (95 % IC : 1,13 – 5,0) dans le bras TMO seul.
Limites, Editorial, Point de vue.
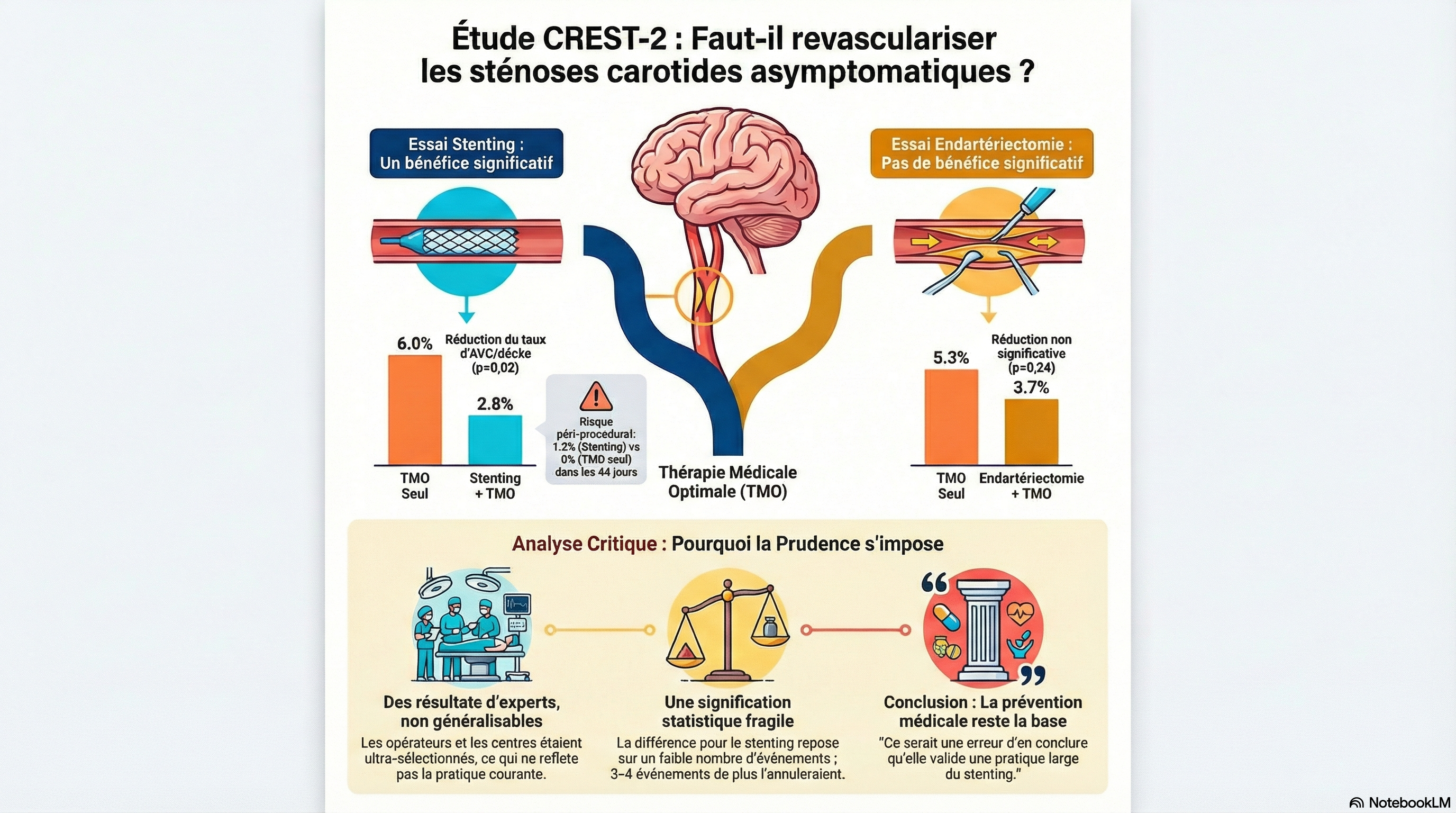
Ceux qui ne liront que le résumé de l’article en particulier la conclusion, ou ceux qui ne regarderont que l’infographie du research summary retiendront que pour le patient porteur d’une sténose carotidienne asymptomatique de haut grade (≥ 70%) le traitement médical optimal c’est bien mais ça ne suffit pas, que l’ajout d’une endartériectomie carotidienne n’apporte rien de plus alors que le stenting carotidien associé au TMO apporte un bénéfice en termes de réduction du risque d’AVC ipsilatéral (cf infra).

- Le faible taux d’AVC associé à la pose de stent reflète une sélection rigoureuse des patients et
l’action d’opérateurs de haut niveau qui ne sont pas présents dans tous les centres vasculaires. Les résultats du bras Stenting + TMO de CREST-2 ne reflètent sans doute pas la réalité de terrain. - La différence entre pose de stent + TMO et TMO seul repose sur un faible nombre d'événements ;
les auteurs indiquent que si seulement 3 ou 4 événements supplémentaires étaient survenus dans le groupe stenting, la différence ne serait plus significative. L'analyse des taux cumulés d'événements dans les quatre groupes de l'étude CREST-2 révèle davantage de similitudes que de différences entre EAC et Stenting. - Le traitement médical pourrait être intensifié et la prévention cardiovasculaire pharmacologique et via l’activité physique ont évolué en puissance comme le reconnaissent les auteurs. Lors du suivi de l'étude CREST-2, seuls 60 à 70 % des patients présentaient une TA systolique dans la cible (< 130 mmHg), moins de 80 % un taux de LDLc à70 mg/dL, et seulement 50 % des patients diabétiques avaient un taux d'HbA1c dans la cible. Actuellement de nouveaux hypolipémiants puissants sont disponibles et la cible LDLc est < 55 mg/dL ; le traitement du diabète et de l’obésité a également gagné en efficacité. (NB, par contre la cible TA à 120/70 n’est peut-être pas judicieuse en cas de Saci ≥ 70% NASCET)
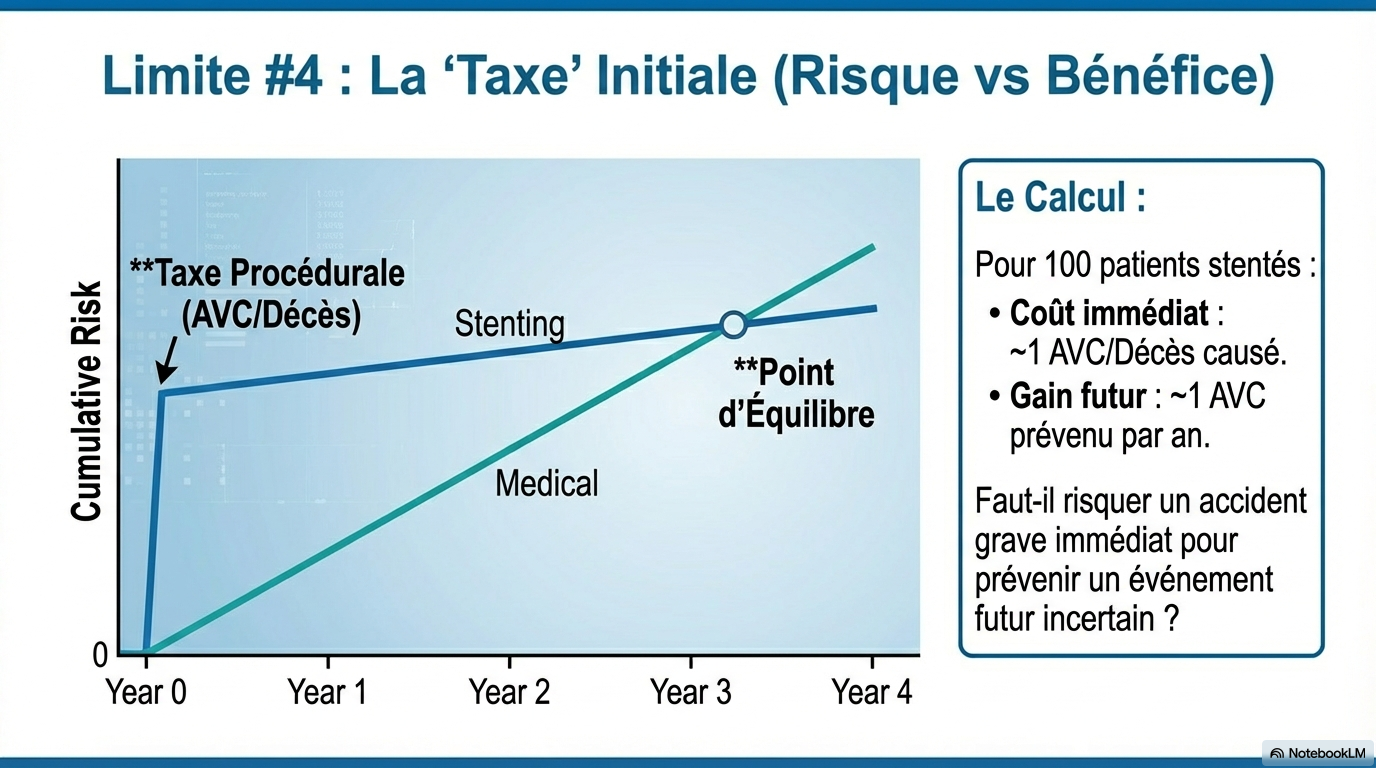
- Une question tout aussi importante est de savoir si le bénéfice observé sur les 4 ans de l'essai justifie l'augmentation précoce du risque lié à la pose d'un stent. Dans l'étude CREST-2, le taux d'AVC ou de décès péri-procéduraux associés à la pose d'un stent était de 1,3 %, alors qu'aucun événement précoce n'a été observé avec le traitement médical seul. Par la suite, le taux d'AVC ipsilatéral était de 0,4 % par personne-année dans le groupe stenting + TMO et de 1,7 % dans celui de la TMO seul. Ainsi, pour 100 patients traités par stent, seul 1 patient environ par an bénéficiera de la prévention d'un AVC, au prix d'un AVC ou d'un décès lié à la procédure pour environ un patient. Il est également pertinent de noter qu'environ deux tiers des événements survenus chez les patients traités par traitement médical intensif seul étaient des AVC non invalidants. Ces patients présentent généralement une récupération bonne ou acceptable, et la revascularisation est alors indiquée pour le traitement de la sténose carotidienne symptomatique.
- Enfin les auteurs rappellent à juste titre que le stenting ou l’endartériectomie carotidienne ne visent pas à prévenir tous les AVCs et que nombre d’AVC en postopératoire ou à terme sont sans rapport avecle geste carotidien ou la sténose carotidienne.
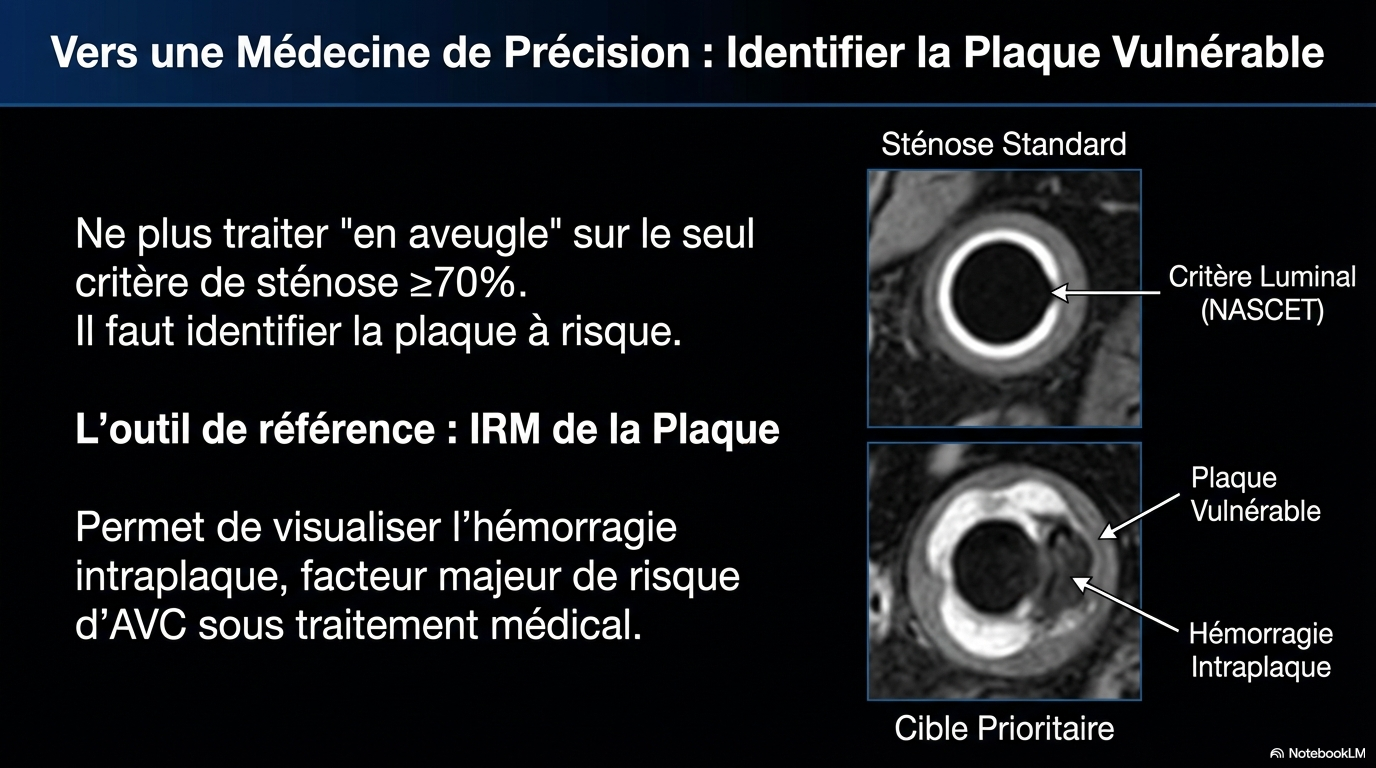
Brown et Bonatti concluent leur éditorial par un propos qui doit résonner chez les médecins vasculaires. « Il faut maintenant des essais cliniques visant à identifier la faible proportion de patients atteints de sténose carotidienne qui développeront un AVC ipsilatéral malgré un traitement médical optimal. L'approche la plus prometteuse consiste à utiliser l'IRM de la plaque carotide pour identifier les hémorragies intraplaques, un facteur de risque majeur d'VC. »
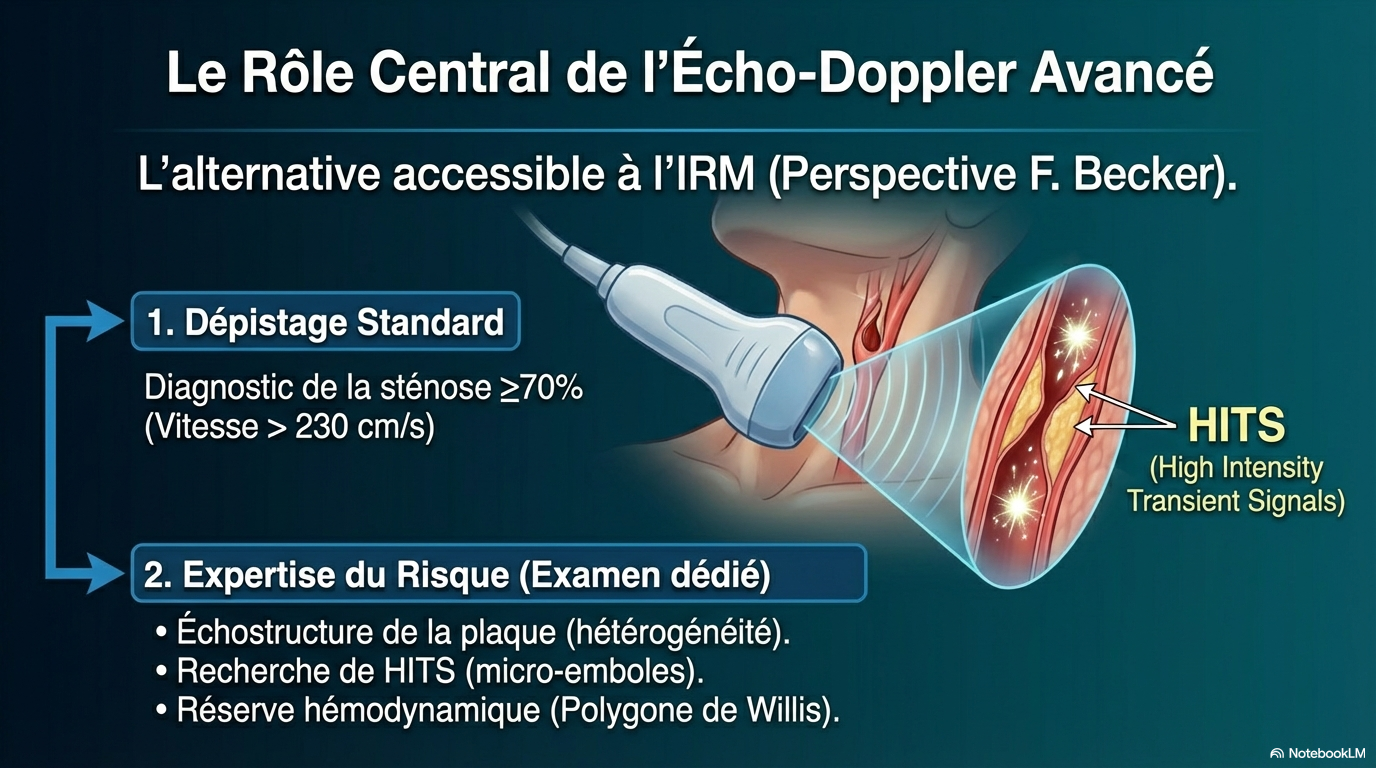
Personnellement je ne suis pas du tout persuadé que l’IRM de la plaque soit la seule clef du diagnostic de sténose carotide à haut risque, l’écho-Doppler (ED) peut avoir une place de 1 er plan mais à condition que l’on fasse évoluer les pratiques et les cotations. Il faut distinguer l’ED cervical conduisant avec précision au diagnostic de Saci ≥ 70% NASCET et secondairement l’ED cervical et transcrânien pour évaluation du risque thrombo-embolique (échostructure de la sténose, recherche de HITS) et du risque hémodynamique (mesure de débits carotidiens, étude du polygone de Willis, étude de la vasoréactivité cérébrale). Ce second examen est minutieux et nécessite une ou deux séances complémentaires.
Fidèle à ses préoccupations, Jean-Pierre me demande de préciser in fine ce que je retiens en tant que médecin vasculaire comme critères, comme indication dans la Vraie Vie.
Dans la vraie vie, je reconnais que ce n’est pas toujours simple.
Cela dépend d’abord du mode de travail et du relationnel avec les patients (est-ce qu’on se contente de faire des examens ou est-ce qu’on contribue aussi à la prise en charge des patients ?), cela dépend aussi de la qualité du réseau de correspondants.
Si l’on est conscient que la somme des études récentes sur les sténoses carotides asymptomatiques montre que le traitement optimal des facteurs de risque CV est le point clé de la prise en charge de ces patients, si l’on est conscient qu’il est inutile d’opérer une Saci asymptomatique chez un patient tabagique sédentaire ne prenant pas ses médicaments, face à la découverte d’une Saci de haut grade asymptomatique, la première chose à faire n’est pas de demander une angiographie « de confirmation » ni d’adresser le patient à un chirurgien vasculaire ou à un radiologue interventionnel.
Au terme de cet examen ED diagnostic, je crois qu’il faut prendre le temps d’expliquer le problème au patient en termes de pronostic et de prise en charge du risque CV, de lui faire comprendre que sous TMO le risque d’AVC ipsilatéral est assez faible (< 2% par an) et que ce TMO a un impact favorable sur toute affection CV athéroscléreuse (tout AVC, IdM, …), de lui expliquer ce qu’est un accident ischémique transitoire et lui dire que vous le suivrez régulièrement et le prendrez en urgence en cas de suspicion d’AIT.
Il faut aussi lui expliquer qu’un petit nombre de Saci sont probablement à plus haut risque d’AVC ipsilatéral ce qui peut justifier un complément d’examen EDC-EDTC pour mieux évaluer le risque thrombo-embolique et le risque hémodynamique de la sténose en question. Ces sténoses à sur-risque, qui sont peu fréquentes, peuvent être suspectées d’emblée en présence d'une sténose très hypoéchogène hétérogène, d'un I.Vi/débit en ACC normal ou abaissé par rapport à l’ACC controlatéral, ou en raison d'une sténose serrée, d'une occlusion ACI controlatérale, ou d'anomalies vertébro-basilaires majeures.
Autre point important le compte rendu d’examen, le courrier au correspondant, au médecin traitant doivent être clairs et précis ; un coup de fil peut être utile.
Il y a bien sûr des patients qui malgré un risque opératoire dans les meilleurs cas à peu près identique au risque annuel sous TMO seul, malgré le risque de re-sténose symptomatique, préfèreront l’intervention d’emblée quel que soit l’aspect de la sténose. Je crois qu’il faut respecter leur choix en leur précisant toutefois que l’intervention ne dispense pas du TMO.
Si une indication opératoire est retenue, le choix se portera sur l'angioplastie-stenting ou l'endartériectomie. Actuellement, entre des mains expertes, les deux techniques se valent. Le choix dépendra des disponibilités et de la configuration anatomique.
PS. La première étude CREST (Carotid Revascularization Endarterectomy versus Stenting Trial – 2000-2008) ne montrait pas de différence significative de résultats (postopératoires, à 4 ans et à 10 ans) entre les patients qui ont eu une endartériectomie carotidienne et ceux qui ont eu un stenting carotidien pour sténose carotide symptomatique ou asymptomatique (Brott T.G. et al for CREST Investigators, NEJM 2016 Feb.)
SYNTHÈSE NOTEBOOKLM
L'étude CREST-2 examine l'efficacité de la revascularisation comparée au traitement médical optimal pour les patients souffrant d'une sténose carotidienne asymptomatique sévère. Les résultats indiquent que l'ajout d'un stent réduit significativement le risque d'AVC sur quatre ans par rapport au traitement médical seul, tandis que l'endartériectomie ne montre pas de bénéfice supplémentaire statistiquement probant. Toutefois, les experts soulignent que ces conclusions reposent sur des opérateurs hautement qualifiés et un nombre limité d'événements cliniques. Malgré l'avantage apparent du stenting, la prévention médicale intensive demeure le pilier central de la prise en charge. Les auteurs recommandent donc d'identifier avec précision les patients à haut risque avant de privilégier une intervention chirurgicale. Une interprétation prudente est nécessaire pour ne pas généraliser ces pratiques sans tenir compte la qualité du suivi médical actuel.







Commentaire
L'analyse de François Becker est optimale, elle est parfaite. Je pense qu'avec ce document chacun trouvera les réponses attendues. La relation aved le patient est pour moi très importante; elle intervient dans la prise de décision si la confiance est là.
Est-ce que l'IA trouvera sa place pour la sténose carotidienne asymptomatique. Probablement au niveau de l'imagerie, mais pour le reste, a priori non !
IA , SCANNER et PLAQUE
https://medvasc.info/archives-blog/ia-scanner-et-plaque
Merci François, toujours au top dans l'excellence !


