« Visez toujours la lune. Même si vous manquez, vous atterrirez parmi les étoiles. » – Les Brown
Rappel
Rappel
À propos d’Anthos Therapeutics
Anthos Therapeutics a été lancé par Blackstone Life Sciences en 2019 et a obtenu de Novartis Pharma les droits mondiaux exclusifs de développement, de fabrication et de commercialisation de l’abélacimab. Anthos Therapeutics est une société biopharmaceutique au stade clinique axée sur le développement et la commercialisation de thérapies innovantes génétiquement et pharmacologiquement validées pour faire progresser les soins aux patients cardiovasculaires à haut risque. Pour plus d’informations, visitez le site Web de l’entreprise et suivez-nous sur Twitter et LinkedIn.
https://medvasc.info/archives-blog/scoop-l-ab%C3%A9lacimabAbelacimab versus Rivaroxaban in Patients with Atrial FibrillationAbelacimab versus rivaroxaban chez les patients atteints de fibrillation auriculaire
Authors: Christian T. Ruff, M.D., M.P.H., Siddharth M. Patel, M.D., M.P.H. https://orcid.org/0000-0002-4637-4361, Robert P. Giugliano, M.D., David A. Morrow, M.D., M.P.H., Bruce Hug, M.D., Ph.D., Julia F. Kuder, M.A., Erica L. Goodrich, M.S., +12, for the AZALEA–TIMI 71 Investigators*Author Info & Affiliations Published January 22, 2025 N Engl J Med 2025;392:361-371 VOL. 392 NO. 4 Copyright © 2025Contexte
L'abelacimab est un anticorps monoclonal entièrement humain qui se lie à la forme inactive du facteur XI et bloque son activation. La sécurité de l'abelacimab par rapport à un anticoagulant oral direct chez les patients atteints de fibrillation auriculaire est inconnue.
Les patients souffrant de fibrillation auriculaire et présentant un risque modéré à élevé d'accident vasculaire cérébral ont été répartis de manière aléatoire, selon un ratio 1:1:1, pour recevoir une injection sous-cutanée d'abelacimab (150 mg ou 90 mg une fois par mois) administrée en aveugle ou du rivaroxaban par voie orale (20 mg une fois par jour) administré en ouvert. Le critère d'évaluation principal était un saignement majeur ou non majeur cliniquement pertinent.
Résultats
Au total, 1 287 patients ont été randomisés. L'âge médian était de 74 ans et 44 % étaient des femmes. À 3 mois, la réduction médiane des taux de facteur XI libre avec l'abelacimab à une dose de 150 mg était de 99 % (écart interquartile de 98 à 99) et avec l'abelacimab à une dose de 90 mg était de 97 % (écart interquartile de 51 à 99). L'essai a été arrêté prématurément sur recommandation du comité indépendant de surveillance des données en raison d'une réduction plus importante que prévu des événements hémorragiques avec l'abelacimab.
Le taux d'incidence d'hémorragies majeures ou non majeures cliniquement pertinentes était de 3,2 événements pour 100 personnes-années avec l'abelacimab 150 mg et de 2,6 événements pour 100 personnes-années avec l'abelacimab 90 mg, contre 8,4 événements pour 100 personnes-années avec le rivaroxaban (rapport de risque pour l'abelacimab 150 mg par rapport au rivaroxaban, 0,38 [intervalle de confiance à 95 % {IC}, 0,24 à 0,60] ; rapport de risque pour l'abelacimab 90 mg par rapport au rivaroxaban, 0,31 [IC à 95 %, 0,19 à 0,51] ; P < 0,001 pour les deux comparaisons). L'incidence et la gravité des événements indésirables semblaient similaires dans les trois groupes.
Le taux d'incidence d'hémorragies majeures ou non majeures cliniquement pertinentes était de 3,2 événements pour 100 personnes-années avec l'abelacimab 150 mg et de 2,6 événements pour 100 personnes-années avec l'abelacimab 90 mg, contre 8,4 événements pour 100 personnes-années avec le rivaroxaban (rapport de risque pour l'abelacimab 150 mg par rapport au rivaroxaban, 0,38 [intervalle de confiance à 95 % {IC}, 0,24 à 0,60] ; rapport de risque pour l'abelacimab 90 mg par rapport au rivaroxaban, 0,31 [IC à 95 %, 0,19 à 0,51] ; P < 0,001 pour les deux comparaisons). L'incidence et la gravité des événements indésirables semblaient similaires dans les trois groupes.


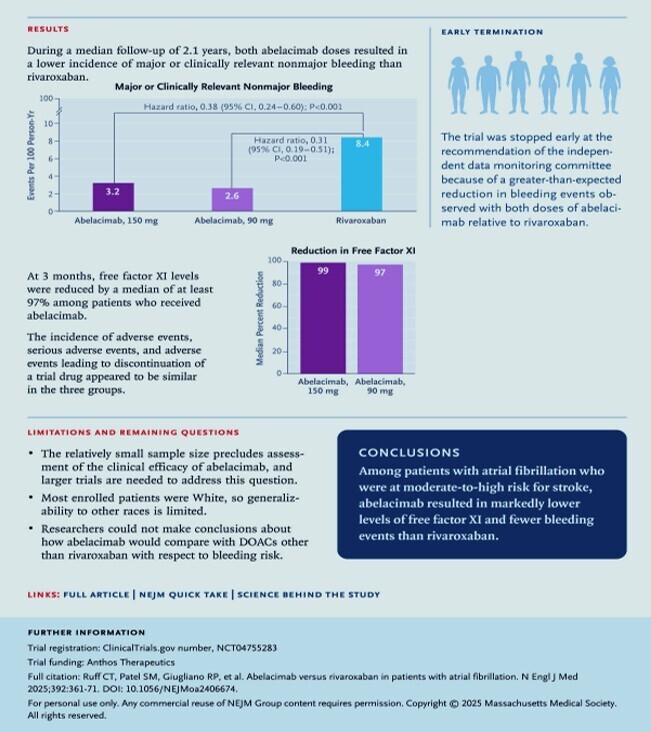
Le traitement par l’anticorps monoclonal entièrement humain abélacimab à des doses de 150 mg et 90 mg a entraîné des réductions marquées et soutenues des taux de facteur XI libre de 97 % ou plus pendant la durée de l’intervalle entre les doses et a entraîné une incidence significativement plus faible de saignements majeurs ou non majeurs cliniquement pertinents que le rivaroxaban (62 % plus faible dans le groupe abélacimab 150 mg et 69 % plus bas dans le groupe abélacimab 90 mg). Un mélange d’hémorragies majeures, non majeures ou mineures cliniquement pertinentes est survenu chez 18,3 % des patients du groupe recevant 150 mg d’abélacimab et chez 12,5 % des patients du groupe recevant de l’abélacimab de 90 mg, comparativement à 26,2 % de ceux du groupe rivaroxaban. Une hémorragie majeure est survenue chez 2,3 % des patients du groupe recevant 150 mg d’abélacimab, chez 1,9 % des patients du groupe recevant de l’abélacimab à 90 mg et chez 7,2 % des patients du groupe recevant du rivaroxaban. Une hémorragie gastro-intestinale majeure est survenue chez 0,5 % des patients du groupe recevant 150 mg d’abélacimab, chez 0,5 % des patients du groupe recevant de l’abélacimab à 90 mg et chez 4,2 % des patients du groupe rivaroxaban. Il n’y avait pas de différences dans l’incidence ou les caractéristiques des événements indésirables entre les groupes.
Cet essai n’a pas été conçu pour fournir des conclusions définitives concernant l’efficacité de l’abélacimab. Le taux d’incidence des accidents vasculaires cérébraux ou des embolies systémiques était faible (environ 1 % par an), mais numériquement, les accidents vasculaires cérébraux étaient plus fréquents dans les deux groupes abélacimab que dans le groupe rivaroxaban.
Cet essai n’a pas été conçu pour fournir des conclusions définitives concernant l’efficacité de l’abélacimab. Le taux d’incidence des accidents vasculaires cérébraux ou des embolies systémiques était faible (environ 1 % par an), mais numériquement, les accidents vasculaires cérébraux étaient plus fréquents dans les deux groupes abélacimab que dans le groupe rivaroxaban.
Cette observation était motivée par les taux d’incidence des accidents vasculaires cérébraux ischémiques.
L’AVC hémorragique, qui représente généralement environ un sixième des AVC chez les patients atteints de fibrillation auriculaire traités par un AOD, est survenu chez 2 des 428 patients du groupe rivaroxaban et chez 1 des 852 patients des groupes abelacimab combinés. Le taux d’incidence de l’événement composite de décès toutes causes confondues ou d’accident vasculaire cérébral était similaire dans les groupes abélacimab et rivaroxaban.
En ce qui concerne les données d’efficacité concernant d’autres membres de cette classe de médicaments, l’essai de phase 3 OCEANIC-AF comparant l’asundexian 50 mg une fois par jour à l’apixaban chez les patients atteints de fibrillation auriculaire a été arrêté prématurément car l’asundexian était moins efficace.
Cette découverte a suscité des questions sur l’utilité de l’inhibition de la voie du facteur XI chez les patients atteints de fibrillation auriculaire.
Cependant, il existe des différences importantes entre l’abélacimab et l’asundexian. Tout d’abord, le mode d’action de l’abélacimab diffère de celui de l’asundexien car l’abélacimab se lie à la forme inactive du facteur XI et empêche la génération de la forme activée (facteur XIa), tandis que l’asundexien n’inhibe que l’activité du facteur XIa.
Deuxièmement, alors que l’abélacimab permet une réduction de 99 % des taux de facteur XI libre à la dose de 150 mg évaluée dans les essais de phase 3, l’asundexian à une dose de 50 mg, la dose testée dans l’étude OCEANIC-AF, semble être moins puissante.
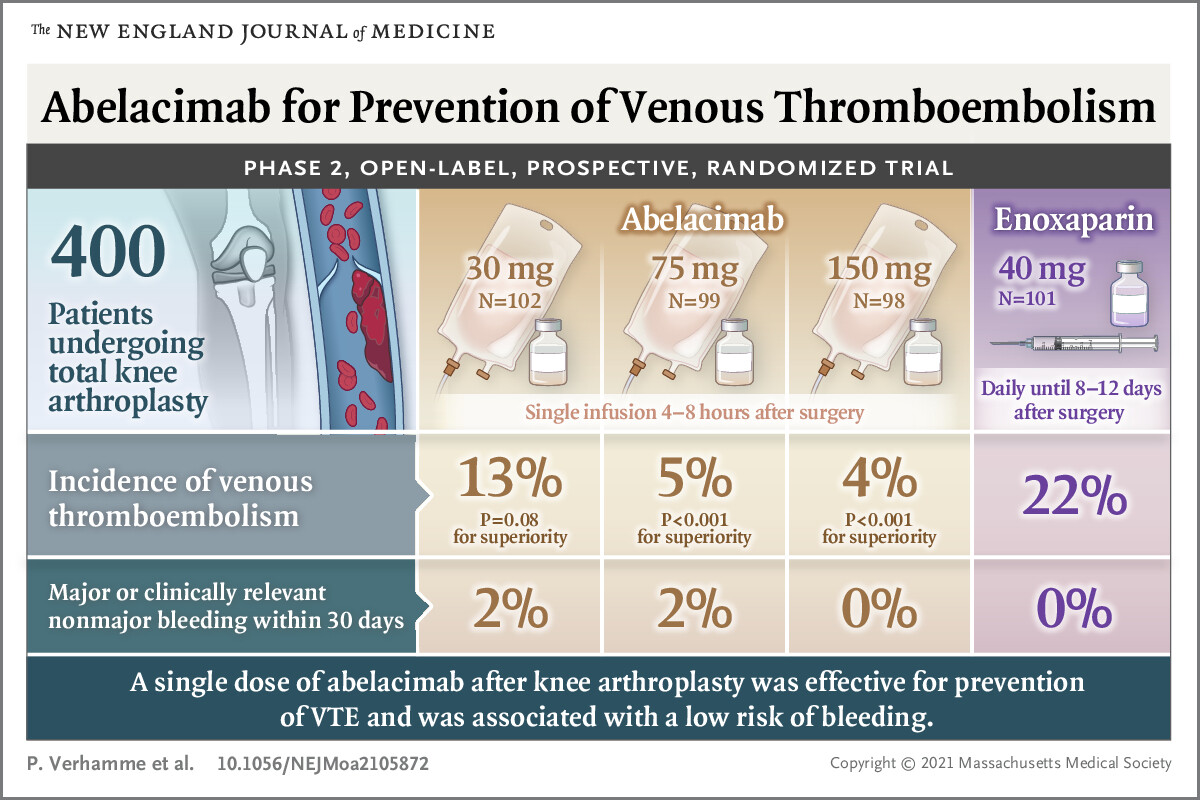
Troisièmement, et c’est le plus important, la preuve de concept selon laquelle l’abélacimab réduit le risque de thrombose a été fournie dans l’essai ANT-005, qui a évalué l’abélacimab par rapport à l’énoxaparine pour la thromboprophylaxie après une arthroplastie élective du genou.
En revanche, aucun essai de preuve de concept n’a été réalisé avec l’asundexian. En fin de compte, cependant, les résultats des essais de phase 3 en cours sont nécessaires pour établir le rapport bénéfice/risque de l’abélacimab.
Conclusions
Parmi les patients atteints de fibrillation auriculaire qui présentaient un risque modéré à élevé d'accident vasculaire cérébral, le traitement par abelacimab a entraîné des taux nettement inférieurs de facteur XI libre et moins d'événements hémorragiques que le traitement par rivaroxaban. (Financé par Anthos Therapeutics ; numéro AZALEA–TIMI 71 ClinicalTrials.gov, NCT04755283 .)
Chez les patients atteints de fibrillation auriculaire qui présentent un risque modéré à élevé d’AVC, l’administration d’abélacimab à une dose de 90 mg ou 150 mg a entraîné une réduction marquée et soutenue des taux de facteur XI et un nombre significativement moins élevé d’événements hémorragiques que le traitement par le rivaroxaban.
L’efficacité de l’abélacimab par rapport à un placebo pour la prévention de l’AVC ischémique et de l’embolisation systémique chez les patients à haut risque atteints de fibrillation auriculaire chez qui les traitements anticoagulants actuellement disponibles ont été jugés inappropriés est actuellement évaluée dans l’essai de phase 3 LILAC-TIMI 76 (numéro ClinicalTrials.gov, NCT05712200).
Commentaire
Commentaire
ANTIDOTE FACT VIIa ou APCC......as usual mais le risque hémorragique est si faible......
Une avancée thérapeutique incontestable dont on attend la suite avec impatience
Affaire à suivre de très prés, la MTEV devrait pourvoir bénéficier de l'ABELACIMAB
Une injection mensuelle représente une autre avancée thérapeutique
Une avancée thérapeutique incontestable dont on attend la suite avec impatience
Affaire à suivre de très prés, la MTEV devrait pourvoir bénéficier de l'ABELACIMAB

Une injection mensuelle représente une autre avancée thérapeutique
A LIRE
Essentiel.
-
L'abelacimab est un anticorps monoclonal qui inhibe le facteur XI et le facteur XI activé (FXIa).
-
La pharmacocinétique de l’abelacimab a été étudiée chez des sujets sains et des patients atteints de fibrillation auriculaire.
-
L'abelacimab IV/SC a été bien toléré et a profondément supprimé le FXI pendant 4 semaines.
-
L'abelacimab produit une inhibition rapide du FXI et peut être administré mensuellement pour maintenir l'inhibition du FXI.
Mais une interrogation : le coût !
Pharmacocinétique et pharmacodynamique de l'Abelacimab (MAA868), un nouvel inhibiteur double du facteur XI et du facteur XIa
https://pmc.ncbi.nlm.nih.gov/articles/PMC9298689/
Article libre d'accès
ASUNDEXIAN : out
https://medvasc.info/archives-blog/asundexian-out?highlight=WyJhc3VuZGV4aWFuIl0=
FA et anti-facteurs XI/XIa : l’abelacimab aussi efficace que le rivaroxaban avec une diminution considérable des saignements
Les résultats de l’étude Azalea-Timi 71 comparant l’abelacimab au rivaroxaban ont été présentés au congrès 2023 de l’American hearth association (AHA) qui s’est tenu mi-novembre à Philadelphie. L’abelacimab est un anticorps monoclonal, humain, qui possède une double activité inhibitrice contre le facteur XI et contre sa forme active, le facteur XIa. L’étude a randomisé 1.287 patients atteints de fibrillation auriculaire avec un risque moyen à élevé d’AVC. Le critère de jugement principal était l’hémorragie majeure ou l’hémorragie non majeure cliniquement pertinente. L’étude a dû être arrêtée après un suivi médian de 21 mois du fait d’une réduction considérable des saignements dans le bras abelacimab avec les doses testées. Les hémorragies majeures ou non majeures cliniquement pertinentes ont été réduites de 67 % avec la dose de 150 mg et 77 % avec la dose de 90 mg d’abelacimab.
https://anticoag-pass-s2d.fr/2023/11/20/fa-et-anti-facteurs-xi-xia-labelacimab-aussi-efficace-que-le-rivaroxaban-avec-une-diminution-considerable-des-saignements/
New targets for antithrombotic medications: seeking to decouple thrombosis from hemostasis ++++++, la référence actuelle sur les AntiXI !
https://www.sciencedirect.com/science/article/pii/S1538783624007232, libre d'accès
Copyright : Dr Jean Pierre Laroche / 2025

