La thromboembolie veineuse est une complication bien établie chez les patients atteints de cancer et une cause majeure de morbidité et de mortalité chez ces patients.
Cependant, le rôle de la radiothérapie dans la thromboembolie veineuse associée au cancer (TVAC) reste moins explicitement défini.
L'incidence de la TVAC dans cette population est très variable, plusieurs études à grande échelle suggérant une association.
Bien que la prise en charge de la TVAC dans cette population suive les recommandations standard, on en sait moins sur la pertinence d'une thromboprophylaxie chez les patients atteints de différents types de cancer.
Les patients atteints de cancer et traités par radiothérapie peuvent également présenter un risque accru de saignement, qui peut être aggravé par l'anticoagulation.
Une approche multidisciplinaire intégrant l'expertise en hématologie et en oncologie est essentielle dans ce contexte.
Des recherches supplémentaires sont nécessaires pour établir des protocoles standardisés et des modèles prédictifs afin d'identifier les patients à risque de thrombose et de saignement sous anticoagulation.
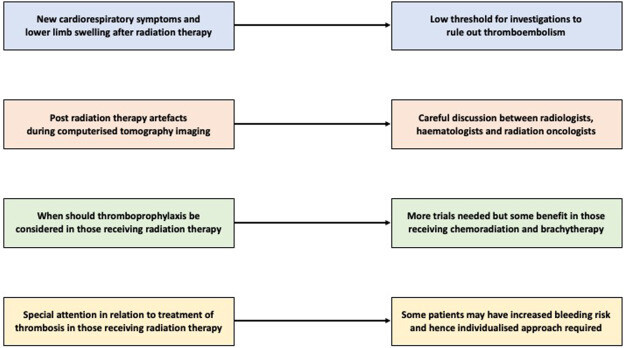
Modèles de stratification du risque de thrombose veineuse (TEV) et de saignement
Une prédiction précise du risque est essentielle pour déterminer quels patients cancéreux subissant une RT sont susceptibles de développer une thrombose veineuse (TEV) ou de présenter des complications hémorragiques sous anticoagulation.
Pour aider davantage les cliniciens, des outils de stratification du risque permettent d'identifier les patients susceptibles de bénéficier d'une thromboprophylaxie tout en minimisant l'exposition inutile aux risques hémorragiques liés à l'anticoagulation.
Le modèle de risque le plus largement utilisé pour la CAT est le score de Khorana, qui intègre le type de cancer, la numération plaquettaire, l'hémoglobine (ou l'utilisation d'érythropoïétine), la numération leucocytaire et l'indice de masse corporelle afin de stratifier les patients sous chimiothérapie ambulatoire en catégories de risque faible, intermédiaire et élevé de TEV. Il a été démontré qu'un score ≥ 2 prédit de meilleurs résultats lorsqu'une thromboprophylaxie pharmacologique est utilisée ; par conséquent, une anticoagulation prophylactique est recommandée aux patients présentant de tels scores.
Cependant, le score de Khorana a été développé pour les patients traités par chimiothérapie et ne tient pas explicitement compte de la RT. Pourtant, il a été démontré qu'il avait une capacité prédictive pour l'incidence de la thromboembolie veineuse (TEV) et la survie dans une cohorte rétrospective mixte de chimiothérapie et de RT + Il peut donc guider les cliniciens dans la stratification du risque d'un individu sous RT en l'absence d'un outil spécifique à la RT.
D'autres modèles, tels que le score COMPASS-CAT (qui inclut les antécédents de TEV, l'indice de masse corporelle et l'hormonothérapie), le dossier médical électronique (DME)-CAT (qui utilise des composants du score de Khorana avec des variables supplémentaires telles que la stadification du cancer, la classe de thérapie systémique, les antécédents de TEV et l'origine ethnique), et le modèle CATS de Vienne (qui intègre les taux de D-dimères et de P-sélectine), sont des outils validés en externe qui peuvent fournir une stratification du risque utile, bien qu'ils n'aient pas été spécifiquement validés dans une population sous RT .
D'autre part, l'évaluation du risque hémorragique est cruciale pour décider d'une prophylaxie ou d'une anticoagulation à long terme. Il est noté que les patients atteints de cancer présentent un risque accru de saignement pendant le traitement anticoagulant .
La nécessité d'une anticoagulation doit donc être évaluée par rapport au risque hémorragique induit par ce traitement.
Le modèle CAT-BLEED est un exemple d'outil d'évaluation du risque hémorragique conçu spécifiquement pour la CAT, mais ses performances sont modérées et il n'a pas été validé en externe . Actuellement, il n'existe pas de modèle d'évaluation du risque validé en externe pour la thromboembolie veineuse (TEV) et la radiothérapie (RT) spécifiquement. Les modèles VTE-PREDICT et RIETE ont été conçus pour estimer à la fois la récidive de la TEV et le risque hémorragique chez les patients ayant terminé l'anticoagulation initiale . Bien qu'il ait été initialement validé dans une population non cancéreuse, ses principes peuvent être appliqués aux patients atteints de cancer sous RT pour équilibrer le rapport risque-bénéfice d'une anticoagulation prolongée. Cependant, une étude examinant les deux modèles dans une cohorte de 110 patients atteints de cancer a déterminé qu'aucun des deux modèles ne pouvait prédire avec précision les événements hémorragiques dans ce groupe. Cela reflète la réalité clinique selon laquelle de nombreux patients atteints de cancer présentent de multiples facteurs de risque, ce qui rend difficile pour un modèle linéaire d'isoler un sous-ensemble à faible risque.
Dans un tel contexte, le jugement clinique et une classification pragmatique par type de cancer pourraient être aussi efficaces que des systèmes de notation formels pour évaluer le risque hémorragique.
Certaines considérations peuvent guider les cliniciens lors de l'évaluation du risque de saignement sous anticoagulation dans le cadre d'une thérapie anticoagulante.
Une analyse secondaire de l'essai CANVAS (Cancer-related VTE Anticoagulaton Strategies), visant à identifier les facteurs de saignement chez les patients atteints de cancer, a conclu qu'une albumine sérique < 3,5 g/dL et une maladie métastatique étaient des facteurs prédictifs indépendant.
En pratique clinique, d'autres caractéristiques à haut risque de saignement comprennent les tumeurs cérébrales primitives ou métastatiques, les cancers gastro-intestinaux, thoraciques ou gynécologiques avec lésions à haut risque, la thrombocytopénie sévère et une intervention chirurgicale récente.
L'analyse du registre RIETE a mis en évidence un risque accru d'hémorragie intracrânienne chez les patients sous RT qui étaient anticoagulés.
De plus, une méta-analyse a identifié un risque de saignement accru associé aux AOD par rapport aux HBPM . Chez les personnes présentant un risque de saignement modéré et nécessitant une anticoagulation, l'HBPM peut être une option viable et est approuvée par plusieurs organismes de recommandations. Étant donné l’absence de modèle discriminant pour les risques de saignement, les facteurs énumérés doivent être pris en compte lors de la prise de décisions en matière d’anticoagulation chez les patients sous RT afin d’évaluer leur risque de saignement.
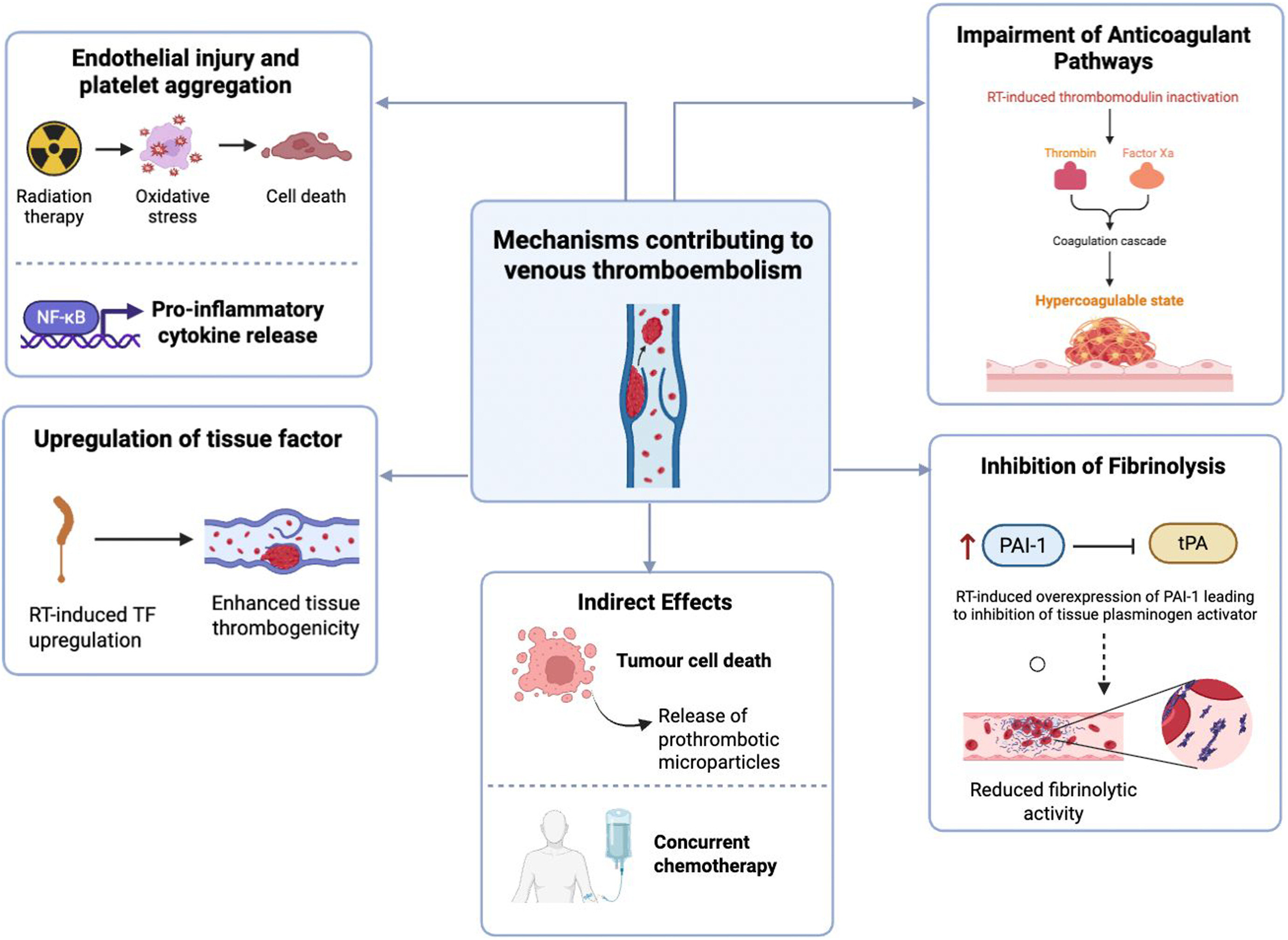
Mécanismes contribuant à la thromboembolie veineuse après radiothérapie (RT). La RT favorise un état prothrombotique par de multiples voies directes et indirectes. Les lésions endothéliales, le stress oxydatif et la libération de cytokines pro-inflammatoires activent le facteur nucléaire κB (NF-Κb) et favorisent l'agrégation plaquettaire. La régulation positive du facteur tissulaire (FT) induite par la RT augmente la thrombogénicité tissulaire. La RT altère également les voies anticoagulantes naturelles en inactivant la thrombomoduline, conduisant à un état d'hypercoagulabilité. Parallèlement, la fibrinolyse est inhibée par la régulation positive de l'inhibiteur de l'activateur du plasminogène-1 (PAI-1), réduisant l'activité de l'activateur tissulaire du plasminogène (tPA). Les mécanismes indirects incluent la mort des cellules tumorales et la chimiothérapie concomitante, qui contribuent tous deux à la libération de microparticules prothrombotiques. Collectivement, ces mécanismes augmentent le risque de thromboembolie veineuse chez les patients sous RT. (Figure réalisée avec BioRender).
 Made by IA, GEMINI
Made by IA, GEMINI