"Alzheimer... C'est un mal qui vole les coeurs, les âmes et les souvenirs. " Nicholas Sparks
"C’est un polytechnicien qui prend une puce. Il lui dit « Saute ! » Elle saute. Il lui coupe les pattes. Il lui dit « Saute ! » Elle ne saute pas. Il note sur son carnet : « Quand on coupe les pattes à une puce, elle devient sourde. »
C’est ainsi que l’intelligence, quand elle ignore le ressenti, peut arriver à affirmer et à prouver à peu près n’importe quoi." Colette Roumanoff
Jack CR Jr, Andrews JS, Beach TG, Buracchio T, Dunn B, Graf A, Hansson O, Ho C, Jagust W, McDade E, Molinuevo JL, Okonkwo OC, Pani L, Rafii MS, Scheltens P, Siemers E, Snyder HM, Sperling R, Teunissen CE, Carrillo MC. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement.
Critères révisés pour le diagnostic et la stadification de la maladie d'Alzheimer : groupe de travail de l'Alzheimer's Association
2024 Jun 27. doi: 10.1002/alz.13859. Epub ahead of print. PMID: 38934362.https://alz-journals.onlinelibrary.wiley.com/doi/10.1002/alz.13859
Article libre d'accès
UN ARTICLE "DOSSIER" majeur dont voici quelques extraits , a LIRE ++++
Le National Institute on Aging et l'Alzheimer's Association ont réuni trois groupes de travail distincts en 2011 et des groupes de travail uniques en 2012 et 2018 pour créer des recommandations pour le diagnostic et la caractérisation de la maladie d'Alzheimer (MA).
Le présent document met à jour le cadre de recherche de 2018 en réponse à plusieurs développements récents.
La définition biologique des maladies, plutôt que basée sur une présentation syndromique, est depuis longtemps la norme dans de nombreux domaines de la médecine (par exemple, l'oncologie) et devient un concept unificateur commun à toutes les maladies neurodégénératives, et pas seulement à la MA.
Le présent document est cohérent avec ce principe.
Notre intention est de présenter des critères objectifs pour le diagnostic et la stadification de la MA, en intégrant les avancées récentes en matière de biomarqueurs, afin de servir de passerelle entre la recherche et les soins cliniques.
Ces critères ne sont pas destinés à fournir des lignes directrices de pratique clinique étape par étape pour le flux de travail clinique ou des protocoles de traitement spécifiques, mais servent plutôt de principes généraux pour éclairer le diagnostic et la stadification de la MA qui reflètent la science actuelle.
POINTS FORTS :
* Nous définissons la maladie d'Alzheimer (MA) comme un processus biologique qui débute par l'apparition d'un changement neuropathologique de la MA (ADNPC) alors que les personnes sont asymptomatiques.
* La progression du fardeau neuropathologique conduit à l'apparition et à la progression ultérieures des symptômes cliniques.
* Les biomarqueurs Core 1 à évolution précoce (tomographie par émission de positons amyloïdes [TEP], biomarqueurs approuvés du liquide céphalorachidien et biomarqueurs plasmatiques précis [en particulier la protéine tau 217 phosphorylée]) se cartographient soit sur la voie de la bêta-amyloïde, soit sur la voie de la tauopathie de la MA ; cependant, ils reflètent la présence d'ADNPC de manière plus générale (c'est-à-dire à la fois des plaques névritiques et des enchevêtrements).
* Un résultat anormal du biomarqueur Core 1 est suffisant pour établir un diagnostic de MA et pour éclairer la prise de décision clinique tout au long du continuum de la maladie.
* Les biomarqueurs Core 2 à évolution tardive (TEP biofluidique et tau) peuvent fournir des informations pronostiques et, lorsqu'ils sont anormaux, augmenteront la confiance dans le fait que la MA contribue aux symptômes.
* Un schéma intégré de stadification biologique et clinique est décrit, qui tient compte du fait que les copathologies courantes, la réserve cognitive et la résistance peuvent modifier les relations entre les stades cliniques et biologiques de la MA.
Principes fondamentaux
Il est nécessaire de séparer le syndrome (trouble cliniquement identifié) de la biologie (étiologie).
La maladie d’Alzheimer (MA) est définie par sa biologie avec les implications suivantes.
La MA est définie par ses résultats neuropathologiques uniques ; par conséquent, la détection d'un changement neuropathologique de la MA par des biomarqueurs équivaut au diagnostic de la maladie.
La maladie d'Alzheimer évolue selon un continuum. La maladie se manifeste d'abord in vivo par l'apparition de biomarqueurs spécifiques à la maladie alors que les personnes sont asymptomatiques. Les mécanismes physiopathologiques impliqués dans le traitement et l'élimination des fragments de protéines peuvent être impliqués très tôt dans le processus de la maladie, mais ils ne sont pas encore bien compris.
Les symptômes sont le résultat de l’évolution de la maladie et ne sont pas nécessaires pour diagnostiquer la MA.
Les personnes non handicapées dont les résultats aux tests de biomarqueurs sont anormaux risquent de développer des symptômes dus à la maladie d’Alzheimer. Elles ne risquent pas de développer une maladie dont elles sont déjà atteintes.
Les syndromes cliniques fréquemment observés dans la MA peuvent également être causés par des troubles autres que la MA. Par conséquent, la présentation clinique seule ne constitue pas un diagnostic de la MA.
La même biologie de la MA peut entraîner des présentations phénotypiques différentes.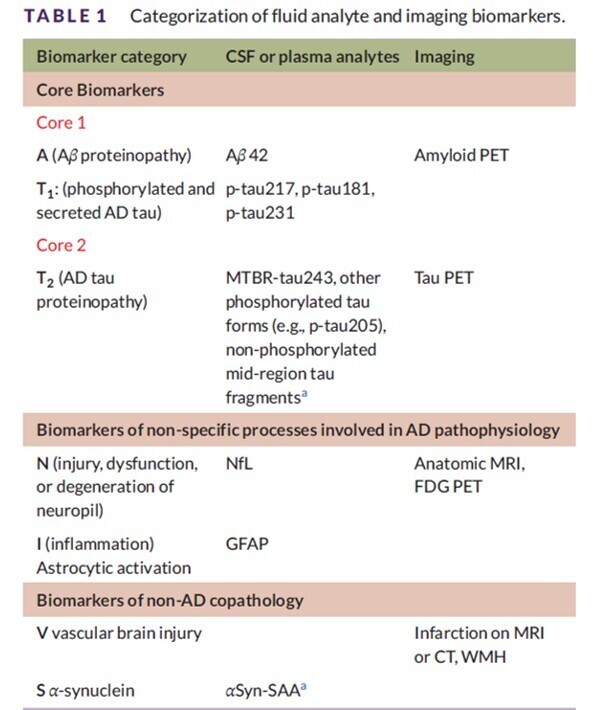
- Remarques : Les fragments tau P-tau231, p-tau205, MTBR-tau243 et non phosphorylés sont inclus dans ce tableau car ils sont abordés dans le texte. Cependant, ces analytes n'ont pas subi le même niveau de tests de validation que les autres biomarqueurs de base. Les biomarqueurs sont classés selon quatre critères. Tout d'abord, trois grands groupes mécanistes ont été identifiés. Ensuite, les biomarqueurs sont sous-classés en fonction de la protéinopathie ou de la voie physiopathologique que chacun mesure (par exemple, A, T 1 , T 2 , N etc.). Troisièmement, dans la catégorie Core, nous faisons une distinction entre les biomarqueurs Core 1 et Core 2. Quatrièmement, les biomarqueurs d'imagerie et d'analytes fluides sont répertoriés séparément dans chaque catégorie.
- Abréviations : Aβ, bêta-amyloïde ; MA, maladie d'Alzheimer ; αSyn-SAA, test d'amplification des graines d'alpha-synucléine ; LCR, liquide céphalo-rachidien ; TDM, tomodensitométrie ; FDG, fluorodésoxyglucose ; GFAP, protéine acide fibrillaire gliale ; IRM, imagerie par résonance magnétique ; MTBR, région de liaison aux microtubules ; NfL, chaîne légère des neurofilaments ; TEP, tomographie par émission de positons ; WMH, hyperintensité de la substance blanche.
- a Analyte liquide qui n'est actuellement informatif que lorsqu'il est mesuré dans le LCR. Aucune notation n'est utilisée si l'analyte liquide est informatif avec le plasma ou le LCR.
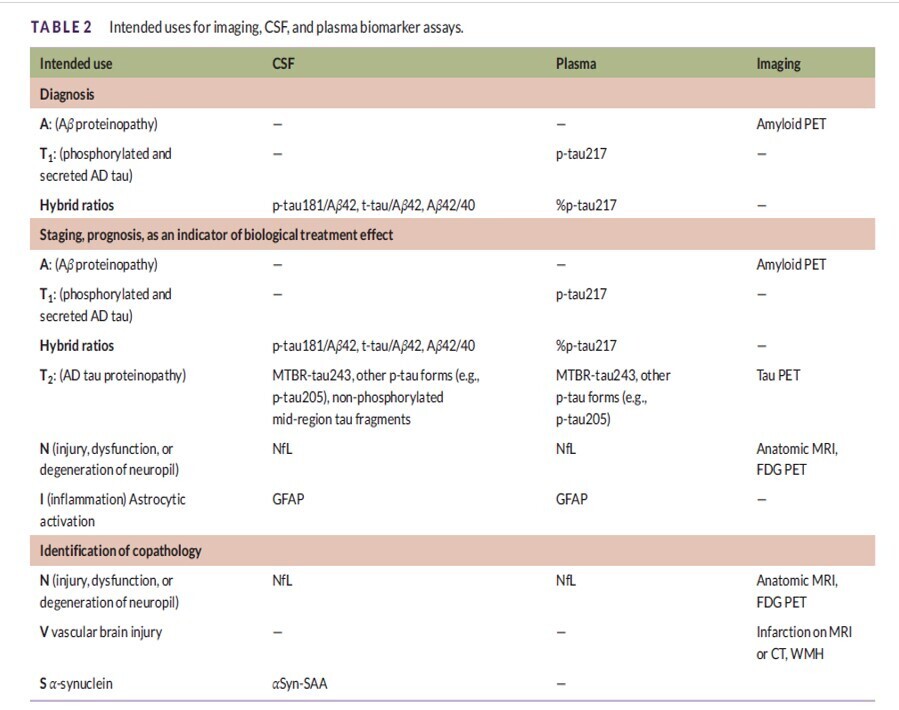
- Remarques : Le tableau 2 répertorie les dosages tandis que le tableau 1 répertorie les analytes ; par conséquent, le plasma et le LCR sont répertoriés séparément dans le tableau 2, mais répertoriés ensemble dans le tableau 1. L'accent dans ce tableau est mis sur le p-tau217 plasmatique et non sur le p-tau231, le p-tau181 ou l'Aβ42/40, car le p-tau217 surpasse généralement ces autres dosages plasmatiques dans les comparaisons directes. Le %p-tau est le rapport p-tau217/tau217 non phosphorylé. Des combinaisons de biomarqueurs Core 1 peuvent également être utilisées pour le diagnostic. Le p-tau205, le MTBR-tau243 et les fragments de tau non phosphorylés n'ont pas subi le même niveau de tests de validation que la TEP tau ; cependant, ils sont inclus pour étayer un schéma de stadification « conceptuel » décrit dans le tableau 5.
- Abréviations : Aβ, bêta-amyloïde ; MA, maladie d'Alzheimer ; αSyn-SAA, test d'amplification des graines d'alpha-synucléine ; LCR, liquide céphalo-rachidien ; TDM, tomodensitométrie ; FDG, fluorodésoxyglucose ; GFAP, protéine acide fibrillaire gliale ; IRM, imagerie par résonance magnétique ; MTBR, région de liaison aux microtubules ; NfL, chaîne légère des neurofilaments ; TEP, tomographie par émission de positons ; p-tau, tau phosphorylée ; WMH, hyperintensité de la substance blanche.
Le diagnostic de la maladie d'Alzheimer, les biomarqueurs Core 1 et Core 2 de la maladie d'Alzheimer
-
Les variants tau phosphorylés de la région médiane (p-tau 217, 181 et 231) deviennent anormaux à peu près au même moment que la tomographie par émission de positons (TEP) amyloïde et bien avant la TEP tau.
En revanche, d'autres fragments tau (par exemple, la région de liaison aux microtubules [MTBR]-tau243) deviennent anormaux plus tard, plus près du début de la TEP tau. Notre solution consiste à scinder la catégorie T : T 1 sont des fragments tau phosphorylés de la région médiane à évolution précoce (p-tau 217, 181 et 231). T 2 sont des fragments tau de biofluides à évolution tardive (par exemple, MTBR-tau243) ainsi que la TEP tau. Nous regroupons ensuite les biomarqueurs de base en Core 1, qui sont des combinaisons A, T 1 et hybrides, par rapport à Core 2, qui sont la TEP tau et les biofluides T 2 .Le diagnostic de la maladie d'Alzheimer (MA) peut être établi par une anomalie sur des biomarqueurs Core 1 spécifiques ; cependant, tous les tests de biomarqueurs Core 1 disponibles n'ont pas une précision suffisante pour être adaptés au diagnostic.
Actuellement, nous considérons que les éléments suivants sont diagnostiques de la MA :
* PET amyloïde,
* liquide céphalorachidien (LCR) Aβ 42/40, LCR p-tau 181/Aβ 42, LCR t-tau/Aβ 42, * dosages plasmatiques « précis » (définis ci-dessous) ou combinaisons de ceux-ci. Dans la plupart des situations, différents biomarqueurs Core 1 doivent être interchangeables pour la détection de changement neuropathologique de la MA (ADNPC) et, par conséquent, pour le diagnostic de la MA. Étant donné que presque tous les individus symptomatiques et la grande majorité des individus asymptomatiques présentant un PET amyloïde anormal présenteront un changement neuropathologique de la MA intermédiaire/élevé, la catégorie Core 1 représente plus généralement l'ADNPC (c'est-à-dire à la fois les plaques et les enchevêtrements). Les biomarqueurs Core 1 définissent le stade initial de la MA qui est détectable in vivo et peut être utilisé à des fins diagnostiques pour (1) la détection précoce de la MA chez les personnes sans symptômes et (2) la confirmation que la MA est une pathologie sous-jacente chez une personne présentant des symptômes.Les biomarqueurs Core 2 ne détectent pas la présence initiale de la maladie et ne peuvent donc pas exclure une pathologie de la MA. Cependant, comme l'amylose est presque toujours une condition préalable à la tauopathie néocorticale de la MA, les biomarqueurs Core 2 sont fortement associés à la pathologie Aβ et peuvent donc être suffisants pour confirmer (affirmer) la pathologie de la MA (bien que de rares exceptions existent). Lorsqu'ils sont combinés aux biomarqueurs Core 1, les biomarqueurs Core 2 peuvent être utilisés pour évaluer la gravité biologique de la maladie et
(1) fournir des informations sur la probabilité que les symptômes soient associés à la MA, (2) informer sur le taux probable de progression chez les personnes symptomatiques et (3) informer sur le risque de progression à court terme chez les personnes asymptomatiques.Seuls les biomarqueurs dont l’exactitude a été prouvée par rapport à une norme de référence acceptée doivent être utilisés à des fins de diagnostic clinique, et les mêmes critères s’appliquent aux biomarqueurs PET, LCR ou sanguins. Nous recommandons, comme exigence minimale, une précision de 90 % pour l’identification des plaques névritiques modérées/fréquente à l’autopsie (ou un substitut approuvé, qui, à ce stade, serait le PET amyloïde ou le LCR) dans la population visée. Pour les dosages de biomarqueurs sanguins, cela se traduit par une précision équivalente à celle des dosages LCR approuvés. Nous nous concentrons sur l’exactitude (vrai positif + vrai négatif)/(vrai positif + vrai négatif + faux positif + faux négatif) comme mesure concise, car il est tout aussi important qu’un test utilisé cliniquement soit correct lorsque le résultat du test est positif et correct lorsqu’il est négatif. La spécification de l’exactitude « dans la population visée » aborde les valeurs prédictives positives et négatives, qui dépendent de la probabilité antérieure de MA dans la population d’intérêt.
Limites des biomarqueurs
-
-
Manque de méthodes et de matériaux de référence certifiés pour les biofluides (à l’exception de l’amyloïde bêta [Aβ]42 du liquide céphalo-rachidien [LCR], où ils sont disponibles).
-
Les biomarqueurs (tomographie par émission de positons [TEP], LCR et sang) sont moins sensibles que l'examen neuropathologique pour la détection des changements neuropathologiques précoces/légers de la maladie d'Alzheimer (ADNPC). La stadification de la maladie par TEP (ou biomarqueurs liquides) n'est pas équivalente à la stadification neuropathologique, par exemple, la captation du ligand TEP tau dans différentes zones de Braak n'est pas équivalente à la stadification neuropathologique de Braak. Bien que les limites de sensibilité des biomarqueurs puissent être considérées comme une faiblesse, elles pourraient également être considérées comme une force, car les biomarqueurs anormaux de Core 1 indiquent que l'ADNPC est très probablement présente de manière plus générale plutôt que simplement des plaques névritiques seules.
-
Il n’existe pas de biomarqueurs étudiés de manière approfondie pour toutes les maladies concernées ; par conséquent, il est impossible de savoir avec certitude in vivo quelles maladies, en plus de la maladie d’Alzheimer, sont présentes chez un individu, ou quelle est la charge proportionnelle spécifique à la maladie parmi les diverses entités pathologiques. Cela nous amène au point 4.
-
La proportion du déficit cognitif observé chez un individu qui est attribuable à la maladie d'Alzheimer par rapport à d'autres entités neuropathologiques ne peut être connue avec certitude. Des estimations probabilistes peuvent être réalisées sur la base de combinaisons de résultats de biomarqueurs et de jugement clinique.
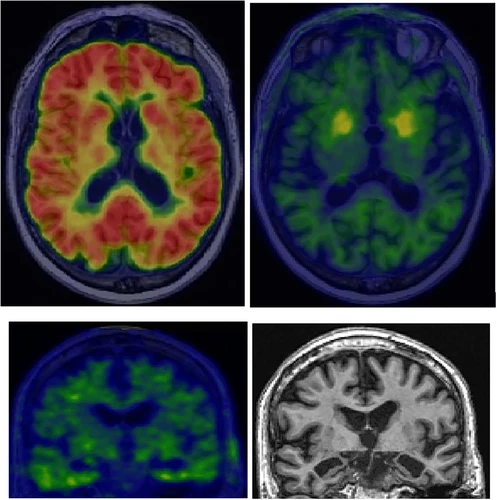
Copathologie et incompatibilité T2N . Un homme de 89 ans atteint de démence amnésique à progression lente. Il portait un diagnostic clinique de maladie d'Alzheimer (MA) probable depuis plusieurs années et recevait un traitement symptomatique. L'imagerie AT2N a cependant révélé une tomographie par émission de positons (TEP) amyloïde anormale (en haut à gauche) mais une tomographie par émission de positons (TEP) tau sans particularité (en haut à droite et en bas à gauche) qui n'était pas suffisamment anormale pour expliquer le degré d'atrophie ou de déficience cognitive (la référence de l'échelle de couleurs de la TEP tau est fournie visuellement par la captation hors cible dans les noyaux gris centraux ; en haut à droite). L'imagerie par résonance magnétique (en bas à droite) a montré une atrophie hippocampique bilatérale marquée qui était compatible avec la déficience cognitive mais incompatible avec le niveau de tauopathie (c'est-à-dire une incompatibilité T2N ) . Le profil du biomarqueur A+T 2 −N+, ainsi que le modèle d'atrophie sur l'imagerie par résonance magnétique, suggéraient que le patient souffrait probablement d'une MA comorbide et d'une encéphalopathie à protéine de liaison à l'ADN TAR 43 (LATE) à prédominance limbique.
-
-
Implications pour les cliniciens
-
Le diagnostic biologique de la maladie d'Alzheimer (MA) est censé faciliter plutôt que remplacer l'évaluation clinique des personnes atteintes de troubles cognitifs.
Les critères révisés dans ce document sont, en grande partie, une réponse aux progrès rapides des biomarqueurs basés sur les fluides, en particulier le sang, et à l'approbation de médicaments ciblant spécifiquement la pathologie bêta-amyloïde (Aβ) chez les personnes atteintes de MA symptomatique précoce, en particulier de troubles cognitifs légers et de démence légère. Ces deux avancées sont d'une grande importance pour l'utilisation clinique dans l'immédiat et l'avenir proche.Premièrement, l’utilisation clinique des biomarqueurs de la MA est actuellement destinée à l’évaluation des individus symptomatiques, et non des individus sans déficience cognitive. Nous soulignons la distinction entre « peut » et « devrait » . La MA peut être diagnostiquée chez des individus asymptomatiques, mais nous ne pensons pas que cela doive être fait à des fins cliniques à l’heure actuelle.
Deuxièmement, bien que la présence de biomarqueurs anormaux du noyau 1 soit suffisante pour confirmer la pathologie de la MA chez un individu symptomatique, elle n’empêche pas la recherche d’autres facteurs contribuant aux symptômes cliniques, en particulier d’autres copathologies courantes. Cela dit, les stades biologiques plus élevés, reflétant la pathologie de l’enchevêtrement de la protéine tau, augmentent la probabilité que les symptômes cognitifs d’un individu soient dus à la pathologie de la MA et renseignent davantage sur le pronostic. L’approche intégrée de la stadification biologique et clinique peut aider au jugement clinique dans l’évaluation de la contribution de la MA au syndrome clinique.
Troisièmement, le groupe de travail affirme que les biomarqueurs de la MA sont fondamentaux pour établir un diagnostic précis et déterminer les contributions probables aux symptômes du patient. Bien qu'il soit attendu que les cliniciens utilisent les biomarqueurs de la MA pour déterminer l'éligibilité potentielle aux thérapies spécifiques à l'Aβ récemment approuvées, les applications cliniques incluent également le conseil et l'adaptation des médicaments pour le traitement symptomatique.
Quatrièmement, le développement de catégories de biomarqueurs de base dans lesquelles les biomarqueurs amyloïdes, de liquide tau et/ou de tomographie par émission de positons peuvent être utilisés pour le diagnostic ou la stadification vise à offrir une plus grande flexibilité aux cliniciens concernant l’accès à des biomarqueurs spécifiques et leur jugement quant au(x) biomarqueur(s) le(s) plus approprié(s).
Cinquièmement, étant donné que bon nombre des mesures de biomarqueurs actuellement disponibles ou qui le seront bientôt, présentées dans ce document, ont été utilisées dans des essais cliniques, elles peuvent offrir aux cliniciens de meilleures possibilités de prendre des décisions concernant les traitements de la MA (réponse thérapeutique et/ou durée des traitements).
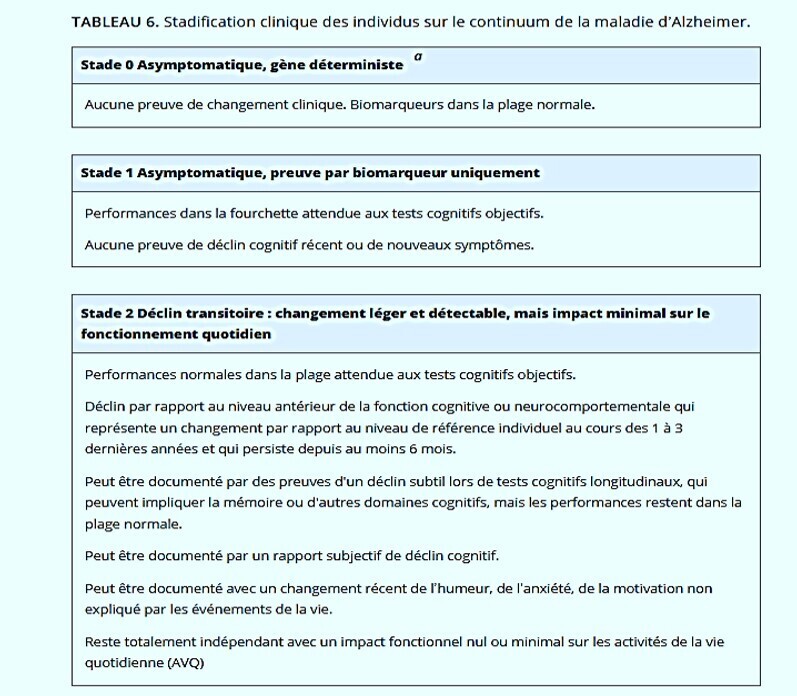
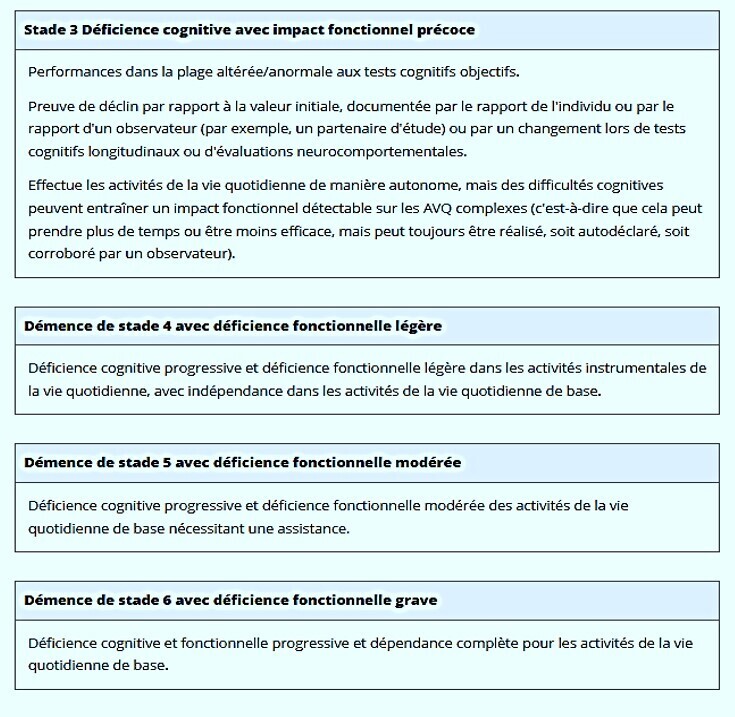
- Les personnes atteintes du syndrome de Down peuvent ne pas être totalement indépendantes même au stade 0 en raison d'une déficience intellectuelle sous-jacente. Chez ces personnes, le déclin de l'indépendance fonctionnelle par rapport au stade initial peut être un indicateur plus approprié du stade.
Les stades cliniques numériques 1 à 6 (tableau 6 ) présentent une ressemblance étroite avec l'échelle de détérioration globale, 153 avec la distinction importante que cette dernière a été créée avant le développement de biomarqueurs spécifiques de la maladie d'Alzheimer. Le schéma numérique à six stades ressemble également étroitement à la stadification des directives de la FDA pour la conduite d'essais cliniques au stade précoce de la maladie d'Alzheimer. 154
Le stade 2 est considéré comme une étape de transition distincte entre l’état asymptomatique (stade 1) et l’état légèrement altéré (stade 3) et ressemble au « stade 3 préclinique de la maladie d’Alzheimer » dans les lignes directrices du NIA-AA de 2011. 1 Ce stade est défini par un ou plusieurs des trois éléments suivants : déclin cognitif objectif, déclin cognitif subjectif ou difficultés neurocomportementales subtiles. Ces trois éléments peuvent être attribuables à la maladie d’Alzheimer, mais ils peuvent également être attribuables à d’autres facteurs que la maladie d’Alzheimer, en particulier les symptômes neurocomportementaux (par exemple, dépression, anxiété, apathie), 155 - 157 qui ne sont souvent pas associés à une maladie neurodégénérative. Un individu peut être classé au stade 2 sur la base des seuls symptômes neurocomportementaux (c’est-à-dire sans déclin cognitif objectif ou subjectif), mais les individus doivent présenter une déficience cognitive pour être classés dans les stades 3 à 6. Les progrès des tests cognitifs numériques non supervisés peuvent améliorer la capacité à détecter de manière fiable les altérations cognitives subtiles caractéristiques du stade 2 grâce à des tests répétés, mais cela reste à déterminer.
La nature du déclin cognitif ou de la déficience cognitive aux stades 2 à 6 peut concerner n’importe quel domaine cognitif, pas seulement la mémoire. La stadification clinique est basée sur la gravité de la déficience cognitive/fonctionnelle plutôt que sur le phénotype, mais différentes présentations phénotypiques de la MA sont bien connues. Cinq phénotypes caractéristiques de la MA sont reconnus : amnésique ou « typique », variante du langage, variante visuospatiale, variante comportementale et variante dysexécutive. 158 , 159 Différents phénotypes se chevauchent souvent chez un même individu, et la gravité de la déficience dans chaque domaine peut être variable.
ORIENTATIONS FUTURES
Ces dernières années, le domaine est passé du diagnostic et de la caractérisation de la maladie d'Alzheimer basés uniquement sur la présentation clinique au diagnostic biologique de la maladie. Le diagnostic et la stadification basés sur la biologie passent désormais de priorités dominées par la recherche seule à des priorités requises à la fois par la recherche et les soins cliniques. Les orientations futures pourraient inclure les suivantes.-
Les études observationnelles et les essais cliniques devraient être menés avec des cohortes plus représentatives. De plus, presque toutes les études observationnelles dans des groupes sous-représentés qui ont inclus des biomarqueurs ont été réalisées sur des échantillons de convenance avec des biais de sélection inévitables. De véritables études épidémiologiques locales et des données du monde réel sur les propriétés des biomarqueurs dans des groupes représentatifs sont nécessaires pour déterminer des relations valables au niveau de la population.
-
Il est nécessaire de normaliser les dosages des fluides biologiques, les méthodes de quantification de la protéine tau par PET et les seuils de détection. Comme dans d'autres maladies, les seuils exacts d'anomalie peuvent évoluer au fil du temps à mesure que des données supplémentaires viennent éclairer la valeur pronostique.
-
Une meilleure compréhension des différentes modifications post-traductionnelles de la protéine tau peut améliorer la stadification biologique basée sur les fluides.
-
Avec une meilleure compréhension du rôle des processus immunitaires/inflammatoires, de la microglie et de la biologie des astrocytes dans la pathogenèse de la MA, nous envisageons un rôle plus important pour les biomarqueurs I dans la caractérisation biologique et le pronostic, en particulier si des changements spécifiques au cerveau peuvent être détectés dans le sang.
-
À mesure que des essais cliniques ciblant des mécanismes autres que l’immunothérapie anti-Aβ sont réalisés, les effets de ces interventions sur les biomarqueurs et les résultats cliniques devraient être inclus dans les critères futurs.
-
Nous envisageons de créer un système complet pour stratifier le risque d'apparition et de progression en intégrant tous les biomarqueurs (AD de base, non-essentiels et biomarqueurs de copathologie non AD) ainsi que les données démographiques et génétiques. L'opérationnalisation pratique d'un système complet de diagnostic et de stadification AT 1 T 2 NISV (avec l'ajout futur de TDP-43) est ambitieuse à ce stade, mais pourrait être envisageable avec le développement de tests BBM multiplex.
-
Le comité reconnaît que la faisabilité de la mise en œuvre de ces critères pour le diagnostic et la stadification biologiques de la maladie d’Alzheimer dans la pratique clinique varie selon les régions, même au sein des pays à revenu élevé désignés par la Banque mondiale. Nous prévoyons que la disponibilité croissante du BBM rendra ces critères plus largement déployables dans les pays à revenu faible ou intermédiaire désignés par la Banque mondiale, où les biomarqueurs basés sur la TEP et le LCR peuvent ne pas être facilement disponibles.
Commentaire
Un travail remarquable, à lire in extenso, impact majeur du diagnostic biologique +++++, rôle du TEP SCAN +++++
ET PUIS la CAFEINE.....
M Yelanchezian YM, Waldvogel HJ, Faull RLM, Kwakowsky A. Neuroprotective Effect of Caffeine in Alzheimer's Disease. Molecules. 2022 Jun 10;27(12):3737. doi: 10.3390/molecules27123737. PMID: 35744865; PMCID: PMC9227174.
"La maladie d'Alzheimer (MA) est la principale cause de démence, et devrait être le fardeau sanitaire le plus important du 21e siècle, avec environ 131,5 millions de patients atteints de démence d'ici 2050. Cette revue vise à fournir un aperçu de l'effet de la caféine sur la MA et la cognition en résumant les recherches pertinentes menées sur ce sujet. Nous avons recherché dans la collection principale de Web of Science et dans PubMed des études liées à l'effet de la caféine sur la MA et la cognition en utilisant les termes de recherche de titre : caféine ; café ; Alzheimer ; cognition. Il existe des preuves suggérant que la caféine est neuroprotectrice contre la démence et peut-être la MA (20 études sur 30 le confirment), mais d'autres études, telles que l'étude « idéale » proposée dans cette revue, sont nécessaires pour prouver ce lien. Les études cliniques indiquent également que la caféine est un normalisateur cognitif et non un activateur cognitif. En outre, les études cliniques suggèrent que l'effet neuroprotecteur de la caféine pourrait être confondu avec le sexe. Il existe des preuves solides basées sur des études in vivo et in vitro selon lesquelles la caféine a des propriétés neuroprotectrices dans les modèles animaux atteints de MA (21 études sur 22 le confirment), mais des études supplémentaires sont nécessaires pour identifier les voies mécanistes médiant ces effets."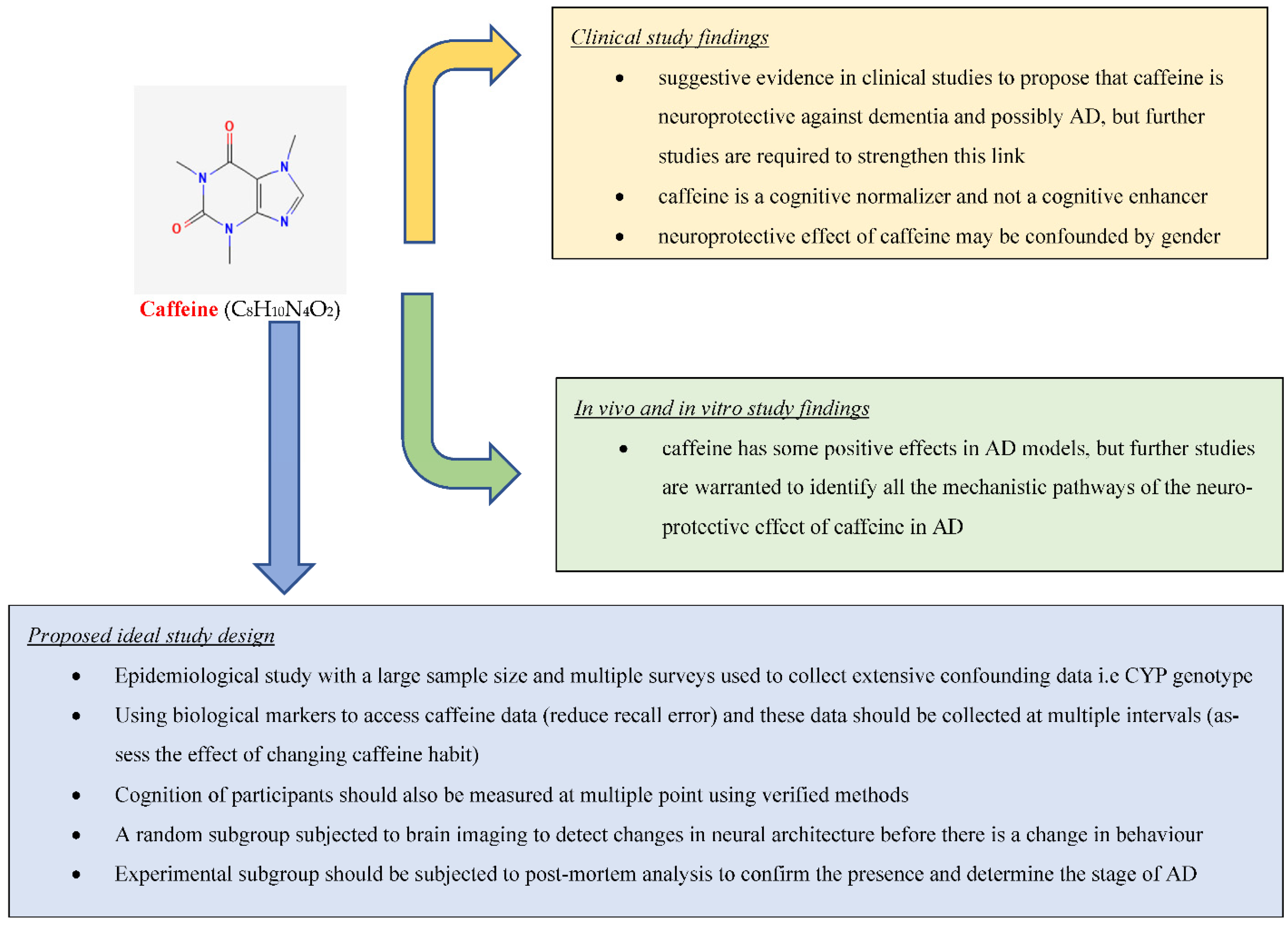
https://www.mdpi.com/1420-3049/27/12/3737
"Cet article est extrait du mensuel Sciences et Avenir - La Recherche n°925, daté mars 2024.Savoir si une personne développe une maladie d'Alzheimer et quel est son degré d'avancement est désormais possible simplement par le dosage dans le sang d'une protéine anormale caractéristique de la maladie, la protéine tau phosphorylée (p-tau217).
Un test sanguin aussi fiable que l'imagerie
Selon une étude parue dans la revue Jama Neurology, ce test ultrasensible de la société de biotechnologie américaine ALZpath s'avère aussi fiable que les mesures classiques de cette protéine effectuées dans le cerveau des patients par imagerie ou par dosage dans le liquide céphalo-rachidien.
Suivre simplement l'évolution de la maladie d'Alzheimer
Ce dosage sanguin également moins coûteux pourrait ainsi rendre le diagnostic de la maladie très accessible. L'équipe de l'université de Göteborg, en Suède, a même pu suivre ainsi l'évolution de la maladie, du trouble cognitif léger à la démence. "Les dosages sanguins de la protéine tau pathologique sont un outil d'autant plus prometteur qu'ils arrivent au moment où certains médicaments capables de retarder la progression de la maladie commencent à apparaître" (lire le mensuel n° 919), confirme Luc Buée, directeur du centre de recherche Lille Neuroscience & Cognition, qui n'a pas participé à l'étude.
Ils pourraient aussi bientôt servir à identifier les patients à un stade plus précoce de la maladie d’Alzheimer afin de pouvoir tester les médicaments capables de l’enrayer, selon les chercheurs."

