"La connaissance s'acquiert par l'expérience, tout le reste n'est que de l'information" Albert Einstein
François Becker , Chamonix
MD, PhD, HDR, PU Médecine Vasculaire
Décryptage par F Becker
La dissection d’artère cervicale (carotide et/ou vertébrale) est une cause peu fréquente d’AVC ischémique, mais elle est la cause de 15 à 25% des AVC ischémiques chez les moins de 50 ans.
Elle a un côté aléatoire puisqu’elle peut se présenter sous forme d’AVC ischémique mineur ou dramatique, sous forme de symptômes locaux ou être asymptomatique (fréquent).
Les dissections des artères cervicales ont bénéficié ce mois de 5 articles importants, 4 dans Stroke, 1 dans International Journal of Stroke.
Nous allons voir dans un premier temps les articles portant sur l’épidémiologie, sur le traitement anti-thrombotique et sur le risque de récidive (1-4), dans un deuxième temps on verra la position de l’AHA (5).
Données épidémiologiques (1).
Le 1er article porte sur l’épidémiologie des dissections d’artère cervicale. Il est dû au département de Neurologie de la Mayo Clinic (Rochester, USA), il a été validé par E. Touzé (Caen) Guest Editor.
Les données dont on disposait jusque-là sont relativement anciennes, les plus récentes sont celles du registre dijonnais des AVC qui donnait un taux d’incidence brut de 2.97 cas pour 100.000/an entre 2006 et 2011. Depuis l’accès plus facile au diagnostic non-invasif a changé la donne, les formes avec symptomatologie mineure ou les formes asymptomatiques sont plus fréquemment diagnostiquées.
Il s’agit d’une étude de cohorte en population générale observationnelle rétrospective utilisant les ressources du Rochester Epidemiology Project (REP) qui établit un lien entre les dossiers médicaux de la quasi-totalité des résidents du comté d’Olmsted (dont la population est similaire à celle de l’ensemble des USA). Tous les dossiers codant pour dissection carotide ou vertébrale ont été revus en détail pour s’assurer de la qualité du diagnostic, de l’imagerie et du suivi.
Les patients de moins de 18 ans, les patients avec dissection intracrânienne, les patients avec traumatisme majeur, les patients avec dissection aortique ont été exclus. Un cas de dissection iatrogène a été également exclu. Seules ont été retenues les dissections cervicales spontanées ou liées à un traumatisme mineur.
Sur une période 19 ans (2002-2020), 262 dossiers ont été identifiés, 123 ont été retenus (63 F, 60 H).
L’âge moyen était de 54 ans pour les hommes (95%IC : 20-91 ans) et de 47 ans pour les femmes (95%IC : 24-88 ans). Il s’agissait de 63 cas de dissection de la carotide interne, 54 cas de dissection vertébrale, 4 cas de dissection de la carotide commune ; 14 patients avaient des dissections multiples (11.3%) au moment du diagnostic (dont 2 cas de dissection des 4 pédicules).
Incidence.
Sur l’ensemble de la période 2002-2020 cela donne une incidence de 4.69 / 100.000 personnes/an (95%IC : 32.85-5.53), 2.43 pour la carotide interne (95%IC : 1.83-3.04), 2.01 pour la vertébrale (95%IC 1.47-2.55).
L’incidence a été évaluée sur 4 périodes successives 2002-2006, 2007-2011, 2012-2016, 2017-2020. Comme montré dans la figure 2 ci-dessous, l’incidence croit significativement de 2.30 /100.000 personne/an (95%IC : 1.07-3.54) sur la période 2002-2006 à 8.93 / 100.000 personnes/an (95%IC : 6.53-11.54) sur la période 2017-2020. La croissance est un peu plus importante chez la femme par rapport à l’homme, mais ça n’est pas significatif.
NB : Cette progression de l’incidence des dissections d’artères cervicales très probablement liée au large accès à l’imagerie non-invasive (ARM, IRM et surtout Angio-CT) laisse supposer que le taux de dissections asymptomatiques ou paucisymptomatiques (symptômes locaux) est sous-estimé en particulier chez les femmes.
Présentation clinique.
- * 19 cas (15.5%) ont été découverts incidemment (12 ACI, 4 vertébrales)
- * 36 cas (29.3%) présentaient des douleurs cervicales (15 ACI, 19 vertébrales)
- * 61 cas (49.6%) présentaient des céphalées (31 ACI, 28 vertébrales)
- * 18 cas (14.6%) présentaient un syndrome de Claude Bernard Horner (18 ACI, 0 vertébrale)
- * 11 cas (8.9%) présentaient des acouphènes pulsatiles (7 ACI, 4 vertébrales)
- * 18 cas (14.6%) présentaient un AIT (7 ACI, 10 vertébrales)
- * 45 cas (36.6%) présentaient un AVC ischémique (20 ACI, 24 vertébrales).
3 patients (2.4%) présentaient des antécédents familiaux de dissection (3 ACI)
7 patients (8.9%) avaient une dysplasie fibro-musculaire connue ou diagnostiquée lors du bilan.
1 cas d’Ehlers-Danlos (0.8%) type IV a été diagnostiqué lors du bilan.
46 patients (37%) étaient migraineux.
44 patients (36%) étaient hypertendus.
Imagerie diagnostique.
Plusieurs types d’imagerie ont pu être utilisés par patient (191 imageries pour 123 cas) :
10 artériographies conventionnelles (8%)
66 ARM (54%)
42 IRM (34%)
71 AngioCT (58%)
et seulement 2 écho-Doppler …
A noter que le taux d’ARM passe de 71% dans la période 2002-2011 à 46% dans la période 2012-2020. Le taux d’angio-CT passe à l’inverse de 24% dans la période 2002-2011 à 73% dans la période 2012-2020.
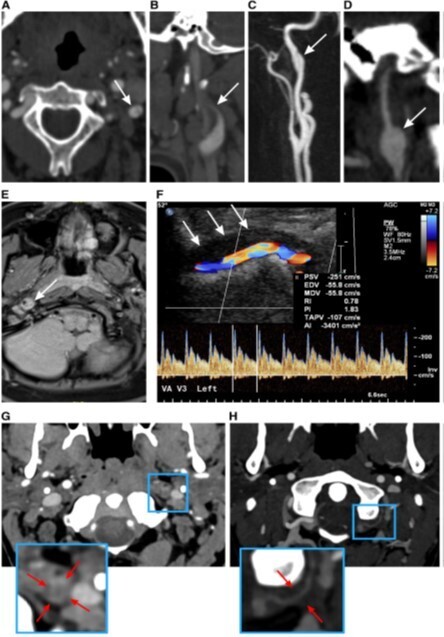
Source (2) : Signes d'imagerie évoquant le diagnostic de dissection. A, double lumière. B, occlusion effilée ou en forme de flamme au niveau du site de dissection typique. C, lambeau intimal. D, Pseudo-anévrisme. E, Hématome intra mural sur T1 en suppression de graisse. F. Hématome mural en duplex à l'imagerie carotidienne (flèches blanches) comme structure hypoéchogène compromettant le flux sanguin artériel dans l'artère vertébrale (segment V3). G, image axiale du cou obtenue par angiographie par tomodensitométrie (CTA) chez un patient présentant une occlusion complète de l'artère carotide interne (ACI) gauche liée à une dissection, montrant le signe de l'anneau, avec rehaussement de la paroi carotidienne et thrombus frais non rehaussé à l'intérieur de la lumière carotidienne. Ce signe n'est pas spécifique de la dissection de l'ACI mais indique une occlusion récente plutôt que chronique. H, image source axiale de l'angio-IRM du cou chez un patient présentant une dissection de l'artère vertébrale gauche, avec un thrombus entourant l'artère vertébrale hypoplasique mais à lumière apparemment normale, connu sous le nom de signe de la couenne sous-occipitale, impliquant le segment atlanto-occipital (V3).
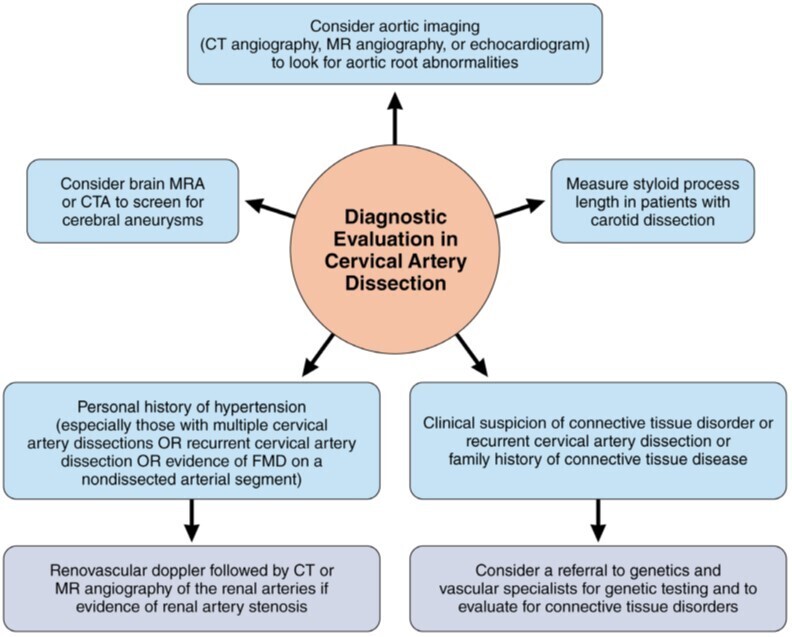
Source (2) : Proposition d'évaluation diagnostique des patients présentant une dissection de l'artère cervicale. CT signifie tomodensitométrie ; CTA, angiographie par tomodensitométrie ; FMD, dysplasie fibromusculaire ; MR, résonance magnétique ; et MRA,
angiographie par résonance magnétique.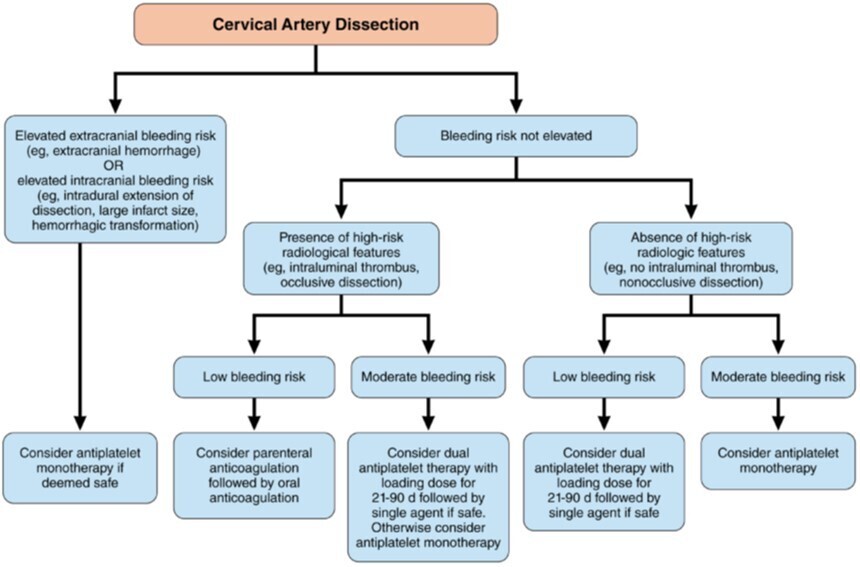
Source (2) Algorithme suggéré pour la sélection du traitement antithrombotique chez les patients présentant une dissection de l'artère cervicale.
Les patients sont stratifiés en fonction des facteurs de risque radiologiques d'hémorragie intracrânienne (par exemple, infarctus de grande taille, transformation hémorragique et extension intracrânienne de la dissection) et des facteurs de risque radiologiques importants d'accident vasculaire cérébral ischémique
d'extension intracrânienne de la dissection) et des facteurs de risque radiologiques importants d'accident vasculaire cérébral ischémique (présence d'un thrombus intraluminal et d'une sténose ou d'une occlusion de haut grade). sténose ou occlusion de haut degré).
Traitement.
Les modalités thérapeutiques ont été assez variables.
Notons que 5 patients ont eu une thrombolyse IV, 2 une thrombectomie endovasculaire et 2 un stenting en phase aigüe.
Intéressant, le taux de patients traités par anticoagulant est passé de 68% dans la période 2002-2011 à 20% dans la période 2012-2020. Le taux de patient mis sous anti-agrégants plaquettaires a suivi la voix inverse avec une forte augmentation des cas sous double anti-agrégation. (Cf Fig.3 infra)
NB : Il faut probablement voir là l’effet de l’étude CADISS publiée début 2016 qui ne montrait pas de différence d’efficacité entre anticoagulants et antiagrégants plaquettaires.
Evolution.
L’évolution a été bonne dans 89% des cas (Echelle de Rankin modifiée de 0 à 2 dans les 2 ans post-AVC).
10 patients (8.1%) ont présenté une récidive d’AIT ou d’AVC.
10 patients (8.1%) ont présenté une récidive de dissection dans un délai médian de 90 jours. Il n’est pas précisé combien ont été symptomatiques. Parmi ces 10 patients, 2 avaient une dysplasie fibro-musculaire et 1 une maladie d’Ehlers-Danlos.
Un patient a eu un stenting à 29 mois pour un pseudo-anévrysme compliqué.
Suivi en imagerie.
109 / 123 patients ont eu un suivi en ARM ou en Angio-CT, le plus souvent à 3 mois post-dissection.
58 patients (53%) ont eu une résolution complète ou quasi-complète des lésions.
50 patients (46%) ont gardé des lésions stables.
1 patient a développé une sténose progressive.
7 patients (6.4%) ont développé un pseudo-anévrysme sur la dissection.
Une récidive de dissection a été notée chez 10 patients (dont 1 au même endroit).
Quel antithrombotique ? (2, 3).
Le choix du traitement antithrombotique en prévention d’AVC post-dissection d’artères cervicales reste controversé. Initialement le traitement anticoagulant était un dogme basé sur des opinions d’experts et non sur des essais. On sait maintenant avec un accès rapide à l’imagerie non-invasive que le pronostic est plutôt bon, que nombre de dissections se présentent sous forme de symptômes locaux sans déficit neurologique ou sont asymptomatiques. Ceci conduit à discuter le rapport bénéfice-risque des anticoagulants.
Les deux RCTs déjà réalisés ne permettent pas de trancher.
L’étude CADISS (Jama Neurol 2019) comparait un traitement antiagrégant plaquettaire (Aspirine ou Clopidogrel ou Dipyridamole ou une association de deux AAP) au traitement anticoagulant (Héparine puis Warfarine avec INR 2-3) pendant 3 mois ; 250 patients ont été randomisés, il n’a pas été noté de différence entre les deux traitements, mais le nombre de récidives d’AVC ou d’AVC a été plus faible que prévu (6 AVC sur un an pour 250 patients).
L’étude TREAT-CAD (Lancet Neurol 2021) testait la non-infériorité de l’Aspirine 300 mg/j. par rapport à un AVK (INR 2-3) pour 3 mois, 194 patients ont été randomisés. La non-infériorité de l’Aspirine n’a pas été démontrée.
Ces deux RCTS n’ont pas été assez puissants pour répondre à la question du clinicien, quel est le traitement au meilleur rapport bénéfice-risque, AAP ou AVK ? Par ailleurs ces deux essais ont été conduits avant l’aire des AODs.
L’étude STOP-CAD publiée dans le N° d’avril de Stroke (2) relève le défi du nombre de patients dans une vaste étude multicentrique observationnelle, certes rétrospective, mais totalisant 3.636 patients de plus de 18 ans avec dissection d’artères cervicales* (hors traumatisme majeur dans les 4 sem. précédentes et hors dissection iatrogène) sur 63 sites dans 16 pays.
* : contrairement au titre, il ne s’agit pas exclusivement de dissections d’artères cervicales, 9% des patients présentaient une extension intracrânienne de leur dissection cervicale, 6% des patients présentaient une dissection intracrânienne.
402 patients (11%) étaient exclusivement sous anticoagulant (AC), 2453 (68%) étaient exclusivement sous anti-agrégant plaquettaire (AAP) dont 535 sous double AAP, 781 patients (21%) ont été sous AC et AAP.
60% patients se sont présentés initialement avec un AVC ischémique (même proportion dans les groupes AC et AAP)
33% des patients avaient une dissection occlusive (34% dans le groupe AAP, 29% dans le groupe AC, différence non-significative)
A 6 mois il était survenu 162 nouveaux AVC ischémiques (4.4% - 87% dans le 1er mois) et 28 accidents hémorragiques majeurs (0.8%, 19 extra-crâniens, 9 intracrâniens)
La comparaison entre patients sous AC et patients sous AAP montre que sous AC -1 il y a un peu moins d’AVC ischémique dans le territoire de l’artère disséquée mais la différence n’est pas significative, -2 il y a un eu plus d’accidents hémorragiques mais la différence n’est pas significative non plus.
Dans le sous-groupe des patients avec dissection occlusive, la différence entre AC et AAP est significativement en faveur des AC.
Dans les autres sous-groupes testés (AVK vs DOACs, AAP en simple vs en double) il n’y a pas de différence significative, mais la taille de ces groupes ne permet pas de conclusion formelle.
Est-ce suffisant pour choisir entre AC et AAP, probablement non. Mais dans la vraie vie sur laquelle insiste JPL, le choix est peut-être fait puisque dans cette vaste série multicentrique il y a 6 patients sous AAP pour 1 sous AC. Les patients avec dissection occlusive ou thrombus intraluminal sont plus souvent sous AC.
Un autre point important est à noter dans cette étude : 87% des AVC ischémiques surviennent dans le mois suivant l’initiation du traitement, à l’inverse l’excès d’hémorragies sous AC survient plutôt au-delà de ce 1er mois. Il apparait aussi dans une analyse post-hoc de cette étude que les patients dont le diagnostic de dissection a été fait face à un AVC ischémique ont moins de récidive d’AVC ischémique sous AC que sous AAP.
Dans cette large série multicentrique, sous antithrombotique (quel qu’il soit) le risque d’AVC ischémique est < 5% à 6 mois et risque de saignement majeur est < 1%.
A défaut de trancher entre AC et AAP, cette étude a le mérite de cibler les patients avec dissection d’artère cervicale probablement les plus aptes à bénéficier d’un traitement AC et de préciser la durée de ce traitement AC s’il est choisi (AC < 3-6 mois, relais avec AAP).
Le prochain essai randomisé AAP vs AC, prospectif et de grande ampleur, sur les dissections d’artères cervicales devra logiquement cibler les dissections occlusives ou avec thrombus intraluminal.
Risque de récidive (4).
Le travail de Lounsbury et al (Ottawa, Canada) est focalisé sur la récidive de dissections cervicales sur la même artère ou sur une autre artère cervicale. Il repose sur une revue systématique de la littérature. La perspective d’une récidive est peut-être la plus grande préoccupation pour un patient jeune, par ailleurs en bonne santé et physiquement actif, qui a fait une dissection avec une bonne récupération fonctionnelle et qui souhaite reprendre une activité professionnelle ou de loisirs normale. Cette question a des ramifications claires sur la qualité de vie. Les recommandations pour le retour à une activité normale manquent de directives fondées sur des preuves, les séries avec suivi sont de petite taille avec une durée de suivi modeste et il n’y a pas de revue systématique.
Les études éligibles étaient des séries de cas, des études observationnelles, des études randomisées impliquant des patients avec dissections spontanées ou traumatiques confirmées radiologiquement et rapportant un taux de récidives. Les études en pédiatrie étaient inclues. Le diagnostic de récidive devait être objectivement prouvé. Le suivi minimum était de 1 mois et au maximum de 5 ans.
Jusque mars 2022, 29 études publiées entre 1986 et 2021 ont pu être retenues pour l’analyse finale : 16 études observationnelles prospectives, 11 études observationnelles rétrospectives, 2 séries de cas pour un total de 5.898 patients âgés de 8 à 50ans. La durée de suivi allait de 4 à 94 mois.
Le taux de récidive moyen était de 4% (95%IC : 3-7%) : 2% à 1 mois (95%IC 1-5%), 7% à 1 an (95%IC : 4-13%). Il n’y avait pas de données suffisantes pour évaluer le risque de récidive plus tardive.
Le risque de récidive symptomatique était de l’ordre de 2% (95%IC 1-3%). La majorité des récidives sont donc asymptomatiques ou paucisymptomatiques (signes locaux sans déficit neurologique).
Dans le sous-groupe de patients avec surveillance systématique en imagerie, le taux de récidive était de 5% (95%IC : 3-9%) alors qu’il était de 3% (95%IC : 2-7%) en l’absence de suivi systématique.
Il n’y avait pas assez de cas pour des études en sous-groupes, néanmoins le taux de récidive était significativement plus important en cas de dysplasie fibro-musculaire, de tortuosité, de jeune âge, d’antécédent familial de dissection et de suivi long.
Références
- Griffin K.J., Harmsen W.S., Mandrekar J., Brown R.D., Keser Z. Epidemiology of spontaneous cervical artery dissection: population-based study. Stroke 2024 Mar ; 55 :670-77
- Yaghi S., Shu L., Mandel D., Leon Guerrero C.R., Henninger N. et al. Antithrombotic treatment for stroke prevention in cervical artery dissection: the STOP-CAD study. Stroke 2024 Apr ; 55 :908-18
- Bernstein R.A., Previch L., Caprio F.Z. Data over dogma in treatment of cervical artery dissections. Editorial. Stroke 2024 Apr ; 55 : 919-20
- Lounsbury E., Niznick N., Mallick R., Dewar B., Davis A. et al. Recurrence of cervical artery dissection: a systematic review and meta-analysis. International Journal of Stroke 2024 ; 19(4) : 388-96
- Yaghi S., Engelter S. Del Brutto V.J., Field T.S., Jadhav A.J. on behalf of the American Heart Association Stroke Council, Council on Cardiovascular and Stroke Nursing, Council on Clinical Cardiology and Council on Peripheral Vascular Disease. Treatment and outcomes of cervical artery dissection in adults: a scientific statement from the American Heart Association. Stroke 2024 Mar ; 55 : e91-e10
MERCI François pour ce dossier complet et très informatif sur les dissections des artères cervicales.
Une analyse méthodique essentielle pour la pratique.

