“Il ne faut pas vendre la peau de l’ours avant de l’avoir tué.” Proverbe français
“Hibernation je me cryogénise dès que je rentre à la maison, je m’enferme dans le congélateur, c’est décidé je serai le premier Findus humain.” Frédéric Beigbeder
Thienel M, Müller-Reif JB, Zhang Z, Ehreiser V, Huth J, Shchurovska K, Kilani B, Schweizer L, Geyer PE, Zwiebel M, Novotny J, Lüsebrink E, Little G, Orban M, Nicolai L, El Nemr S, Titova A, Spannagl M, Kindberg J, Evans AL, Mach O, Vogel M, Tiedt S, Ormanns S, Kessler B, Dueck A, Friebe A, Jørgensen PG, Majzoub-Altweck M, Blutke A, Polzin A, Stark K, Kääb S, Maier D, Gibbins JM, Limper U, Frobert O, Mann M, Massberg S, Petzold T. Immobility-associated thromboprotection is conserved across mammalian species from bear to human. Science. 2023 Apr 14;380(6641):178-187. doi: 10.1126/science.abo5044. Epub 2023 Apr 13. PMID: 37053338.
La thromboprotection associée à l'immobilité est conservée dans toutes les espèces de mammifères, de l'ours à l'homme
https://www.science.org/doi/10.1126/science.abo5044
La thromboprotection associée à l'immobilité est conservée dans toutes les espèces de mammifères, de l'ours à l'homme
https://www.science.org/doi/10.1126/science.abo5044
La thromboembolie veineuse (MTEV) comprenant la thrombose veineuse profonde et l'embolie pulmonaire est une cause majeure de morbidité et de mortalité. Les conditions liées à l'immobilité à court terme sont un facteur de risque majeur pour le développement de la MTEV.
Paradoxalement, les ours bruns hibernants immobilisés à long terme et les patients paralysés de la moelle épinière (SCI) sont protégés contre la MTEV.
Nous avons cherché à identifier les mécanismes de protection contre les MTEV associés à l'immobilité dans une approche inter-espèces. La protéomique basée sur la spectrométrie de masse a révélé une signature antithrombotique dans les plaquettes d'ours bruns en hibernation avec la protéine de choc thermique 47 (HSP47) comme protéine la plus réduite.
La régulation à la baisse ou l'ablation de HSP47 a atténué l'activation des cellules immunitaires et la formation de pièges extracellulaires de neutrophiles, contribuant à la thromboprotection chez les ours, les patients atteints de lésions médullaires et les souris.
Paradoxalement, les ours bruns hibernants immobilisés à long terme et les patients paralysés de la moelle épinière (SCI) sont protégés contre la MTEV.
Nous avons cherché à identifier les mécanismes de protection contre les MTEV associés à l'immobilité dans une approche inter-espèces. La protéomique basée sur la spectrométrie de masse a révélé une signature antithrombotique dans les plaquettes d'ours bruns en hibernation avec la protéine de choc thermique 47 (HSP47) comme protéine la plus réduite.
La régulation à la baisse ou l'ablation de HSP47 a atténué l'activation des cellules immunitaires et la formation de pièges extracellulaires de neutrophiles, contribuant à la thromboprotection chez les ours, les patients atteints de lésions médullaires et les souris.
Lorsque les humains connaissent une immobilité aiguë causée par une maladie ou une blessure, ils courent un risque accru de thromboembolie veineuse potentiellement mortelle. En revanche, les ours en hibernation restent immobiles pendant des mois chaque année sans éprouver de telles complications. De même, les patients chroniquement immobilisés atteints d'une lésion de la moelle épinière n'ont pas de risque accru de thrombose. En examinant le sang d'humains en immobilisation chronique, de volontaires sains en repos prolongé au lit et d'ours bruns en liberté pendant leurs périodes d'activité et d'hibernation, Thienel et al . identifié des protéines spécifiques qui sont régulées à la baisse pendant les périodes d'immobilité prolongée et protègent de la thrombose
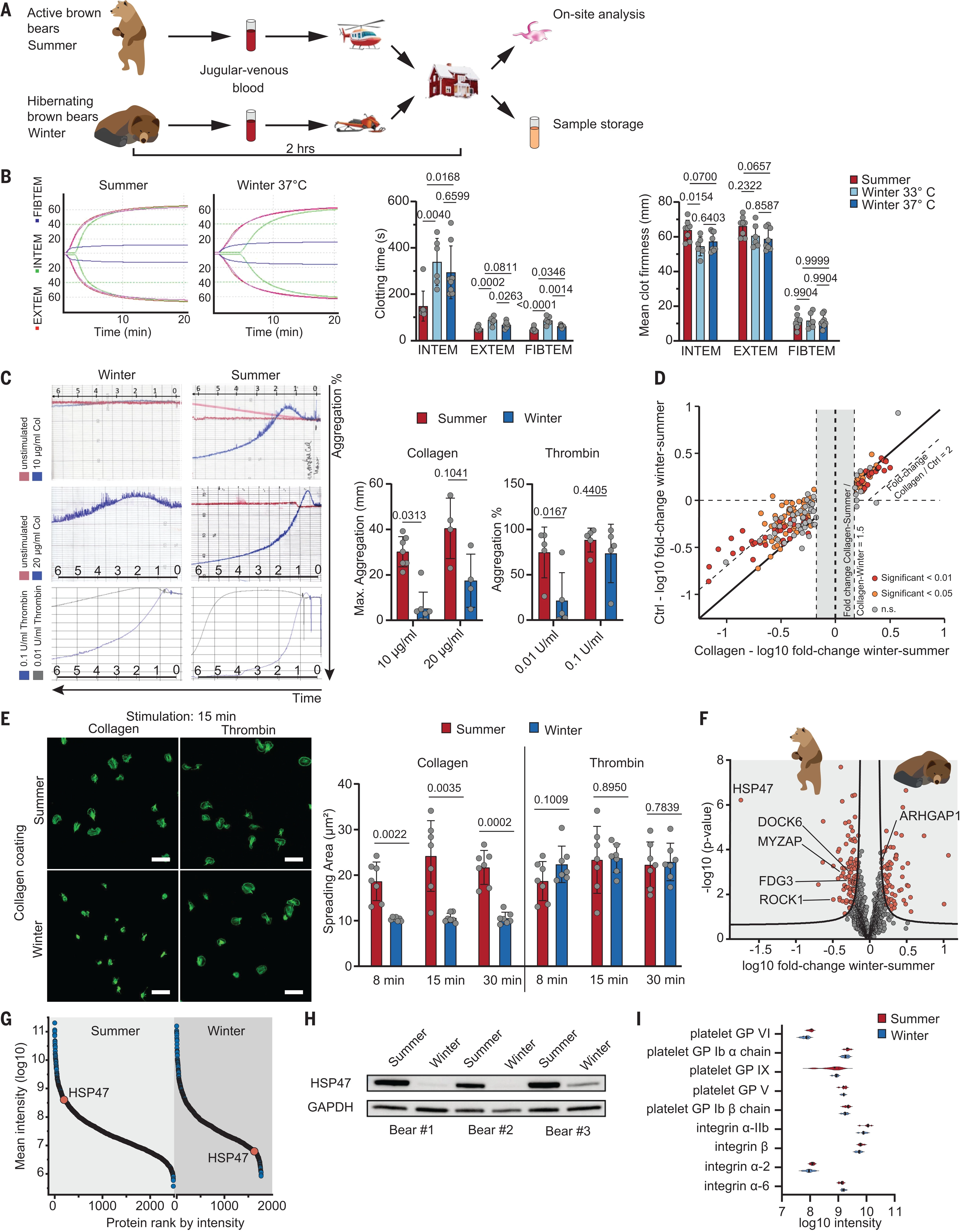

Fonction plaquettaire chez les ours bruns en hibernation.
( A ) Le schéma d'étude sur le terrain est illustré. ( B ) Quantification du temps de coagulation et de la fermeté moyenne du caillot par thromboélastographie après activation INTEM, EXTEM et FIBTEM. Les différences entre le sang d'été ( n = 8), le sang frais d'hiver (33°C ; n = 6) et le sang réchauffé d'hiver (37°C ; n = 8) ont été analysées. Les symboles représentent des ours individuels ; données représentées par des moyennes ± SD ; Les valeurs P ont été déterminées avec un test d'analyse de variance unidirectionnelle (ANOVA). ( C) L'aggrégométrie de transmission lumineuse des plaquettes lavées des ours d'hiver et d'été a été réalisée après stimulation avec les agonistes indiqués. L'agrégation maximale après 6 minutes a été évaluée et des courbes d'agrégation représentatives sont présentées ( n = 5 pour la thrombine 0,01 U/ml et la thrombine 0,1 U/ml, n = 4 pour le collagène 20 μg/ml, n = 7 pour le collagène 10 μg/ml ; les symboles représentent les ours individuels ; les données sont présentées sous forme de moyennes ± ET ; les valeurs P ont été déterminées avec le test t apparié pour le collagène 20 μg/ml et la thrombine 0,1 U/ml ; le test de Wilcoxon pour le collagène 10 μg/ml et le test t non apparié pour la thrombine 0,01 U/ml). ( D) Les protéines sécrétées par les plaquettes d'ours (hiver et été) ont été analysées lors d'une stimulation au collagène ou d'un traitement de contrôle avec la protéomique basée sur la SEP. Les protéines changeant de manière significative (FDR 5%) dans l'une des deux comparaisons de groupe sont mises en évidence en couleurs et seules les protéines avec un changement de pli> 1,5 fois pour la stimulation du collagène sont affichées. Les lignes diagonales en pointillés marquent le seuil de changement de facteur 2 entre la comparaison des axes x et y . ( E ) La taille d'étalement des plaquettes individuelles stimulées avec les agonistes indiqués sur des surfaces recouvertes de collagène I soluble a été analysée après 8, 15 et 30 minutes ( n = 7 ; les symboles représentent des ours individuels ; les données sont présentées sous forme de moyennes ± SD ; valeurs P ont été déterminés avec t apparié-test). Les images représentatives montrent l'épandage après 15 minutes ; la barre d'échelle représente 20 μm. ( F ) L'analyse statistique du protéome plaquettaire des plaquettes d'ours en hibernation et actives révèle que HSP47 est la protéine la plus modifiée (variation de 55,26 fois). Les protéines modifiées impliquées dans la signalisation ROCK1 sont marquées par des noms de gènes. Les protéines changeant significativement (FDR < 0,05) sont surlignées en rouge dans une analyse non appariée des plaquettes de huit individus pendant la phase et l'activité d'hibernation. ( G ) Protéomes de plaquettes d'ours classés par intensité protéique moyenne des huit individus pour l'été et l'hiver. Le rang de HSP47 passe de 184 (été) à 1624 (hiver). ( H) Immunoblots représentatifs de trois ours individuels pendant l'hiver et l'été pour HSP47 dans les plaquettes sont présentés. ( I ) L'expression de groupe (protéomique basée sur MS) d'un panel de marqueurs d'activation de surface plaquettaire est représentée sous forme de graphiques de violon, qui révèlent une absence de régulation entre les échantillons d'été et d'hiver.
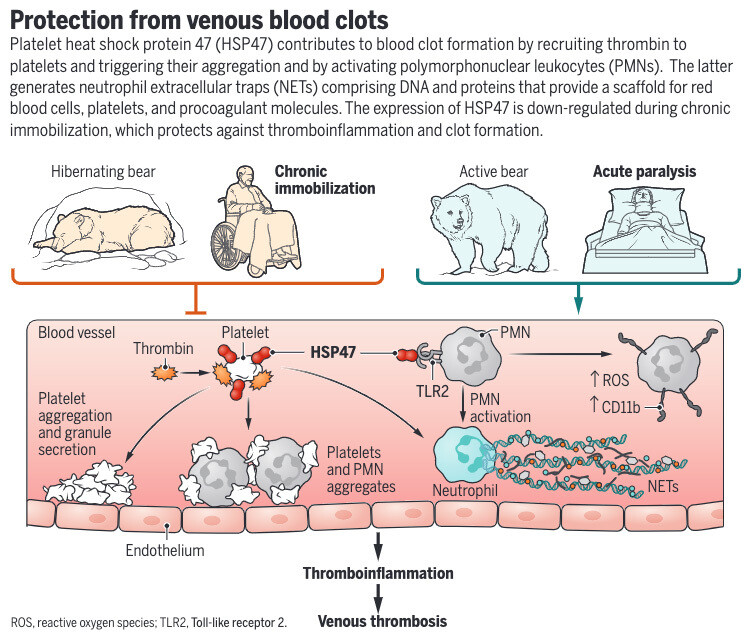
En combinant des analyses fonctionnelles chez des ours bruns, des souris, des porcs et des humains en liberté, nous avons découvert un processus physiologique conservé inter-espèces lors de l'immobilisation. Grâce à la régulation à la baisse de HSP47, l'immobilisation chronique confère une protection contre la TMEV en inversant l'état pro-thromboinflammatoire qui suit normalement l'immobilisation. Nous suggérons donc que HSP47 est une cible prometteuse pour prévenir la MTEV chez les patients exposés à l'immobilisation, qui pourrait être conservée de manière évolutive chez les mammifères. Nos résultats fournissent un aperçu mécaniste du paradoxe selon lequel le risque de MTEV des patients blessés médullaires immobilisés à long terme ressemble au risque de la population générale. Une enquête plus approfondie est nécessaire concernant la base moléculaire de la mécanosensation pendant l'hémostase et la thrombose dans divers contextes, y compris la microgravité dans l'espace. Cependant, nos données établissent également une fonction de HSP47 entraînant la thromboinflammation dans l'interaction étroitement contrôlée des cellules immunitaires innées et des plaquettes en général. Vers une application clinique, nos résultats suggèrent donc un concept pour le traitement des maladies cardiovasculaires thrombo-inflammatoires en utilisant des mécanismes thromboprotecteurs naturels.
L'immobilité n'est pas la seule cause de MTEV et nous n'avons pas étudié le rôle de HSP47 dans d'autres environnements thromboemboliques tels que le cancer ou les troubles de la coagulation. Néanmoins, les patients à risque de MTEV au-delà de l'immobilisation pourraient bénéficier de traitements imitant le mécanisme thromboprotecteur décrit ici.
Coup de veine
Quand l’hibernation des ours nous éclaire sur les risques de phlébite
"En temps normal, la protéine HSP47 aide le corps à lutter contre l’inflammation, et aide la coagulation en cas de saignements. «Cette protéine est la clé du mécanisme naturel qui protège l’organisme des caillots quand il ne peut pas bouger, résume Ole Frøbert. Cette découverte est très intéressante car elle a du potentiel pour les personnes à risque de développer des caillots.» De nouveaux traitements antithrombotiques pourront exploiter la trouvaille : «comme nous avons réussi à baisser le taux de HSP47 chez les souris, nous pensons qu’il est possible de développer un nouveau type de traitement préventif avec des effets secondaires beaucoup plus légers que ceux disponibles aujourd’hui.»
https://www.liberation.fr/sciences/biologie/quand-lhibernation-des-ours-nous-eclaire-sur-les-risques-de-phlebite-20230418_BOHVYN35BFHLROOITQUMBU63WE/
( A ) Le schéma d'étude sur le terrain est illustré. ( B ) Quantification du temps de coagulation et de la fermeté moyenne du caillot par thromboélastographie après activation INTEM, EXTEM et FIBTEM. Les différences entre le sang d'été ( n = 8), le sang frais d'hiver (33°C ; n = 6) et le sang réchauffé d'hiver (37°C ; n = 8) ont été analysées. Les symboles représentent des ours individuels ; données représentées par des moyennes ± SD ; Les valeurs P ont été déterminées avec un test d'analyse de variance unidirectionnelle (ANOVA). ( C) L'aggrégométrie de transmission lumineuse des plaquettes lavées des ours d'hiver et d'été a été réalisée après stimulation avec les agonistes indiqués. L'agrégation maximale après 6 minutes a été évaluée et des courbes d'agrégation représentatives sont présentées ( n = 5 pour la thrombine 0,01 U/ml et la thrombine 0,1 U/ml, n = 4 pour le collagène 20 μg/ml, n = 7 pour le collagène 10 μg/ml ; les symboles représentent les ours individuels ; les données sont présentées sous forme de moyennes ± ET ; les valeurs P ont été déterminées avec le test t apparié pour le collagène 20 μg/ml et la thrombine 0,1 U/ml ; le test de Wilcoxon pour le collagène 10 μg/ml et le test t non apparié pour la thrombine 0,01 U/ml). ( D) Les protéines sécrétées par les plaquettes d'ours (hiver et été) ont été analysées lors d'une stimulation au collagène ou d'un traitement de contrôle avec la protéomique basée sur la SEP. Les protéines changeant de manière significative (FDR 5%) dans l'une des deux comparaisons de groupe sont mises en évidence en couleurs et seules les protéines avec un changement de pli> 1,5 fois pour la stimulation du collagène sont affichées. Les lignes diagonales en pointillés marquent le seuil de changement de facteur 2 entre la comparaison des axes x et y . ( E ) La taille d'étalement des plaquettes individuelles stimulées avec les agonistes indiqués sur des surfaces recouvertes de collagène I soluble a été analysée après 8, 15 et 30 minutes ( n = 7 ; les symboles représentent des ours individuels ; les données sont présentées sous forme de moyennes ± SD ; valeurs P ont été déterminés avec t apparié-test). Les images représentatives montrent l'épandage après 15 minutes ; la barre d'échelle représente 20 μm. ( F ) L'analyse statistique du protéome plaquettaire des plaquettes d'ours en hibernation et actives révèle que HSP47 est la protéine la plus modifiée (variation de 55,26 fois). Les protéines modifiées impliquées dans la signalisation ROCK1 sont marquées par des noms de gènes. Les protéines changeant significativement (FDR < 0,05) sont surlignées en rouge dans une analyse non appariée des plaquettes de huit individus pendant la phase et l'activité d'hibernation. ( G ) Protéomes de plaquettes d'ours classés par intensité protéique moyenne des huit individus pour l'été et l'hiver. Le rang de HSP47 passe de 184 (été) à 1624 (hiver). ( H) Immunoblots représentatifs de trois ours individuels pendant l'hiver et l'été pour HSP47 dans les plaquettes sont présentés. ( I ) L'expression de groupe (protéomique basée sur MS) d'un panel de marqueurs d'activation de surface plaquettaire est représentée sous forme de graphiques de violon, qui révèlent une absence de régulation entre les échantillons d'été et d'hiver.

En combinant des analyses fonctionnelles chez des ours bruns, des souris, des porcs et des humains en liberté, nous avons découvert un processus physiologique conservé inter-espèces lors de l'immobilisation. Grâce à la régulation à la baisse de HSP47, l'immobilisation chronique confère une protection contre la TMEV en inversant l'état pro-thromboinflammatoire qui suit normalement l'immobilisation. Nous suggérons donc que HSP47 est une cible prometteuse pour prévenir la MTEV chez les patients exposés à l'immobilisation, qui pourrait être conservée de manière évolutive chez les mammifères. Nos résultats fournissent un aperçu mécaniste du paradoxe selon lequel le risque de MTEV des patients blessés médullaires immobilisés à long terme ressemble au risque de la population générale. Une enquête plus approfondie est nécessaire concernant la base moléculaire de la mécanosensation pendant l'hémostase et la thrombose dans divers contextes, y compris la microgravité dans l'espace. Cependant, nos données établissent également une fonction de HSP47 entraînant la thromboinflammation dans l'interaction étroitement contrôlée des cellules immunitaires innées et des plaquettes en général. Vers une application clinique, nos résultats suggèrent donc un concept pour le traitement des maladies cardiovasculaires thrombo-inflammatoires en utilisant des mécanismes thromboprotecteurs naturels.
L'immobilité n'est pas la seule cause de MTEV et nous n'avons pas étudié le rôle de HSP47 dans d'autres environnements thromboemboliques tels que le cancer ou les troubles de la coagulation. Néanmoins, les patients à risque de MTEV au-delà de l'immobilisation pourraient bénéficier de traitements imitant le mécanisme thromboprotecteur décrit ici.
Coup de veine
Quand l’hibernation des ours nous éclaire sur les risques de phlébite
"En temps normal, la protéine HSP47 aide le corps à lutter contre l’inflammation, et aide la coagulation en cas de saignements. «Cette protéine est la clé du mécanisme naturel qui protège l’organisme des caillots quand il ne peut pas bouger, résume Ole Frøbert. Cette découverte est très intéressante car elle a du potentiel pour les personnes à risque de développer des caillots.» De nouveaux traitements antithrombotiques pourront exploiter la trouvaille : «comme nous avons réussi à baisser le taux de HSP47 chez les souris, nous pensons qu’il est possible de développer un nouveau type de traitement préventif avec des effets secondaires beaucoup plus légers que ceux disponibles aujourd’hui.»
https://www.liberation.fr/sciences/biologie/quand-lhibernation-des-ours-nous-eclaire-sur-les-risques-de-phlebite-20230418_BOHVYN35BFHLROOITQUMBU63WE/
Commentaire
Non ce n'est pas un poisson d'Avril, l'hibernation de l'ours brun sans MTEV, une solution pour pré²venir la mTEV chez les humains.
Pourquoi ? Parce que la protéomique basée sur la spectrométrie de masse a révélé une signature antithrombotique dans les plaquettes d'ours bruns en hibernation avec la protéine de choc thermique 47 (HSP47) comme protéine la plus réduite.
"La thrombose veineuse profonde (TVP) est une caractéristique courante de l'immobilisation à court terme, qui survient, par exemple, chez les patients atteints de paralysie aiguë. Cependant, en cas d'immobilisation chronique, par exemple en raison d'une lésion de la moelle épinière (SCI), l'incidence de la TVP est égale à celle de la population générale . Les mécanismes qui protègent contre la TVP pendant l'immobilisation chronique chez les patients atteints de SCI sont inconnus. Thienel et al. rapportent une analyse de la machinerie thrombo-inflammatoire chez des ours bruns hibernants ( Ursus arctos ), qui souffrent rarement de TVP malgré 6 mois d'immobilisation pendant l'hibernation . Ils ont découvert que les plaquettes des ours en hibernation présentent une signature antithrombotique caractérisée par une diminution de l'expression de la protéine de choc thermique 47 (HSP47) et des biomarqueurs globalement réduits de la thromboinflammation par rapport à ceux des ours bruns actifs. De plus, cette signature est conservée dans différentes espèces animales, y compris les souris, les porcs et les humains, ce qui suggère que cela pourrait être une cible thérapeutique pour réduire la TVP chez les patients immobilisés.
https://www.science.org/doi/10.1126/science.adh3276
A LIRE
http://www.facmv.ulg.ac.be/amv/articles/2002_146_4_01.pdf
Non ce n'est pas un poisson d'Avril, l'hibernation de l'ours brun sans MTEV, une solution pour pré²venir la mTEV chez les humains.
Pourquoi ? Parce que la protéomique basée sur la spectrométrie de masse a révélé une signature antithrombotique dans les plaquettes d'ours bruns en hibernation avec la protéine de choc thermique 47 (HSP47) comme protéine la plus réduite.
"La thrombose veineuse profonde (TVP) est une caractéristique courante de l'immobilisation à court terme, qui survient, par exemple, chez les patients atteints de paralysie aiguë. Cependant, en cas d'immobilisation chronique, par exemple en raison d'une lésion de la moelle épinière (SCI), l'incidence de la TVP est égale à celle de la population générale . Les mécanismes qui protègent contre la TVP pendant l'immobilisation chronique chez les patients atteints de SCI sont inconnus. Thienel et al. rapportent une analyse de la machinerie thrombo-inflammatoire chez des ours bruns hibernants ( Ursus arctos ), qui souffrent rarement de TVP malgré 6 mois d'immobilisation pendant l'hibernation . Ils ont découvert que les plaquettes des ours en hibernation présentent une signature antithrombotique caractérisée par une diminution de l'expression de la protéine de choc thermique 47 (HSP47) et des biomarqueurs globalement réduits de la thromboinflammation par rapport à ceux des ours bruns actifs. De plus, cette signature est conservée dans différentes espèces animales, y compris les souris, les porcs et les humains, ce qui suggère que cela pourrait être une cible thérapeutique pour réduire la TVP chez les patients immobilisés.
https://www.science.org/doi/10.1126/science.adh3276
Un traitement sans effets secondaires ?
La question est de savoir s'il est possible de transférer le mécanisme naturel de l'ours à la physiologie humaine et, par exemple, de l'activer chez les patients contraints à une inactivité prolongée - par exemple les personnes paralysées en raison de lésions de la moelle épinière.
La question est de savoir s'il est possible de transférer le mécanisme naturel de l'ours à la physiologie humaine et, par exemple, de l'activer chez les patients contraints à une inactivité prolongée - par exemple les personnes paralysées en raison de lésions de la moelle épinière.
Il existe déjà plusieurs médicaments largement utilisés pour prévenir les caillots sanguins. La caractéristique commune à tous est qu'ils sont associés à un risque de saignement, qui peut mettre la vie en danger.
Par conséquent, Ole Frøbert voit de grandes perspectives pour le développement de nouveaux médicaments contre les caillots sanguins sur la base des résultats de l'étude.
"Il existe de nombreux mécanismes qui régulent la coagulation sanguine, et nous en avons démontré un autre. Puisque nous avons réussi à réguler négativement HSP47 par manipulation génétique chez la souris, nous pensons que le nouveau mécanisme pourrait ouvrir le développement d'un nouveau type de traitement préventif doux. avec un risque significativement plus faible de saignement et d'autres effets secondaires »
https://biomed.au.dk/display/artikel/researchers-decode-the-secret-of-bears-in-pursuit-of-new-treatment-against-blood-clots
ETUDE EXTRAORDINAIRE !!!!
https://biomed.au.dk/display/artikel/researchers-decode-the-secret-of-bears-in-pursuit-of-new-treatment-against-blood-clots
ETUDE EXTRAORDINAIRE !!!!
A LIRE
http://www.facmv.ulg.ac.be/amv/articles/2002_146_4_01.pdf

