- « Tout le monde est un génie. Mais si vous jugez un poisson sur ses capacités à grimper à un arbre, il passera sa vie à croire qu’il est stupide. » Albert Einstein
- « C’est un de mes mantras – focus et simplicité. La simplicité peut être plus difficile à atteindre que la complexité : il faut travailler dur pour bien penser et faire simple. Mais cela vaut le coup à la fin parce qu’une fois que tu y arrives, tu peux déplacer des montagnes. » Steve Jobs
Luca Saba, Riccardo Cau, Rocco Vergallo, M Eline Kooi, Daniel Staub, Gavino Faa, Terenzio Congiu, George Ntaios, Bruce A Wasserman, John Benson, Valentina Nardi, Rika Kawakami, Giuseppe Lanzino, Renu Virmani, Peter Libby, Carotid artery atherosclerosis: mechanisms of instability and clinical implications, Athérosclérose de l'artère carotide : mécanismes d'instabilité et implications cliniques
https://doi.org/10.1093/eurheartj/ehae933
En IMAGES !
Dans ce spectre, l’athérosclérose de l’artère carotide est une maladie complexe et multiforme, et un précurseur important de l’accident vasculaire cérébral ischémique aigu et d’autres événements cardiovasculaires.
L’interaction complexe entre l’inflammation, le stress oxydatif, le dysfonctionnement endothélial, le métabolisme lipidique et les réponses immunitaires participe au développement des lésions, conduisant à une sténose luminale et à une instabilité potentielle de la plaque.
Même les plaques non sténotiques peuvent précipiter un événement cérébrovasculaire soudain, quel que soit le degré d’empiètement luminal.
Dans ce contexte, les modalités d’imagerie carotidienne ont prouvé leur efficacité pour fournir une caractérisation in vivo des caractéristiques de la plaque, contribuant ainsi de manière substantielle à la stratification du risque des patients et à la gestion clinique.
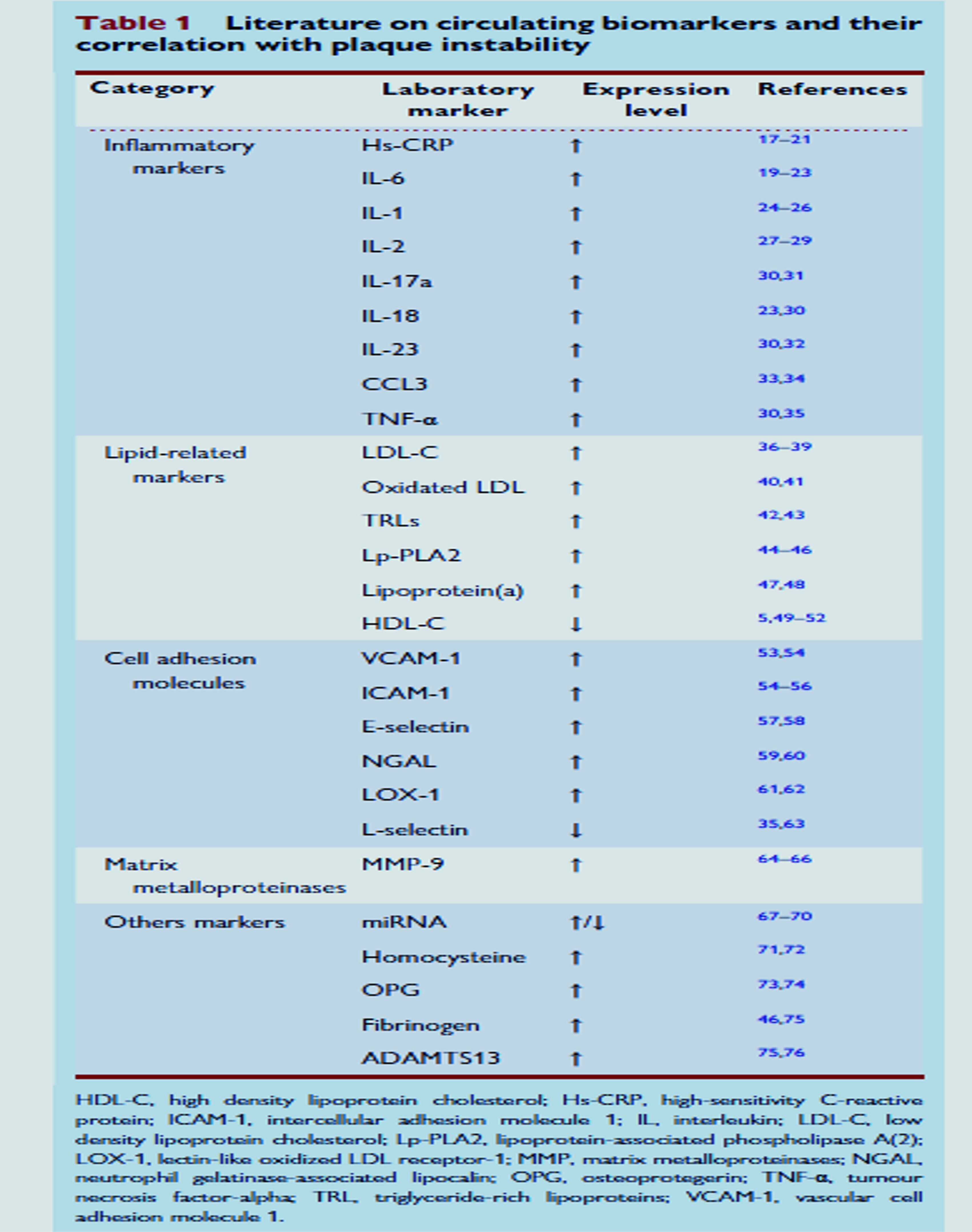
Cette revue souligne l’importance d’identifier les individus à haut risque en utilisant les modalités d’imagerie, les biomarqueurs et les outils de stratification du risque actuels.
De telles approches éclairent l’intervention précoce et la mise en œuvre de stratégies thérapeutiques personnalisées, améliorant ainsi les résultats des patients dans le domaine de la gestion des maladies cardiovasculaires.
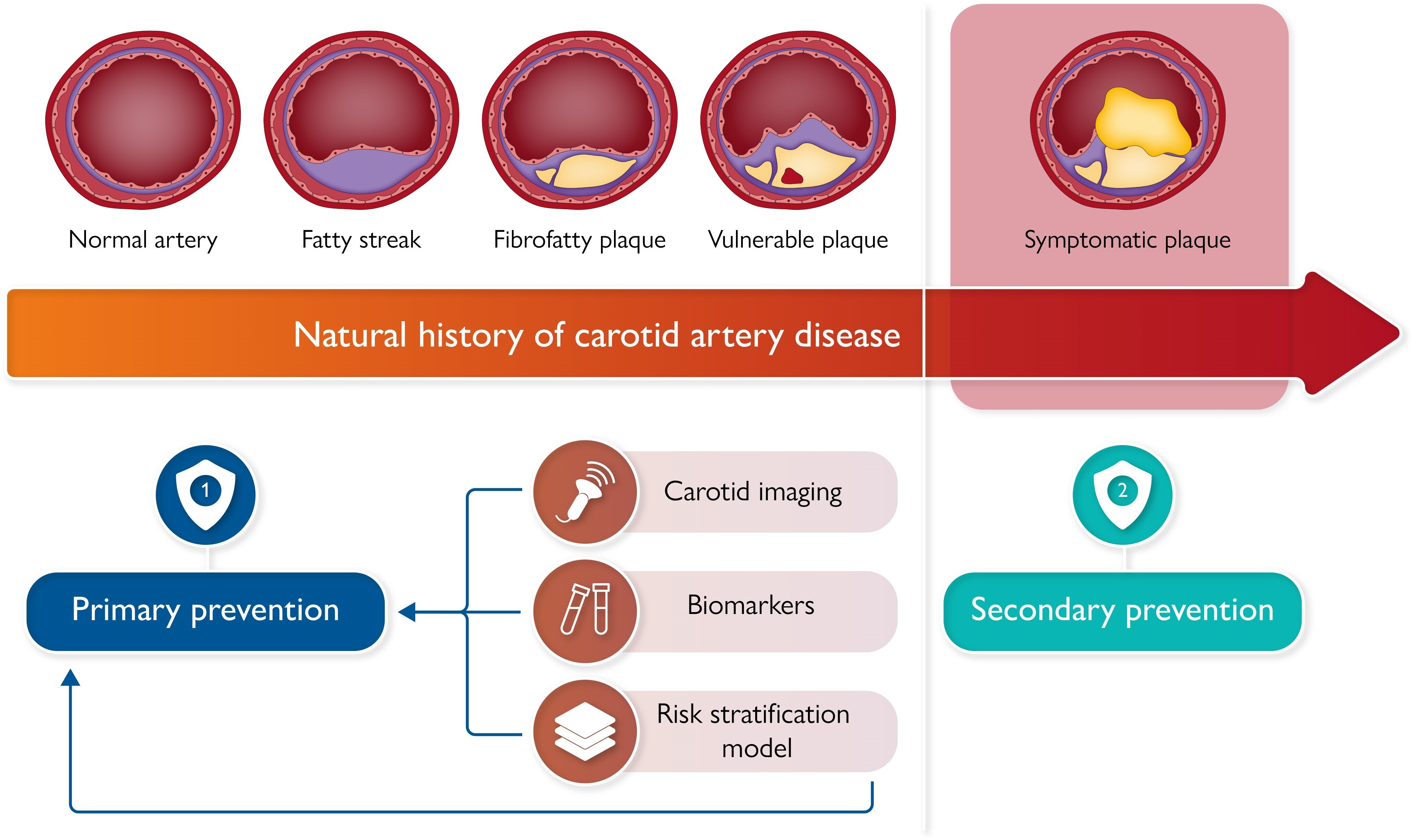
Progression de la plaque athéroscléreuse carotidienne, d'une paroi carotidienne normale à une plaque symptomatique. Les modalités d'imagerie non invasives, les biomarqueurs circulants et les instruments de stratification du risque peuvent modifier cette évolution naturelle.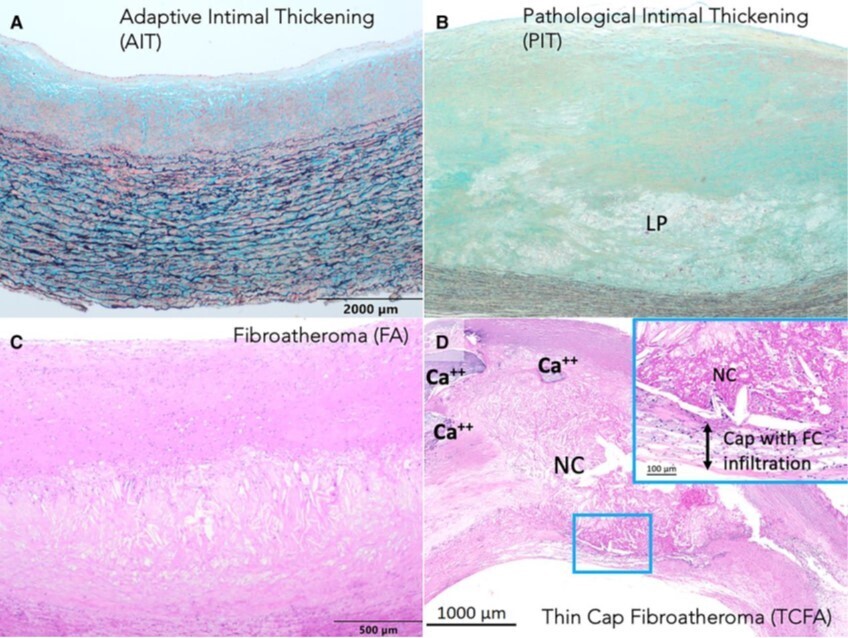
Épaississement intimal adaptatif, épaississement intimal pathologique, fibroathérome et fibroathérome à chape fine. La lésion intimale non athérosclérotique consiste en un épaississement intimal adaptatif (EIA). L'artère carotide commune présente un EIA, composé de cellules musculaires lisses dans une matrice de protéoglycanes (A). La lésion athérosclérotique progressive comprend l'épaississement intimal pathologique (EIP) (B). L'EIP montre une intima épaissie composée de cellules musculaires lisses dans une matrice de protéoglycanes, avec des zones focales de perte de cellules musculaires lisses mais riches en matrice extracellulaire riche en acide hyaluronique et en protéoglycanes mélangés à des graisses neutres, y compris l'apo B, appelées pools lipidiques (B, PL). Peu d'infiltrations de macrophages sont observées dans le PL (B). Notez le pool lipidique infiltré par des macrophages spumeux et la perte de protéoglycanes et de collagène, convertissant le pool lipidique en un noyau nécrotique avec des cholestérols libres, représentant un fibroathérome (C). Le fibroathérome à chape fine se compose d'un grand noyau nécrotique (NN) recouvert d'une fine chape fibreuse (≤165 μm) (D) avec une infiltration substantielle de macrophages et quelques lymphocytes T. Notez la présence de calcium vers la média. EIA, épaississement intimal adaptatif ; PL, pool lipidique ; NN, noyau nécrotique ; EIP, épaississement intimal pathologique. (A et B) Coloration pentachrome de Movat (MP), (C et D) coloration à l'hématoxyline et à l'éosine (H&E)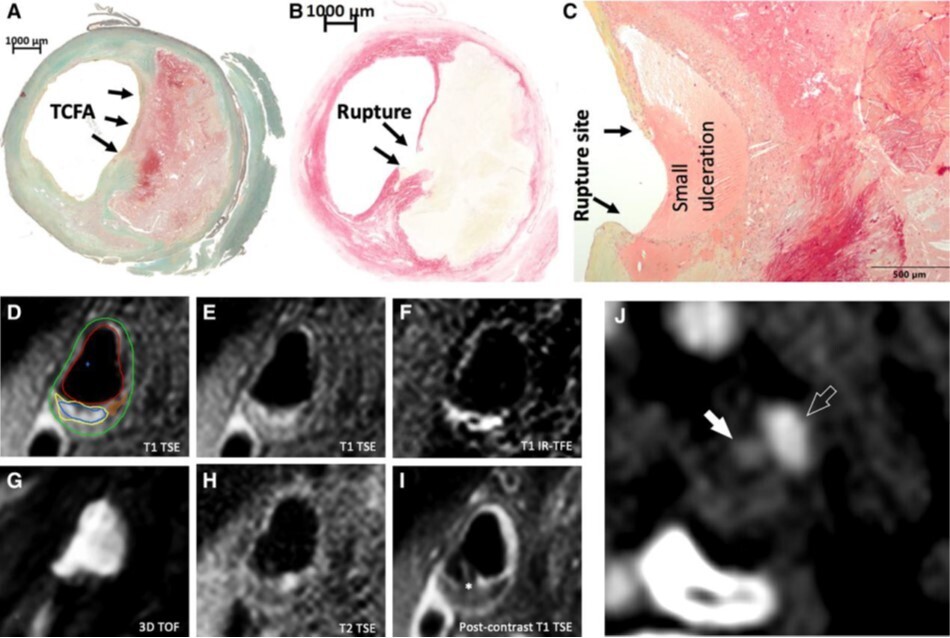
Rupture de plaque avec ulcération superficielle. Le panneau A montre un fibroathérome à chape fine (flèches). Le panneau B, coloré au rouge Picro Sirius, montre la zone du site de rupture et la chape fine au site de rupture. Le panneau C montre la petite ulcération superficielle sous-jacente. (D-I) Images IRM multi-séquences d'une plaque carotidienne avancée à la bifurcation de l'artère carotide droite. Les parois interne et externe du vaisseau sont délimitées sur l'image pré-contraste T1 pondérée en sang noir turbo spin echo (TSE) (D et E). Une région calcifiée (brune en D) apparaît sombre sur toutes les pondérations IRM. L'hémorragie intraplaque (D) est identifiée comme un signal hyperintense dans la majeure partie de la plaque sur l'image d'inversion-recovery turbo field echo (IR-TFE) (F). Le noyau nécrotique riche en lipides (LRNC) (D) peut être identifié comme une région qui ne se rehausse pas sur l'image T1w TSE sang noir post-contraste (I). La chape fibreuse apparaît comme une région avec rehaussement de contraste recouvrant le LRNC. Cette région avec rehaussement du signal est interrompue, ce qui indique une chape fibreuse fine ou rompue (astérisque en I). (J) Examen CTA montrant un rehaussement globulaire après administration de produit de contraste (flèche blanche) dans la plaque de la CI gauche dans la portion de la plaque en contact direct avec la lumière opacifiée est visible. Ceci est probablement dû à la rupture de la chape fibreuse et au contact direct du flux sanguin opacifié avec la plaque. 3D TOF, temps de vol tridimensionnel ; CI, artère carotide interne ; IR-TFE, inversion-recovery turbo field echo ; LRNC, noyau nécrotique riche en lipides ; TCFA, fibroathérome à chape fine ; TSE, turbo spin echo. (A et C) Coloration H&E, (B) Coloration rouge Picro Sirius
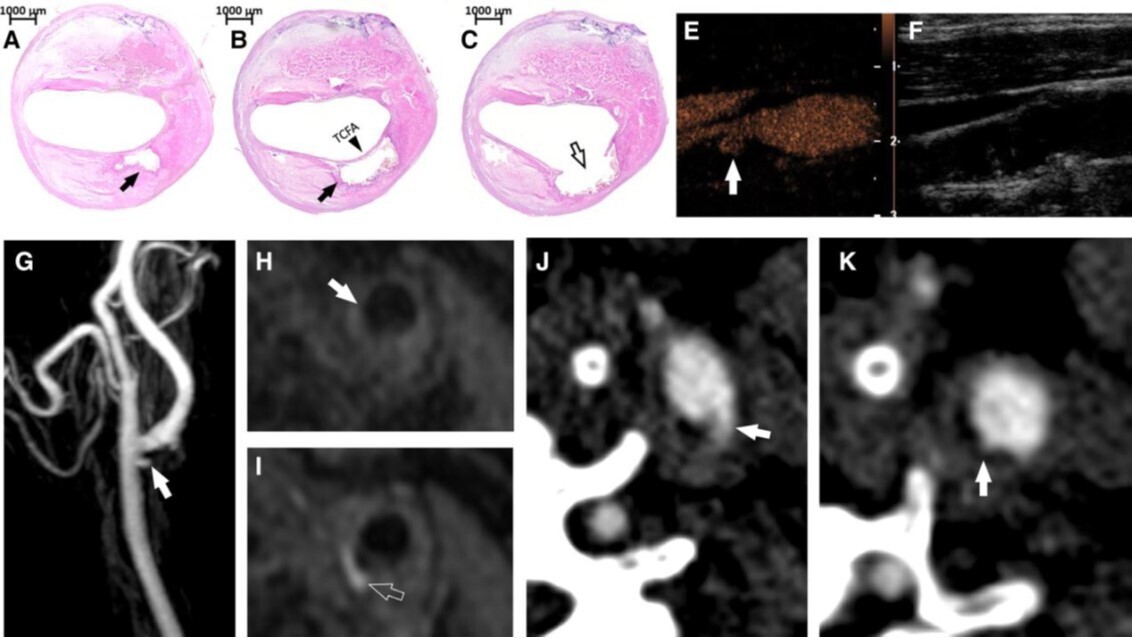
Rupture de plaque avec un large ulcère. Coupes sériées de l'artère carotide interne avec coloration H&E. Notez une zone d'ulcère pénétrant dans les panneaux A et B (flèches noires) et la fine chape fibreuse dans le panneau B (pointe de flèche noire). Le panneau C montre le site de rupture (flèches noires ouvertes). L'échographie avec contraste à microbulles (E) et sans contraste à microbulles (F) montre la présence de l'ulcération visible uniquement avec l'utilisation des microbulles (flèche blanche), alors qu'elle n'est pas visible avec l'échographie conventionnelle. L'ARM 3D reformatée post-gadolinium (G) démontre une petite ulcération juste en amont de la bifurcation carotidienne (flèche blanche pleine). L'ulcération est visible sur les images T1 SPACE sans contraste (flèche blanche, H). De plus, un rehaussement marqué est observé autour de l'ulcération sur les images T1 SPACE post-contraste (flèche blanche ouverte, I). Les panneaux J et K montrent le cas d'un patient où deux ulcères différents sont visibles (flèches blanches en J et K). H&E, hématoxyline et éosine ; NC, noyau nécrotique ; SPACE, Sampling Perfection with Application optimized Contrast using different flip angle Evolution ; TCFA, fibroathérome à chape fine
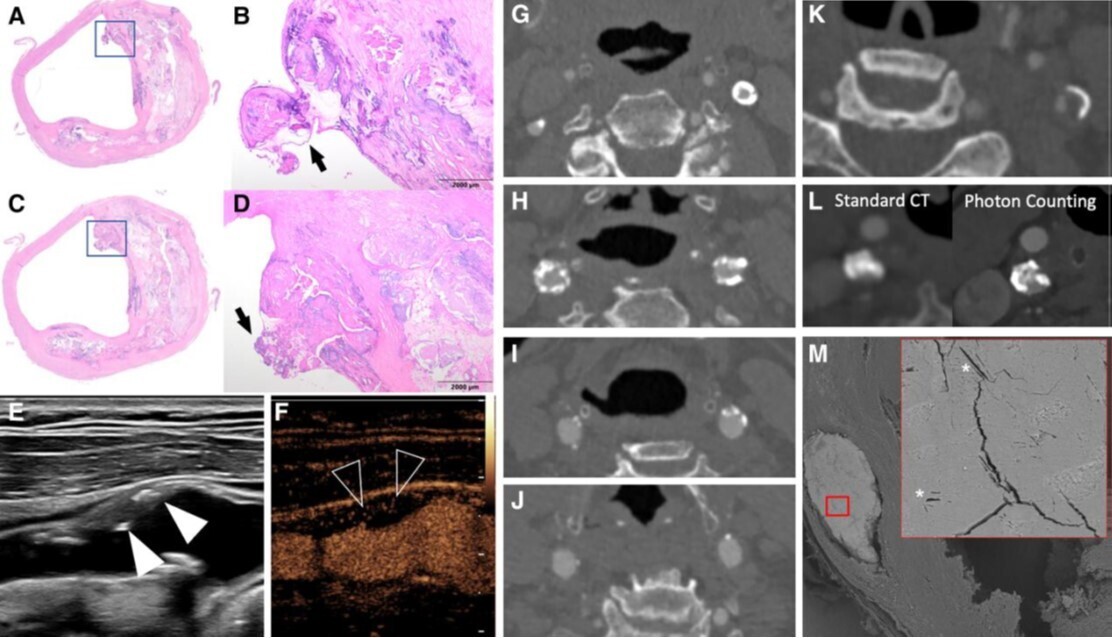
Plaque fibrocalcifique avec zones de calcification nodulaire. Des coupes sériées du spécimen d'endartériectomie carotidienne sont présentées dans les panneaux A et C. La présence de nodules à fort grossissement est montrée dans les panneaux B et D de la zone nodulaire. La calcification nodulaire consiste en des nodules de calcium séparés par du tissu collagéneux. La surface luminale montre la présence de cellules endothéliales. Dans les panneaux E et F, l'échographie en mode B (E) et après injection de microbulles (F) sont présentées. L'imagerie en mode B montre une plaque principalement hypoéchogène avec des parties hyperéchogènes et des calcifications à l'origine de l'artère carotide interne (flèches en E). Une néovascularisation intraplaque extensive est visible sur l'échographie de contraste (CEUS) (pointe de flèche ouverte en F) ainsi que des irrégularités de surface de la plaque. Dans les panneaux G-M, l'imagerie CTA montre différents types de configurations et densités de calcium. Dans le panneau L, la différence de visualisation et de résolution partielle entre le PCCT et le CT conventionnel est présentée. Dans le panneau H, l'imagerie MIP-CTA est fournie pour montrer la différence de charge calcique dans les artères carotides droite (flèche blanche) et gauche (flèches blanches ouvertes). CEUS, échographie de contraste ; PCCT, tomodensitométrie à comptage de photons ; MIP, projection d'intensité maximale. (A-D) Coloration H&
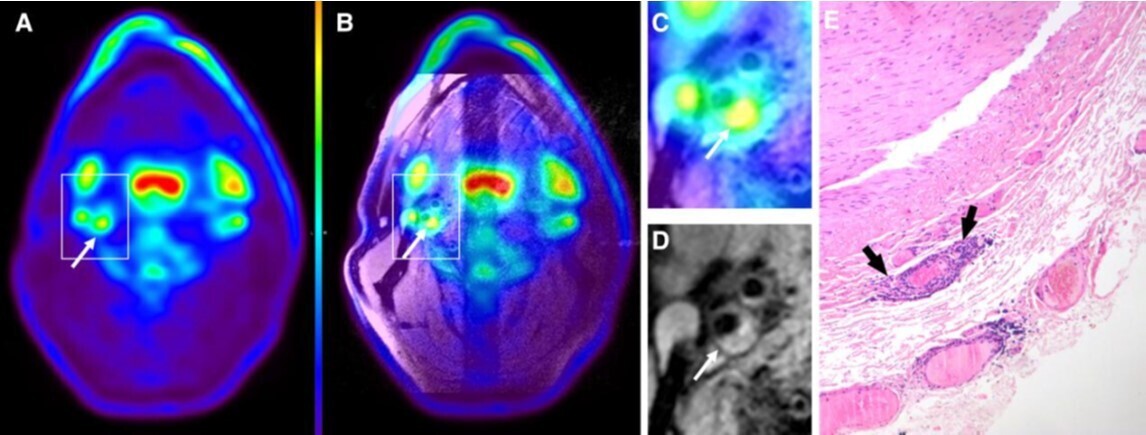
PET-IRM et Inflammation. L'image TEP au 18F-FDG du cou d'un patient symptomatique avec une plaque ipsilatérale dans l'artère carotide droite est affichée. Une superposition colorée de l'image TEP (comme montré en A) est superposée sur l'image IRM correspondante, illustrant la captation de 18F-FDG (B). Un agrandissement de l'artère carotide droite est fourni dans le panneau C. L'image IRM pondérée T1 en écho de spin rapide correspondante indique une grande plaque dans l'artère carotide interne (D). Dans le panneau E, une plaque carotidienne à un grossissement de 300× est montrée, révélant la présence d'un vaisseau à l'intérieur, entouré d'une large population de cellules inflammatoires (flèches noires en D). (E) Coloration H&E
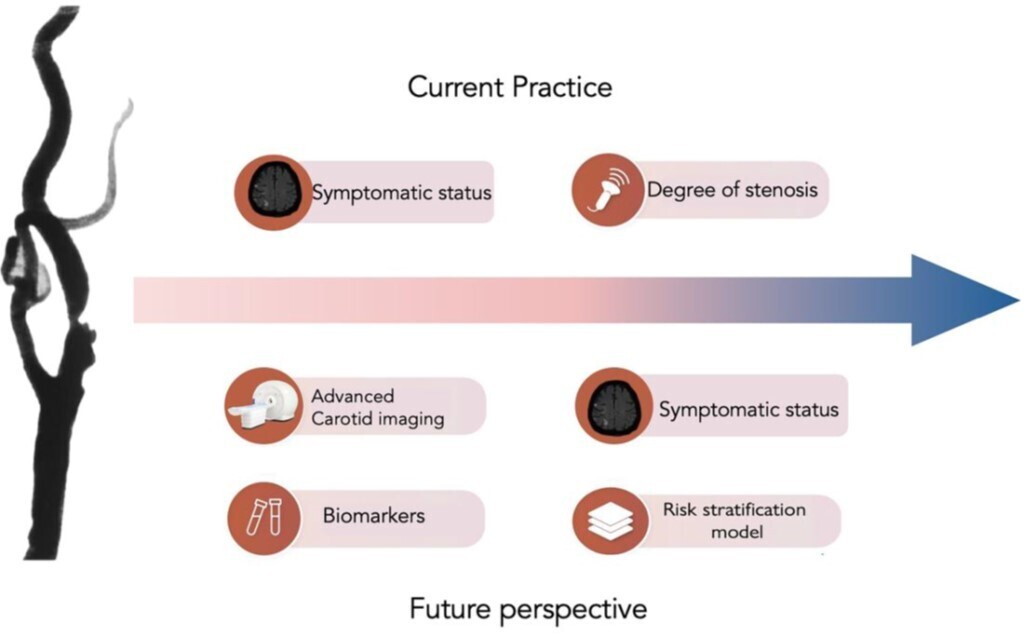
Approches actuelles et futures de la gestion de l'athérosclérose de l'artère carotide. La figure contraste la pratique clinique actuelle dans la gestion de l'athérosclérose de l'artère carotide avec les tendances émergentes qui pourraient façonner la gestion future, illustrant le passage d'une approche centrée sur la sténose à un modèle d'évaluation globale du risque qui intègre l'imagerie, les biomarqueurs et les profils de risque individualisés des patients.Panneau supérieur (pratique actuelle) : représente l'approche standard, où les décisions de traitement sont principalement basées sur le degré de sténose carotidienne et le statut symptomatique du patient
.Panneau inférieur (perspective future) : met en évidence les avancées dans le domaine, notamment l'utilisation de modalités d'imagerie avancées qui se concentrent sur la morphologie et la composition de la plaque, ainsi que l'intégration de nouveaux biomarqueurs et de modèles de stratification du risque
- Malgré les progrès dans la compréhension de l'athérosclérose, l'AVC reste une cause majeure de morbidité et de mortalité à l'échelle mondiale
- Les préoccupations des patients concernant la perte d'indépendance, de mobilité et de capacité à communiquer due aux AVC sont importantes
- Les soins aigus et chroniques ainsi que la réadaptation post-AVC représentent un fardeau considérable pour les systèmes de santé
- L'amélioration des modalités d'imagerie, potentiellement soutenue par des modèles "-omiques" et des biomarqueurs circulants, pourrait ouvrir de nouvelles voies pour la médecine de précision
- Ces avancées pourraient conduire à des approches préventives et thérapeutiques personnalisées pour les patients et les plaques à haut risque
- L'application de l'intelligence artificielle (IA) et de l'apprentissage automatique devrait bientôt élargir, mécaniser et standardiser l'interprétation des études d'imagerie
- Des essais cliniques randomisés supplémentaires sont nécessaires pour établir le rôle prédictif de l'imagerie des plaques, en conjonction avec les avancées technologiques et les modèles de stratification des risques combinés, dans la prise de décision clinique
Plaque carotidienne vulnérable by MISTRAL IA
Une plaque carotidienne vulnérable est une formation athérosclérotique dans les artères carotides qui présente un risque élevé de rupture, ce qui peut entraîner des complications graves comme un accident vasculaire cérébral (AVC).
Voici quelques caractéristiques typiques d'une plaque carotidienne vulnérable :
-
Grande taille de la nécrose lipidique : Une plaque vulnérable contient souvent une grande quantité de lipides, formant un noyau lipidique volumineux.
-
Fine capsule fibreuse : La capsule fibreuse qui recouvre le noyau lipidique est mince et fragile, augmentant le risque de rupture.
-
Inflammation : La présence de cellules inflammatoires, comme les macrophages et les lymphocytes, indique une activité inflammatoire élevée.
-
Hémorragie intraplaque : La présence de vaisseaux sanguins néoformés (néovascularisation) dans la plaque peut entraîner des hémorragies intraplaques, augmentant ainsi le risque de rupture.
-
Calcifications : Bien que les calcifications puissent stabiliser certaines plaques, une calcification ponctuelle ou irrégulière peut être un signe de vulnérabilité.
-
Instabilité mécanique : La plaque peut présenter des signes de stress mécanique, comme des fissures ou des ulcérations, qui augmentent le risque de rupture.
-
Activité enzymatique : La présence d'enzymes protéolytiques, comme les métalloprotéinases de matrice (MMP), qui dégradent la matrice extracellulaire, peut contribuer à la fragilité de la capsule fibreuse.
-
Réduction de la couche de cellules musculaires lisses : Une diminution du nombre de cellules musculaires lisses dans la capsule fibreuse peut également contribuer à la vulnérabilité de la plaque.
Ces caractéristiques peuvent être évaluées par diverses techniques d'imagerie, comme l'échographie Doppler, la tomodensitométrie (CT scan), l'imagerie par résonance magnétique (IRM), et parfois par des techniques plus avancées comme l'imagerie moléculaire.
Quel le meilleur moyen de mettre en évidence une plaque carotidienne vulnérable ?
Mettre en évidence une plaque carotidienne vulnérable nécessite l'utilisation de techniques d'imagerie avancées qui permettent de visualiser non seulement la structure de la plaque, mais aussi ses caractéristiques internes et son activité biologique. Voici quelques-unes des méthodes les plus efficaces :
-
Échographie Doppler :
- Avantages : Non invasive, largement disponible, et permet de visualiser la morphologie de la plaque et le flux sanguin.
- Limitations : Moins précise pour évaluer les caractéristiques internes de la plaque.
-
Imagerie par Résonance Magnétique (IRM) :
- Avantages : Haute résolution et capable de détecter des caractéristiques spécifiques comme le noyau lipidique, l'hémorragie intraplaque, et l'inflammation.
- Limitations : Coûteuse et peut nécessiter des agents de contraste.
-
Tomodensitométrie (CT scan) :
- Avantages : Permet de visualiser les calcifications et la morphologie de la plaque.
- Limitations : Exposition aux radiations et moins précise pour les caractéristiques internes de la plaque par rapport à l'IRM.
-
Tomographie par Émission de Positons (TEP) :
- Avantages : Utilise des traceurs spécifiques pour détecter l'activité inflammatoire et métabolique dans la plaque.
- Limitations : Coûteuse et nécessite l'injection de traceurs radioactifs.
-
Imagerie Moléculaire :
- Avantages : Permet de visualiser des processus biologiques spécifiques comme l'inflammation et l'activité enzymatique.
- Limitations : Encore en développement et moins largement disponible.
-
Angiographie par Résonance Magnétique (ARM) :
- Avantages : Non invasive et permet de visualiser les artères carotides sans utiliser de produits de contraste iodés.
- Limitations : Moins précise pour les détails internes de la plaque par rapport à l'IRM standard.
-
Échographie Intravasculaire (IVUS) :
- Avantages : Permet une visualisation très détaillée de la plaque de l'intérieur de l'artère.
- Limitations : Invasive et nécessite une procédure de cathétérisme.
-
Optical Coherence Tomography (OCT) :
- Avantages : Très haute résolution pour visualiser les détails internes de la plaque.
- Limitations : Invasive et nécessite une procédure de cathétérisme.
Recommandations
Pour une évaluation complète et précise, une combinaison de ces techniques peut être utilisée. Par exemple, l'IRM peut être utilisée pour une évaluation initiale non invasive, suivie d'une TEP pour évaluer l'activité inflammatoire si nécessaire.
Conclusion
Le choix de la méthode dépendra des ressources disponibles, de l'état clinique du patient, et des objectifs spécifiques de l'évaluation. Une consultation avec un spécialiste en imagerie vasculaire ou un cardiologue est essentielle pour déterminer la meilleure approche......UN MEDECIN VASCULAIRE AUSSI cher MISTRAL IA !
Commentaire
Mettre en evidence le caractère vulnrérable d'une plque carotidienne est possible à la condition d'utiliser des techniques validées, utiles et faisables. Il existe une "avalanche de tests" , tous plus ou moins utiles et tous ne sont pas accessibles dans la pratique quotidienne
L'écho-Doppler reste l'un des moyens le plus abouti mais qui pourrait largement bénéficié de l'IA afin d'augmenter ses performance s
"L’analyse de la plaque en IUU par un score multipapamétrique, combinant l’élasticité de plaque et la contrainte de cisaillement, permet une identification des plaques carotidiennes histologiquement instables."
https://www.em-consulte.com/article/1504105/evaluation-de-l-instabilite-de-la-plaque-carotidie

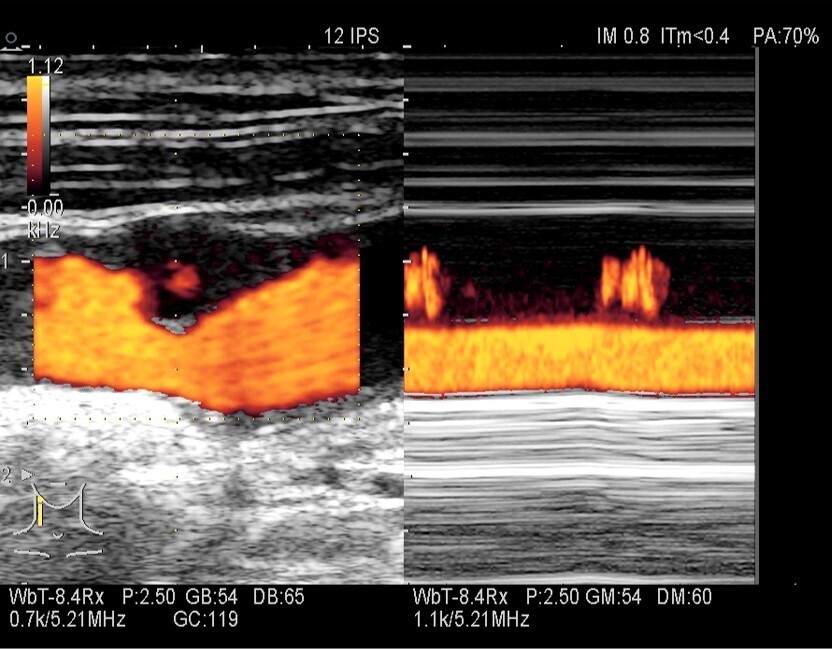 Un écho-
Un écho-Niche dans une plaque carotidienne en TM couleur
Un écho-Doppler / IA devrait presque cocher toutes les cases .......mais comme nous l'avons déjà souligné, les industriels se concentrent sur l'écho-Doppler intelligent dans le but de le rendre accessible à des non médecins . Par contre les spécialistes réclament autre choses. Disposer d'un écho-Doppler permettant une étude optimale à partir des données anatomiques et hémodynamiques d'une sténose carotidienne. C'est possible à la condition d'avoir les équipes pour............le concept d'un appreil multiparamétrique serait un très bon début
A LIRE
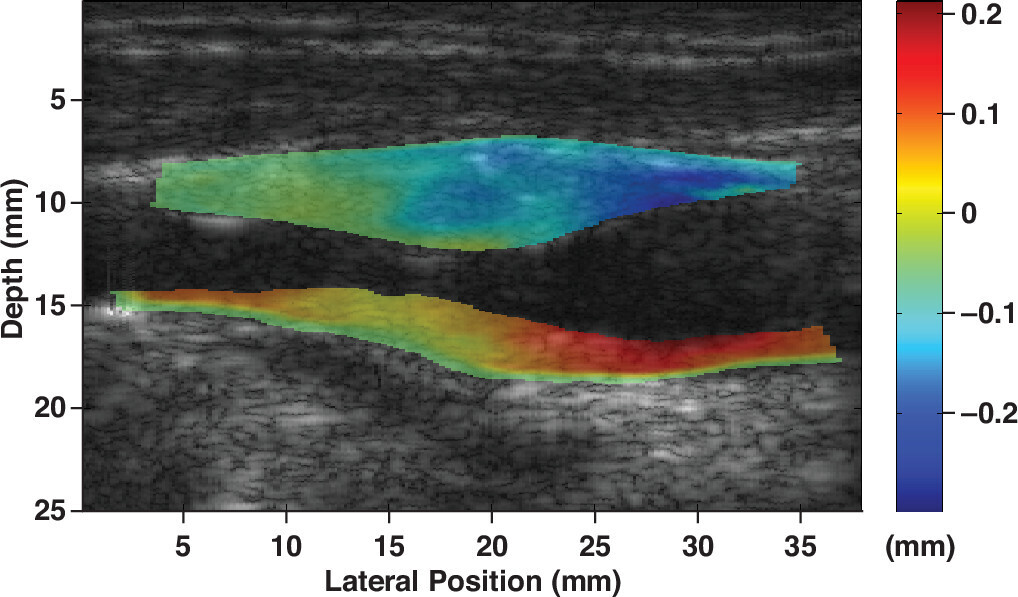
Roy Cardinal MH, Heusinkveld MHG, Qin Z, Lopata RGP, Naim C, Soulez G, Cloutier G. Carotid Artery Plaque Vulnerability Assessment Using Noninvasive Ultrasound Elastography: Validation With MRI.
Évaluation de la vulnérabilité des plaques carotidiennes par élastographie ultrasonore non invasive : validation par IRM
AJR Am J Roentgenol. 2017 Jul;209(1):142-151. doi: 10.2214/AJR.16.17176. Erratum in: AJR Am J Roentgenol. 2017 Sep;209(3):709. doi: 10.2214/AJR.17.18743. PMID: 28639927.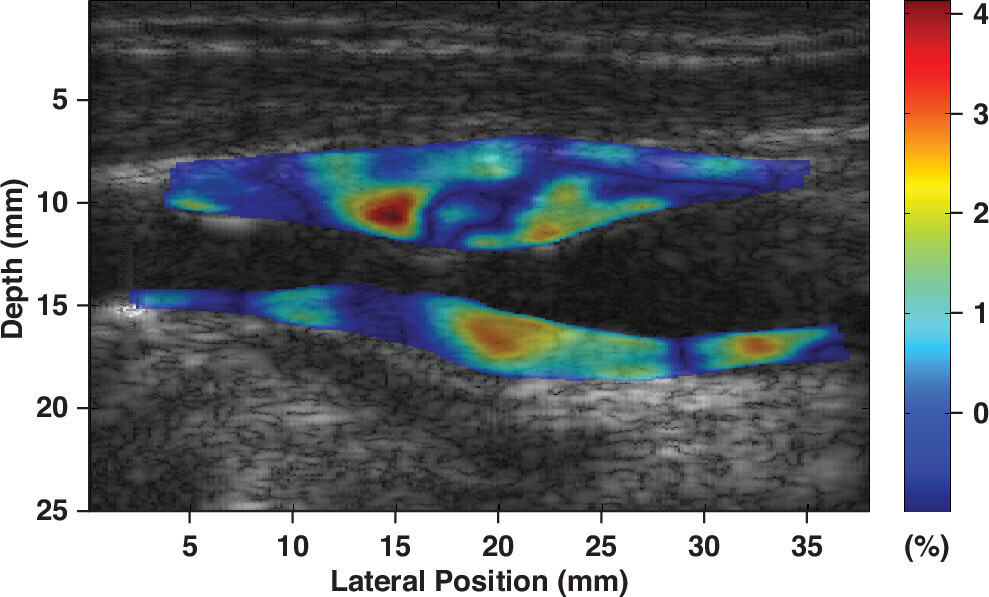
Homme de 76 ans présentant une sténose de 60 % de l'artère carotide interne. Des images longitudinales bidimensionnelles en mode B reconstruites à partir de données de radiofréquence avec des images d'élastographie vasculaire non invasive superposées montrent une plaque segmentée sur les parois éloignées et proches de l'artère carotide avec différentes composantes d'élastogramme.
https://www.ajronline.org/doi/10.2214/AJR.16.17176
Libre d'accès

