-
"Nous travaillons sur des vaccins individualisés contre certains cancers."
-
" Le but est de stimuler les propres défenses immunitaires du patient pour l’aider à lutter contre les cellules cancéreuses existantes. On ne cherche pas à s’attaquer au cancer directement, comme avec une chimiothérapie, mais à aider l’organisme à le combattre."
-
"Les vaccins n’ont pas d’effets secondaires importants."
-
" Depuis 2015, un autre vaccin s’avère aussi efficace contre le mélanome métastatique : le talimogène, qui s’appuie sur l’inoculation d’un virus modifié de l’herpès. Et récemment, des essais de phases III se sont avérés concluants pour un vaccin thérapeutique contre le cancer du poumon. À chaque fois, les patients développent des anticorps efficaces contre les cellules cancéreuses. "Pr Christophe Le Tourneau - Institut Curie / PERPLEXITY/IA
"je me vaccinerai conte le cancer"
Citation Information: J Clin Invest. 2025;135(13):e195673. https://doi.org/10.1172/JCI195673.
https://www.jci.org/articles/view/195673
-
Le système immunitaire est finement réglé pour nous protéger des agents pathogènes étrangers, mais il peut également détecter de nouveaux antigènes exprimés lors du développement du cancer.
Le cancer est un adversaire redoutable, où les cellules hôtes se transforment et s'adaptent avec souplesse pour échapper aux réponses immunitaires et les atténuer.
D'ici 2050, le fardeau mondial du cancer devrait atteindre le chiffre impressionnant de 35 millions de nouveaux cas par an.
Forts des enseignements tirés de l'exploitation du système immunitaire pour lutter contre les maladies infectieuses, les vaccins constituent un outil offrant un potentiel considérable pour réduire considérablement le fardeau mondial du cancer.Un horizon émergent est celui des vaccins thérapeutiques contre le cancer, qui ciblent le système immunitaire de manière plus précise que les thérapies actuelles.
Nous abordons ici l'état actuel des vaccins pour la prévention du cancer, les efforts en cours pour développer des vaccins contre le cancer et les défis qui restent à relever dans ce domaine.Les vaccins jouent un rôle important dans la prévention du cancer.
Le carcinome hépatocellulaire (CHC) représente 90 % de tous les cas de cancer primitif du foie, se classant au troisième rang en termes de mortalité parmi tous les cancers, et plus de la moitié des cas de CHC sont imputables à une cirrhose associée à une infection chronique par le virus de l'hépatite B (VHB) . Le vaccin contre le VHB, disponible depuis les années 1980, permettra d'éviter environ 38 millions de décès chez les personnes nées entre 2000 et 2030 et d'économiser plus de 120 milliards de dollars sur la même période, faisant de la vaccination le moyen le plus efficace et le plus économique de prévenir le CHC lié au VHB.
De même, il a été démontré que l'adoption généralisée de vaccins ciblant le virus du papillome humain (VPH) réduit efficacement l'incidence de plusieurs cancers et a le potentiel d'éliminer pratiquement le risque de cancer du col de l'utérus .
Environ un sixième de tous les cancers humains résultent de seulement sept virus, et la lutte contre ces virus par la vaccination représente une énorme opportunité de réduire l'incidence du cancer dans le monde, à moindre coût et à vie.
Cette ampleur d’effet ne peut être sous-estimée.Les vaccins offrent également une possibilité de prévention contre les cancers non viraux.
Par exemple, le syndrome de Lynch, une maladie génétique, prédispose les individus à divers cancers, tous résultant de défauts génétiques prévisibles des gènes responsables de la réparation des mésappariements de l'ADN. Des études préliminaires sont en cours sur les personnes atteintes du syndrome de Lynch afin de déterminer si les vaccins ciblant des néoantigènes communs définis (nouveaux antigènes qui se forment dans les tumeurs suite à des mutations génétiques) peuvent prévenir ou retarder le cancer .Il est à noter que l'administration de vaccins pour orienter l'immunité ne doit pas se limiter à la prévention du cancer. Grâce aux technologies disponibles, les vaccins peuvent orienter le système immunitaire contre les cellules cancéreuses de manière à améliorer le contrôle de la maladie et à réduire la toxicité en introduisant un niveau de spécificité indispensable. Les promesses de cette approche reflètent l'aboutissement d'une longue tradition de renforcement de notre système immunitaire pour traiter le cancer.
- La longue saga de l'immunité et du cancer
L'idée de mobiliser le système immunitaire pour combattre le cancer remonte à l'Antiquité.
En 2700 avant J.-C., le médecin égyptien Imhotep aurait induit des infections sur des tumeurs dans le cadre d'une stratégie thérapeutique.
Poursuivant ce concept, des interventions telles que le vaccin contre le bacille de Calmette-Guérin (BCG), qui agit comme un agent non spécifique déclenchant une réaction immunitaire au niveau de la muqueuse vésicale et est appliqué dans le cancer de la vessie non invasif sur le plan musculaire, ont été développées et demeurent une norme de soins aujourd'hui . Ces premiers outils, comme d'autres, étaient toutefois limités par leur manque de spécificité antigénique.
La découverte d'antigènes tumoraux spécifiques a marqué l'avènement de la thérapie de précision, permettant la mise au point de vaccins anticancéreux ciblant des protéines spécifiques des cellules cancéreuses. Malgré des profils de sécurité étonnants pour les vaccins anticancéreux, les conceptions de première génération et la sous-estimation de la forte résistance du cancer à une réponse immunitaire ont donné lieu à une série de tentatives décevantes de démontrer une réponse clinique substantielle .
L'espoir renouvelé pour les vaccins contre le cancer a repris avec l'approbation en 2011 de la première immunothérapie vaccinale à base de cellules dendritiques, connue sous le nom de sipuleucel-T.
Mais cet enthousiasme était prématuré ; le sipuleucel-T peut prolonger la survie de certains sous-groupes de patients atteints d'un cancer de la prostate , mais le coût et la modeste prolongation de la survie chez les patients individuels ont limité l’impact.En fin de compte, l'essor des inhibiteurs de points de contrôle immunitaires (ICI) pourrait constituer la plus grande opportunité pour que la thérapie vaccinale change la donne .
Les ICI fonctionnent en faisant basculer le délicat équilibre interne des lymphocytes T CD8 + de l'auto-tolérance vers l'élimination du cancer.
Les ICI sont largement reconnus pour leurs réponses durables qui peuvent survenir chez de nombreux patients atteints de cancer, ce qui a un impact sur l'issue à l'échelle de la population ; cependant, les réponses individuelles sont imprévisibles et variables. Les chercheurs étudient désormais des stratégies visant à améliorer l'efficacité ou à élargir l'admissibilité à ces traitements en réduisant les effets secondaires indésirables dus aux toxicités liées au système immunitaire . À l'ère de la médecine personnalisée, les immunothérapies devraient exploiter les connaissances acquises grâce à la recherche sur les maladies infectieuses et l'auto-immunité pour affiner les modalités de traitement afin qu'elles soient plus sûres, plus efficaces et plus spécifiques contre le cancer. La vaccination est une approche idéale pour répondre à ce besoin.
- La synergie entre les vaccins contre le cancer et l'immunothérapie
Les ICI sont plus efficaces lorsque les lymphocytes T CD8 + sont déjà présents dans ou autour d'une tumeur. Tous les lymphocytes T CD8 + ne se valent pas, et les meilleures réponses sont obtenues lorsque le compartiment des lymphocytes T CD8 + est de type « souche », doté de la capacité de se répliquer et de détruire la tumeur .
Cependant, les cellules tumorales sont extrêmement résistantes et adaptent leurs mécanismes pour contrer les envahisseurs immunitaires. Les dommages continus à l'ADN, la reprogrammation épigénétique et la croissance non régulée créent des opportunités d'évolution tumorale tout en générant un catalogue de néoantigènes. Ces néoantigènes apparaissant au cours du développement tumoral représentent des cibles potentielles pour la vaccination thérapeutique.
Malheureusement, seule une fraction des néoantigènes connus provoque des réponses notables des lymphocytes T dans les tumeurs, et les lymphocytes T spécifiques des néoantigènes présents dans les tumeurs sont souvent « épuisés », incapables de tuer la tumeur ou de répondre efficacement à l'ICI . Moins de la moitié des mutations à haute fréquence dans le cancer sont susceptibles de se lier aux allèles HLA-A ou B les plus courants, ce qui réduit les chances de succès des vaccins néoantigènes « prêts à l'emploi ».
Cependant, les caractéristiques génomiques qui apparaissent au cours de la tumorigenèse, telles que l'expression de rétrovirus endogènes, offrent des possibilités d'expression de néoantigènes. Les vaccins anticancéreux personnalisés étaient jusqu'à présent inaccessibles, compte tenu de l'étendue des mécanismes conservés inhérents à la sélection thymique négative pour éliminer les lymphocytes T autoréactifs. Les vaccins anticancéreux dirigés contre les auto-antigènes suffisamment modifiés pour être considérés comme des néoantigènes nécessitent une approche précise pour éviter de déclencher une auto-immunité , mais les progrès actuels en matière de technologie de vaccination sont sur le point de faire des vaccins personnalisés contre le cancer une réalité.
- Améliorations de la vaccination
-
Le développement de vaccins à base d'ARN représente une avancée majeure pour la recherche et la mise en œuvre de vaccins contre le cancer.
Les vaccins à ARN reposent sur des décennies de recherche fondamentale, mais la pandémie mondiale de COVID-19 a accéléré le développement de la technologie vaccinale. Les vaccins à ARNm représentent une méthode de déploiement moins coûteuse, plus rapide et plus évolutive que les vaccins classiques à base de peptides, essentielle au développement de vaccins personnalisés contre le cancer. La vaccination de millions de personnes avec des vaccins à ARNm a démontré leur excellent profil de sécurité . Actuellement, plusieurs stratégies et vecteurs différents sont étudiés pour personnaliser la formulation des vaccins afin de cibler des organes et des types de cancer spécifiques . Ces stratégies de vaccination bénéficient d’années de recherche, non seulement sur les structures améliorées des vaccins, mais aussi sur les autres facteurs qui déterminent la manière dont nous dirigeons les cellules T.Les voies de vaccination, les considérations temporelles, ainsi que les adjuvants et les immunostimulants, influencent tous la réponse immunitaire induite par le vaccin, son efficacité, la dose d'antigène requise et sa toxicité.
Modifier le paradigme actuel de l'administration intramusculaire en faveur de l'administration intraveineuse , intradermique, intranodale et même muqueuse a amélioré l'immunité durable.Administrer un ICI avant un vaccin anticancéreux peut annuler l'effet curatif de l'association. Il est donc essentiel de déterminer le moment opportun pour administrer les vaccins anticancéreux avec ICI afin d'obtenir la meilleure réponse. Idéalement, dans un futur paradigme de traitement personnalisé, la vaccination serait intégrée aux soins aux patients : la tumeur d’un patient pourrait être retirée chirurgicalement, l’ADN tumoral séquencé, les néoantigènes immunogènes déterminés à l’aide de modèles in silico et d’IA, et les vaccins développés efficacement à l’aide de la technologie de l’ARNm pour être administrés comme un modulateur immunitaire personnalisé en fonction de la génétique du cancer du patient ( Figure 1 ). Si l’on compare cela aux fardeaux de la radiothérapie, des thérapies systémiques et des thérapies cellulaires adoptives où les effets indésirables graves sont fréquents, il est clair que les vaccins contre le cancer représentent une voie potentiellement plus sûre vers un contrôle personnalisé et durable de la maladie et le bien-être des patients.
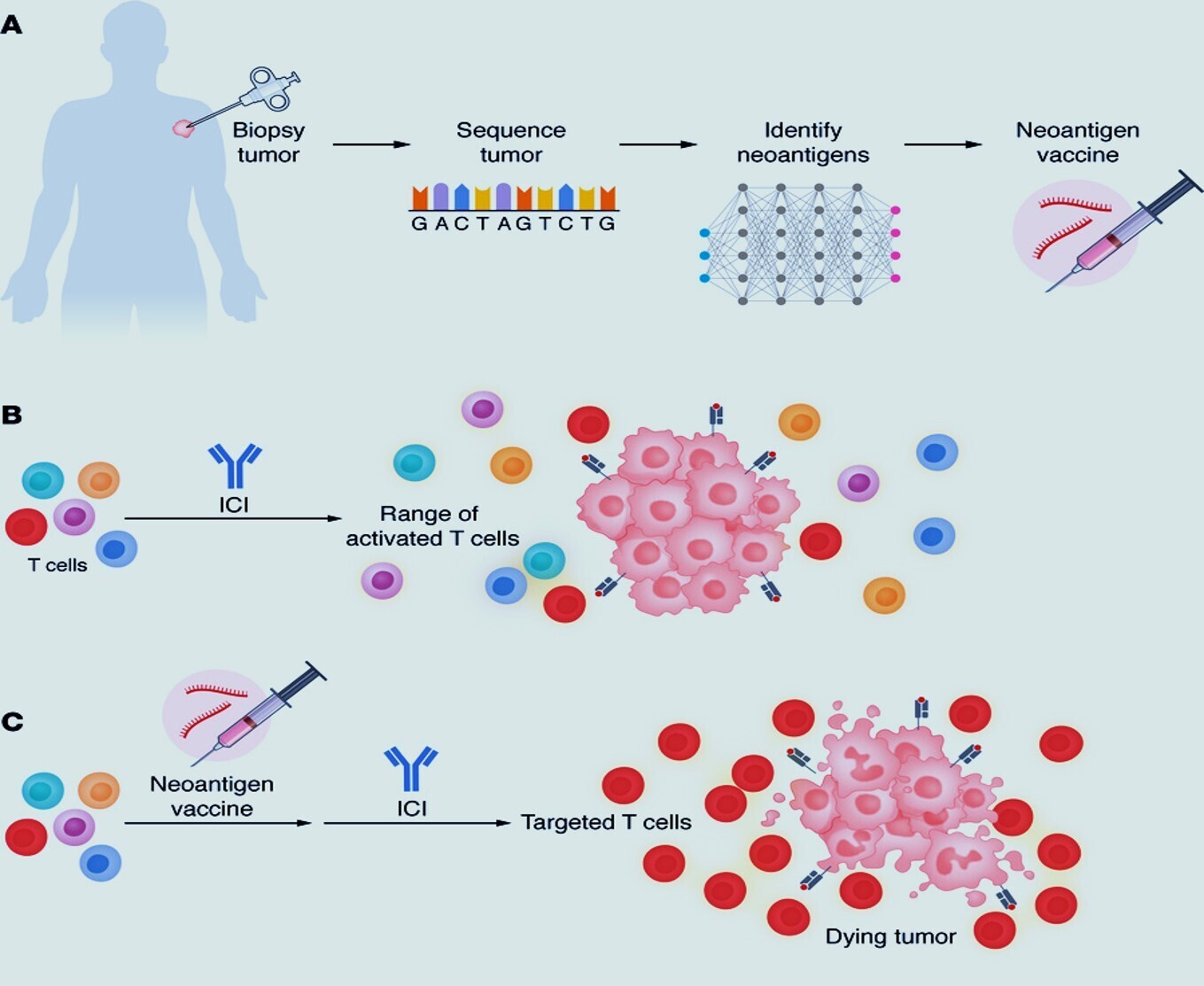
Figure 1
Le processus et les effets des vaccins néoantigènes pour apporter une spécificité à la réponse immunitaire tumorale.
( A ) Un organigramme illustrant les étapes allant de la biopsie tumorale au séquençage des cellules tumorales, à l'identification des néoantigènes, à l'administration du vaccin néoantigène à base d'ARNm.
( B ) L'immunothérapie par anticorps active une gamme de cellules T dans le corps, avec une faible proportion de cellules T spécifiques au cancer.
( C ) Un vaccin néoantigène peut stimuler les cellules T du patient à être ciblées de manière optimale contre les antigènes spécifiques du cancer, et l'ajout d'immunothérapies par anticorps au vaccin néoantigène stimule la réponse des cellules T pour attaquer le cancer.Bien que les études testant ces stratégies soient bien avancées, il est important de connaître l'histoire des vaccins contre le cancer, des traitements prometteurs depuis longtemps qui n'ont pas abouti à une concrétisation clinique significative.
Cette perspective a été renforcée par deux récents essais cliniques à grande échelle sur le mélanome et le glioblastome où les patients vaccinés contre les antigènes associés aux tumeurs n'ont pas obtenu de meilleurs résultats que leurs homologues témoins. Il est important de noter que ces études manquaient des éléments essentiels que sont la spécificité personnalisée et la synergie avec les ICI. L'avenir des vaccins contre le cancer doit tenir compte des leçons du passé afin de mettre en œuvre stratégiquement les avancées de la science fondamentale qui ont ouvert la voie au succès des vaccins contre le cancer.
- La promesse émergente des vaccins personnalisés contre le cancer
-
Plusieurs études récentes ont testé l'association de vaccins anticancéreux et d'ICI en prévention secondaire chez les patients atteints de tumeurs réséquées.
Dans le cas d'un mélanome cutané à haut risque réséqué, les patients ont reçu un vaccin à base de néoantigène à ARNm avec ou sans ICI. À deux ans, le groupe vaccin plus ICI présentait une survie sans récidive (SSR) et une survie sans métastases à distance (SDM) prolongées . Dans le cas d'un CCRcc à haut risque, les patients ont reçu un vaccin à base de peptides néoantigènes et un ICI en postopératoire, et à 40 mois de suivi, aucun des 9 participants n'avait récidivé.
Tous les patients ont présenté une réponse immunitaire au vaccin.
Dans le cas de l'adénocarcinome canalaire pancréatique, les chercheurs ont constaté qu'un vaccin personnalisé à base de néoantigènes à ARNm, administré par voie intraveineuse, entraînait une survie sans maladie médiane plus longue, les répondeurs étant ceux générant une réponse des lymphocytes T au vaccin , offrant aux chercheurs à la fois les conditions de réussite et des indicateurs pour améliorer les essais futurs. Ces études ont montré des profils de sécurité impressionnants et ont mis en évidence un éventail de tumeurs pour lesquelles cette technologie pourrait offrir un avantage substantiel. Les métastases tardives restent la principale cause de létalité pour la plupart des cancers, et la génération de clones de lymphocytes T à longue durée de vie spécifiques aux cancers, comme le démontrent ces premières études , représente le moyen le plus fiable de se protéger naturellement contre la récidive de la maladie. Des essais randomisés de phase II portant sur un large éventail d'histologies cancéreuses et de néoantigènes sont en cours.
- Conclusions
-
Des décennies de progrès dans le domaine des maladies infectieuses, conjugués à la biologie du cancer et à la génomique avancée, ont permis aux vaccins anticancéreux de répondre aux besoins actuels en cancérologie.
Un niveau de précision inégalé permet de développer des thérapies exploitant la mosaïque moléculaire unique de chaque tumeur, et il est temps de saisir pleinement les promesses de cette approche. Bien que les vaccins préventifs établis aient vu leur popularité décliner en raison de l'hésitation vaccinale, ces agents sont très efficaces et leur adoption au niveau de la population bénéficie des mêmes interventions fondées sur des données probantes et culturellement adaptées que celles appliquées dans le cadre de la prévention des maladies infectieuses pour élargir l'acceptation vaccinale .
La question ne sera pas de savoir si nous devons utiliser les vaccins anticancéreux, mais comment les mettre en œuvre pour optimiser les résultats pour les patients.Nous reconnaissons que les vaccins contre le cancer ne guériront pas tous les cancers.
Comme toutes les innovations médicales, ils évolueront au fil des tests et des perfectionnements afin d'améliorer les résultats pour les patients.
Nous devons continuer à soutenir l'innovation dans ce domaine afin d'étendre cette opportunité à un plus large éventail de pathologies. Nous devons également impliquer la communauté des patients dans cette transformation des soins pour permettre une pénétration optimale de ces outils contre le cancer.
Bien sûr, permettre aux lymphocytes T mémoires d'identifier et de tuer sélectivement les cellules cancéreuses représente une méthode cruciale – et probablement notre meilleur espoir – pour éradiquer les cancers émergents ou existants, annonçant ainsi le nec plus ultra de l'oncologie de précision.
Commentaire
Pour l'instant la vaccination classique des sujets à risque est essentielle.
La vaccination contre les cancers n'est pas encore la réalité, mais elle le deviendra un jour.
Si les résultats démontrent l'efficacité de tels vaccins, il va falloir convaincre et ce sera le plus difficile car les "antivax" seront de la partie, mais tout reste possible.
Patientons sereinement le temps à venir des vaccins anticancer.
À lireL'AVENIR DES VACCINS CONTRE LE CANCER
https://cancer.ca/fr/about-us/stories/2025/the-future-of-cancer-vaccines
À NOTER
RAPPEL ; les vaccins "CLASSIQUES "sur MEDVASC.INF
https://medvasc.info/archives-blog/vaccination-saison-2,-recommandations-cv-2025
Copyright : Dr Jean Pierre Laroche : 2025

