"Plus faibles sont les risques, meilleure est l'entreprise.” Sophocle
"Notre «moi» est fait de la superposition de nos états successifs. Mais cette superposition n'est pas immuable comme la stratification d'une montagne. Perpétuellement des soulèvements font affleurer à la surface des couches anciennes." Marcel Proust
"Notre «moi» est fait de la superposition de nos états successifs. Mais cette superposition n'est pas immuable comme la stratification d'une montagne. Perpétuellement des soulèvements font affleurer à la surface des couches anciennes." Marcel Proust
Kronenberg F, Mora S, Stroes ESG, Ference BA, Arsenault BJ, Berglund L, Dweck MR, Koschinsky M, Lambert G, Mach F, McNeal CJ, Moriarty PM, Natarajan P, Nordestgaard BG, Parhofer KG, Virani SS, von Eckardstein A, Watts GF, Stock JK, Ray KK, Tokgözoğlu LS, Catapano AL. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur Heart J. 2022 Oct 14;43(39):3925-3946. doi: 10.1093/eurheartj/ehac361. PMID: 36036785; PMCID: PMC9639807.
https://pubmed.ncbi.nlm.nih.gov/36036785/
https://pubmed.ncbi.nlm.nih.gov/36036785/
Article libre d'accés
Ce consensus de 2022 de la Société européenne de l'athérosclérose sur la lipoprotéine(a) [Lp(a)] met à jour les preuves du rôle de la Lp(a) dans les maladies cardiovasculaires athéroscléreuses (ASCVD) et la sténose valvulaire aortique, fournit des conseils cliniques pour tester et traiter une Lp(a) élevée et envisage son inclusion dans l’estimation du risque global.
Des études épidémiologiques et génétiques portant sur des centaines de milliers d'individus soutiennent fortement une association causale et continue entre la concentration de Lp(a) et les résultats cardiovasculaires dans différentes ethnies ; une Lp(a) élevée est un facteur de risque même à des taux très faibles de cholestérol à lipoprotéines de basse densité. Une Lp(a) élevée est associée à la fois à une microcalcification et à une macrocalcification de la valve aortique. Les résultats actuels ne soutiennent pas la Lp(a) comme facteur de risque d'événements thrombotiques veineux et d'altération de la fibrinolyse. Des niveaux très faibles de Lp(a) peuvent être associés à un risque accru de diabète sucré méritant une étude plus approfondie.
La Lp(a) possède des propriétés pro-inflammatoires et pro-athéroscléreuses, qui peuvent être en partie liées aux phospholipides oxydés portés par la Lp(a). Ce panel recommande de tester la concentration de Lp(a) au moins une fois chez l'adulte ; Les tests en cascade ont une valeur potentielle en cas d'hypercholestérolémie familiale ou d'antécédents familiaux ou personnels de Lp(a) (très) élevée ou d'ASCVD prématurée. Sans thérapies spécifiques réduisant la Lp(a), une prise en charge précoce et intensive des facteurs de risque est recommandée, ciblée en fonction du risque cardiovasculaire global et du niveau de Lp(a). L'aphérèse des lipoprotéines est une option en cas de Lp(a) très élevée avec maladie cardiovasculaire évolutive malgré une gestion optimale des facteurs de risque. En conclusion, cette affirmation renforce les preuves de la Lp(a) en tant que facteur de risque causal pour les conséquences cardiovasculaires. Les essais de traitements spécifiques réduisant la Lp(a) sont essentiels pour confirmer les bénéfices cliniques pour les maladies cardiovasculaires et la sténose valvulaire aortique.
Des études épidémiologiques et génétiques portant sur des centaines de milliers d'individus soutiennent fortement une association causale et continue entre la concentration de Lp(a) et les résultats cardiovasculaires dans différentes ethnies ; une Lp(a) élevée est un facteur de risque même à des taux très faibles de cholestérol à lipoprotéines de basse densité. Une Lp(a) élevée est associée à la fois à une microcalcification et à une macrocalcification de la valve aortique. Les résultats actuels ne soutiennent pas la Lp(a) comme facteur de risque d'événements thrombotiques veineux et d'altération de la fibrinolyse. Des niveaux très faibles de Lp(a) peuvent être associés à un risque accru de diabète sucré méritant une étude plus approfondie.
La Lp(a) possède des propriétés pro-inflammatoires et pro-athéroscléreuses, qui peuvent être en partie liées aux phospholipides oxydés portés par la Lp(a). Ce panel recommande de tester la concentration de Lp(a) au moins une fois chez l'adulte ; Les tests en cascade ont une valeur potentielle en cas d'hypercholestérolémie familiale ou d'antécédents familiaux ou personnels de Lp(a) (très) élevée ou d'ASCVD prématurée. Sans thérapies spécifiques réduisant la Lp(a), une prise en charge précoce et intensive des facteurs de risque est recommandée, ciblée en fonction du risque cardiovasculaire global et du niveau de Lp(a). L'aphérèse des lipoprotéines est une option en cas de Lp(a) très élevée avec maladie cardiovasculaire évolutive malgré une gestion optimale des facteurs de risque. En conclusion, cette affirmation renforce les preuves de la Lp(a) en tant que facteur de risque causal pour les conséquences cardiovasculaires. Les essais de traitements spécifiques réduisant la Lp(a) sont essentiels pour confirmer les bénéfices cliniques pour les maladies cardiovasculaires et la sténose valvulaire aortique.
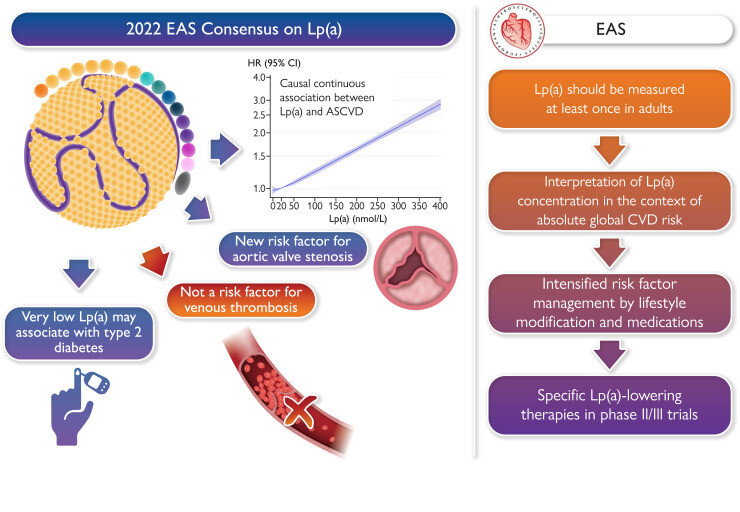
Points clés de la déclaration de consensus Lp(a) 2022. Les preuves actuelles démontrent une association causale continue dans différentes ethnies entre la concentration de Lp(a) et les résultats cardiovasculaires, y compris la sténose valvulaire aortique, mais pas pour les événements thrombotiques veineux. Une méta-analyse d'études prospectives montre que des niveaux très faibles de Lp(a) sont associés à un risque accru de diabète sucré. Pour la pratique clinique, la Lp(a) doit être mesurée au moins une fois chez l'adulte et les résultats interprétés dans le contexte du risque cardiovasculaire global absolu d'un patient, avec des recommandations sur une gestion précoce intensifiée des facteurs de risque par une modification du mode de vie. La déclaration passe également en revue les possibilités actuellement disponibles et futures pour réduire spécifiquement la Lp(a).
Quoi de neuf depuis la déclaration de consensus de l’EAS de 2010 ?
Preuve solide d'une association causale entre la concentration de Lp(a) et les résultats cardiovasculaires dans différentes ethnies.
Cette association est continue même à de faibles niveaux de cholestérol à lipoprotéines de basse densité.
La Lp(a) est un nouveau facteur de risque de sténose valvulaire aortique.
La Lp(a) est un nouveau facteur de risque de sténose valvulaire aortique.
Les preuves ne soutiennent pas la Lp(a) comme facteur de risque de thromboembolie veineuse et d'altération de la fibrinolyse.
De très faibles concentrations de Lp(a) tout au long de la vie peuvent être associées au diabète sucré.
La Lp(a) doit être mesurée au moins une fois chez l’adulte.
Une concentration élevée de Lp(a) doit être interprétée dans le contexte d’autres facteurs de risque et du risque cardiovasculaire global absolu, et traitée par une gestion intensifiée du mode de vie et des facteurs de risque.
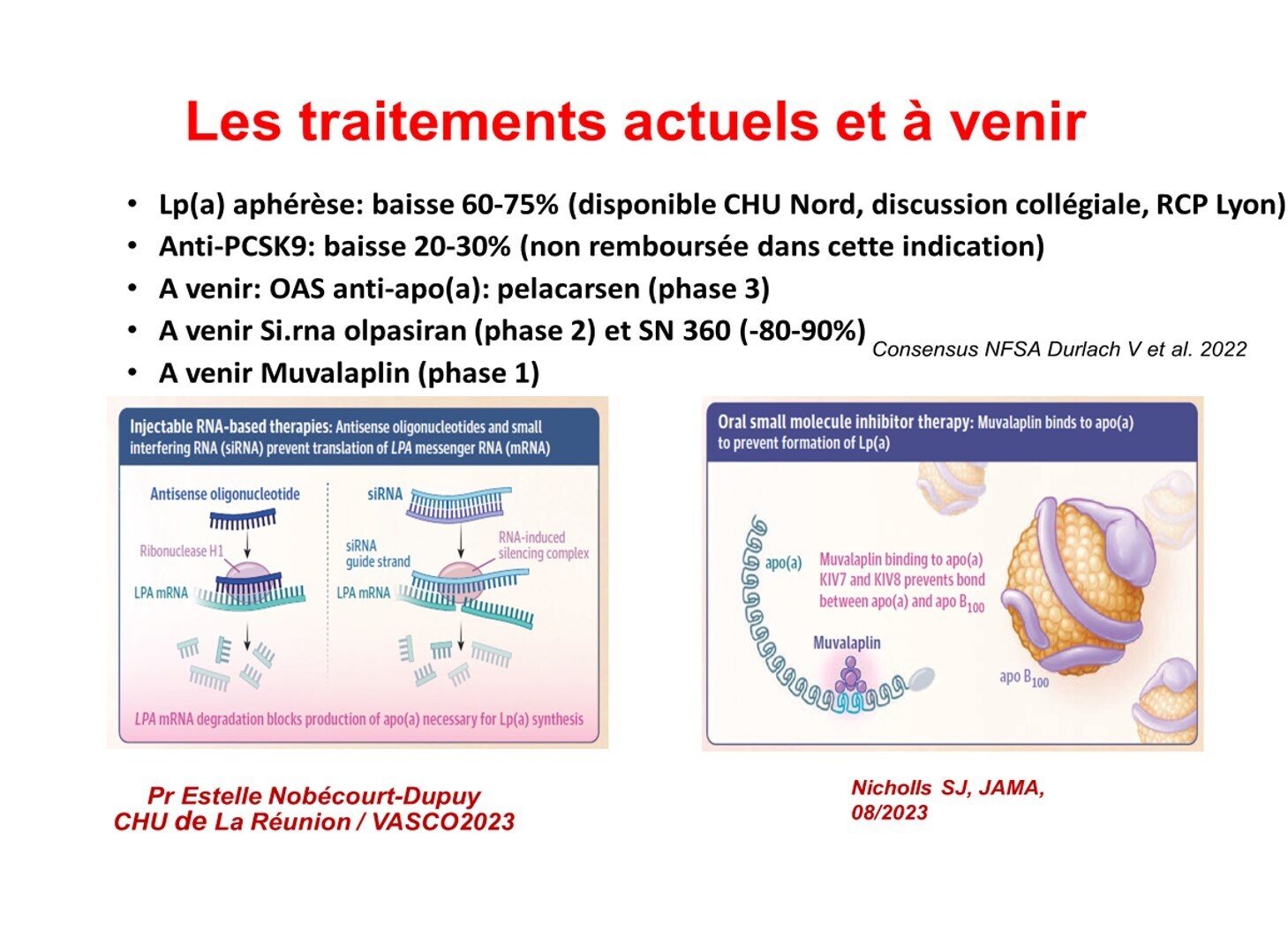
Des thérapies spécifiques efficaces réduisant la Lp(a) sont en cours d’essais cliniques de phase II/III.
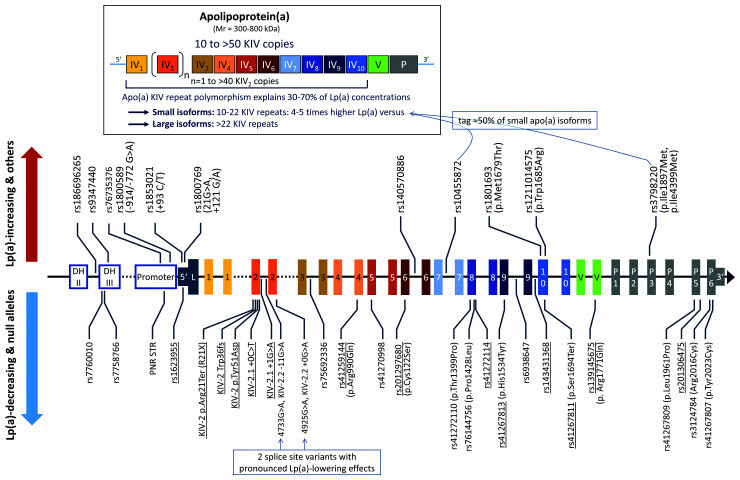
Structure et variabilité génétique du gène LPA. Le panneau supérieur montre la topologie de l'apolipoprotéine ( a) et l'association du polymorphisme répété de Kringle-IV avec la concentration de lipoprotéine (a) [Lp (a)], qui explique 30 à 70 % de la variation selon l'origine ethnique. Le panneau inférieur montre la structure du gène LPA et les polymorphismes mononucléotidiques connus au sein du gène qui ont des effets marqués sur la concentration de Lp(a). Les exons sont numérotés en fonction du domaine qu'ils codent (séquence leader de L., 1–10 : KIV-1 à KIV-10, V : domaine KV, P : domaine protéase, 5' : 5'UTR, 3' : 3 ′UTR). Les polymorphismes mononucléotidiques associés à une concentration accrue de Lp(a) sont indiqués au-dessus de la structure du gène, et ceux associés à une diminution des concentrations de Lp(a) (à la fois de manière causale ou par association uniquement) sont présentés ci-dessous. Les polymorphismes mononucléotidiques qui provoquent des allèles nuls sont soulignés ; cependant, les polymorphismes mononucléotidiques abaissant la Lp(a) peuvent provoquer des allèles nuls s'ils sont présents sur un allèle déjà associé à une faible production de Lp(a). Les polymorphismes mononucléotidiques de la région Kringle-IV Type-2 sont nommés en fonction de leur publication ; on ne peut pas leur attribuer un seul identifiant rs car leur emplacement n'est pas unique. Figure fournie et adaptée par le professeur Florian Kronenberg et le professeur Stefan Coassin sur la base d'une référence.
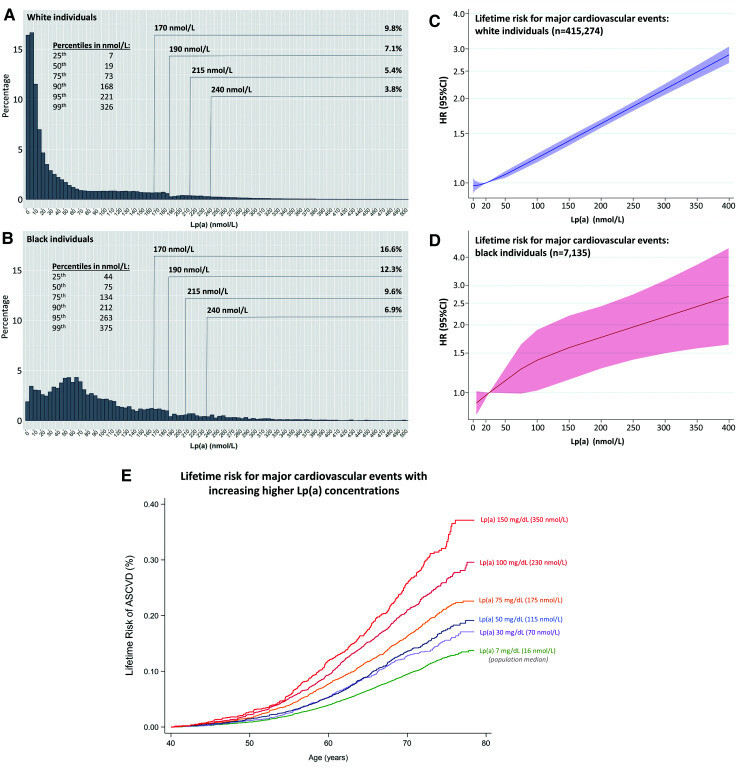
Distribution de la concentration de lipoprotéine(a) [Lp(a)] et association avec le risque d'événements cardiovasculaires majeurs. Les données de la biobanque britannique montrent la distribution typique de la Lp(a) concentrations chez les Blancs (Panel A) et les Noirs (Panel B) et la relation linéaire entre la concentration de Lp(a) et le risque d'événements cardiovasculaires majeurs chez les Blancs (Panel C) et les Noirs (< a i=8>Panneau D). Les panneaux A et B donnent le pourcentage de la population ayant une Lp(a) de 170, 190, 215 et 240 nmol/L ou plus, respectivement. Les panneaux C et D montrent le rapport de risque (HR) ajusté lissé et l'intervalle de confiance à 95 % (IC à 95 %) pour le risque à vie d'événements cardiovasculaires majeurs pour une concentration donnée de Lp(a) par rapport à la Lp(a) médiane dans la population ( 19,7 nmol/L). Ces données ont été estimées à l'aide d'un modèle de régression à risques proportionnels de Cox ajusté en fonction de l'âge à l'inscription, du sexe et des 10 premières composantes principales de l'ascendance et modélisées à l'aide de splines naturelles cubiques. Les intervalles de confiance sont plus larges chez les Noirs en raison de la taille plus petite de l’échantillon. Le panel E montre le risque au cours de la vie d'événements cardiovasculaires majeurs avec des concentrations croissantes de Lp(a) chez les hommes d'ascendance européenne dans la biobanque britannique (les résultats étaient similaires pour les femmes mais avec des taux d'événements absolus plus faibles). Les participants ont été répartis en catégories présentant des concentrations plasmatiques médianes de Lp(a) de plus en plus élevées ; et les taux cumulatifs d'événements cardiovasculaires majeurs ont été tracés pour chaque groupe jusqu'à l'âge de 80 ans. Panel A et B sont fournis par le professeur Florian Kronenberg et Silvia Di Maïo ; Panel C-E sont fournis par le professeur Brian Ference et le professeur Alberico L. Catapano. Pour une description méthodologique détaillée,
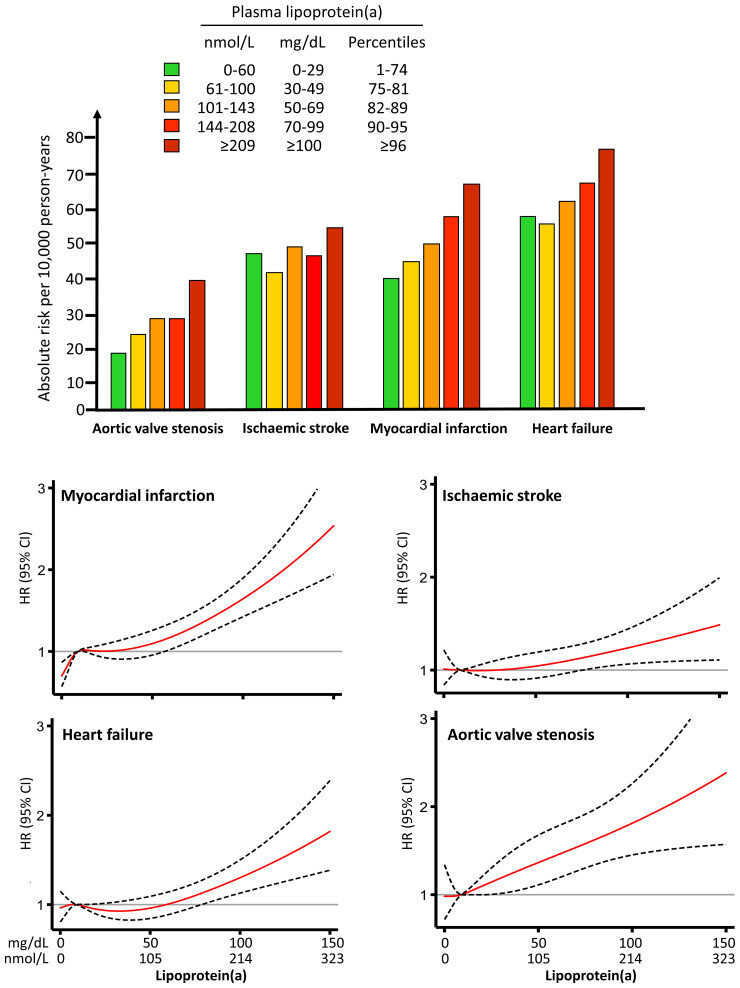
Risque de résultats cliniques avec la concentration de Lp(a). Risques absolus et relatifs de sténose valvulaire aortique, d'accident vasculaire cérébral ischémique, d'infarctus du myocarde et d'insuffisance cardiaque en fonction de l'augmentation de la concentration plasmatique de Lp(a) dans la population générale. Le panneau supérieur montre le risque absolu pour 10 000 années-personnes, et le panneau inférieur montre les taux de risque sous forme de ligne rouge continue avec des intervalles de confiance à 95 % sous forme de lignes noires en pointillés ; lorsque l’intervalle de confiance inférieur à 95 % ne chevauche plus la valeur de référence du rapport de risque de 1,0 pour la concentration médiane de Lp(a), le risque est significativement élevé. Basé sur les données de 70 286 individus blancs de l’étude sur la population générale de Copenhague avec un suivi médian de 7,4 ans. Données fournies par le professeur Børge G. Nordestgaard et le Dr Anne Langsted.
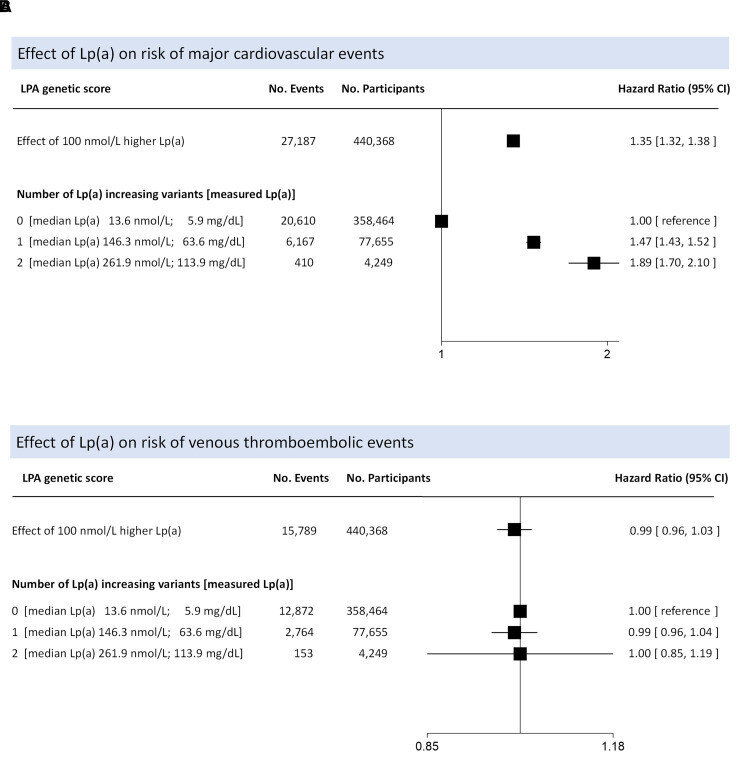
Effet de la concentration de Lp(a) et des copies du score LPA sur le risque d'événements cardiovasculaires majeurs et d'événements thrombotiques veineux.< a i = 3> Les données proviennent de 440 368 participants à la biobanque britannique d'ascendance européenne. Le score LPA est défini comme le nombre d'allèles mineurs des variantes LPA rs10455872 ou rs3798220 hérités par chaque participant, le groupe de référence étant défini comme des participants sans copies de l'un ou l'autre des allèles mineurs. La concentration médiane mesurée en Lp(a) est fournie pour chaque groupe. Le panel A montre l'effet d'une Lp(a) plus élevée parmi les participants qui héritent d'un allèle mineur [Lp(a) médiane 146,3 nmol/L] ou de deux allèles mineurs allèles [Lp(a) médiane 261,9 nmol/L] sur le risque d'événements cardiovasculaires majeurs [définis comme le composite de la première survenue d'un infarctus du myocarde mortel ou non mortel, d'un accident vasculaire cérébral ischémique mortel ou non mortel ou d'une revascularisation coronarienne (percutanée intervention coronarienne ou pontage aorto-coronarien)] par rapport au groupe de référence [Lp(a) médiane 13,6 nmol/L]. Le panel B montre l'effet sur le risque d'événements thromboemboliques veineux (TEV, défini comme une thrombose veineuse profonde ou une embolie pulmonaire). Des taux plus élevés de Lp(a) étaient fortement associés à un risque accru de maladie cardiovasculaire athéroscléreuse, mais pas de TEV. Les cases pleines représentent les estimations ponctuelles de l’effet et les lignes les intervalles de confiance à 95 %. Données fournies par le professeur Brian Ference et le professeur Alberico L. Catapano. Pour une description méthodologique détaillée,
Points clés du consensus : Lp(a) et résultats cliniques
Points clés du consensus : Lp(a) et résultats cliniques
Des preuves observationnelles et génétiques démontrent de manière convaincante qu'une concentration élevée de Lp(a) est à l'origine de l'ASCVD, de l'AVS et de la mortalité cardiovasculaire et toutes causes confondues chez les hommes et les femmes et dans tous les groupes ethniques.
La relation entre la concentration de Lp(a) et ces résultats est continue ; une Lp(a) élevée est un facteur de risque même à une concentration très faible de LDL-C.
Le risque d'accident vasculaire cérébral ischémique et d'insuffisance cardiaque augmente à des niveaux de Lp(a) plus élevés que ceux associés au risque d'infarctus du myocarde et d'AVS.
Chez les enfants, une Lp(a) > 30 mg/dL (>75 nmol/L) est associée à un risque accru d'accident vasculaire cérébral ischémique artériel (récurrent).
La Lp(a) n’est pas un facteur de risque de thromboembolie veineuse.
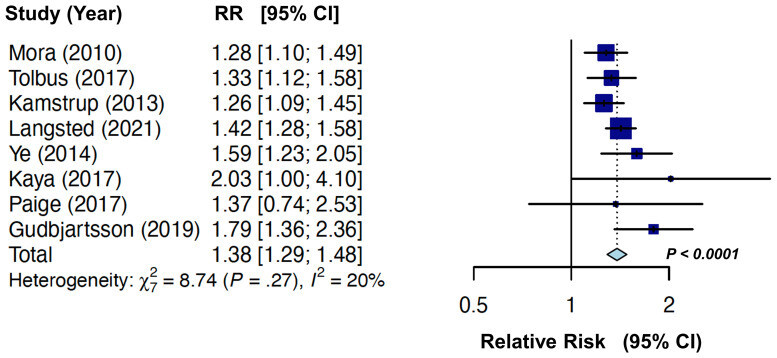
Association entre la concentration de Lp(a) et le diabète sucré. Méta-analyse des effets aléatoires de sept études prospectives135-141 et une étude cas-témoins76 examinant l'association de la lipoprotéine(a) avec le risque de diabète. Les risques relatifs récapitulatifs comparant le quintile inférieur au quintile supérieur ont été ajustés en fonction des facteurs de risque cliniques, la taille des carrés étant proportionnelle au nombre de cas dans chaque étude. Les résultats étaient similaires en excluant Kamstrup et al. étude137 (pour chevauchement potentiel avec le Tolbus et al.76.et al) ou en excluant l'étude cas-témoins de Gudbjartsson Figure S1A, Matériel supplémentaire en ligne études ; 138 .et al et Langsted 136Matériel supplémentaire en ligne, Figure S1B). Les valeurs récapitulatives du risque relatif P étaient toutes <0,001. (Voir également Matériel supplémentaire en ligne). Données fournies par le professeur Samia Mora, le Dr Olga Demler et le Dr Yanyan Liu.
Points clés du consensus : mécanismes proposés pour la pathogénicité de la Lp(a) dans l'ASCVD et l'AVS
La Lp(a) possède des propriétés pro-inflammatoires et pro-athéroscléreuses, qui peuvent être en partie liées aux OxPL portées par la Lp(a).
Le rôle potentiel de la Lp(a) dans l'activité pro-thrombotique et anti-fibrinolytique in vivo reste à prouver.
Une Lp(a) élevée induit l'expression de gènes inflammatoires et de calcification dans les cellules vasculaires et valvulaires et est associée à une incidence et une progression accrues du SVA.
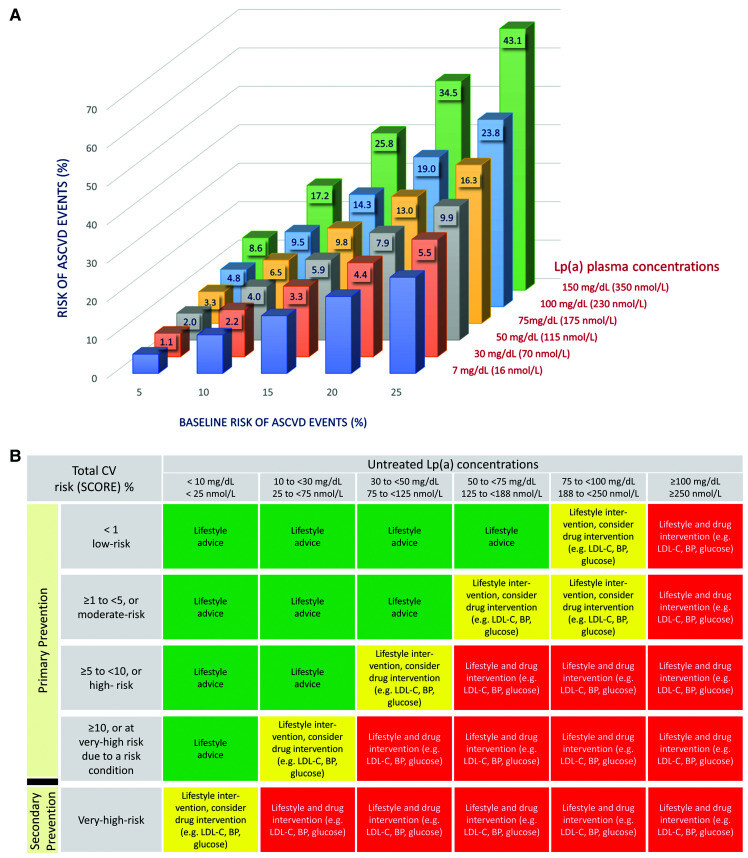
Effet de l'augmentation des niveaux de Lp(a) et risque absolu de base estimé d'événements cardiovasculaires majeurs. Le panneau A montre le risque estimé restant à vie d'événements cardiovasculaires majeurs. un événement cardiovasculaire majeur [défini comme la première survenue d'un infarctus du myocarde mortel ou non mortel, d'un accident vasculaire cérébral ischémique mortel ou non mortel ou d'une revascularisation coronarienne (intervention coronarienne percutanée ou pontage aorto-coronarien)] parmi 415 274 participants de l'étude Ascendance européenne dans la biobanque britannique pour laquelle les valeurs mesurées de Lp(a) étaient disponibles. Les participants sont divisés en catégories de risque de base estimé à vie (5 %, 10 %, 15 %, 20 % et 25 %) calculé à l'aide de l'algorithme d'estimation du risque à vie des Joint British Societies (JBS3) (dérivé d'une population britannique similaire). Au sein de chaque catégorie de risque de base, les participants sont ensuite divisés en catégories définies par la concentration de Lp(a) mesurée de base. L'augmentation progressive du risque provoquée par des concentrations plus élevées de Lp(a) de 30 à 150 mg/dL (70 à partir de 350 nmol/L) a été estimée en ajoutant la Lp(a) en tant qu'exposition indépendante à l'algorithme d'estimation du risque JBS3. Les chiffres à l'extrémité supérieure de chaque barre représentent l'augmentation du risque absolu accru au-dessus du risque de base estimé causé par Lp(a). Ces informations sont présentées sous forme de tableau dans Matériel supplémentaire en ligne, Tableau S2 . Par exemple, pour une personne ayant un risque de base de 5 %, une concentration de Lp(a) de 30 mg/dL augmente le risque absolu restant à vie d'un événement cardiovasculaire majeur de 1,1 % à 6,1 % (par rapport à une personne avec un risque de Lp(a) de 30 mg/dL). (a) de 7 mg/dL). En revanche, pour une personne présentant un risque initial de 25 %, une concentration de Lp(a) de 30 mg/dL augmente le risque absolu d'événement cardiovasculaire majeur de 5,5 % à 30,5 % (vs une personne ayant un risque de Lp(a) ) de 7 mg/dL). Pour les individus ayant une concentration de Lp(a) de 75 mg/dL, les augmentations absolues correspondantes du risque sont respectivement de 3,3 % et 16,3 %. La figure illustre que le fait de ne pas prendre en compte le niveau de Lp(a) d’une personne peut conduire à une sous-estimation substantielle de son risque absolu d’événement cardiovasculaire majeur. Données fournies par le professeur Brian Ference et le professeur Alberico L. Catapano. De plus amples détails sont fournis dans le Matériel supplémentaire en ligne. Le panel B fournit les stratégies d'intervention en fonction du risque cardiovasculaire total et de la concentration de Lp(a) non traitée. En l’absence de traitement spécifique réduisant la Lp(a), ceux-ci se concentrent sur la gestion d’autres facteurs de risque cardiovasculaire. Pour une description méthodologique détaillée,
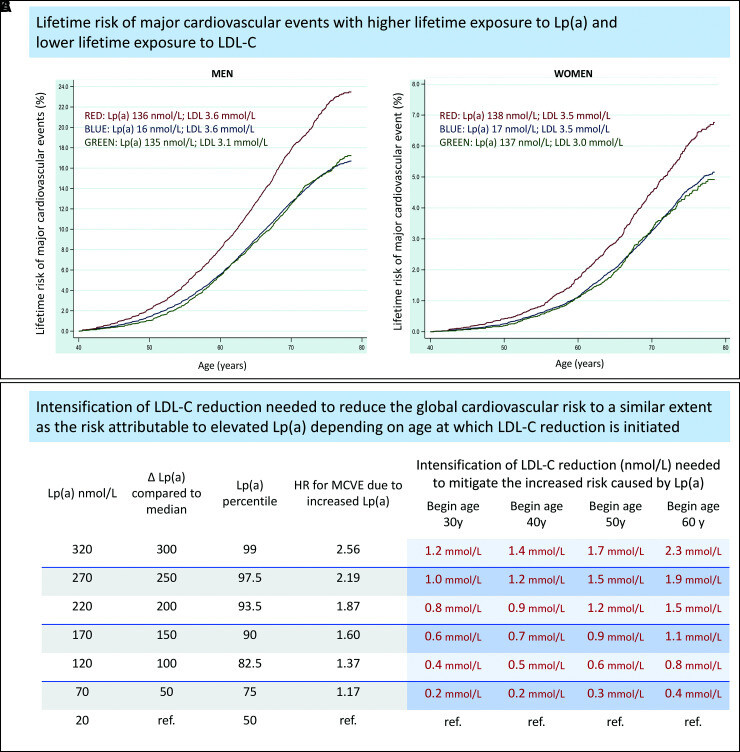
Une réduction du cholestérol lié aux lipoprotéines de basse densité est nécessaire pour réduire le risque cardiovasculaire global dans une mesure similaire à celle attribuable à un taux élevé de Lp(a). Panel A montre le risque cumulatif absolu au cours de la vie d'un événement cardiovasculaire majeur (défini comme la première occurrence d'un infarctus du myocarde mortel ou non mortel, d'un accident vasculaire cérébral ischémique mortel ou non mortel ou d'une revascularisation coronarienne [intervention coronarienne percutanée ou pontage aorto-coronarien chirurgie de greffe]) parmi 440 368 participants d'origine européenne à la biobanque britannique. Pour chaque sexe, ceux-ci ont été divisés en trois groupes : un groupe de référence avec une Lp(a) moyenne de la population [16–17 nmol/L] et des taux de cholestérol des lipoprotéines de basse densité [3,5–3,6 mmol/L] qui n'avait aucune copie de l'un ou l'autre des deux. les allèles augmentant la Lp(a) rs10455872 ou rs3798220 ; un groupe avec une exposition à vie plus élevée à la Lp(a) [136–138 nmol/L) en raison de l'héritage d'une copie des allèles augmentant la Lp(a) rs10455872 ou rs3798220, mais avec des taux moyens de cholestérol des lipoprotéines de basse densité dans la population [3,5 –3,6 mmol/L] ; et un groupe avec à la fois une exposition au cours de la vie plus élevée à la Lp(a) [136–138 nmol/L) en raison de l'héritage d'une copie des allèles augmentant la Lp(a) rs10455872 ou rs3798220 ET une exposition au cours de la vie à 0,5 mmol/L cholestérol à lipoprotéines de densité [3,0-3,1 mmol/L) en raison de l'héritage d'une combinaison de variantes génétiques abaissant le cholestérol à lipoprotéines de basse densité. La figure démontre que le risque accru d’événement cardiovasculaire majeur causé par une exposition au cours de la vie à une Lp(a) supérieure d’environ 120 nmol/L peut être atténué à tous les âges par une exposition au cours de la vie à un taux de LDL-C inférieur d’environ 0,5 mmol/L. Cette découverte illustre la possibilité d’estimer dans quelle mesure l’intensification de la modification des facteurs de risque, en l’occurrence la réduction du cholestérol des lipoprotéines de basse densité, est nécessaire pour atténuer le risque accru d’événements cardiovasculaires majeurs provoqués par le taux de Lp(a) d’une personne. Panneau B fournit une estimation quantitative de l'intensification de la réduction du cholestérol des lipoprotéines de basse densité nécessaire pour atténuer le risque accru d'événement cardiovasculaire majeur provoqué par des taux de Lp(a) de plus en plus élevés, et de l'âge auquel la réduction du cholestérol des lipoprotéines de basse densité est initiée. Étant donné que la réduction proportionnelle du risque produit par la diminution du cholestérol des lipoprotéines de basse densité diminue avec la diminution de la durée d'exposition, une plus grande intensification de la réduction du cholestérol des lipoprotéines de basse densité est nécessaire pour atténuer un taux de Lp(a) donné si la réduction du cholestérol des lipoprotéines de basse densité est commencée. à un âge plus avancé. Par exemple, une personne ayant un taux de Lp(a) élevé de 220 nmol/L a un risque 1,87 fois plus élevé d’événement cardiovasculaire majeur qu’une personne ayant un taux de Lp(a) de 20 nmol/L (en supposant que tous les autres les facteurs de risque sont égaux). Ce risque accru d'événement cardiovasculaire majeur peut être atténué en abaissant le cholestérol des lipoprotéines de basse densité de 0,8 mmol/L si on commence à l'âge de 30 ans, mais nécessiterait une baisse plus intense du cholestérol des lipoprotéines de basse densité de 1,5 mmol/L si on commence à 60 ans. années. Les données du tableau du panel B développent les lignes directrices de pratique clinique actuelles qui recommandent une modification plus intense des facteurs de risque chez les personnes présentant des taux élevés de Lp(a) en fournissant des indications quantitatives spécifiques sur le degré d'intensification de la réduction du cholestérol des lipoprotéines de basse densité pour atténuer le risque accru d'événement cardiovasculaire majeur causé par des taux de Lp(a) de plus en plus élevés. Un algorithme en ligne facile à utiliser concernant les risques et les avantages de la Lp(a) peut fournir des conseils pratiques et spécifiques sur le degré d'intensification de la réduction du cholestérol des lipoprotéines de basse densité qui est nécessaire pour atténuer le risque causé par le niveau de Lp(a) d'une personne en fonction du âge auquel la réduction du cholestérol à lipoprotéines de basse densité est initiée. Cependant, lorsque la majeure partie du risque est importante et principalement imputable à la Lp(a), une diminution des facteurs de risque traditionnels tels que le cholestérol des lipoprotéines de basse densité sera insuffisante pour atténuer ce risque accru. Dans ces cas, des thérapies spécifiques réduisant la Lp(a) sont nécessaires de toute urgence. Ces informations devraient motiver les tests de Lp(a) et éclairer l’utilisation clinique des niveaux de Lp(a) mesurés. L'algorithme de risque et de bénéfice Lp(a) en ligne est disponible sur le site Web de la Société européenne de l'athérosclérose (www.eas-society.org/LPA_risk_and_benefit_algorithm). De plus amples détails sont fournis dans le Matériel supplémentaire en ligne. Pour une description méthodologique détaillée, voir Matériel supplémentaire en ligne. Données fournies par le professeur Brian Ference et le professeur Alberico L. Catapano.
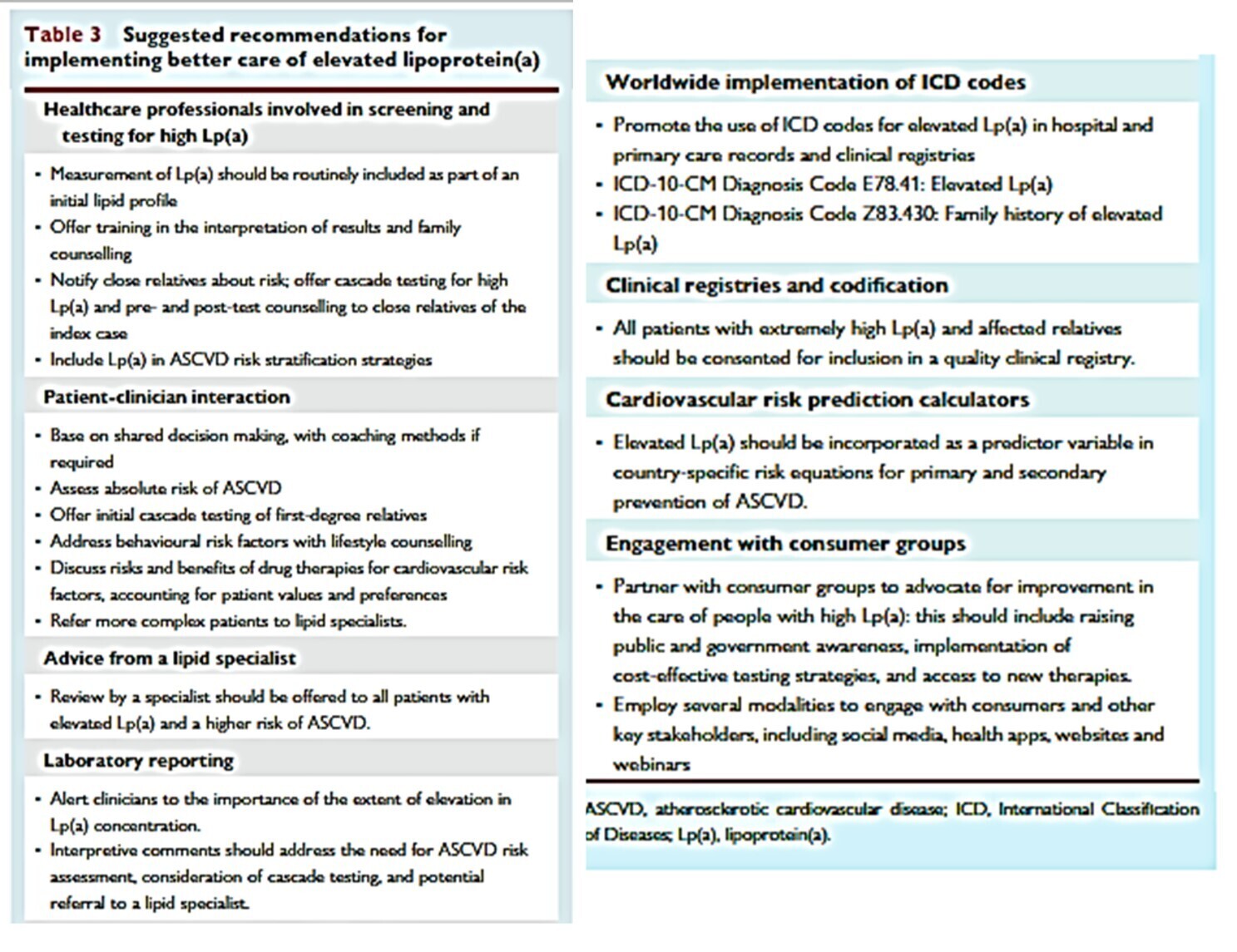
Recommandations du panel de consensus pour les tests Lp(a)
La Lp(a) doit être mesurée au moins une fois chez les adultes pour identifier ceux présentant un risque cardiovasculaire élevé.
Le dépistage est également recommandé chez les jeunes ayant des antécédents d’accident vasculaire cérébral ischémique ou des antécédents familiaux d’ASCVD prématurée ou de Lp(a) élevée et sans autre facteur de risque identifiable.
Un test en cascade pour une Lp(a) élevée est recommandé dans les cas d'HF, d'antécédents familiaux de Lp(a) (très) élevée et d'antécédents personnels ou familiaux d'ASCVD.
Les laboratoires doivent utiliser un test Lp(a) insensible à l’isoforme apo(a) et traçable aux matériaux de référence officiels.
La mesure de Lp(a) doit être effectuée en unités molaires si disponible. Dans le cas contraire, les unités dans lesquelles le test est calibré doivent être utilisées pour le rapport.
Plutôt que des valeurs absolues, les lignes directrices cliniques devraient envisager d'utiliser des seuils de risque avec des zones « grises » (par exemple, 30 à 50 mg/dL ou 75 à 125 nmol/L) pour déterminer soit (≥ 50 mg/dL ; 125 nmol/L). ) ou exclure (<30 mg/dL; 75 nmol/L) risque cardiovasculaire.
Recommandations du panel de consensus pour la gestion des concentrations élevées de Lp(a)
En l’absence de traitements spécifiques réduisant la Lp(a), une prise en charge précoce des facteurs de risque est recommandée pour les personnes présentant une Lp(a) élevée, en tenant compte de leur risque cardiovasculaire global absolu et de leur taux de Lp(a).
Chez les patients présentant une Lp(a) élevée, tous les facteurs de risque cardiovasculaire doivent être pris en compte de manière globale conformément aux recommandations des lignes directrices.
L'aphérèse des lipoprotéines peut être envisagée chez les patients présentant une Lp(a) très élevée et une maladie cardiovasculaire évolutive malgré une prise en charge optimale des facteurs de risque.
La niacine n’est pas recommandée pour réduire la Lp(a).
A RETENIR
La Lp(a) est une MARQUEUR du RISQUE CV , elle permet de le stratifier, son dosage n'est pas encore remboursée mais ça ne saurait tarder. La Lp(a) si elle est pathologique doit inciter à renforcer la prévention CV à son maximum. Elle est aussi utile chez les enfant issus de famille à sur risque CV ou en cas d'hypercholéstérolémie familale. A ce jour , la Lp(A) n'est pas un marqeur de risque de la MTEV.
Affaire à suivre, la Lp(a) nous réserve encore d'autres surprises.
A LIRE
Affaire à suivre, la Lp(a) nous réserve encore d'autres surprises.
A LIRE
https://medvasc.info/archives-blog/dossier-lp-a?highlight=WyJscCIsImEiXQ==
https://medvasc.info/archives-blog/lp-a-en-30-questions-r%C3%A9ponses?highlight=WyJscCIsImEiXQ==
https://medvasc.info/archives-blog/r%C3%A9duire-la-lp-a-r%C3%A9duire-le-risque-cv?highlight=WyJscCIsImEiXQ==
https://medvasc.info/archives-blog/r%C3%A9duire-la-lp-a-r%C3%A9duire-le-risque-cv?highlight=WyJscCIsImEiXQ==
https://medvasc.info/archives-blog/lp-a-en-30-questions-r%C3%A9ponses?highlight=WyJscCIsImEiXQ==
https://medvasc.info/archives-blog/r%C3%A9duire-la-lp-a-r%C3%A9duire-le-risque-cv?highlight=WyJscCIsImEiXQ==
https://medvasc.info/archives-blog/r%C3%A9duire-la-lp-a-r%C3%A9duire-le-risque-cv?highlight=WyJscCIsImEiXQ==

