"Conserver la santé et guérir les maladies : tel est le problème que la médecine a posé dès son origine et dont elle poursuit encore la solution scientifique. " Plutarque
"Anticiper le malheur sans faire partager les affres de l’anticipation, là est le véritable héroïsme. " Daniel Pennac

Management of bleeding and invasive procedures in patients treated with anti–factor XI(a) anticoagulants: proposals from the French Working Group on Perioperative Haemostasis and French Society of Thrombosis and Haemostasis . Prise en charge des saignements et des procédures invasives chez les patients traités par anticoagulants anti-facteur XI(a) : propositions du Groupe de travail français sur l'hémostase périopératoire et de la Société française de thrombose et d'hémostase,Godier, Anne et al. Research and Practice in Thrombosis and Haemostasis, Volume 9, Issue 3, 102860
Article libre d'accès
Plusieurs agents anti-FXI(a) aux mécanismes d'action et aux propriétés pharmacologiques distincts sont actuellement en développement clinique.
Objectifs
Méthodes
Résultats
Conclusion
Essentiel
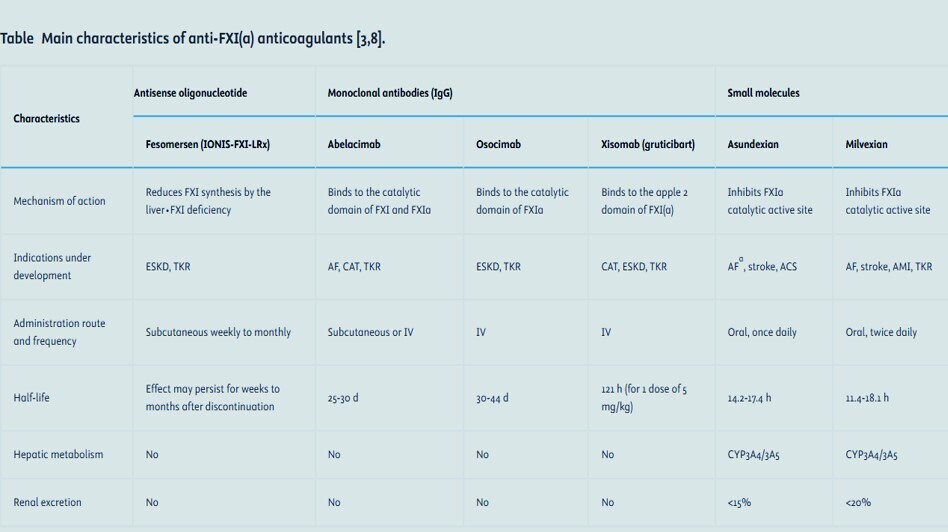
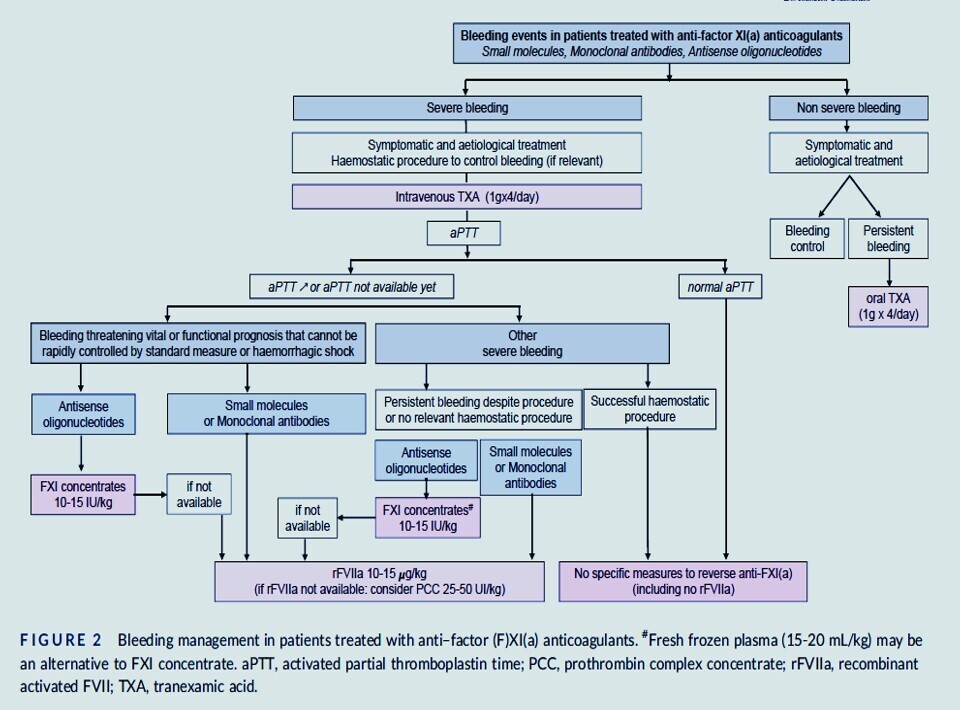
Prise en charge des saignements chez les patients traités par anticoagulants anti-FXI(a)
Reprise du traitement anti-FXI(a). La reprise du traitement anti-FXI(a) après une intervention chirurgicale ou une hémorragie grave est mal documentée.
Conclusion
Ce document présente les propositions du groupe de travail français sur l'hémostase périopératoire et de la Société Française de Thrombose et d'Hémostase pour la gestion des saignements et des procédures invasives chez les patients sous anticoagulants anti–facteur XI(a). L'article souligne le besoin de protocoles clairs pour cette nouvelle classe d'anticoagulants, dont le risque hémorragique est potentiellement plus faible que d'autres options, mais dont la réversibilité est moins établie. S'appuyant sur l'expérience des déficits héréditaires en FXI et les données d'essais cliniques préliminaires, les auteurs proposent des stratégies de laboratoire et de prise en charge pratique, y compris l'utilisation d'agents pro-hémostatiques. En proposant ces dernières, ils reconnaissent la nécessité de réévaluer ces recommandations à mesure que de nouvelles données émergent. (NotebooKLM)
" Les anti-XI(a) offrent la promesse d’une anticoagulation plus sûre, avec un risque hémorragique réduit, mais leur efficacité dans la prévention des événements thromboemboliques majeurs reste à confirmer dans certaines indications." Leur place future dépendra des résultats des essais de phase 3 en cours et de leur capacité à démontrer un rapport bénéfice/risque supérieur aux anticoagulants actuels "PERPLEXITY
Inhibiteurs du facteur XI ; future proche ?
https://medvasc.info/archives-blog/inhibiteurs-du-facteur-xi-futur-proche
A relire sur les inhibiteurs des Anti XI
https://medvasc.info/1897-manuel-monreal-%C3%A0-retenir-pour-2022
UN ANTI-XI ORAL EN PRÉVENTION DE LA THROMBOSE APRÈS CHIRURGIE DE PROTHÈSE TOTALE DE GENOU
https://www.portailvasculaire.fr/node/81654
Le point sur les anti XI(a) avec PERPLEXITY/IA
Où en est-on avec les anti-XI(a) ?
Résumé actuel du développement et des perspectives :
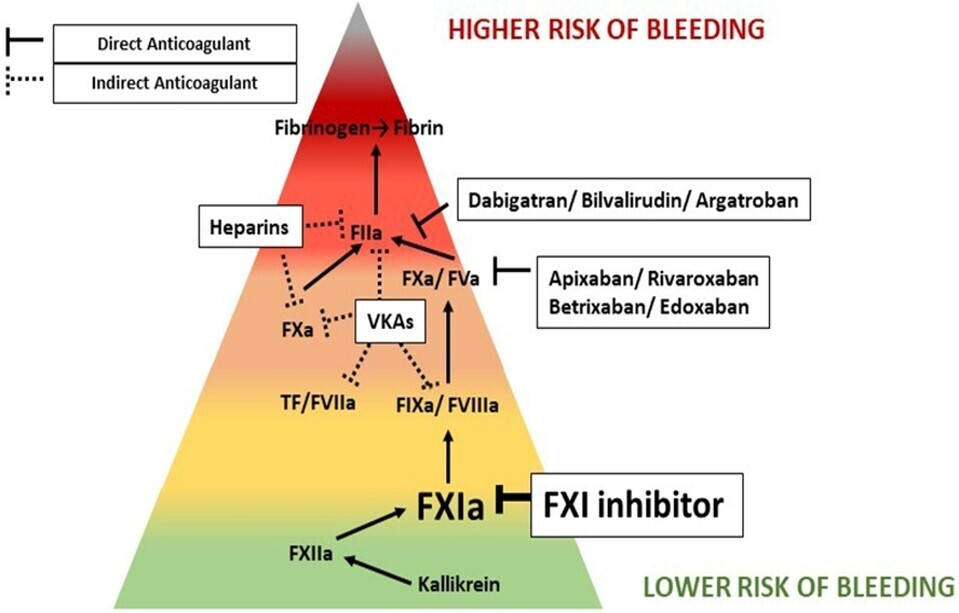
Les inhibiteurs du facteur XIa (anti-XI[a]) représentent une nouvelle génération d’anticoagulants, conçus pour réduire le risque thrombotique tout en limitant le risque hémorragique, un enjeu majeur des traitements anticoagulants actuels156. Plusieurs molécules sont en développement, notamment l’asundexian, le milvexian (petites molécules orales), et l’abelacimab (anticorps monoclonal).
Points clés issus des dernières études
-
Efficacité et sécurité :
-
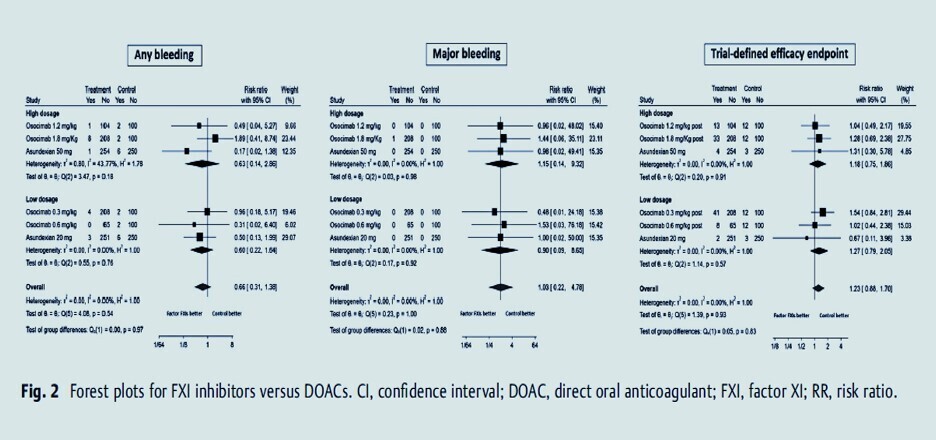
Les anti-XI(a) ont montré, dans des études de phase 2 et 3, une réduction significative des complications hémorragiques par rapport aux anticoagulants oraux directs (AOD) classiques comme l’apixaban1.
-
Cependant, dans l’essai de phase 3 OCEANIC-AF (asundexian vs apixaban chez des patients avec fibrillation auriculaire), une augmentation préoccupante du nombre d’AVC et d’événements emboliques a été observée sous asundexian (presque 4 fois plus qu’avec l’apixaban), malgré une réduction des saignements. L’essai a été interrompu prématurément, jetant un doute sur l’intérêt de cette classe dans cette indication.
-
Pour le milvexian, les résultats dans la prévention de la thrombose après arthroplastie du genou sont prometteurs, avec une efficacité comparable ou supérieure à l’énoxaparine et un profil hémorragique favorable, mais il reste à démontrer son intérêt dans d’autres indications5.
-
-
Place concrètement clinique :
-
Les anti-XI(a) pourraient trouver leur place dans des situations où le risque hémorragique est particulièrement préoccupant, mais leur efficacité dans la prévention des événements thromboemboliques majeurs reste à confirmer dans des indications larges comme la fibrillation auriculaire138.
-
L’abelacimab, notamment, a montré dans l’étude AZALEA-TIMI 71 une efficacité comparable au rivaroxaban dans la FA, avec une diminution spectaculaire des saignements, mais les résultats détaillés et leur impact sur la pratique restent à préciser
-
-
Surveillance biologique et impact sur la biologie :
-
Les anti-XI(a) n’exigent pas de surveillance biologique systématique, mais peuvent influencer certains tests de coagulation, ce qui nécessite une adaptation des pratiques de laboratoire4.
-
Conclusion
Après des débuts jugés très prometteurs, les anti-XI(a) sont aujourd’hui confrontés à des résultats cliniques mitigés, en particulier dans la fibrillation auriculaire. En effet, l’efficacité sur la prévention des AVC n’a pas été démontrée de façon satisfaisante pour certains agents comme l’asundexian. Leur place future pourrait se limiter à des indications de niche ou à des populations spécifiques à haut risque hémorragique, en attendant les résultats définitifs des essais en cours avec d’autres molécules de la classe.
La recherche se poursuit, mais l’enthousiasme initial est tempéré par la nécessité de mieux définir le rapport bénéfice/risque de ces nouveaux anticoagulants.
On peut rajouter une question : le coût ?AntiXI(a) : des indications "niches"
Copyright : Dr Jean Pierre Laroche / 2025


