« Pour que la médecine de précision ait du succès, il faut s’assurer que l’information génétique soit bien expliquée et associée à des actions et des bénéfices pour le patient en offrant, par exemple, un suivi adapté aux femmes identifiées avec un risque élevé de cancer du sein » Jacques Simard
Feldman S, Gupta D, Navi B, et al. Le profil génomique tumoral est associé au risque de thromboembolie artérielle chez les patients atteints d'un cancer solide. J Am Coll Cardiol CardioOnc. 2023 avril, 5 (2) 246–255.
https://doi.org/10.1016/j.jaccao.2023.01.009
Article libre d'accès
Les patients atteints de cancer ont un risque accru de thromboembolie artérielle (ETA). Il existe peu de données sur l'impact des altérations génomiques spécifiques au cancer sur le risque d'ETA
Objectifs
Le but de cette étude était de déterminer si les altérations génomiques somatiques individuelles des tumeurs solides influencent l'incidence d'ETA.
Méthodes
Une étude de cohorte rétrospective a été menée à l'aide de données sur l'altération génétique des tumeurs d'adultes atteints de cancers solides qui ont subi le test Memorial Sloan Kettering–Integrated Mutation Profiling of Actionable Cancer Targets entre 2014 et 2016. Le résultat principal, ATE, a été défini comme un infarctus du myocarde, une revascularisation coronarienne , accident vasculaire cérébral ischémique , occlusion artérielle périphérique ou revascularisation d'un membre et identifiée par des évaluations systématiques des dossiers médicaux électroniques . Les patients ont été suivis à partir de la date d'adhésion au contrôle sanguin compatible avec les tissus jusqu'au premier événement ATE ou au décès, jusqu'à 1 an. Régression des risques proportionnels de Cox par causea été utilisé pour déterminer les RH de l'ATE pour les gènes individuels ajustés pour les covariables cliniques pertinentes.
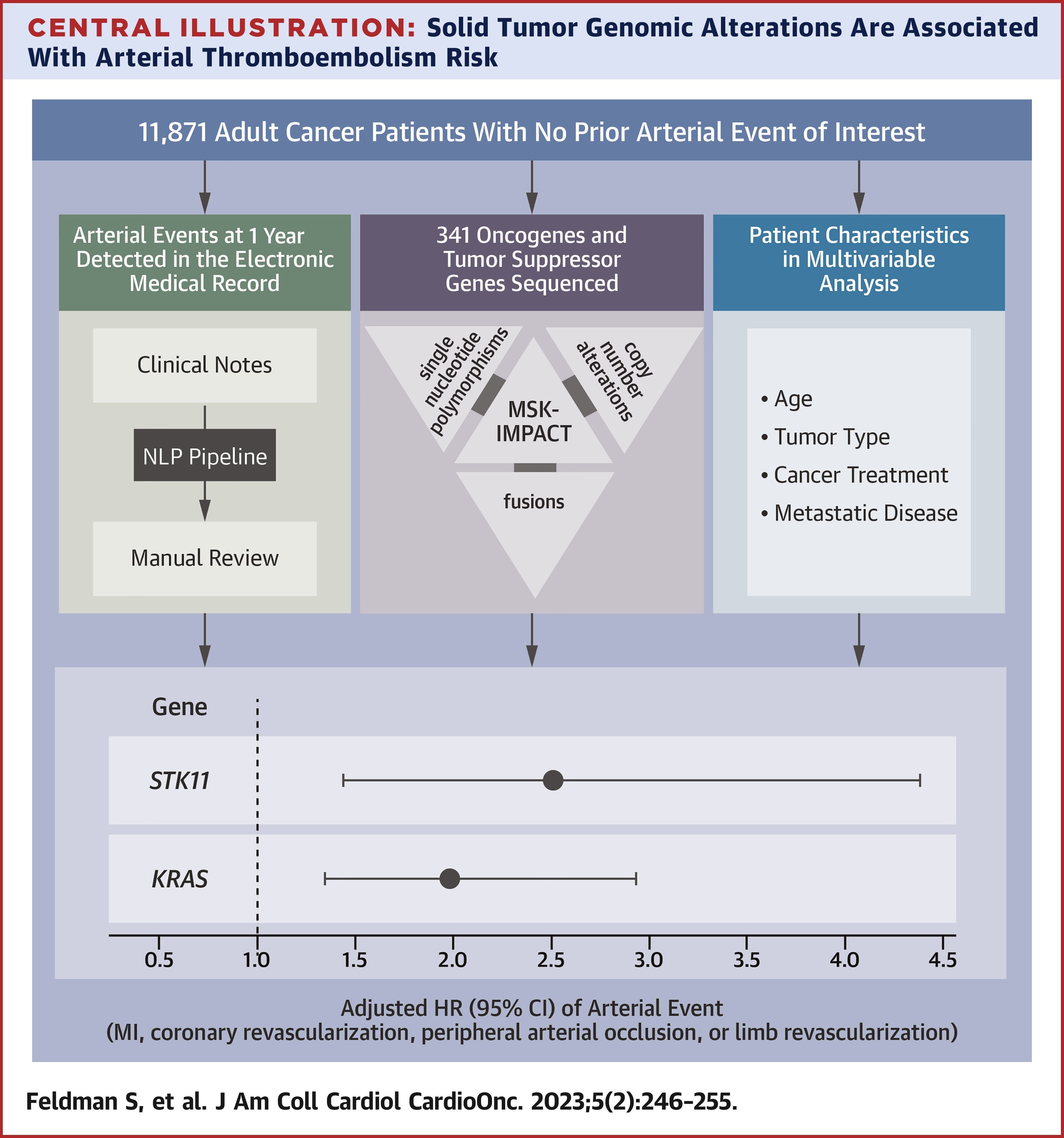
Résultats
Parmi les 11 871 patients éligibles, 74 % avaient une maladie métastatique et il y a eu 160 événements ATE. Un risque significativement accru d'ATE indépendamment du type de tumeur a été noté pour le gène suppresseur de tumeur (HR : 2,51 ; IC à 95 % : 1,44-4,38 ; multiplicité ajustée
Conclusion
Dans un vaste registre de profilage génomique des tumeurs de patients atteints de cancers solides, les altérations de KRAS et de STK11 étaient associées à un risque accru d'ATE indépendamment du type de cancer . Une enquête plus approfondie est nécessaire pour élucider le mécanisme par lequel ces mutations contribuent à l'ATE dans cette population à haut risque.
Dans un vaste registre de profilage génomique des tumeurs de patients atteints de cancers solides, les altérations de KRAS et de STK11 étaient associées à un risque accru d'ATE indépendamment du type de cancer . Une enquête plus approfondie est nécessaire pour élucider le mécanisme par lequel ces mutations contribuent à l'ATE dans cette population à haut risque.
Même constation T Solides , génomique et MTEV
" Pour inventer il faut penser à côté" Etienne Souriau
Andrew Dunbar, Kelly L. Bolton, Sean M. Devlin, Francisco Sanchez-Vega, Jianjiong Gao, Jodi V. Mones, Jonathan Wills, Daniel Kelly, Mirko Farina, Keith B. Cordner, Young Park, Sirish Kishore, Krishna Juluru, Neil M. Iyengar, Ross L. Levine, Ahmet Zehir, Wungki Park, Alok A. Khorana, Gerald A. Soff, Simon Mantha ; Le profilage génomique identifie les mutations somatiques prédictives du risque thromboembolique chez les patients atteints de tumeurs solides. Blood 2021 ; 137 (15): 2103-2113. doi : https://doi.org/10.1182/blood.2020007488
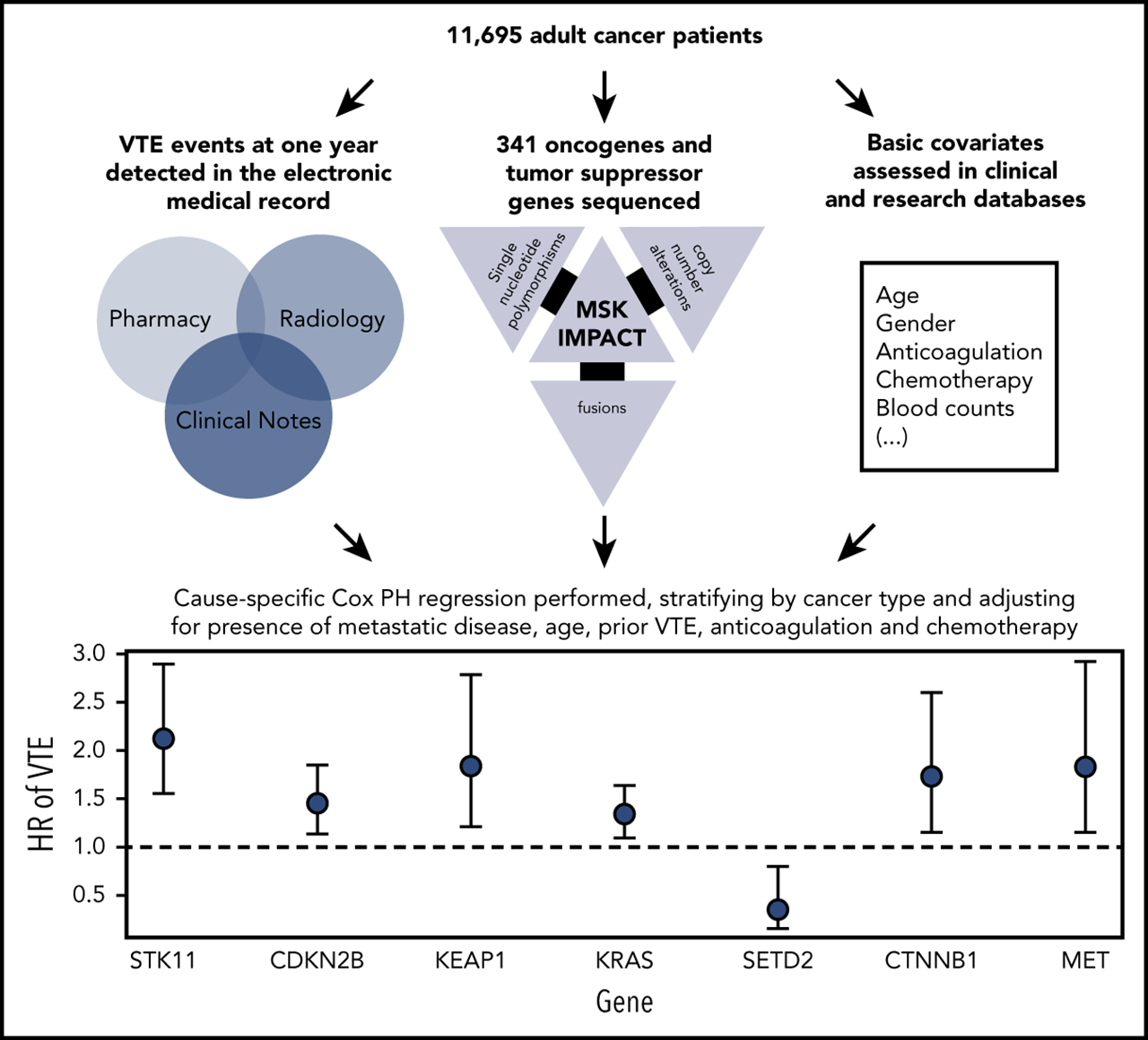
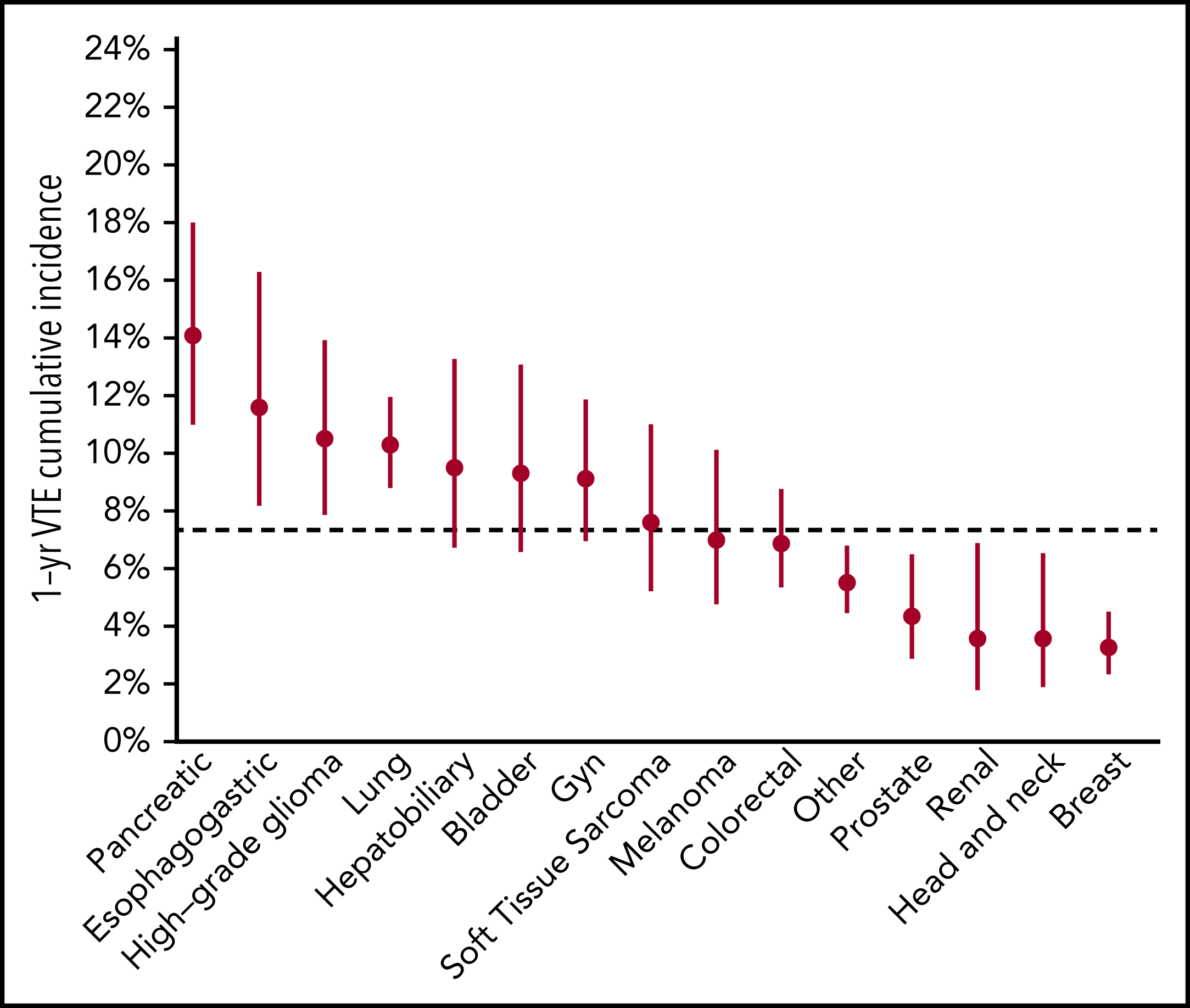
La thromboembolie veineuse (TEV) associée au cancer (CAT) est une complication bien décrite du cancer et une cause majeure de décès chez les patients atteints de cancer. Le but de cette étude était d'évaluer les associations potentielles de signatures moléculaires avec CAT, y compris les mutations spécifiques à la tumeur et la présence d'hématopoïèse clonale. Nous avons analysé les données de séquençage d'ADN ciblées à couverture approfondie de plus de 14 000 échantillons de tumeurs solides à l'aide de la plateforme Memorial Sloan Kettering–Integrated Mutation Profiling of Actionable Cancer Targets pour identifier les altérations somatiques associées à la TEV. Le point final a été défini comme le premier cas d'embolie pulmonaire associée au cancer et/ou de thrombose veineuse profonde proximale/distale des membres inférieurs. Une régression des risques proportionnels de Cox spécifique à la cause a été utilisée, en ajustant les covariables cliniques pertinentes. Sur 11 695 personnes évaluables, 72 % avaient une maladie métastatique au moment de l'analyse. Mutations spécifiques à la tumeur dansKRAS (risque relatif [HR], 1,34 ; intervalle de confiance (IC) à 95 %, 1,09-1,64 ; P ajusté = 0,08), STK11 (HR, 2,12 ; IC à 95 %, 1,55-2,89 ; P ajusté < 0,001), KEAP1 (HR, 1,84 ; IC à 95 %, 1,21-2,79 ; P ajusté = 0,07), CTNNB1 (HR, 1,73 ; IC à 95 %, 1,15-2,60 ; P ajusté = 0,09), CDKN2B (HR, 1,45 ; 95 % IC, 1,13-1,85 ; P ajusté = 0,07) et MET (HR, 1,83 ; IC à 95 %, 1,15-2,92 ; P ajusté = 0,09) étaient associés à un risque significativement accru de CAT indépendamment du type de tumeur. Mutations dans SETD2 étaient associés à une diminution du risque de CAT (HR, 0,35 ; IC à 95 %, 0,16-0,79 ; P ajusté = 0,09). La présence d'hématopoïèse clonale n'était pas associée à une augmentation du taux de TEV. Il s'agit de la première analyse à grande échelle pour élucider les événements génomiques spécifiques à la tumeur associés à CAT. Les mutations tumorales somatiques de STK11 , KRAS , CTNNB1 , KEAP1 , CDKN2B et MET ont été associées à un risque accru de MTEV chez les patients atteints de tumeurs solides. Une analyse plus approfondie est nécessaire pour valider ces résultats et identifier des signatures moléculaires supplémentaires propres à chaque type de tumeur.
" Pour inventer il faut penser à côté" Etienne Souriau
Andrew Dunbar, Kelly L. Bolton, Sean M. Devlin, Francisco Sanchez-Vega, Jianjiong Gao, Jodi V. Mones, Jonathan Wills, Daniel Kelly, Mirko Farina, Keith B. Cordner, Young Park, Sirish Kishore, Krishna Juluru, Neil M. Iyengar, Ross L. Levine, Ahmet Zehir, Wungki Park, Alok A. Khorana, Gerald A. Soff, Simon Mantha ; Le profilage génomique identifie les mutations somatiques prédictives du risque thromboembolique chez les patients atteints de tumeurs solides. Blood 2021 ; 137 (15): 2103-2113. doi : https://doi.org/10.1182/blood.2020007488

La thromboembolie veineuse (TEV) associée au cancer (CAT) est une complication bien décrite du cancer et une cause majeure de décès chez les patients atteints de cancer. Le but de cette étude était d'évaluer les associations potentielles de signatures moléculaires avec CAT, y compris les mutations spécifiques à la tumeur et la présence d'hématopoïèse clonale. Nous avons analysé les données de séquençage d'ADN ciblées à couverture approfondie de plus de 14 000 échantillons de tumeurs solides à l'aide de la plateforme Memorial Sloan Kettering–Integrated Mutation Profiling of Actionable Cancer Targets pour identifier les altérations somatiques associées à la TEV. Le point final a été défini comme le premier cas d'embolie pulmonaire associée au cancer et/ou de thrombose veineuse profonde proximale/distale des membres inférieurs. Une régression des risques proportionnels de Cox spécifique à la cause a été utilisée, en ajustant les covariables cliniques pertinentes. Sur 11 695 personnes évaluables, 72 % avaient une maladie métastatique au moment de l'analyse. Mutations spécifiques à la tumeur dansKRAS (risque relatif [HR], 1,34 ; intervalle de confiance (IC) à 95 %, 1,09-1,64 ; P ajusté = 0,08), STK11 (HR, 2,12 ; IC à 95 %, 1,55-2,89 ; P ajusté < 0,001), KEAP1 (HR, 1,84 ; IC à 95 %, 1,21-2,79 ; P ajusté = 0,07), CTNNB1 (HR, 1,73 ; IC à 95 %, 1,15-2,60 ; P ajusté = 0,09), CDKN2B (HR, 1,45 ; 95 % IC, 1,13-1,85 ; P ajusté = 0,07) et MET (HR, 1,83 ; IC à 95 %, 1,15-2,92 ; P ajusté = 0,09) étaient associés à un risque significativement accru de CAT indépendamment du type de tumeur. Mutations dans SETD2 étaient associés à une diminution du risque de CAT (HR, 0,35 ; IC à 95 %, 0,16-0,79 ; P ajusté = 0,09). La présence d'hématopoïèse clonale n'était pas associée à une augmentation du taux de TEV. Il s'agit de la première analyse à grande échelle pour élucider les événements génomiques spécifiques à la tumeur associés à CAT. Les mutations tumorales somatiques de STK11 , KRAS , CTNNB1 , KEAP1 , CDKN2B et MET ont été associées à un risque accru de MTEV chez les patients atteints de tumeurs solides. Une analyse plus approfondie est nécessaire pour valider ces résultats et identifier des signatures moléculaires supplémentaires propres à chaque type de tumeur.

"Demain est moins à découvrir qu'à inventer " Gaston Berger
Commentaire Isabelle Mahé et Coll sur l'article de S Fedman
Mahé I, Scotté F, Elalamy I, et al. La génétique tumorale est thrombogène : la nécessité d'agir
J Am Coll Cardiol CardioOnc. 2023 avril, 5 (2) 256–258.
https://www.sciencedirect.com/science/article/pii/S2666087323000613
J Am Coll Cardiol CardioOnc. 2023 avril, 5 (2) 256–258.
https://www.sciencedirect.com/science/article/pii/S2666087323000613
Article libre d'accés
"Les patients atteints de cancer présentent un risque élevé de thrombose veineuse et artérielle ultérieure. Ce risque est basé sur des associations multifactorielles et synergiques impliquant les comorbidités des patients, les caractéristiques du cancer et le traitement antitumoral.
"Les patients atteints de cancer présentent un risque élevé de thrombose veineuse et artérielle ultérieure. Ce risque est basé sur des associations multifactorielles et synergiques impliquant les comorbidités des patients, les caractéristiques du cancer et le traitement antitumoral.
Dans leur étude dans ce numéro de JACC: CardioOncology , Feldman et al mettent en évidence une forte association entre les altérations génomiques tumorales et le risque de thromboembolie artérielle (ATE) à 1 an dans un vaste registre rétrospectif de profilage tumoral impliquant 14 223 patients adultes atteints de tumeurs malignes solides (1 044 ont été exclus en raison d'antécédents d'ATE). Parmi les 341 gènes testés, KRAS et STK11les altérations génétiques somatiques du cancer étaient associées à un risque accru d'ATE, quel que soit le site de la tumeur. Il s'agit de l'une des rares études portant sur le rôle des altérations génétiques dans le risque d'ATE. Le même groupe a précédemment rapporté dans une cohorte similaire que les mutations tumorales somatiques de STK11 , KRAS , CTNNB1 , KEAP1 , CDKN2B et MET prédisaient une incidence accrue de thromboembolie veineuse (TEV) jusqu'à 1 an avant le diagnostic."
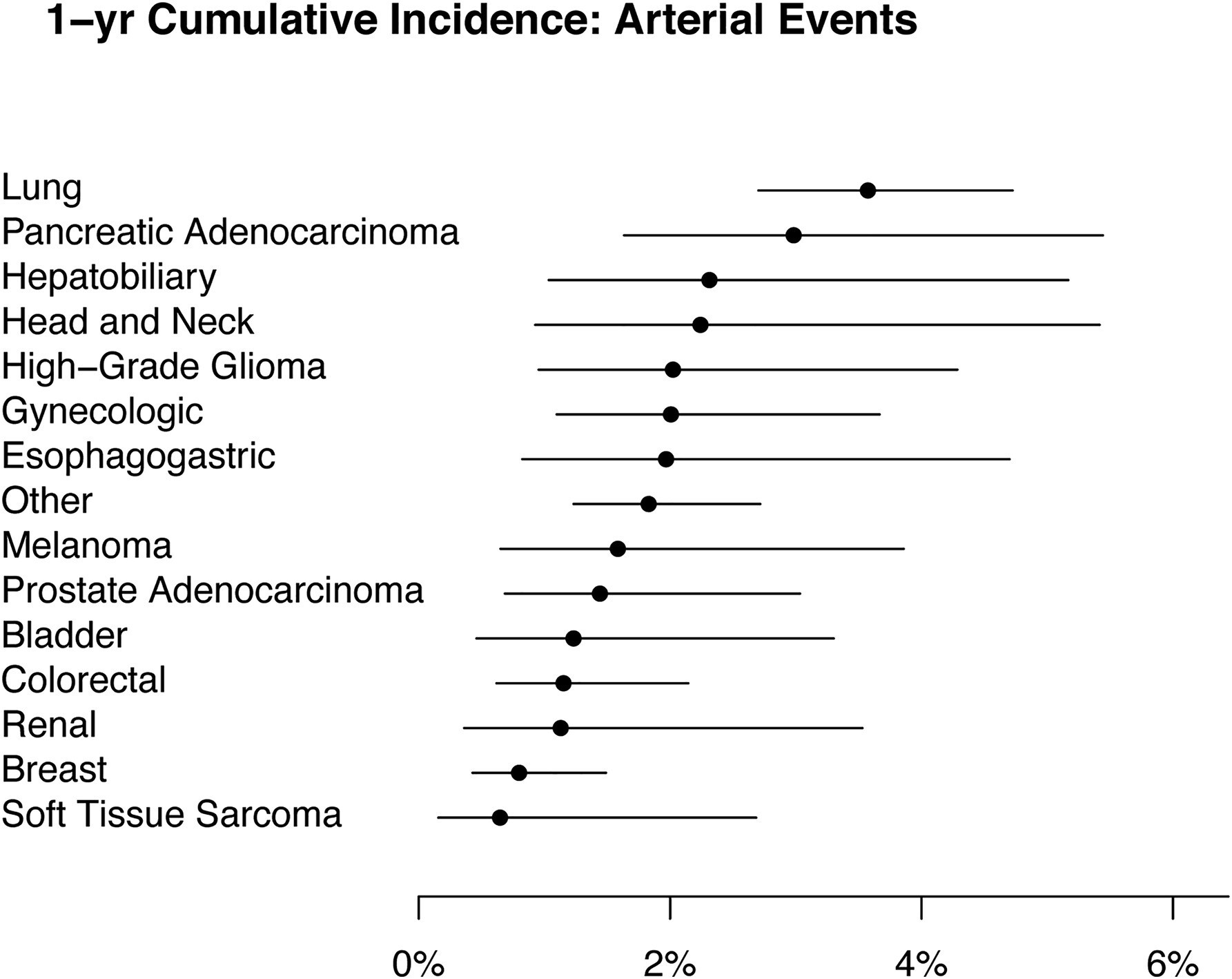
Fait intéressant dans la présente étude de Feldman et al, 1 les patients atteints de tous les types de cancer étudiés présentaient un risque accru d'ATE, les cancers du poumon et du pancréas conférant le risque le plus élevé en termes d'incidence cumulée sur 1 an, comme pour la MTEV. (Dunbar A)
Ainsi, l'identification et l'intégration de la génomique moléculaire des tumeurs dans l'évaluation clinique et la stratification des risques constitueraient une avancée majeure dans la prise en charge des patients atteints de cancer. Une approche plus globale intégrant les caractéristiques des patients (âge, comorbidités, médicaments, fragilité, etc.), les données biologiques et l'analyse génomique multidisciplinaire pourrait être envisagée à l'avenir pour évaluer l'impact pronostique sur la progression du cancer, l'évolution des comorbidités et la survenue de complications telles que qiue lesaccidents de thrombose artérielle .....et la MTEV ! D'où ce "CALL TO ACTION" nécessaire et indispensable . Une fois de plus l'IA devrait accélérer ces actions à entreprendre, IA un passage obligé ne médecin mais un passage que les médecins doivent maîtrier .
Commentaire
Fait intéressant dans la présente étude de Feldman et al, 1 les patients atteints de tous les types de cancer étudiés présentaient un risque accru d'ATE, les cancers du poumon et du pancréas conférant le risque le plus élevé en termes d'incidence cumulée sur 1 an, comme pour la MTEV. (Dunbar A)
Ainsi, l'identification et l'intégration de la génomique moléculaire des tumeurs dans l'évaluation clinique et la stratification des risques constitueraient une avancée majeure dans la prise en charge des patients atteints de cancer. Une approche plus globale intégrant les caractéristiques des patients (âge, comorbidités, médicaments, fragilité, etc.), les données biologiques et l'analyse génomique multidisciplinaire pourrait être envisagée à l'avenir pour évaluer l'impact pronostique sur la progression du cancer, l'évolution des comorbidités et la survenue de complications telles que qiue lesaccidents de thrombose artérielle .....et la MTEV ! D'où ce "CALL TO ACTION" nécessaire et indispensable . Une fois de plus l'IA devrait accélérer ces actions à entreprendre, IA un passage obligé ne médecin mais un passage que les médecins doivent maîtrier .
Commentaire
Un grand pas de plus entre Cancer, MTEV et Thrombose artérielle, grâce à la génomique des tumeurs . La génomique pourrait aider à mieux stratifier les patients notamment leur risque vasculaire MTEV, Thrombose artérielle
Nous entrons à cadence rapide dans la médecine de précision et une médecine prédictive.
Pour en savoir plus sue la génomique des tumeurs : https://pfmg2025.aviesan.fr/patients-et-famille/la-medecine-genomique-appliquee-aux-cancers/
Dans la pratique médicale, la génomique permet :
* d'améliorer les diagnostics;
* d'identifier des prédispositions génétiques d'une personne par rapport à une maladie;
* de mettre au point des traitements selon l'information génétique de chaque individu et, par conséquent, de permettre l'avancement de la médecine personnalisée;
* de connaître les effets de nos modes de vie et de notre environnement sur notre génome et notre santé.
La fin de l’approche « même médicament et même traitement pour tous »?
Plusieurs années, voire quelques décennies, s’écouleront avant que la médecine personnalisée ne livre toutes ses promesses. Mais avec les progrès amorcés en génétique, en protéomique (étude des protéines), en métabolomique (étude des métabolites, de petites molécules produites par le métabolisme, comme le glucose) ou encore en épigénétique (étude de l’influence de l’environnement et des habitudes de vie sur la santé), les applications de la médecine personnalisée seront de plus en plus accessibles aux patients dans les cliniques.
https://www.genomequebec.com/votre-sante/* d'identifier des prédispositions génétiques d'une personne par rapport à une maladie;
* de mettre au point des traitements selon l'information génétique de chaque individu et, par conséquent, de permettre l'avancement de la médecine personnalisée;
* de connaître les effets de nos modes de vie et de notre environnement sur notre génome et notre santé.
La fin de l’approche « même médicament et même traitement pour tous »?
Plusieurs années, voire quelques décennies, s’écouleront avant que la médecine personnalisée ne livre toutes ses promesses. Mais avec les progrès amorcés en génétique, en protéomique (étude des protéines), en métabolomique (étude des métabolites, de petites molécules produites par le métabolisme, comme le glucose) ou encore en épigénétique (étude de l’influence de l’environnement et des habitudes de vie sur la santé), les applications de la médecine personnalisée seront de plus en plus accessibles aux patients dans les cliniques.
MÉDECINE PERSONNALISÉE OU MÉDECINE DE PRÉCISION?
On emploie souvent ces deux termes comme des synonymes. Et c’est presque le cas! Pour les spécialistes cependant, il existe une petite distinction entre les deux.
On emploie souvent ces deux termes comme des synonymes. Et c’est presque le cas! Pour les spécialistes cependant, il existe une petite distinction entre les deux.
* La médecine de précision permet une stratification au niveau moléculaire.
* La médecine personnalisée vise à identifier des traitements spécifiques, et/ou à cibler des stratégies de prévention et de traitement en regard des caractéristiques uniques d’un individu (par exemple, socioculturelles).
Pour en savoir plus sue la génomique des tumeurs : https://pfmg2025.aviesan.fr/patients-et-famille/la-medecine-genomique-appliquee-aux-cancers/
En quoi consiste l’examen des caractéristiques génétiques d’une tumeur ?
Il consiste à séquencer (c’est-à-dire décoder) l’ADN acide désoxyribonucléique – et l’ARN – acide ribonucléique – qui se trouvent dans les cellules tumorales et sera effectué à partir d’un fragment de la tumeur.
Il consiste à séquencer (c’est-à-dire décoder) l’ADN acide désoxyribonucléique – et l’ARN – acide ribonucléique – qui se trouvent dans les cellules tumorales et sera effectué à partir d’un fragment de la tumeur.
Lors du diagnostic et au cours de votre suivi, des prélèvements de sang, de cellules, de liquides ou de tissus ont été réalisés. Ces prélèvements sont conservés pendant plusieurs années et peuvent être utilisés pour établir le profil génétique de la tumeur.
Il pourra cependant être nécessaire de réaliser une nouvelle biopsie. Le médecin en discutera alors avec le patient lui demandera votre accord.
Pour en savoir encore plus
Pourquoi déterminer les caractéristiques génétiques d’une tumeur ?
Les mécanismes à l’origine du développement et de la progression des cancers sont très divers et varient d’un patient à l’autre. Chaque tumeur possède des caractéristiques qui lui sont propres, que ce soit au niveau des cellules tumorales elles mêmes ou de leur interaction avec les cellules et organes qui les entourent.
Les mécanismes à l’origine du développement et de la progression des cancers sont très divers et varient d’un patient à l’autre. Chaque tumeur possède des caractéristiques qui lui sont propres, que ce soit au niveau des cellules tumorales elles mêmes ou de leur interaction avec les cellules et organes qui les entourent.
Il n’existe pas un cancer par organe mais une multitude de sous-types de cancers caractérisés chacun par des anomalies particulières. Une meilleure connaissance de ces anomalies, en particulier au niveau de l’ADN des cellules tumorales (les gènes de la tumeur), et de leurs conséquences sur les mécanismes de développement des cancers, a permis de mettre en place de nouveaux traitements qui conduisent à la destruction spécifique des cellules tumorales.
La médecine de précision, fondée sur ces derniers acquis de la recherche en génomique, a pour objectif de proposer au patient un traitement adapté aux caractéristiques génétiques de sa tumeur (une thérapie ciblée ou un traitement adapté), s’il existe. Il ne remplace pas les traitements déjà en place mais vient les compléter, lorsqu’ils sont peu ou pas assez efficaces.
Pour en savoir encore plus
" On vient de décoder entièrement le génome de la poule. Il suffit désormais de décoder celui de l'œuf pour savoir qui est arrivé en premier." Hervé Le Tellier

