« Ce n’est pas le fait d’être aimé par quelqu’un qui guérit notre guerre civile intérieure, c’est d’être aimé par soi-même, de s’accepter, de la racine à la cime. » Placide Gaboury
Obésité, dyslipidémie et maladies cardiovasculaires : une étude conjointe de l'Obesity Medicine Association et de la National Lipid Association (2024) Harold Edward Bays, Carol Kirkpatrick, Kevin C. Maki, Peter P. Toth, Ryan T. Morgan, Justin Tondt, Sandra Michelle Christensen, Dave Dixon, Terry A. Jacobson Piliers de l'obésité Juin 2024 © 2024 L'auteur(s). Publié par Elsevier Inc. pour le compte de l'Obesity Medicine Association et de la National Lipid Association
https://www.sciencedirect.com/science/article/pii/S266736812400010X#abs0015
Article libre d'accès
Contexte
Méthodes
Résultats
RÉSUMÉ CLINIQUE EXÉCUTIF
1) L'Obesity Medicine Association a défini l'obésité comme une « maladie neurocomportementale multifactorielle grave, chronique, progressive, récurrente et traitable, dans laquelle une augmentation de l'adiposité favorise un dysfonctionnement du tissu adipeux et des forces physiques anormales de la masse grasse, entraînant des conséquences néfastes sur la santé métabolique, biomécanique et psychosociale ».- 2) Dans les adipocytes blancs, les triglycérides représentent plus de 90 % du volume des adipocytes.
- 3) le tissu adipeux représente le plus grand réservoir corporel de cholestérol libre.
- 4) La plupart des lipides du tissu adipeux proviennent d’interactions avec les lipoprotéines circulantes.
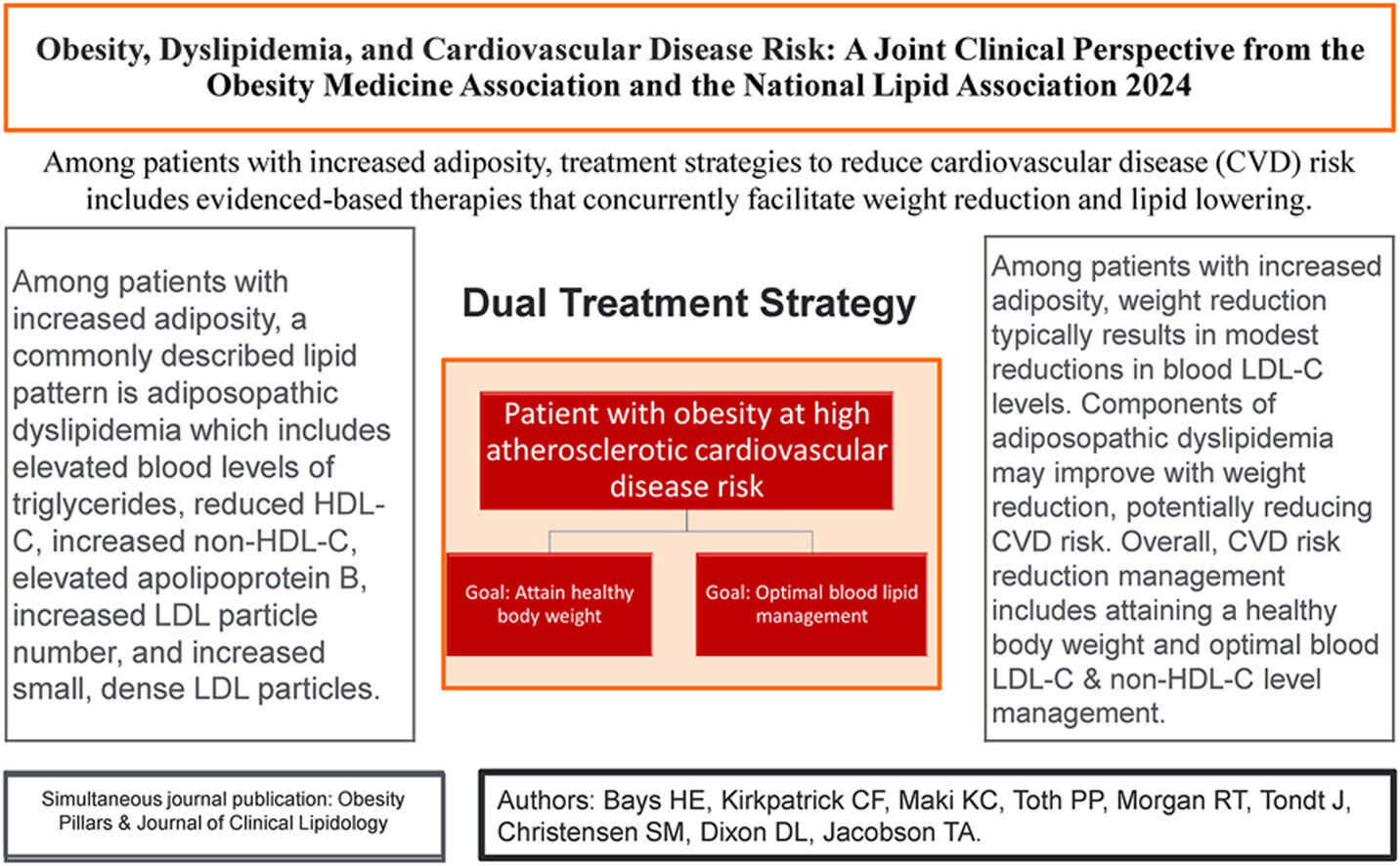
- 5) Parmi les patients présentant une adiposité accrue, un schéma lipidique fréquemment décrit est la dyslipidémie adiposopathique (« dyslipidémie athérogène ») qui comprend des taux élevés de triglycérides sanguins, des taux réduits de HDL-C sanguin, une augmentation du non-HDL-C, une augmentation de l'apolipoprotéine B, une augmentation du nombre de particules LDL et une augmentation des petites particules LDL denses.
- 6) L’augmentation légère à modeste des taux sanguins de LDL-C chez les patients obèses peut ne pas caractériser de manière adéquate le risque accru de MCVA attribuable à la dyslipidémie.
- 7) Chez les patients présentant une adiposité accrue, une alimentation saine et une activité physique régulière peuvent aider à réduire le poids corporel et à améliorer les niveaux de lipides.
- 8) Chez les patients présentant une adiposité accrue, une réduction de poids ≥ 5 % peut réduire les taux de triglycérides sanguins, une réduction de poids plus importante réduisant encore les taux de triglycérides sanguins et augmentant les taux de HDL-C sanguin ; une réduction de poids encore plus importante de > 10 à 15 % a le potentiel de réduire le risque de MCV.
- 9) Chez les patients présentant une adiposité accrue, la perte de poids n’entraîne généralement qu’une réduction légère à modeste des taux de LDL-C dans le sang.
- 10) Parmi les patients présentant une adiposité accrue, les stratégies de traitement visant à réduire le risque de MCV comprennent des thérapies fondées sur des données probantes qui facilitent simultanément la perte de poids et la réduction des lipides athérogènes.
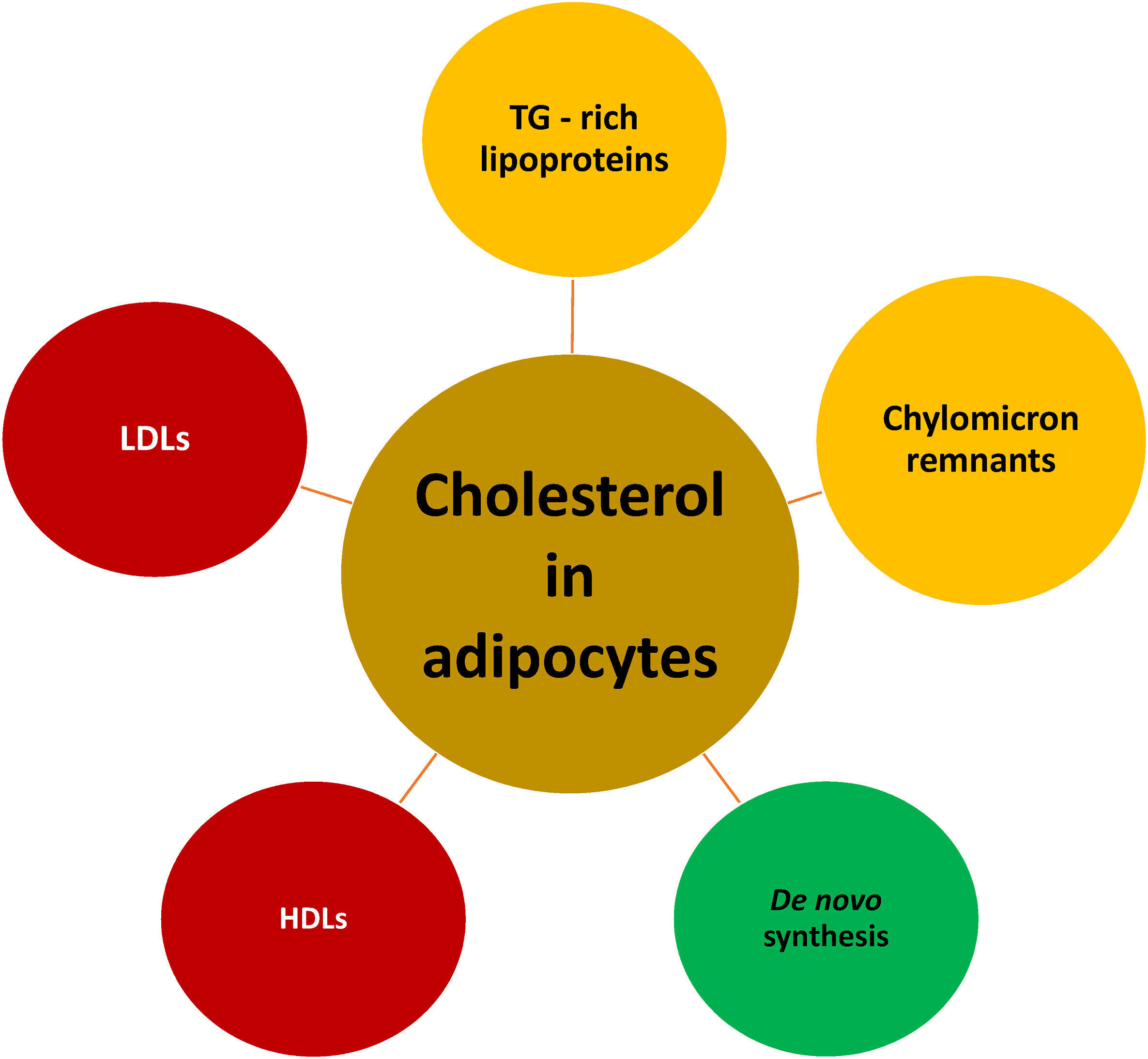
Afflux de cholestérol dans les adipocytes. Les adipocytes subissent une synthèse de novo limitée de cholestérol [ 29 ]. L'origine de la majeure partie du cholestérol trouvé dans les adipocytes provient d'interactions avec les lipoprotéines. Les lipoprotéines riches en TG circulantes sécrétées hépatiquement, telles que les VLDL et leurs résidus lipoprotéiques (c'est-à-dire les petites VLDL et les lipoprotéines de densité intermédiaire) interagissent avec les récepteurs des lipoprotéines ancrés à la membrane des adipocytes, tels que le récepteur des VLDL (membre de la famille des récepteurs des LDL) . De même, les particules de LDL circulantes interagissent avec les récepteurs des LDL des adipocytes. L'interaction des lipoprotéines (ainsi que de leur cholestérol) avec leurs récepteurs adipocytes respectifs entraîne leur endocytose dans les adipocytes . Le cholestérol postprandial peut être délivré aux adipocytes à partir des restes circulants de chylomicrons (c'est-à-dire, les chylomicrons étant de grosses lipoprotéines produites par l'intestin grêle), via des interactions avec les récepteurs LDL des adipocytes et les protéines apparentées aux récepteurs LDL qui reconnaissent et interagissent avec les lipoprotéines contenant de l'apolipoprotéine E .Enfin, les adipocytes peuvent obtenir du cholestérol supplémentaire à partir des HDL sécrétées hépatiques/intestinales via le SR-B1 bidirectionnel .
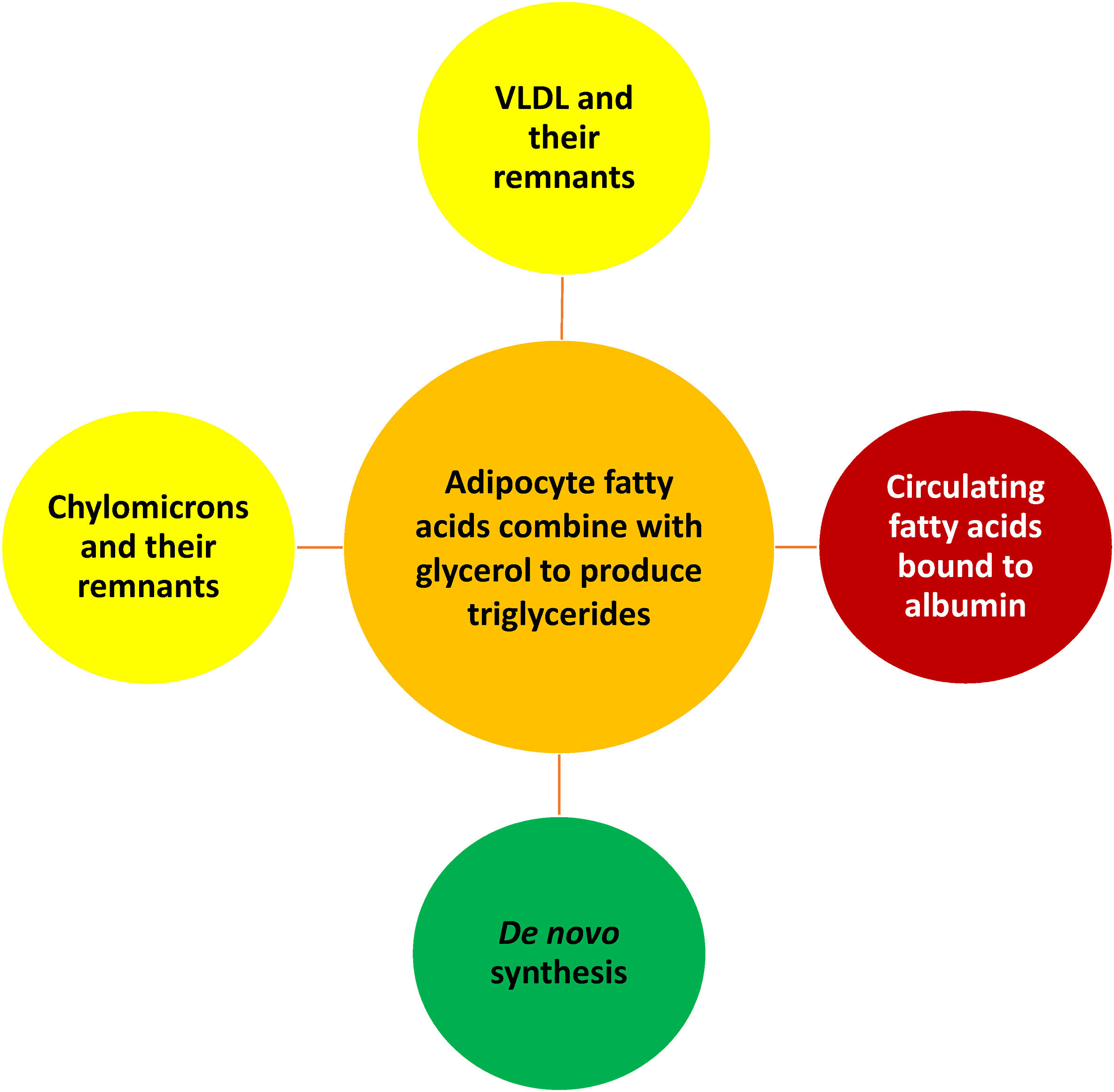
Origine des acides gras et des triglycérides dans les adipocytes. Les adipocytes subissent une synthèse de novo limitée de triglycérides. Les triglycérides endogènes synthétisés par le foie circulent dans les lipoprotéines riches en triglycérides sécrétées hépatiquement, telles que les VLDL et leurs résidus lipoprotéiques (lipoprotéines de densité intermédiaire). Les triglycérides alimentaires sont transportés dans la circulation par les chylomicrons riches en triglycérides et leurs résidus (les chylomicrons étant de grosses lipoprotéines produites par l'intestin grêle). La LPL présente sur les cellules endothéliales capillaires du tissu adipeux hydrolyse les triglycérides des lipoprotéines riches en triglycérides, générant ainsi des acides gras et du glycérol. Les acides gras sont générés lorsque la LPL agit sur les lipoprotéines riches en triglycérides. Ces acides gras pénètrent dans les adipocytes, où ils peuvent être réestérifiés avec du glycérol pour (re)former des triglycérides. De plus, les acides gras sont transportés dans la circulation sanguine liés à l'albumine. Les acides gras pénétrant dans les adipocytes peuvent également provenir d'acides gras qui se dissocient de l'albumine.
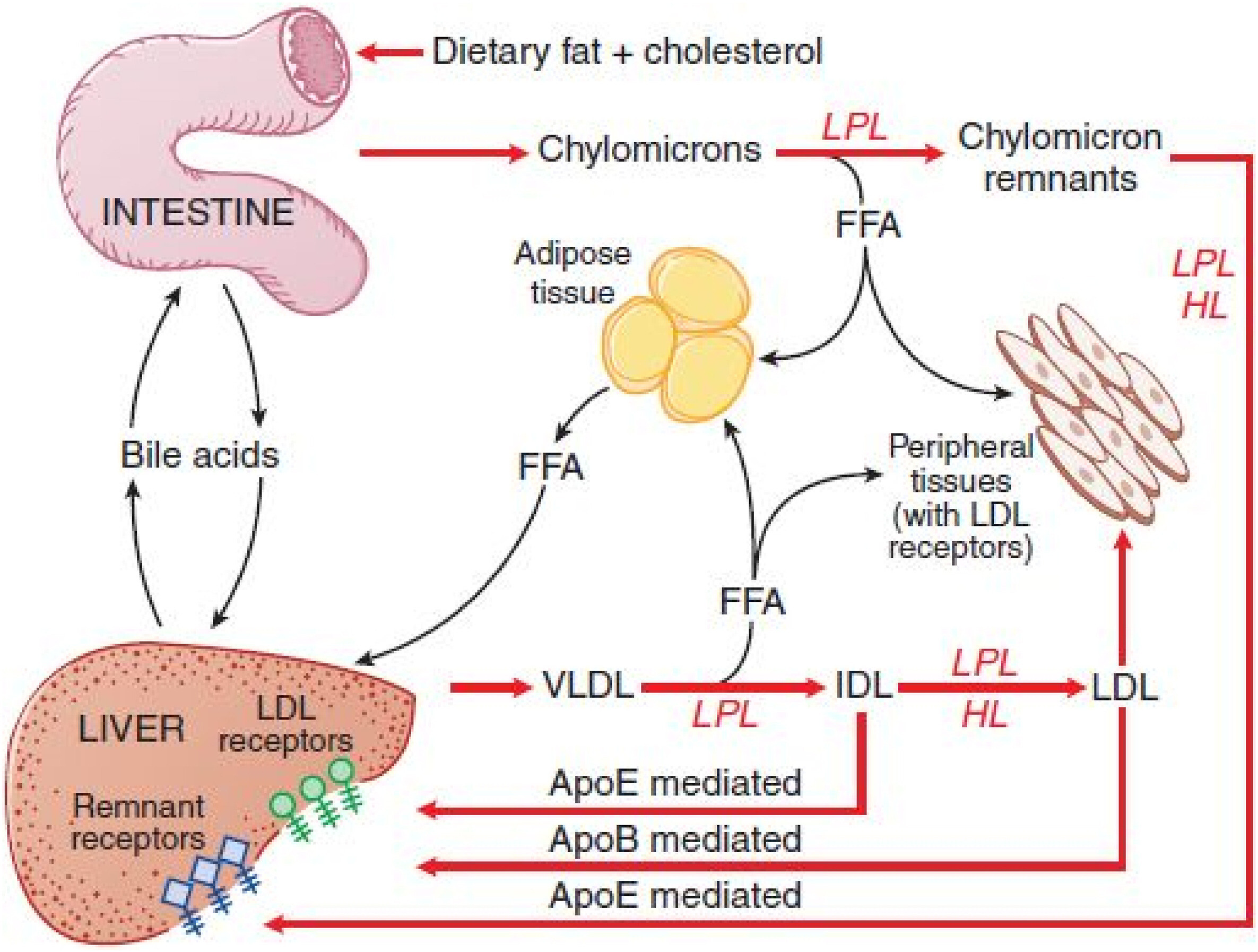
Éléments clés du métabolisme des triglycérides : Cette figure résume les principales voies de métabolisme des chylomicrons synthétisés dans l'intestin et des VLDL synthétisés dans le foie.

Lipolyse des triglycérides adipocytaires . Les voies lipolytiques intracellulaires dans les adipocytes impliquent : (a) l'hydrolyse de TAG en DAG et un acide gras par ATGL, (b) l'hydrolyse de DAG en MAG et un acide gras par HSL, et (c) l'hydrolyse de MAG en glycérol et un acide gras par MGL . HSL est une enzyme sentinelle dans les adipocytes qui est activée par des hormones, telles que l'hormone de libération de la corticotropine, l'épinéphrine, la noradrénaline et le glucagon, et supprimée par l'insuline . Bien que cette figure décrive l'activité de HSL sur DAG, HSL a également une activité hydrolytique sur d'autres substrats, tels que TAG, les esters de cholestérol et les esters de rétinyle . Étant donné que l'HSL est supprimée par l'insuline, la résistance à l'insuline peut entraîner une dysrégulation de la lipolyse, contribuant potentiellement à l'augmentation de la masse du tissu adipeux .

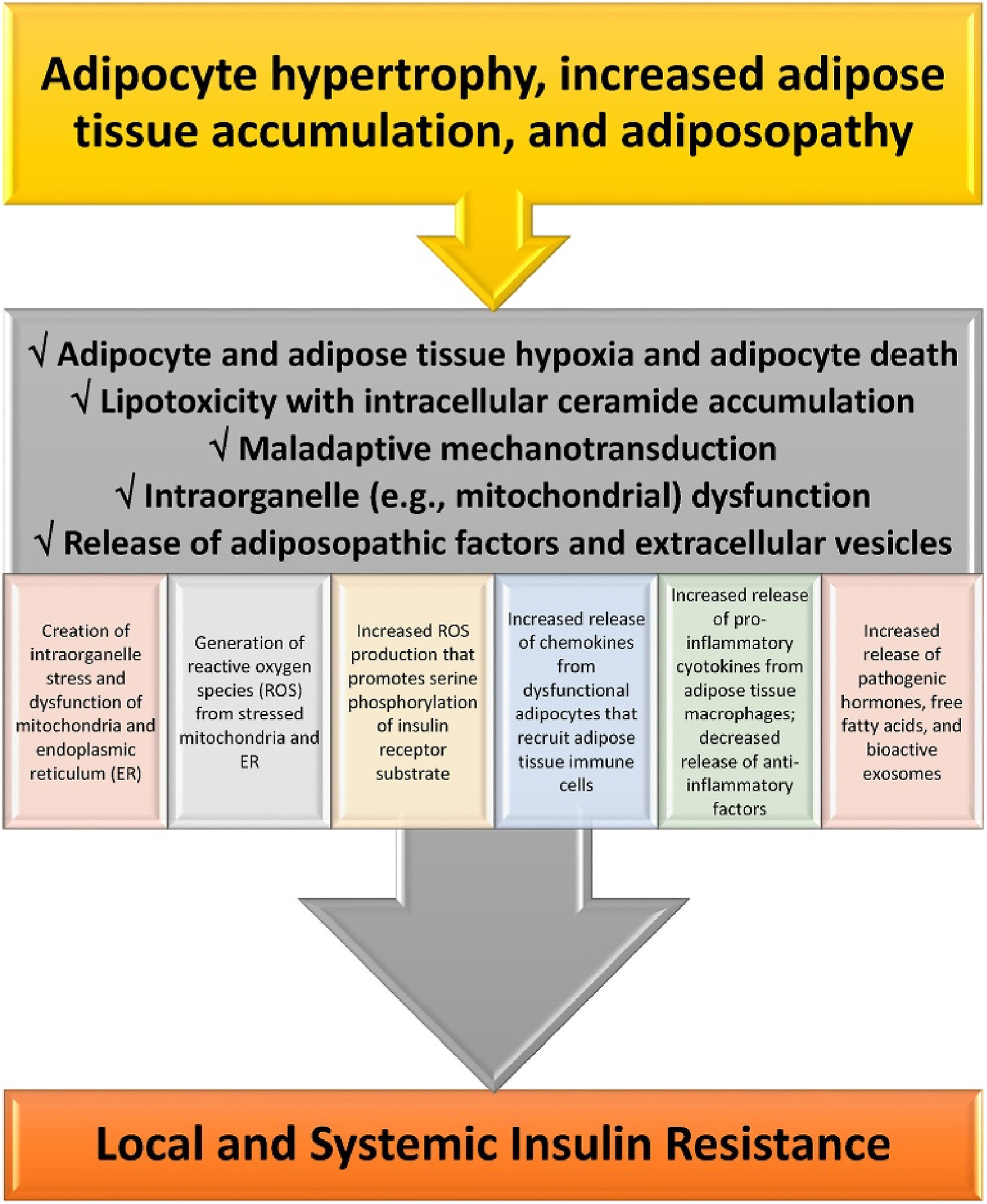
Mécanismes détaillant comment les processus adiposopathiques conduisent à la résistance à l'insuline. Si l'hypertrophie adipocytaire et l'accumulation de tissu adipeux induites par l'obésité dépassent son apport vasculaire, l'apport insuffisant d'oxygène peut contribuer à l'hypoxie des adipocytes et du tissu adipeux et à une augmentation de la mortalité des adipocytes. L'hypoxie des adipocytes et du tissu adipeux peut affecter de nombreux processus métaboliques tels que l'angiogenèse, la prolifération et la différenciation des adipocytes, la production d'espèces réactives de l'oxygène, l'inflammation et la fibrose. Français Au-delà de l'hypoxie des adipocytes et du tissu adipeux, un excès de lipides intracellulaires sous forme d'acides gras peut conduire à la formation de céramide (c'est-à-dire de sphingolipides estérifiés en acide gras) et de diacylglycérol (DAG) dans les adipocytes, où, de manière similaire à l'effet indésirable de l'augmentation de l'afflux d'acides gras et de l'accumulation de céramides et de DAG dans le foie et les muscles, peut provoquer une lipotoxicité conduisant à un dysfonctionnement des adipocytes, tel que : (a) l'inhibition de la protéine kinase B AKT et donc une diminution de l'absorption du glucose via GLUT 4, (b) l'inhibition de la lipase sensible aux hormones et donc une diminution de la lipolyse à médiation adrénergique, et (c) une altération de la fonction mitochondriale, entraînant un état pro-oxydatif dû à la production accrue de radicaux libres d'oxygène et des altérations de la dynamique énergétique en raison d'une production réduite d'adénosine triphosphate, contribuant tous à la résistance à l'insuline. La mécanotransduction se produit lorsque les cellules détectent, intègrent et répondent à des stimuli mécaniques via la signalisation et les adaptations biologiques. Lors d'une expansion saine, le tissu adipeux réagit en s'adaptant à son microenvironnement (par exemple, formation, dissolution et reformation de la matrice extracellulaire) par un remodelage continu afin de maintenir son intégrité structurelle et fonctionnelle. En cas de bilan calorique positif, notamment en cas de prolifération altérée, l'expansion du tissu adipeux s'accompagne souvent d'une hypertrophie des adipocytes existants. L'hypertrophie adipocytaire, l'infiltration des cellules immunitaires, la fibrose et les modifications de l'architecture vasculaire peuvent générer un stress mécanique sur les adipocytes, altérer la mécanotransduction adaptative et perturber la physiologie de l'expansion des adipocytes. Une mécanotransduction inadaptée peut favoriser un dysfonctionnement du tissu adipeux associé à l'obésité (adiposopathie). Globalement, les facteurs contribuant au dysfonctionnement mitochondrial comprennent l'hypoxie des adipocytes et du tissu adipeux, la lipotoxicité, une mécanotransduction inadaptée, l'hyperglycémie, l'apport de certains acides gras saturés nocifs [ 132 ] et, plus particulièrement en cas d'obésité, un apport excessif en nutriments [ 133].]. Le dysfonctionnement mitochondrial des adipocytes est une cause potentielle majeure d'inflammation du tissu adipeux. Parmi les conséquences néfastes du dysfonctionnement mitochondrial adiposopathique (et du réticulum endoplasmique) figure la production d'espèces réactives de l'oxygène (ERO). Les ERO sont des molécules instables contenant de l'oxygène qui réagissent facilement avec d'autres molécules cellulaires, contribuant aux lésions de l'acide désoxynucléique, au cancer, à la fibrose et au vieillissement. D'autres facteurs contribuant à l'augmentation de la production d'ERO sont l'hyperglycémie et l'augmentation adiposopathique des cytokines, telles que le facteur de nécrose tumorale. L'augmentation de la production d'ERO mitochondriale médiée par le facteur de nécrose tumorale peut faciliter l'activation de JNK, augmenter la phosphorylation de la sérine du substrat du récepteur de l'insuline-1 (IRS-1), diminuer la phosphorylation de l'IRS-1 sur tyrosine stimulée par l'insuline et ainsi contribuer à la résistance à l'insuline médiée par l'obésité. En résumé, l'hypertrophie des adipocytes, conduisant à un dysfonctionnement initial, entraîne des effets pro-inflammatoires locaux qui, à leur tour, aggravent la fonction adipocytaire, entraînant une aggravation de l'adiposopathie et de la résistance à l'insuline des adipocytes. Au niveau systémique, les facteurs pro-inflammatoires adiposopathiques, les hormones pathogènes et les acides gras libres peuvent être libérés dans la circulation soit directement à partir du tissu adipeux, soit via les vésicules extracellulaires des adipocytes (par exemple, des molécules bioactives telles que les lipides, les protéines et les acides nucléiques, qui sont conditionnées et transférées des adipocytes vers d'autres tissus via les exosomes, les microvésicules et les corps apoptotiques formés suite à la nécroptose ou à la pyroptose des adipocytes). L'augmentation des facteurs pro-inflammatoires (par exemple, le facteur de nécrose tumorale et les interleukines 1 bêta et 6) et la diminution de la sécrétion de facteurs anti-inflammatoires (par exemple, l'adiponectine) peuvent favoriser la résistance à l'insuline (c'est-à-dire une réduction des récepteurs de l'insuline à la surface cellulaire et des défauts des récepteurs post-insuline) dans les organes périphériques sensibles du tissu non adipeux, tels que le muscle squelettique et le foie, contribuant à une « inflexibilité » dans la gestion, la réponse ou l'adaptation aux changements des substrats métaboliques. (Adapté/copié avec la permission de : Bays HE, Obesity Pillars. 2023)
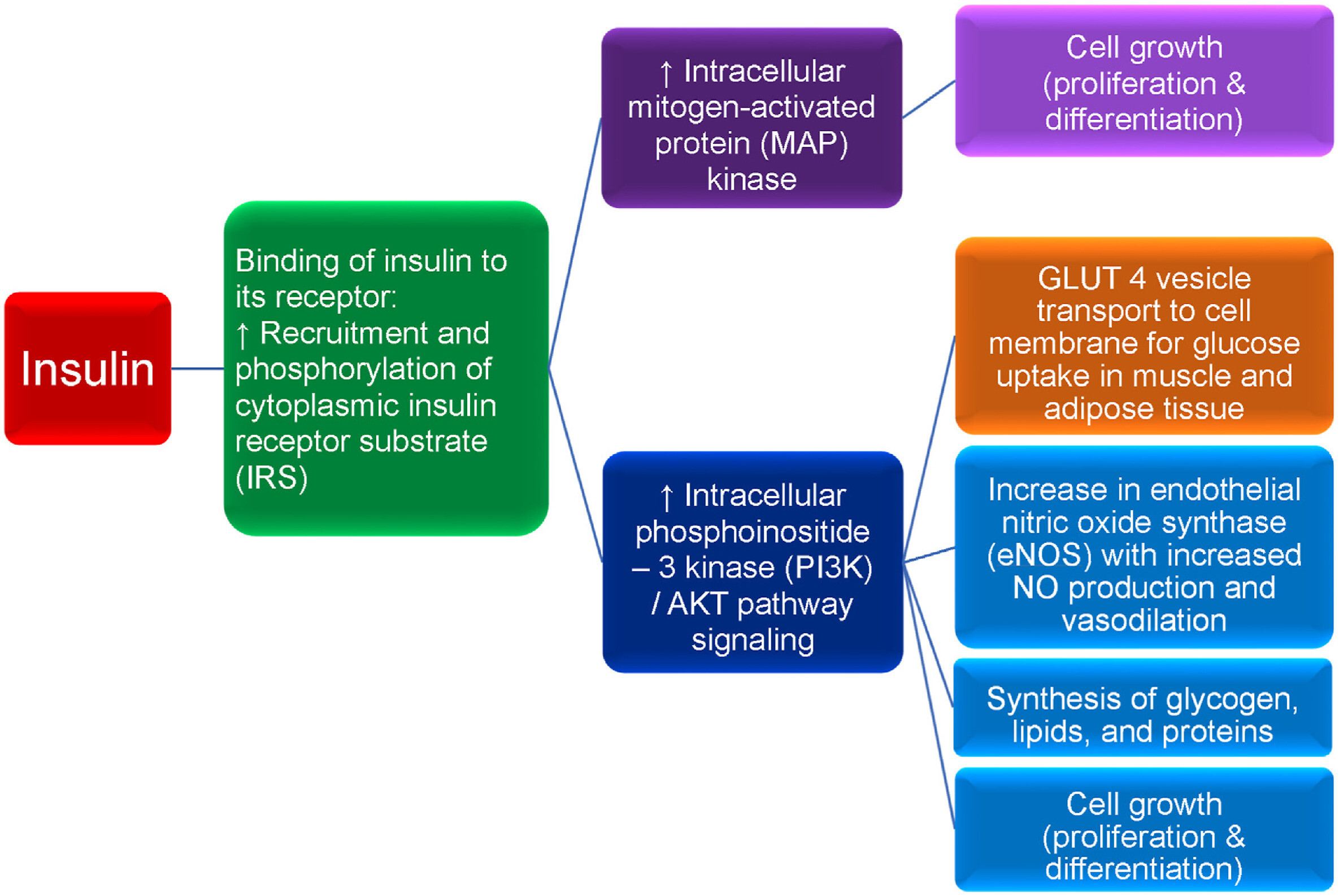
Fonctions de l'insuline et des récepteurs de l'insuline. Une diminution de l'activité de l'insuline peut être due à une diminution absolue ou relative de l'insuline circulante et/ou à une altération de la signalisation de l'insuline via un nombre réduit de récepteurs de l'insuline et/ou une altération de la signalisation de l'insuline post-récepteur. La normoglycémie peut être maintenue aux premiers stades de la résistance à l'insuline par une augmentation de l'insuline basale (c'est-à-dire une hyperinsulinémie), comme c'est souvent le cas chez les patients obèses. Cependant, avec le temps, la sécrétion d'insuline peut ne plus être suffisante pour surmonter la résistance à l'insuline, ce qui entraîne une hyperglycémie. L'obésité et l'hyperglycémie du diabète de type 2 (DT2) peuvent entraîner une diminution relative de la sécrétion pancréatique d'insuline, potentiellement due à des élévations des taux de leptine, ainsi qu'à l'apoptose avec diminution de la masse des cellules bêta pancréatiques résultant de : (a) l'épuisement/surcharge des cellules bêta, (b) la glucolipotoxicité, (c) l'augmentation des facteurs pro-inflammatoires, et (d) la diminution des anti- Facteurs inflammatoires (par exemple, l'adiponectine). L'insuline est une hormone peptidique libérée par les cellules bêta du pancréas en réponse à une augmentation de la glycémie (par exemple, réponse postprandiale à l'ingestion de glucides). Le fructose, certains acides aminés et les acides gras peuvent également augmenter la libération d'insuline. L'insuline se lie à la sous-unité alpha extracellulaire du récepteur cellulaire transmembranaire de l'insuline des tissus corporels (par exemple, foie, muscles, graisse, cerveau). Cela active une cascade de phosphorylation impliquant les sous-unités bêta transmembranaires du récepteur de l'insuline qui traitent l'activité tyrosine kinase, autophosphorylent les tyrosines du récepteur de l'insuline et favorisent la phosphorylation et l'activation du substrat cytoplasmique du récepteur de l'insuline (IRS). L'IRS activé stimule la protéine kinase activée par les mitogènes (MAP) intracellulaire, qui à son tour favorise la croissance cellulaire (par exemple, la prolifération et la différenciation des tissus, tels que les cellules musculaires squelettiques et les cellules adipeuses). Bien que l'insuline agisse principalement comme un facilitateur mitogénique physiologique, l'hyperinsulinémie peut prédisposer à une mitogenèse non régulée et au cancer. La phosphorylation de l'IRS médiée par l'insuline facilite également la voie phosphoinositide 3-kinase (PI3K)/AKT (AKT, également appelée protéine kinase B), responsable de la plupart des effets métaboliques de l'insuline, tels que le transport des transporteurs vésiculaires du glucose (GLUT 4) vers les membranes cellulaires externes, entraînant l'absorption du glucose circulant dans les tissus, abaissant ainsi la glycémie. Le GLUT 4, insulino-dépendant, est présent dans les muscles squelettiques et le tissu adipeux ; le GLUT 2, insulino-indépendant, est présent dans le foie. L'augmentation de la signalisation PI3K/AKT favorise également (a) l'augmentation de la synthèse endothéliale d'oxyde nitrique (eNOS), ce qui facilite la production accrue d'oxyde nitrique, la vasodilatation et l'irrigation sanguine du tissu adipeux, permettant ainsi une meilleure absorption du glucose et des acides gras libres par les adipocytes pour leur stockage ; (b) la synthèse du glycogène, des lipides et des protéines ; et (c) la croissance cellulaire (prolifération et différenciation). Une dysrégulation des voies Ras/MAP kinase et/ou PI3K/AKT peut nuire à la croissance cellulaire (prolifération et différenciation) par ailleurs saine, pouvant conduire au développement de cancers chez l'homme [ 134 , 135 ], ce qui pourrait avoir une incidence sur le risque accru de cancer chez les patients obèses [ 136].]. Chez les patients obèses et diabétiques de type 2 (DT2), outre une réduction du nombre de récepteurs à l'insuline potentiellement due à une altération de l'apport de ces récepteurs à la surface cellulaire due au stress du réticulum endoplasmique, une insulinorésistance sévère est principalement décrite comme un défaut de signalisation post-récepteur à l'insuline, via une perturbation de la cascade IR/IRS. Plus précisément, l'obésité peut entraîner une augmentation adiposopathique des facteurs inflammatoires (par exemple, des cytokines telles que le facteur de nécrose tumorale et les interleukines) et des acides gras libres qui peuvent altérer la signalisation PI3K/AKT tandis que l'hyperinsulinémie continue de stimuler la signalisation de la MAP kinase, contribuant potentiellement à l'insulinorésistance post-récepteur, au prédiabète, au DT2, au dysfonctionnement endothélial et/ou au cancer. (Adapté/copié avec la permission de : Bays HE, Obesity Pillars. 2023)
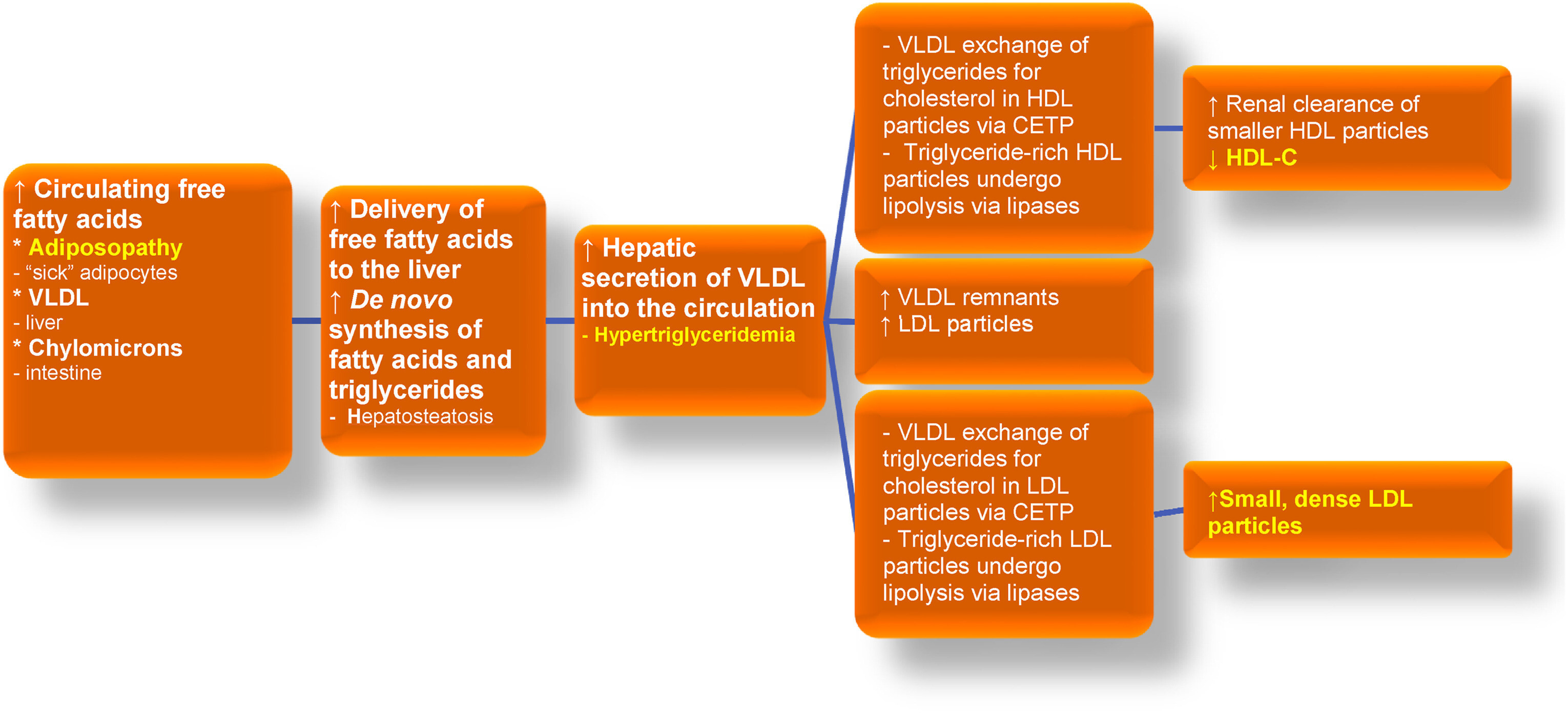
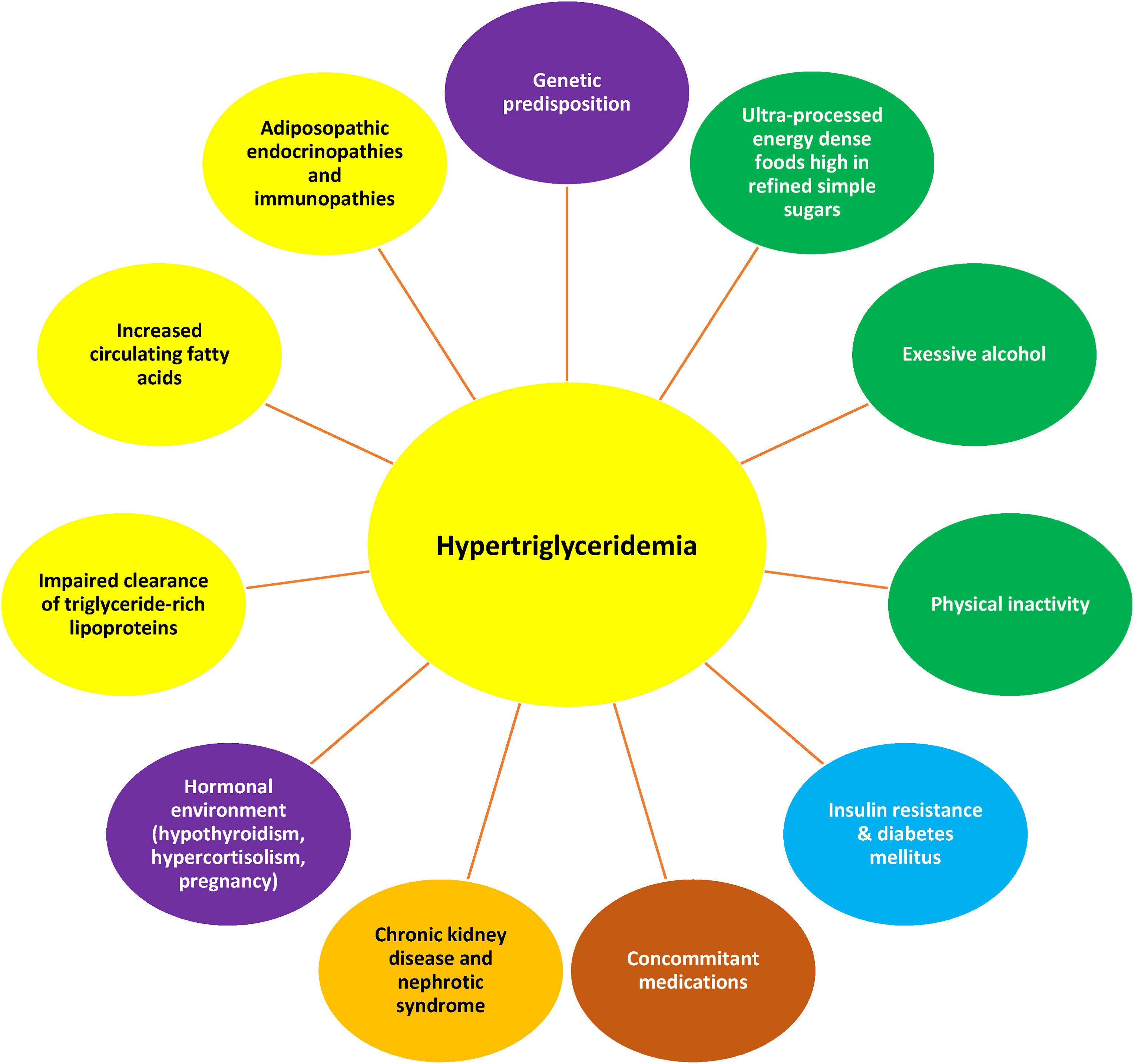
Dyslipidémie adiposopathique : L'excès d'adiposité peut contribuer à l'hypertriglycéridémie, à une diminution du taux sanguin de HDL-C et à une augmentation des particules de LDL plus petites et plus denses. Des termes similaires à « dyslipidémie adiposopathique » incluent « dyslipidémie athérogène » et/ou « dyslipidémie diabétique », tous destinés à refléter un profil lipidique observé chez de nombreux patients obèses, ainsi que chez les patients atteints de diabète de type 2 et/ou de MASLD [ 137 ]. Les origines de l'apport d'acides gras libres au foie comprennent la lipolyse des lipoprotéines riches en triglycérides (par exemple, les VLDL originaires du foie et les chylomicrons de l'intestin), ainsi que le flux adiposopathique d'acides gras provenant du tissu adipeux en raison de la résistance à l'insuline. Enfin, l'obésité peut être associée à une augmentation de la synthèse de novo d'acides gras .Un contributeur important à la dyslipidémie adiposopathique est la CETP, qui facilite l'échange de triglycérides et d'esters de cholestérol entre les lipoprotéines circulantes. La CETP augmente avec l'obésité, ce qui peut améliorer l'échange de triglycérides des VLDL contre des esters de cholestérol des HDL. De même, la CETP peut faciliter l'échange de triglycérides des VLDL contre des esters de cholestérol dans les LDL. L'action des lipases corporelles sur les particules de HDL riches en triglycérides produit des particules de HDL plus petites qui sont plus facilement métabolisées par le foie et les reins, ce qui entraîne une réduction des taux sanguins de HDL-C. L'action des lipases corporelles sur les particules de LDL riches en triglycérides produit des particules de LDL plus petites et plus denses. (Figure adaptée avec la permission de Bays HE et al. Obesity Algorithm Slides, présentée par l'Obesity Medicine Association. www.obesityalgorithm.org . 2020). CETP : protéine de transfert des esters de cholestérol ; HDL-C : cholestérol des lipoprotéines de haute densité ; LDL : lipoprotéines de basse densité ; MASLD : maladie hépatique stéatosique associée à un dysfonctionnement métabolique ; VLDL : lipoprotéines de très basse densité.
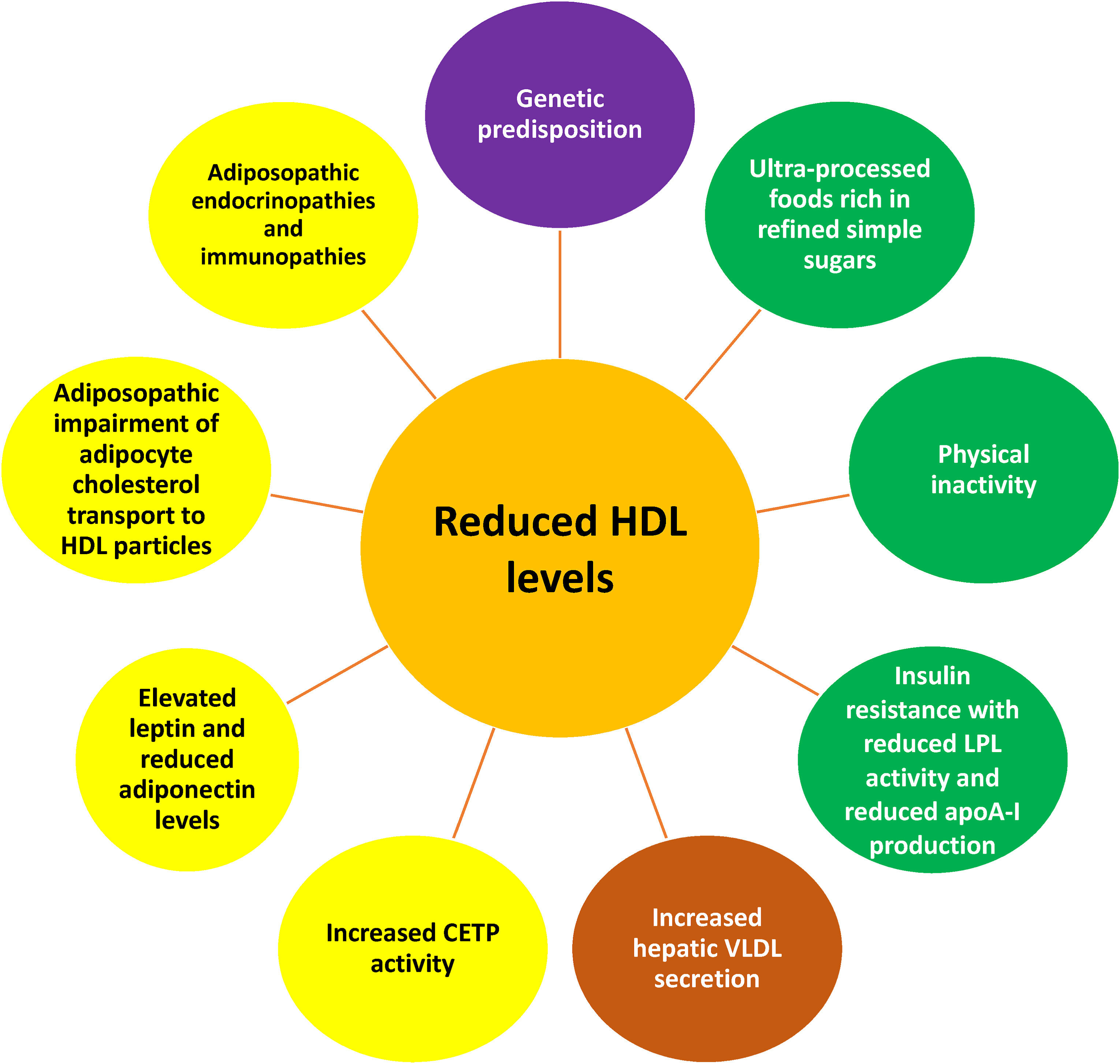
Relation entre la réduction du HDL-C et l'obésité. Les taux sanguins de HDL-C sont largement déterminés par la génétique individuelle . Parmi les causes les plus courantes de réduction des taux sanguins de HDL-C figurent les aliments ultra-transformés contenant des sucres simples raffinés et l'inactivité physique , tous deux pouvant accompagner l'obésité. La réduction adiposopathique de l'activité LPL observée chez les patients obèses altère le métabolisme des lipoprotéines riches en triglycérides (c.-à-d. VLDL et chylomicrons) . L'obésité peut faciliter un plus grand transfert médié par la CETP du cholestérol des particules de HDL aux lipoprotéines riches en triglycérides en échange de triglycérides. Les particules de HDL riches en triglycérides peuvent ensuite subir une lipolyse à partir de la lipase hépatique, créant des particules de HDL plus petites qui sont plus facilement métabolisées par le foie et les reins , ce qui entraîne une réduction des taux sanguins de HDL-C. Français De plus, l'effet de réduction du HDL-C de la CETP peut être exacerbé dans l'obésité en raison de l'augmentation endocrinienne adiposopathique des taux de leptine, qui augmentent l'activité de la CETP . Une autre conséquence endocrinienne adiposopathique de l'obésité est la réduction des taux d'adiponectine. L'adiponectine augmente la production d'apoA-I (une apolipoprotéine qui est un composant majeur des particules HDL) ainsi que d'ABCA1 hépatique, qui fonctionne comme un transporteur lipidique qui médie le transfert des phospholipides cellulaires et du cholestérol libre (non estérifié) à l'apoA-I et aux protéines apparentées, ce qui devrait augmenter les taux sanguins de HDL-C. Français À l'inverse, la diminution de l'adiponectine généralement observée avec l'obésité devrait diminuer les taux sanguins de HDL-C [ 118 ]. De même, la promotion adiposopathique de la résistance à l'insuline peut également réduire la production d'apoA-I . Enfin, un effet immunitaire adiposopathique de l'obésité est l'inflammation des adipocytes qui peut réguler à la baisse l'expression d'ABCA1 et de SR-B1 et ainsi altérer l'efflux de cholestérol des adipocytes vers les particules HDL.
Conclusions
Le profil de dyslipidémie adiposopathique le plus souvent décrit chez les patients présentant une adiposité accrue comprend une élévation des triglycérides sanguins, une diminution du taux de HDL-C sanguin, une augmentation du taux de non-HDL-C, une augmentation de l'apoB, une augmentation de la concentration en particules LDL et une augmentation des petites particules LDL denses. Des études de population suggèrent une légère augmentation du taux de LDL-C sanguin avec une adiposité accrue. Les conclusions cliniques de cette revue d'experts conjointe de l'OMA et de la NLA sont les suivantes :
- • Une augmentation de l’adiposité est généralement associée à un profil lipidique athérogène, ainsi qu’à d’autres facteurs de risque cardiométaboliques, qui contribuent tous probablement à un risque accru de MCV.
- •Chez les patients obèses, les interventions visant à réduire le poids corporel et à améliorer les résultats des maladies cardiovasculaires sont généralement associées à une réduction des taux de triglycérides sanguins et à une augmentation des taux de HDL-C sanguins, souvent avec seulement des améliorations légères à modestes des taux de LDL-C sanguins.
- •Chez les patients atteints ou à risque de MCVA, une double priorité comprend une intervention précoce sur le mode de vie et/ou pharmacologique pour traiter à la fois l'excès d'adiposité et les niveaux élevés de cholestérol athérogène (c'est-à-dire LDL-C et/ou non-HDL-C).
RESUME GENRATIF
Ce document est une revue d'experts sur l'obésité, la dyslipidémie et le risque de maladie cardiovasculaire, publiée par l'Obesity Medicine Association et la National Lipid Association.
Obésité, dyslipidémie et risque cardiovasculaire
Cette revue conjointe examine les liens entre l'obésité, la dyslipidémie et le risque de maladies cardiovasculaires (MCV).
- L'obésité est définie comme une maladie chronique affectant plus de 40 % des adultes aux États-Unis.
- * La MCV est une cause majeure de mortalité chez les personnes obèses.
- * Les coûts annuels directs et indirects de l'obésité aux États-Unis sont estimés à plus de 400 milliards de dollars.
- * Les critères de diagnostic incluent un IMC ≥ 25 kg/m² pour le surpoids et ≥ 30 kg/m² pour l'obésité.
Rôle des lipides dans le tissu adipeux
Cette section décrit la fonction des lipides, notamment le cholestérol et les triglycérides, dans le tissu adipeux.
- * Les triglycérides constituent plus de 90 % du volume des adipocytes.
- * Le tissu adipeux est le plus grand réservoir de cholestérol libre dans le corps, stockant plus de 50 % du cholestérol total chez les personnes obèses.
- * Les lipides dans le tissu adipeux proviennent principalement des lipoprotéines circulantes.
Dyslipidémie adiposopathique et risque accru
Cette partie aborde le profil lipidique associé à l'obésité et son impact sur le risque cardiovasculaire.
- * La dyslipidémie adiposopathique se caractérise par des triglycérides élevés, un HDL-C réduit et un LDL-C augmenté.
- * Une légère augmentation du LDL-C chez les obèses peut ne pas refléter le risque accru de MCV.
- * Des interventions pour réduire le poids et améliorer les résultats cardiovasculaires sont généralement associées à une amélioration des niveaux lipidiques.
Mécanismes d'influx et d'efflux du cholestérol
Cette section explique comment le cholestérol est transporté vers et depuis le tissu adipeux.
- * Le cholestérol est principalement dérivé des lipoprotéines circulantes, notamment les LDL et les VLDL.
- * Les adipocytes expriment des récepteurs qui facilitent l'endocytose des lipoprotéines riches en cholestérol.
- * Les transporteurs de cholestérol dans les adipocytes permettent l'efflux vers les HDL.
Origine des acides gras dans le tissu adipeux
Cette partie traite de l'origine des acides gras et des triglycérides dans le tissu adipeux.
- * Les acides gras proviennent des lipoprotéines riches en triglycérides, comme les VLDL et les chylomicrons.
- * L'hydrolyse des triglycérides par la lipoprotéine lipase (LPL) libère des acides gras pour l'absorption par les adipocytes.
- * Les types d'acides gras dans le tissu adipeux reflètent ceux présents dans l'alimentation et les lipoprotéines circulantes.
Origine des triglycérides dans les tissus adipeux
Les triglycérides dans les adipocytes proviennent principalement de l'hydrolyse des lipoprotéines circulantes et de la synthèse de novo.
- * LPL (lipoprotéine lipase) hydrolyse les triglycérides des lipoprotéines en acides gras.
- * Les acides gras peuvent entrer dans les adipocytes par diffusion ou via des transporteurs.
- CD36 est un transporteur clé pour les acides gras dans les adipocytes, influençant l'adipogenèse et la lipolyse.
- * Les triglycérides sont formés à partir d'acides gras et de glycérol, ce dernier étant dérivé du glucose.
Rôle de la résistance à l'insuline sur l'activité de LPL
La résistance à l'insuline altère l'activité de LPL, contribuant à l'hypertriglycéridémie chez les personnes obèses.
- * Bien que l'activité totale de LPL puisse être augmentée, sa réponse à l'insuline est diminuée.
- * L'augmentation d'apoC-III (inhibiteur de LPL) et la diminution d'apoC-II (activateur de LPL) sont observées.
- * Cela entraîne une incapacité à hydrolyser efficacement les lipoprotéines riches en triglycérides.
Libération des acides gras dans la circulation
Les acides gras sont libérés des adipocytes par lipolyse, un processus régulé par des hormones.
- * La lipolyse implique ATGL, HSL et MGL, qui hydrolysent les triglycérides en acides gras et glycérol.
- * Les acides gras peuvent être libérés dans la circulation par diffusion ou médiés par des protéines.
- * Une fois dans la circulation, les acides gras se lient à l'albumine pour être transportés vers d'autres tissus.
Profil lipidique chez les patients obèses
Les patients obèses présentent souvent un profil lipidique caractérisé par des niveaux élevés de triglycérides et de lipoprotéines atherogènes.
- * Hypertriglycéridémie due à une surproduction de lipoprotéines riches en triglycérides.
- * Diminution des niveaux de HDL-C et d'apoA-I, avec une augmentation des particules LDL petites et denses.
- * Ce profil lipidique est associé à un risque accru de maladies cardiovasculaires (ASCVD).
Impact de l'obésité sur les niveaux de LDL-C
L'obésité est généralement associée à une augmentation modeste des niveaux de LDL-C.
- * La capacité de stockage du cholestérol dans le tissu adipeux limite l'augmentation des niveaux de LDL-C.
- * L'augmentation de l'activité de CETP favorise le transfert de cholestérol des HDL vers les LDL.
- * La diminution de l'efflux de cholestérol des adipocytes vers les HDL peut également atténuer l'augmentation des niveaux de LDL-C.
Effet de l'obésité sur l'absorption intestinale du cholestérol
L'obésité est liée à une diminution de l'absorption intestinale du cholestérol, surtout chez les patients résistants à l'insuline.
- * La perte de poids peut améliorer l'absorption intestinale du cholestérol.
- Les régimes cétogènes peuvent entraîner des augmentations marquées des niveaux de LDL-C chez certains patients obèses.
Signification clinique des niveaux de LDL-C chez les obèses
Des niveaux de LDL-C non substantiellement élevés peuvent masquer des risques cardiovasculaires chez les patients obèses.
- * Les particules LDL plus petites et denses sont plus atherogènes.
- * Une augmentation de la concentration de particules atherogènes est un facteur de risque important pour l'ASCVD.
Pertinence clinique des niveaux de non-HDL-C
Les niveaux élevés de non-HDL-C sont un meilleur prédicteur du risque d'ASCVD que les niveaux de LDL-C seuls.
- * Le non-HDL-C inclut le cholestérol des lipoprotéines atherogènes, y compris VLDL et IDL.
- * La gestion des niveaux de non-HDL-C est cruciale, surtout chez les patients obèses.
Comment l'obésité contribue à l'élévation des triglycérides
L'obésité entraîne une augmentation des niveaux de triglycérides en raison de divers facteurs endocriniens et immunitaires.
- * Les adiposopathies augmentent la production de lipoprotéines riches en triglycérides et diminuent leur lipolyse.
- * L'insulinorésistance et l'inflammation contribuent à l'élévation des niveaux de triglycérides.
Impact de l'obésité sur les niveaux de HDL-C
Des niveaux de HDL-C bas sont associés à un risque accru de maladies cardiovasculaires.
- * L'obésité est liée à une réduction de l'activité de LPL et à une augmentation de l'activité de CETP.
- * La diminution des niveaux d'adiponectine contribue également à la baisse des niveaux de HDL-C.
Relation clinique entre l'obésité et les niveaux de lipoprotéine (a)
La lipoprotéine (a) est un facteur de risque indépendant pour les maladies cardiovasculaires, influencée par la génétique.
- * L'augmentation de la lipoprotéine (a) et de l'IMC est additive pour le risque d'ASCVD.
Relation entre l'obésité abdominale et le syndrome métabolique
L'obésité abdominale est un indicateur de dysfonctionnement adipocytaire et de risque accru de maladies cardiovasculaires.
- * Le syndrome métabolique inclut l'obésité centrale, l'élévation des triglycérides et la diminution du HDL-C.
Effet de l'alimentation sur le profil lipidique
L'alimentation influence les niveaux de lipoprotéines et le profil lipidique.
- * Les substitutions de macronutriments peuvent améliorer les niveaux de lipides.
- * Les effets varient selon les types de macronutriments et les changements de poids.
Effet de l'activité physique sur le profil lipidique
L'activité physique augmente les niveaux de HDL-C et réduit les triglycérides.
- * Les effets sur les niveaux de LDL-C sont variables.
Effet de la réduction de poids sur le profil lipidique
La réduction de poids améliore généralement les niveaux de lipides, en particulier les triglycérides.
- * Une perte de poids de 5 à 10 % est souvent nécessaire pour des améliorations significatives.
Effet des médicaments anti-obésité sur le profil lipidique
Les médicaments anti-obésité peuvent améliorer le profil lipidique et réduire les facteurs de risque cardiovasculaire.
- * Certains médicaments montrent des effets significatifs sur la réduction des triglycérides et l'augmentation du HDL-C.
Effets de la chirurgie bariatrique sur le profil lipidique
La chirurgie bariatrique peut réduire les facteurs de risque cardiovasculaire chez les patients obèses.
- * La chirurgie bariatrique, comme le bypass gastrique et la gastrectomie en manchon, réduit le LDL-C, les triglycérides et augmente le HDL-C.
- * Une étude a montré une réduction de 24 % du risque de mortalité chez les patients ayant subi une chirurgie bariatrique par rapport à un groupe témoin.
- * L'incidence de l'hypertriglycéridémie était de 27 % dans le groupe témoin contre 17 % dans le groupe chirurgical.
- * Les effets sur le lipoprotéine (a) sont variés, certains études indiquant une augmentation, d'autres une diminution après la chirurgie.
Comparaison des bénéfices de la réduction de poids et du LDL-C
Il est difficile de comparer les bénéfices de la réduction de poids et de la baisse du LDL-C sur le risque de maladie cardiovasculaire (MCV) chez les patients obèses.
- * La réduction du LDL-C diminue principalement le risque d'ASCVD.
- * La perte de poids améliore également d'autres facteurs de risque de MCV, comme la glycémie et la pression artérielle.
- * Les études montrent que la chirurgie bariatrique peut réduire la mortalité toutes causes confondues de 40 à 50 %.
- * Les données actuelles ne permettent pas de déterminer quel facteur est le plus efficace pour réduire le risque de MCV.
Impact de la réduction de poids chez les enfants obèses
La réduction de poids chez les enfants obèses est associée à des améliorations significatives des facteurs de risque cardiométaboliques.
- Une revue systématique a révélé qu'une perte de 0,74 kg était liée à une augmentation de 1 mg/dL du HDL-C et une diminution de 1 mg/dL des triglycérides.
- Les interventions pour traiter l'obésité pédiatrique incluent des médicaments, la chirurgie et des changements de mode de vie.
Gestion de la dyslipidémie chez les patients obèses
La gestion de la dyslipidémie est cruciale pour les patients obèses, surtout ceux à risque élevé de MCV.
- * Les patients obèses sans maladie métabolique aiguë peuvent bénéficier d'une approche "Traiter l'obésité d'abord".
- * Les patients à haut risque de MCV avec des niveaux élevés de LDL-C doivent gérer à la fois l'obésité et la dyslipidémie.
- * Une approche multidisciplinaire est recommandée pour optimiser la gestion de l'obésité et de la dyslipidémie.
Conclusion sur l'obésité et la dyslipidémie
L'obésité est généralement associée à un profil lipidique athérogène et à d'autres facteurs de risque cardiométaboliques.
- * La réduction du poids et l'amélioration des résultats cardiovasculaires sont souvent liées à une diminution des triglycérides et à une augmentation du HDL-C.
- * Les interventions visant à réduire l'excès de poids et à gérer les lipoprotéines athérogènes sont des priorités dans la gestion des patients obèses.
Revue systématique et méta-analyse
L'accent est mis sur l'analyse des données cliniques concernant les lipides.
Directives de pratique clinique fiables
Ce document présente des lignes directrices pour des pratiques cliniques basées sur des preuves.
SYNTHESE
Ce document est une revue d'experts conjointe de l'Obesity Medicine Association (OMA) et de la National Lipid Association (NLA), publiée dans la revue Obesity Pillars en 2024. Il fournit aux cliniciens un aperçu des considérations pathophysiologiques et cliniques concernant l'obésité, la dyslipidémie et le risque de maladie cardiovasculaire (MCV). L'article définit l'obésité comme une maladie chronique et explique que l'augmentation de l'adiposité est liée à un profil lipidique athérogène, souvent appelé dyslipidémie adiposopathique, qui comprend des triglycérides élevés et un faible taux de cholestérol HDL. Les auteurs soulignent que les interventions visant à la réduction du poids et l'amélioration des résultats cardiovasculaires sont généralement associées à une amélioration des taux de lipides, mais recommandent une double priorité incluant le traitement de l'adiposité excessive et la réduction du cholestérol athérogène (LDL-C et/ou non-HDL-C) pour réduire le risque de MCV. Le texte couvre également des sujets tels que le rôle du cholestérol et des triglycérides dans le tissu adipeux, les effets de l'alimentation, de l'activité physique et des interventions médicales ou chirurgicales sur le profil lipidique.
Commentaire
Obésité + dyslipidémie + risque cardiovasculaire accru = affection potentiellement grave. Il est donc d'appréhender ces patient(e)s de manière holistique et de ne pas se focaliser que sur le poids ce serait une erreur ou " l'arbre qui cache la forêt".
A LIRE
DOSSIER : OBÉSITÉ ET RISQUE CV
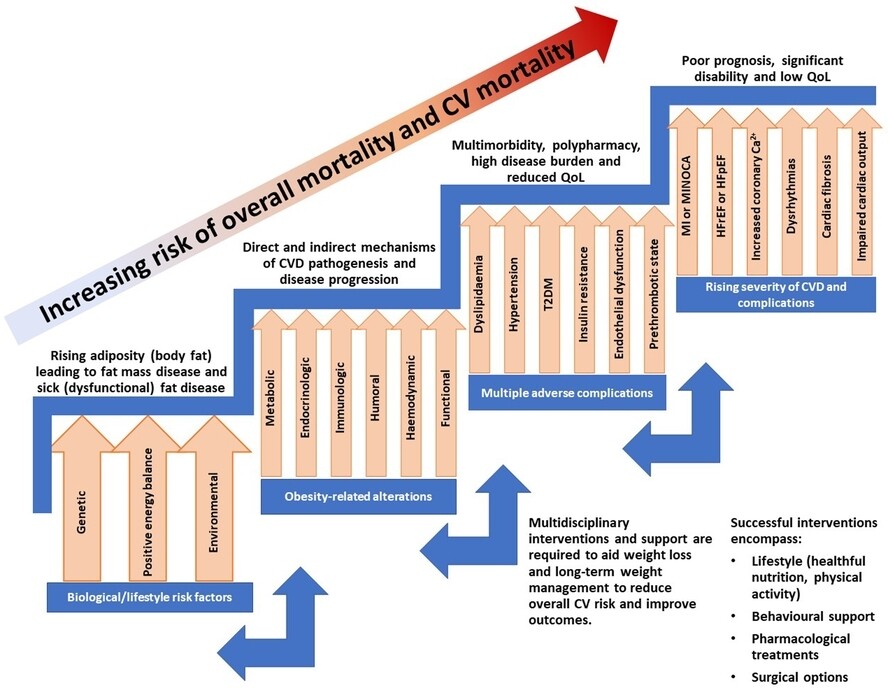
Plan d'action de la Fédération mondiale du cœur et de la Fédération mondiale contre l'obésité pour la gestion des risques liés à l'obésité et cardiovasculaires
Le plan d'action suivant vise à aider à identifier et à réduire le risque de MCV et de mortalité liés à l'obésité. La WOF et la WHF reconnaissent la diversité des systèmes de santé à travers le monde et la mise en œuvre de ces recommandations doit être adaptée en fonction de la disponibilité des ressources et des services locaux.
-
La base de preuves croissante suggère que l'obésité est un contributeur majeur aux maladies cardiovasculaires via des mécanismes directs et indirects. Par conséquent, des stratégies efficaces sont nécessaires pour prévenir l'obésité au niveau de la population et pour aider les personnes en surpoids/obésité et à risque de MCV ou de MCV existantes à perdre du poids et à maintenir un poids santé.
-
Compte tenu de la richesse des preuves établissant un lien entre les maladies cardiovasculaires et l'obésité, l'évaluation du risque CV et les stratégies agressives de réduction des risques chez les personnes en surpoids/obésité devraient contribuer à réduire le fardeau de la morbidité et de la mortalité CV dans ce groupe.
-
Bien que les réponses individuelles varient considérablement, les modifications du mode de vie (par exemple, une alimentation saine, une activité physique aérobie et de résistance de routine) entraînent généralement une perte de poids modeste et (même indépendamment de la perte de poids) des avantages CV à long terme L'orientation vers des conseils en matière d'alimentation ou de nutrition et/ou d'activité physique peut être envisagée pour les personnes en surpoids/obésité et à risque CV ou de MCV qui sont intéressées ou réceptives au traitement.
-
Les avantages potentiels des options de traitement pharmacologique (par exemple, les AR GLP-1) peuvent être discutés parallèlement aux modifications du mode de vie avec les personnes appropriées, conformément aux preuves actuelles et émergentes dans ce domaine en évolution rapide. En particulier, les preuves des CVOT (Cardiovascular Outcome Trial)en cours peuvent être pertinentes pour éclairer les futures approches de prescription et de gestion pour les personnes en surpoids/obésité et MCV.
-
Il a été démontré que la chirurgie bariatrique favorise la perte de poids, réduit les facteurs de risque CV et diminue le risque global de MCV. Les professionnels de la santé devraient discuter de l'orientation vers des services de chirurgie bariatrique appropriés avec les personnes souffrant d'obésité sévère (en général, les personnes ayant un IMC > 35 kg/m 2 avec une maladie cardiovasculaire établie ou un IMC > 40 kg). /m 2 ).
-
L'évaluation de la graisse corporelle, WHR ou WC est recommandée pour les personnes en réadaptation cardiaque afin d'identifier celles qui présentent un excès d'adiposité totale ou viscérale et qui sont susceptibles de bénéficier d'une enquête plus approfondie concernant le risque CV (par exemple, évaluation des lipides). Il existe des cas où l'adiposité totale et centrale n'est pas détectée chez les personnes ayant un IMC relativement bas.
-
Les futures options de traitement de l'obésité ont le potentiel d'entraîner une perte de poids substantielle et soutenue et offrent l'occasion de clarifier l'impact de la réduction de poids intentionnelle sur le risque CV et la mortalité. Entre-temps, les cliniciens devraient diagnostiquer l'obésité chez les personnes atteintes de maladies cardiovasculaires ou à risque de maladies cardiovasculaires afin de mieux permettre une approche centrée sur le patient et de maximiser les chances d'atteindre un poids corporel sain et de réduire le risque de maladies cardiovasculaires.
https://medvasc.info/archives-blog/dossier-ob%C3%A9sit%C3%A9-et-rcbv?highlight=WyJvYlx1MDBlOXNpdFx1MDBlOSJd
OBÉSITÉ EN PARLER AUTREMENT
https://medvasc.info/archives-blog/ob%C3%A9sit%C3%A9-en-parler-autrement
L'OBÉSITÉ DÉCRYPTÉE
https://medvasc.info/archives-blog/l-ob%C3%A9sit%C3%A9-d%C3%A9ccypt%C3%A9e
Copyright : Dr Jean Pierre Laroche / 2025

