Covid-19
-
Dexaméthasone
Avec le Convid-19 on fait du neuf avec du vieux......la Dexaméthasone a eu sa première autorisation de Mise sur le Marché (AMM) en 1974.Cette molécule est donc très bien connue, largement utilisée et en plus on connaît ses effets secondaires que l'on sait maîtriser. La Dexaméthasone appartient aux corticoïdes synthétiques, qui sont utilisés principalement pour leur effet anti-inflammatoire. A forte dose, ils diminuent la réponse immunitaire. Son utilisation pourrait ainsi calmer la réaction immunitaire excessive des patients atteints d’une forme grave de Covid-19, appelée orage cytokinique.Avantage de ce médicament : il n’est pas cher, et il est immédiatement accessible dans la plupart des pays.
L'étude récente RECOVERY a testé plusieurs molécules dans la Covid-19, dont la Dexaméthasone, celle-ci réduirait d’un tiers la mortalité chez les malades les plus gravement atteints. Nous ne disposons pas encore des résultats publiés de l'étude RECOVERY, il s'agit d'une première annonce. La Dexaméthasone est « déjà utilisée à grande échelle » dans les hôpitaux français, selon l’infectiologue Karine Lacombe. « La dexaméthasone fait partie de la famille des corticoïdes. (…) En France, on a très rapidement donné très tôt des corticoïdes chez des patients qui avaient le Covid-19 parce que ça diminue l’inflammation au niveau des poumons », a déclaré sur la Radio France Inter la cheffe du service des maladies infectieuses de l’hôpital Saint-Antoine (AP-HP), à Paris. Donc attendons "calmement " les résultats complets de RECOVERY, ce qui permettra de finaliser cet article rapidement .Mais c'est une avancée certaine, prudence , recommandations numéro 1 en matière de Covid-19 , car nous avons trop souvent été échaudés.L 'utlisation de la Dexaméthasone dans la Covid-19 n'est pas une surprise, ce qui sera intéressant ce sont les modalités de prescription dans RECOVERY (dose, durée, médicaments associés).
Coût : DECTANCYL (Dexaméthasone) : comprimé sécable , boîte de 30, sur ordonnance (Liste I) - Remboursable à 65 % - Prix : 3,69 €
Source :https://www.20minutes.fr/sante/2801671-20200617-coronavirus-sait-dexamethasone-ameliore-survie-patients
Dexaméthasone ou pas, #1MASQUEPOURTOUS reste la protection numéro 1 -
Diabète, HTA, BMI, tabac and Covid-19
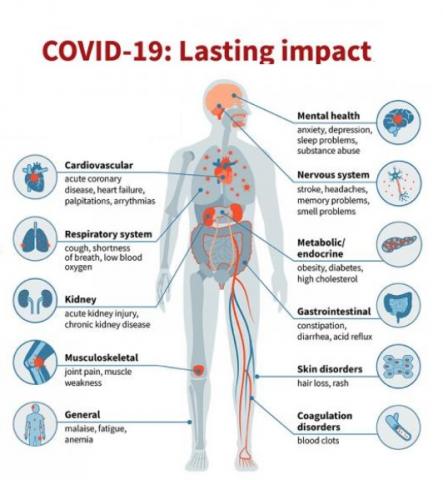 Iconographie : https://www.santelog.com/actualites/covid-19-de-multiples-sequelles-long-terme-un-risque-de-deces-accru
Iconographie : https://www.santelog.com/actualites/covid-19-de-multiples-sequelles-long-terme-un-risque-de-deces-accru
Charles Nicolle, prix Nobel 1928, écrit en 1933 « Il y aura donc des maladies nouvelles. C’est un fait fatal. Un autre fait, aussi fatal, est que nous ne saurons jamais les détecter à leur origine. Elles seront méconnues, confondues avec des maladies déjà existantes. Pour qu’on les reconnaisse plus vite, il faudrait que l’infection soit d’importation exotique et douée d’un pouvoir marqué de contagiosité, telle autrefois la syphilis à son débarquement en Europe. »
« Mille problèmes sollicitent donc le chercheur. Souhaitons qu’il sache les étudier toujours dans une parfaite sérénité. Le savant digne de ce nom ne sert qu’un maître, la science. Il n’assigne qu’un but à sa recherche, la vérité. Il ne désire qu’elle, mais il la désire passionnément et sait faire taire, lorsqu’elle parle, tous les bruits du monde, et, s’il le faut, jusqu’aux battements de son cœur. » Théodore Monod
Analyse article :
Diabetes, hypertension, body mass index, smoking and COVID-19- related mortality: a systematic review and meta-analysis of observational studies, Yahya Mahamat-Saleh, Thibault Fiolet, Mathieu Edouard Rebeaud, Matthieu Mulot, Anthony Guihur , Douae El Fatouhi,Nasser Laouali,1Nathan Peiffer-Smadja, Dagfinn Aune , Gianluca Severi, BMJ Open 2021;11:e052777. doi:10.1136/ bmjopen-2021 052777,https://pubmed.ncbi.nlm.nih.gov/34697120/,article en accès libre
Résumé
Objectifs : Nous avons mené une revue systématique de la littérature et une méta-analyse d'études observationnelles pour étudier l'association entre le diabète, l'hypertension, l'indice de masse corporelle (IMC) ou le tabagisme avec le risque de décès chez les patients atteints de COVID-19 et pour estimer la proportion de décès attribuables à ces conditions.
Méthodes : Des études observationnelles pertinentes ont été identifiées par des recherches dans les bases de données PubMed, Cochrane Library et Embase jusqu'au 14 novembre 2020. Des modèles à effets aléatoires ont été utilisés pour estimer les risques relatifs résumés (SRR) et les IC à 95 %. La certitude des données probantes a été évaluée à l'aide des méthodes Cochrane et du cadre de classement des recommandations, de l'évaluation, du développement et des évaluations.
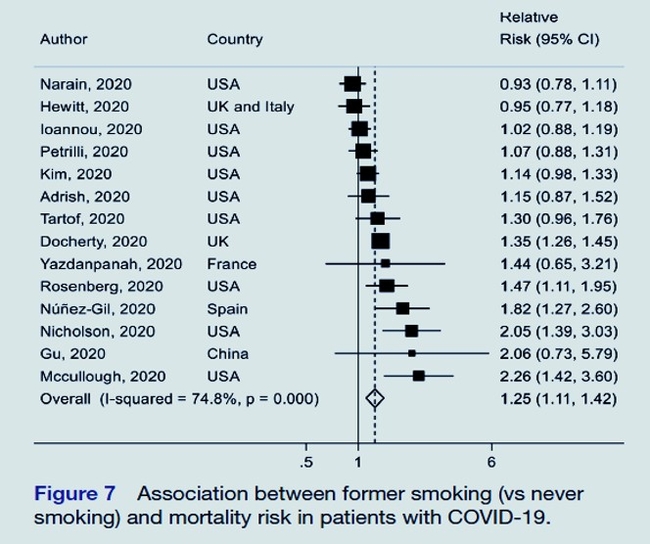
Résultats : Un total de 186 études représentant 210 447 décès parmi 1 304 587 patients atteints de COVID-19 ont été inclus dans cette analyse. Le SRR de décès chez les patients atteints de COVID-19 était de 1,54 (IC à 95 % 1,44 à 1,64, I 2 =92 %, n = 145, faible certitude) pour le diabète et de 1,42 (IC à 95 % 1,30 à 1,54, I 2 = 90 % , n=127, faible certitude) pour l'hypertension par rapport aux patients sans chacune de ces comorbidités. Concernant l'obésité, le SSR était de 1,45 (IC à 95 % 1,31 à 1,61, I 2 = 91 %, n = 54, certitude élevée) pour les patients avec un IMC ≥ 30 kg/m 2 par rapport à ceux avec un IMC < 30 kg/m 2 et 1,12 (IC à 95 % 1,07 à 1,17, I 2 = 68 %, n = 25) pour 5 kg/m 2augmentation de l'IMC. Il y avait des preuves d'une relation dose-réponse non linéaire en forme de J entre l'IMC et la mortalité due au COVID-19, avec le nadir de la courbe à un IMC d'environ 22-24, et une augmentation de 1,5 à 2 fois du COVID- 19 mortalité avec obésité extrême (IMC de 40-45). Le SRR était de 1,28 (IC à 95 % 1,17 à 1,40, I 2 = 74 %, n = 28, faible certitude) pour toujours, 1,29 (IC à 95 % 1,03 à 1,62, I 2 = 84 %, n = 19) pour 1,25 (IC à 95 % 1,11 à 1,42, I 2 = 75 %, n = 14) pour les anciens fumeurs par rapport aux non-fumeurs. Le risque absolu de décès par COVID-19 a augmenté de 14 %, 11 %, 12 % et 7 % pour le diabète, l'hypertension, l'obésité et le tabagisme, respectivement. La proportion de décès attribuables au diabète, à l'hypertension, à l'obésité et au tabagisme était respectivement de 8 %, 7 %, 11 % et 2 %.
Conclusion : Nos résultats suggèrent que le diabète, l'hypertension, l'obésité et le tabagisme étaient associés à une mortalité liée au COVID-19 plus élevée, contribuant à près de 30 % des décès dus au COVID-19.
Ananlyse des auteurs
À notre connaissance, cette étude est l'une des plus grandes méta-analyses d'association entre le diabète, l'hypertension, l'obésité, le tabagisme et la mortalité due au COVID-19. Nous avons constaté que les patients diabétiques avaient un risque de décès du COVID-19 54% plus élevé que les patients non diabétiques ; ceux souffrant d'hypertension avaient une augmentation de 42% du risque relatif de décès par COVID-19 par rapport aux patients sans hypertension et ceux souffrant d'obésité ont un risque relatif de décès par COVID-19 supérieur de 45% par rapport aux patients non obèses. En outre, nous avons constaté que le tabagisme actuel et ancien était associé à des augmentations de 28 %, 29 % et 25 % du risque relatif de décès chez les patients atteints de COVID-19. Notre méta-analyse linéaire dose-réponse a suggéré que chaque 5 kg/km 2 d'augmentation de l'IMC était associée à un risque accru de 12% de décès par COVID-19. Cependant, des preuves de non-linéarité ont été observées dans l'analyse de l'IMC et du risque de décès par COVID-19, avec une relation dose-réponse en forme de J avec aplatissement de la courbe dose-réponse entre 22 et 24 du niveau d'IMC et une légère augmentation en dessous de cette plage et une augmentation de 1,5 à 2 fois du risque avec un IMC de 40 à 45. Bien qu'il n'y ait pas eu de biais de publication, l'hétérogénéité des études était élevée pour toutes les expositions et cela a persisté dans la plupart des analyses de sous-groupes. Cependant, l'hétérogénéité semble être due dans une plus large mesure à des différences dans la force des associations, qu'à des différences dans la direction de l'effet, car la grande majorité des études ont signalé des associations positives significatives ou non significatives entre ces expositions et une mortalité accrue et relativement peu d'études ont rapporté des estimations de risque dans le sens d'une association inverse.Commentaire
Barvo à la "DREAM TEAM" de la SCIENCE pour cet article exemplaire qui est dans le VRAI et le CONCRET.
Un travail remarquable qu'il faut saluer et surtout diffuser, ce que je fait. Cet article m'a donné l'idée d'une affiche (A3) pour salle d'attente . En effet encore aujourd'hui je vois des patients en consultation , des vasculaires, qui, tout âge confondu ne sont pa vaccinés, une dizaine par semaine, parfois plus. Ce ne sont pas des "anti vax" mais uniquement des personnes qui doutent, on leur a dit que, ils ont lu que , ils ont entendu que, ils ont peur de , ils "réfléchissent " , etc...... Cette affiche a déjà un impact positif.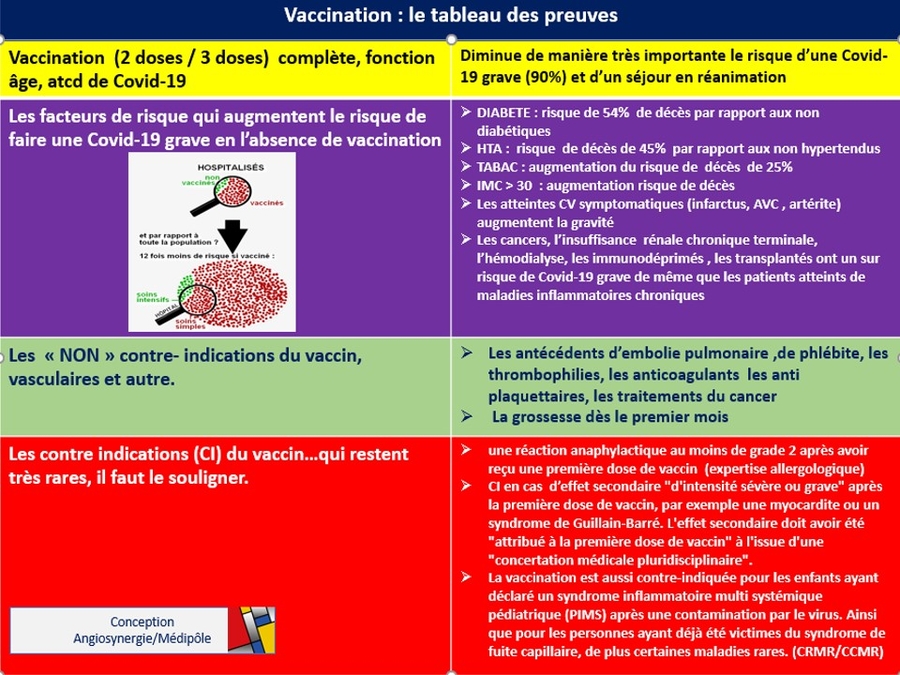
#VACCINE3.0
-
Durée de vie et COVID-19 : vive les vaccins !
 "Il n'y a pas de vaccin contre la stupidité."Albert Einstein
"Il n'y a pas de vaccin contre la stupidité."Albert Einstein
"Lors de sa première expérimentation humaine du vaccin contre la rage, sa méthode n'est pas encore validée. « La mort de cet enfant paraissant inévitable, je me décidai, non sans de vives et cruelles inquiétudes, [...] à tenter sur Joseph Meister la méthode qui m'avait constamment réussi sur des chiens », écrira Louis Pasteur en 1885. L'enfant sera sauvé.
https://fr.wikiquote.org/wiki/Vaccination
Life expectancy losses and bounce-backs during the COVID-19 pandemic
Pertes et rebonds de l'espérance de vie pendant la pandémie de COVID-19.Nat Hum Behav (2022). https://doi.org/10.1038/s41562-022-01451-2Article libre d'accésLes espérances de vie ont divergé en 2021, se rapprochant des niveaux pré-pandémiques en Europe occidentale et se détériorant davantage en Europe orientale, aux États-Unis et au Chili. Les déficits d'espérance de vie en 2021 s'expliquent presque uniquement par les décès prématurés dus au COVID-19. En conséquence, les pays ayant une proportion plus élevée d'individus vaccinés ont subi le moins de déficit d'espérance de vie.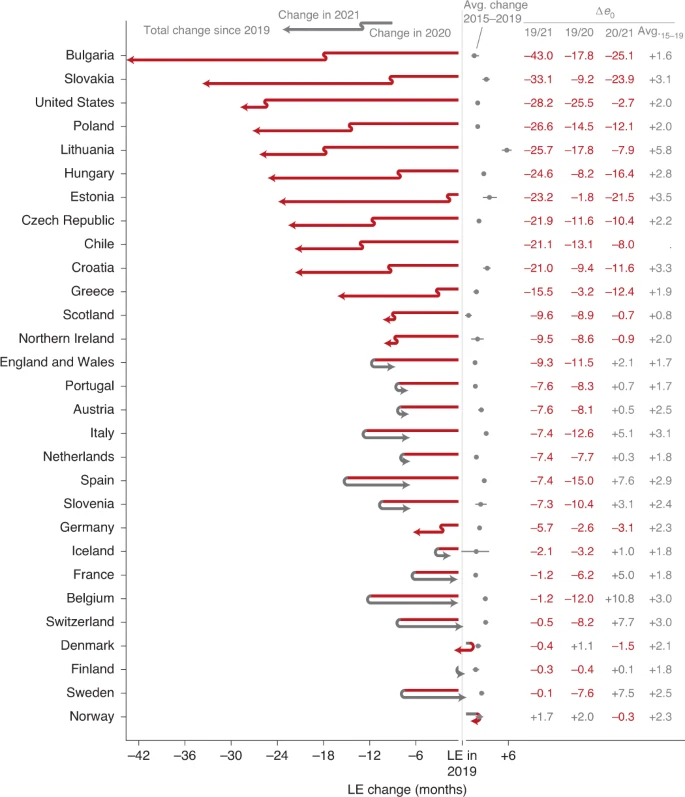 Les tendances de longue date à l'augmentation de l'espérance de vie ont été perturbées par la pandémie de COVID-19. Alors que certains pays ont rapidement retrouvé leurs niveaux d'avant la pandémie, d'autres ont subi des pertes considérables d'espérance de vie deux ans après le début de la pandémie. La variation de l'espérance de vie de la période au fil du temps est notée ∆ e 0 . Les pays sont classés par augmentation des pertes cumulées d'espérance de vie depuis 2019. Les points gris indiquent les variations annuelles moyennes de l'espérance de vie au cours des années 2015 à 2019 (intervalle d'incertitude à 95 %). © 2022, Schöley, J. et al., CC BY 4.0 .
Les tendances de longue date à l'augmentation de l'espérance de vie ont été perturbées par la pandémie de COVID-19. Alors que certains pays ont rapidement retrouvé leurs niveaux d'avant la pandémie, d'autres ont subi des pertes considérables d'espérance de vie deux ans après le début de la pandémie. La variation de l'espérance de vie de la période au fil du temps est notée ∆ e 0 . Les pays sont classés par augmentation des pertes cumulées d'espérance de vie depuis 2019. Les points gris indiquent les variations annuelles moyennes de l'espérance de vie au cours des années 2015 à 2019 (intervalle d'incertitude à 95 %). © 2022, Schöley, J. et al., CC BY 4.0 .
L'optimisme en 2021 n'était certainement pas injustifié, car certains pays d'Europe occidentale ont connu un rebond des espérances de vie d'avant la pandémie suite à une crise aiguë de la mortalité en 2020.Pourtant, dans le même temps, une baisse record de l'espérance de vie en 2020 dans d'autres pays a été suivie de nouvelles pertes en 2021, en particulier en Europe de l'Est.
Fondamentalement, ces développements opposés s'inscrivent dans la ligne des inégalités préexistantes en matière de santé de la population. Au moins à court terme, la pandémie a déclenché un « effet Matthew » de désavantage cumulatif conduisant à une divergence de la mortalité entre les régions européennes.Nous en sommes encore au début du processus d'explication des succès relatifs de différents pays pour contenir et inverser les effets de la COVID-19 sur la mortalité.
Bien qu'il ne soit pas surprenant que les populations les moins vaccinées aient souffert des déficits d'espérance de vie les plus importants, ce résultat devra être élargi en tenant compte de facteurs supplémentaires, tels que les différences régionales dans la capacité du système de santé, la morbidité préexistante de la population et les interventions non pharmaceutiques.Les démographes du monde entier continueront de surveiller l'effet du COVID-19 sur la mortalité. Finalement, nous saurons si le COVID-19 a été temporairement perturbateur - comme d'autres événements au cours du siècle dernier - ou a changé la tendance de longue date à l'amélioration de la santé de la population.
La COVID-19 a été transitoirement lors des confinements un dépollueur !
CommentaireUne preuve indirecte de l'efficacité vaccinale anti Covid-19. Et dire qu'ajourd'hui encore je rencontre des anti vaccins ou des aptrients qui hésitent depuis le début de la pandémie !!!!! Les preuves des bienfaits des vaccins se multiplient pendant que cetrains "regardent alleurs" enfermés dans de fausses convictions entretenue par des "anti sciences" égarés dans leur esprit par des "sorciers et majes" ignards mais oh combien polluants.
Remarquez sur le graphique l'absence de la Russie dont le vaccin SPOUTNIK s'est égaré en vol et c'est auto détruit .
Par contre la France bien placée fait partie des pays à "haute vaccinations".En fait dans ce classement rien de bien étonnant, chaque pays est à sa place et à la place qu'il mérite compte-tenu de sa politique de Santé , de son Humanisme et de sa foi en la SCIENCE .Il est nécessaire de redoubler de vigilance , la 9° vague est là, mais la banalisation actuelle des politiques pour la Covid-19 pose problème.
On en parle moins voire pas et "tout va bien" !!!!! douce illusion
Pour les septiques en tout genre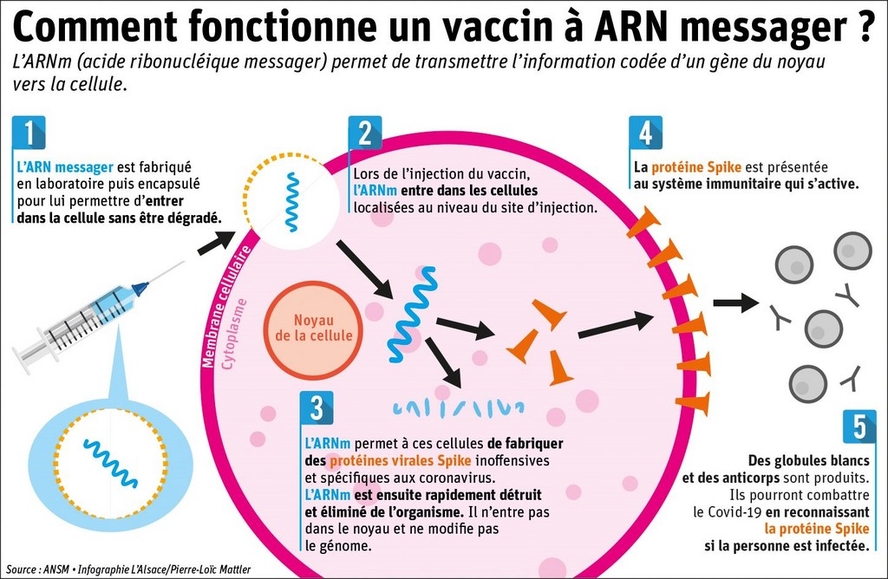



 Les personnels de Santé anti vaccins doivent changer d'orientation professionnelle et ne pas être ré intégrer car ils ne croient pas à la Science qui est le fondement même de la Santé.
Les personnels de Santé anti vaccins doivent changer d'orientation professionnelle et ne pas être ré intégrer car ils ne croient pas à la Science qui est le fondement même de la Santé.
Une autre raison de se faire vacciner - le risque de thromboses veineux a augmenté chez tous les patients atteints de Covid, mais beaucoup plus chez les non vaccinés (HR 21,42) que chez les vaccinés (HR 5,95) ; une différence significative (p=0,02). Réf JAMA Annals Int Med Nov 2022 @MerrimanEileen VACCINEZ-VOUS GRIPPE et COVID19 MASQUEZ -VOUS (lieux clots,transports etc)
VACCINEZ-VOUS GRIPPE et COVID19 MASQUEZ -VOUS (lieux clots,transports etc) -
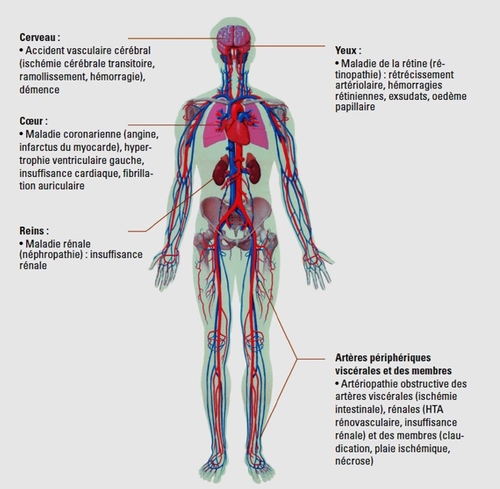
Enquête : covid-19 et compliance aux traitements vasculaires
 "La maladie ne se guérit point en prononçant le nom du médicament, mais en prenant le médicament." Thomas Sankara
"La maladie ne se guérit point en prononçant le nom du médicament, mais en prenant le médicament." Thomas Sankara
"L'ambition est comme un médicament, il faut en prendre la dose prescrite, car elle peut être soit bénéfique, soit nocive." Marc Allegret
Analyse d'article : Discontinuation of vascular therapeutics during the COVID-19 pandemic first wave in France
Arrêt des thérapies vasculaires lors de la première vague de la pandémie COVID-19 en France
Journal de Médecine Vasculaire,Available online 16 January 2021
MéthodesUn questionnaire en 6 points a été proposé aux patients lors d'une consultation ambulatoire par des médecins vasculaires membres de la Société Française de Médecine Vasculaire (SFMV). Les médecins avaient précédemment reçu une demande de participation par courrier électronique en remplissant un questionnaire en ligne (LimeSurvey® Software, Hambourg). Les patients ont été informés des objectifs de la recherche et de l'anonymat des données collectées. Le temps estimé pour répondre aux questions était de deux minutes. Les données anonymes ont été centralisées dans une base de données hébergée par la SFMV. La participation n'était pas rémunérée. Les résultats quantitatifs sont exprimés en moyenne ± écart type et qualitatifs en pourcentage.
RésultatsEn mai 2020, 1936 courriels ont été envoyés aux membres de la SFMV. Cela a abouti à la collecte de questionnaires remplis pour 297 patients dont les caractéristiques sont présentées dans le tableau ci-dessous.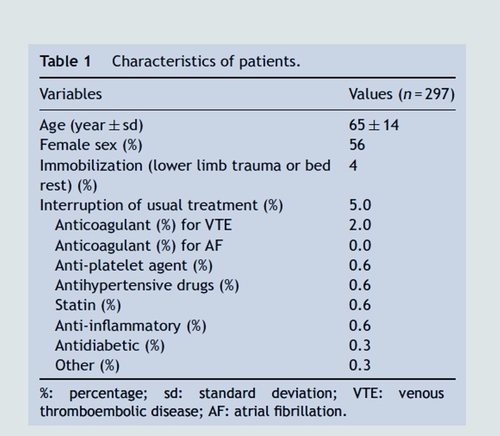 Cette enquête a identifié 5% des abandons de traitement.Les traitements habituellement prescrits pour les maladies chroniques, comme les antiplaquettaires ou les statines pour les artères périphériques, ont été largement maintenus (respectivement 0,3% et 1,0% d'arrêt).
Cette enquête a identifié 5% des abandons de traitement.Les traitements habituellement prescrits pour les maladies chroniques, comme les antiplaquettaires ou les statines pour les artères périphériques, ont été largement maintenus (respectivement 0,3% et 1,0% d'arrêt).
Discussion
D'autres études ont étudié l'impact de la pandémie sur la prise en charge des patients, y compris une diminution des hospitalisations d'urgence et des interruptions de traitement immunomodulateur mais à notre connaissance il s'agit du premier rapport sur le suivi thérapeutique vasculaire pendant le COVID -19 pandémie. Il a été constaté que 5% des patients ont arrêté les traitements sur un échantillon de 297 patients. Les circonstances de ces arrêts sont inconnues, mais on peut supposer que certains d'entre eux, comme ceux des anticoagulants (MTEV) , peuvent être secondaires au non-renouvellement d'une prescription ou à la fin prévue d'un traitement de courte durée. Il est à noter qu'il n'y a pas eu d'interruption d'approvisionnement ou de pénurie de ces médicaments dans les pharmacies françaises . La controverse initiale sur l'ECA ou l'ARB2 ne semble pas avoir conduit à l'arrêt du traitement et ne doit pas être abordée plus avant à la lumière des résultats de l'étude BRACE CORONA, qui n'a trouvé aucune différence significative de survie à 30 jours entre l'arrêt ou la poursuite de l'ECA. / ARB2 chez lespatients hospitalisés pour COVID-19 . Enfin, il est à noter que l'activité des médecins vasculaires a probablement été fortement impactée au cours de cette pandémie comme le suggère une enquête de la même période, utilisant une méthodologie de questionnaire identique remplie par des médecins vasculaires volontaires, potentiellement soumis au même biais de sélection .
Concernant les limites, cette étude n'a pas été en mesure d'évaluer les conséquences de ces changements thérapeutiques et la représentativité des patients atteints de maladies vasculaires chroniques n'est pas assurée. En effet, les antécédents des patients n'étaient pas systématiquement collectés, le motif de la consultation était inconnu ainsi que le taux de participation.
Conclusion
Cette enquête n'a pas identifié de modification majeure de la thérapeutique vasculaire au cours de la première vague de la pandémie COVID-19 chez les patients suivis par des médecins vasculaires membres du SFMV.
CommentaireEtude intéressante et informative sur la compliance des patients vasculaires à leur traitement. Je suis d'accord avec le peu de traitement stoppé. Par contre si la prise de médicaments a été prise en compte, l'autre partie du traitement ne l'est pas. Durant ce premier confinement, parmi patients qui présentaient une artériopathie des membres inférieurs , une partie s'est aggravée. Celle des patients qui compte tenu du contexte ont arrêté de marcher, et surtout ont repris leur intoxication tabagique. Les artéritiques diabétiques ont notamment été concernés comme les polyvasculaires. .Pour les patients qui étaient traités pour une thrompbose veineuse profonde ont vu l'aggravation de l'oedème de la jambe, du fait d'une immobilité renforcée ,la réduction voire l'absence de la marche et du port irrégulier de la compression. Ceci montre s'il fallaitencore le démontrer que le traitement médicamenteux n'est qu' une partie du traitement des patients vasculaires. La marche active, le contrôle de facteurs de risques comme le tabac restant encore plus d'actualité de même que l'activité physique et les mesures hygiéno-diététiques.A la sortie de la première vague, les patients qui avaient annulé leur consultation sont revenus consulter et il a fallu renforcer les mesures d'hygiène de vie "artérielle" très sérieusement. En ce qui concerne la compliance il aurait été intéressant de connaître le nombre de comprimés pris par patient.On sait qu'au-delà de 5 médicaments, la compliance...s'étiole....La compliance au traitement est une préoccupation au quotidien des médecins.
Comment améliorer la compliance ?
Adhérence, adhésion thérapeutique, compliance (anglicisme), observance… un jargon bien connu des personnes atteintes de maladies chroniques comme l’hypertension artérielle, l’asthme, le diabète de type 2, l’ostéoporose, l’insuffisance cardiaque ou encore l’hypercholestérolémie.
Même si ces notions clés sont importantes pour optimiser la réussite du traitement, elles restent néanmoins difficiles à appliquer au quotidien. Il faut être humble lorsque l'on prescrit car à 5 ans , 50% des patients réduisent ou stoppent leur traitement. C'est donc un travail de chaque jour pour toutes et tous les soignants.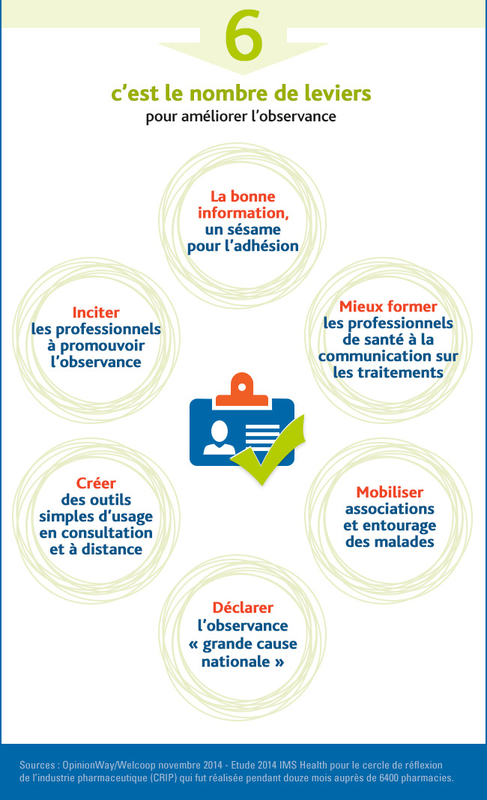
Bravo aux auteurs pour cette enquête "vasculaire" intéressante .
Source "accès libre"
Les auteurs : D. Lanéelle,M. Dadon,I. Quere, S. Zuily, J. Emmerich, M.-A. Sevestre, G. Mahé, on behalf the SFMV
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7816936/
https://www.hypertension.qc.ca/gestion/pdf/definition.pdf#vacciné1°et2°inj -
Entretien avec Marc Carrier : COVID-19 et MTEV
 "Le Canada est délimité au nord par l'or, à l'ouest par l'orient, à l'est par l'histoire et au sud par des amis" Frances Shelley Wees
"Le Canada est délimité au nord par l'or, à l'ouest par l'orient, à l'est par l'histoire et au sud par des amis" Frances Shelley Wees
« Advance - Ottawa - en Avant ». Devise de la ville d'Ottawa
Entretien avec Marc Carrier :Senior Scientist, Clinical Epidemiology Program
Ottawa Hospital Research Institute
Chief, Division of Hematology, Department of Medicine
The Ottawa Hospital
Professor, Department of Medicine
University of Ottawa
Marc Carrier est un éminenent spécialiste sur le maladie Vieneuse thrombo Embolique.
Il a publié entre 2011 et 2021 , 210 articles sur cette thématique dans les revues les plus prestigieuse.Cet entretien est centré sur la MTEV et la Covid-19Merci Marc , un grand Merci d'avoir répondu à mes questions et en francais
L’orage cytokinique qui est présent chez les patients Covid-19 en réanimation, comment est-il un activateur des phénomènes thrombotiques ?Excellente question. Je crois que l’entrée du virus dans la cellule endothéliale (exposition de facteur tissulaire), la cascade inflammatoire (relâche de cytokines) et l’orage cytokinique (activation du complément) sont tous des activateurs inter-reliés qui contribuent à la formation de thrombine, le dépôt de fibrine et les phénomènes thrombotiques.
A votre avis si la prévention par héparine de bas poids moléculaire est le médicament de la prévention de la maladie thrombo embolique en réanimation au décours de la Covid-19, à quelle dose ? Préventive ? Intermédiaire ? Ou curative ?
Pour l’instant, les données probantes semblent suggérer que les HBPM à dose préventive devraient être utilisées chez les patients en réanimation pour Covid-19. L’essai multi-plateforme randomisé (mRCT) qui a randomisé les patients avec Covid-19 en réanimation entre une dose d’héparine (majorité HBPM) thérapeutique et une dose standard (intermédiaire et préventive) n’a pas démontré de bénéfices sur le critère de jugement primaire de “Organ-support free days ». Les taux d’évènements thrombotiques (artériels et veineux) étaient moins élevés chez les patients recevant des dose thérapeutiques (5.7% vs. 10.3%) mais sans diminution de la morbidité et la mortalité. La prévention primaire à dose thérapeutique est aussi associée à une augmentation du risque hémorragique de 1.3% (définition de l’ISTH). L’étude iranienne INSPIRATION nous donne quelques indices pour décider entre une dose préventive et intermédiaire chez les patients en réanimation. Une dose intermédiaire n’a pas diminué le risque de survenue du critère de jugement principal (thromboses artérielles et veineuses, mortalité et traitement d’oxygénation extracorporelle) mais semble augmenter le risque hémorragique (définition de BARC; 2.5 vs 1.4%). Il y a donc peu de données randomisées en faveur d’une dose thérapeutique ou intermédiaire chez les patients Covid-19 en réanimation.
https://www.medrxiv.org/content/10.1101/2021.03.10.21252749v1
https://jamanetwork.com/journals/jama/fullarticle/2777829Pensez-vous que les anticoagulants oraux directs aient une place dans la prévention de la maladie thrombo embolique, chez les patients Covid-19 hospitalisés mais non en réanimation ?
Il y a plusieurs essais en cours et nous aurons peut-être une perspective différente dans les prochaines semaines ou mois. Pour l’instant l’étude ACTION, qui a comparé le rivaroxaban à une dose de 20 mg par jour (patients hospitalisés stables et au long cours (30 jours)) et l’énoxaparine 1 mg/kg BID (patients en réanimation) à une dose préventive (énoxaparine 40 mg par jour) pendant l’hospitalisation, n’a pas démontré de bénéfices mais une augmentation du risque hémorragique. Donc, pour l’instant, je ne crois pas que les anticoagulants oraux directs aient une place mais des études pré- et post-hospitalisation sont en cours et les données pourraient changer notre prise en charge. Il est possible que les héparines (HBPM ou non-fractionnée) puissent avoir d’autres fonctions (ex. diminution de l’entrée du virus, etc.) qui pourraient avoir des bénéfices chez les patients hospitalisés avec Covid-19
Pensez-vous que les D Dimères chez les patients hospitalisés en médecine et ou en réanimation en cas de Covid-10 puissent aider à moduler la gestion de la prévention de la thrombose en ce qui concerne sa posologie ?
Plusieurs études et essais en cours utilisent différents biomarqueurs (incluant les D-dimères) afin de stratifier les patients hospitalisés avec la Covid-19. Donc nous aurons plus d’information dans les prochains mois.
Au début de la pandémie, les niveaux élevés des D-dimères chez les patients hospitalisés semblaient être associés à une coagulopathie spécifique à la Covid-19. Maintenant, nous savons que les D-dimères peuvent être générés dans l’espace alvéolaire. L’écoulement de protéines plasmatiques (afin d’activer les cytokines) contient aussi de la thrombine et du fibrinogène qui éventuellement sera dégradé en D-dimères. Donc les D-dimères pourraient être un facteur pronostique de détérioration pulmonaire (et de mortalité) plutôt que d’un risque thrombo-embolique ou vasculaire.
L’essai mRCT n’a pas rapporté de différences importantes dans les odds-ratio favorisant une dose thérapeutique plutôt qu’une dose standard chez les patients hospitalisés (mais pas en réanimation) qui avaient des D-dimères élevés (2X la limite de la normale) ou non. Les odds ratios pour le critère de jugement principal (voir question 2) étaient de 1.3 (probabilité de 97%) et 1.2 (probabilité de 92%) chez les patients hospitalisés avec la Covid-19 (mais pas en réanimation) avec des D-dimères élevés ou non, respectivement. Donc pour l’instant, les données probantes semblent démontrer que les D-dimères ne sont pas très importants pour moduler la gestion de la thrombose chez les patients hospitalisés avec la Covid-19.
https://www.medrxiv.org/content/10.1101/2021.05.13.21256846v1
A. Khorana a évoqué dans un article du JTH, qu’il existait des ressemblances entre le Cancer et la Covid-19 en matière de maladie thrombo embolique veineuse, les 2 CC. Qu’en pensez-vous ?
Comme je suis un des auteurs de la publication, je suis un peu biaisé. Le but était de réviser la pathophysiologie de ces deux maladies pro-thrombo emboliques en donnant une perspective différente afin de générer une discussion et un débat. Je crois, en effet, qu’il y a des ressemblances intéressantes. Le risque thrombotique est élevé, les d-dimères sont très élevés et possiblement associé à un mauvais pronostic et la prévention primaire à dose de prophylactique semble insuffisante. Cependant, les différences entre les deux maladies (Cancer et COVID) permettent aussi aux cliniciens de réfléchir à la pathophysiologie sous-jacente et d’établir une prise en charge optimale afin de prévenir la malade thromboembolique chez ces patients. Je vous encourage à lire l’article :
https://onlinelibrary.wiley.com/doi/10.1111/jth.15294
Avez-vous été confronté dans votre pratique à des thromboses veineuses classiques, thrombose veineuse profonde des membres, thrombose veineuse superficielle et/ou embolie pulmonaire post vaccination anti Covid-19 et avec quel vaccin ?
C’est une excellente question. Comme la vaccination s’est accélérée dans les derniers mois au Canada, toutes les nouvelles TVP, thromboses superficielles et EP sont diagnostiquées chez des patients ayant récemment reçu la vaccination (Pfizer, Moderna et Astra-Zeneca). Cependant, nous avons eu quelques cas de thromboembolies veineuses dans le contexte de thrombocytopénie thrombotique associée au vaccin Astra-Zeneca. Tous les patients avaient des anticorps anti-PF4 positifs. Les immunoglobulines polyvalentes, les échanges plasmatiques et l’argatroban ont été utilisés avec succès dans la prise en charge de ces patients. Une série de cas Canadiens sera bientôt publiée afin de partager notre expérience clinique. Ce vaccin n’est plus utilisé au Canada et donc, nous avons eu aucun cas dans les dernières semaines.
MERCI
Une penseé pour Cleave Kearon -
Entretien avec Nicolas Gendron : D Dimères
 “L’expérience est une observation provoquée dans le but de faire naître une idée.” Claude Bernard« Le savant n’étudie pas la nature parce que cela est utile ; il l’étudie parce qu’il y prend plaisir et il y prend plaisir parce qu’elle est belle. » Henri Poincaré" Comprendre c'est le reflet de créer " Auguste de Villiers de l'Isle-Adam
“L’expérience est une observation provoquée dans le but de faire naître une idée.” Claude Bernard« Le savant n’étudie pas la nature parce que cela est utile ; il l’étudie parce qu’il y prend plaisir et il y prend plaisir parce qu’elle est belle. » Henri Poincaré" Comprendre c'est le reflet de créer " Auguste de Villiers de l'Isle-Adam
Les D-dimères font la une depuis quelques années, mais quand et pourquoi sont-ils intéressants dans la démarche médicale actuelle. Sont-ils trop prescrits ? Sont-ils si utiles ?
Il était donc nécessaire de faire le point avec un spécialiste afin d’avoir un éclairage EBM sur leur utilisation.
J’ai donc sollicité le Dr Nicolas Gendron afin qu’une fois pour toute les D-dimères soient démystifiés, un grand merci d'avoir accepté. Hématologiste
Hématologiste
Praticien Hospitalier :
Service d'Hématologie biologique de l'Hôpital européen Georges Pompidou avec le Pr D SMADJA (cheffe de service, Pascale GAUSSEM)
Université de Paris, Innovation Thérapeutique en Hémostase, INSERM UMRS 1140 et Laboratoire de Recherches Biochirurgicales (Fondation Carpentier), Paris, France
Service d'hématologie biologique, Hôpital européen Georges Pompidou, Paris, France
@GendronNico
C’est tout d’abord un honneur de participer à cette interview et parler de l’apport et des limites d’un examen de biologie médicale dans la prise en charge des patients.Question 1
Pouve- vous nous rappeler ce que sont le D-dimères plasmatiques ?
On rentre dans le vif du sujet. Il faut d’abord se rappeler que le but de la cascade de la coagulation c’est de générer de la thrombine (facteur IIa) pour former à partir du fibrinogène de la fibrine (formation du caillot) et donc coaguler. Cette fibrine sera d’abord soluble puis avec l’action du FXIII, il va y avoir un cross-linking de cette fibrine pour qu’elle devienne insoluble et forme un caillot de fibrine insoluble et stable. C’est ensuite que les mécanismes de la fibrinolyse physiologiques vont dégrader ce caillot, par l’action de plasmine, en produits de dégradations de la fibrine (PDF) et en D-dimères.
Ainsi les D-dimères sont un marqueur indirect de la coagulation car ils représentent en fait la lyse d’un caillot préalablement formé. Ainsi les monomères de fibrines sont quant à eux un marqueur de coagulation.
A noter qu’en cas de fibrinolyse sur un caillot de fibrine soluble (avant l’action du FXIII) dans le cas de la fibrinogénolyse (pathologie acquise et extrêmement rare de la coagulation), on aurait formation de PDF sans formation D-dimères.
Question 2A votre avis quand doit-on prescrire l’évaluation des D-dimères et pourquoi ?
A mon avis, par ordre de priorité/pertinence/évidence clinico-biologique
- Dans le cadre d’une suspicion d’embolie pulmonaire de probabilité clinique faible ou modérée du fait leur très bonne valeur prédictive négative (VPN). Dans le but d’exclure en toute sécurité le diagnostic d’EP et d’éviter le recours à un angio-scanner cher, irradiant et potentiellement néphrotoxique. Il y a actuellement, plusieurs stratégies d’exclusion de l’EP en fonction du taux de D-dimères. La plus utilisée en France et selon les recommandations Française de 2019 de prise en charge de la maladie veineuse thromboembolique (MTEV, Sanchez O et al., Rev Mal Res 2019) : Age-ADJUST+++ : le seuil D-dimères ajusté à l’âge. Après évaluation de la probabilité clinique, le taux D-dimères pour exclure l’EP est : 500 ng/mL pour les moins de 50 ans ou 10 ng/mL x âge pour les >50 ans
Mais il existe d’autres stratégies en cours de développement qui adaptent le taux de D-dimères à la probabilité clinique : par exemple, le seuil de D-dimères sera plus élevé lorsque la probabilité clinique sera faible et inversement. Il s’agit des stratégies YEARS (van der Hulle T et al., Lancet 2017) ou encore PEGeD (Kearon C et al., PEGeD ,NEJM 2019).
Pour rappel, il n’est pas recommandé de réaliser un dosage des D-dimères chez un patient sous anticoagulation à dose curative, en effet le taux peut-être faussement négatif (perte de sa VPN) et si il est positif, il faudra, dans tous les cas, recourir à l’imagerie.
Dans le diagnostic d’exclusion de thrombose veineuse profonde (TVP) les D-dimères peuvent être utile pour le diagnostic de la TVP des membres inférieurs voire des membres supérieurs. Le score âge-ADJUST est souvent utilisé mais il n’y a encore à ce jour de validation prospective de ce score, seulement rétrospectif.- La place des D-dimères est devenue importante pour évaluer la durée de traitement anticoagulant chez les femmes (uniquement !) et sous anticoagulant dans le cadre du score HERDOO-2 (men continue). En effet, chez une femme sous anticoagulant après un 1er évènement non provoqué de TVP/EP si le score HERDOO-2 est <2, on pourra arrêter le traitement anticoagulant avec un très faible risque de récidive.
Pour les puristes, le score HERDOO-2 a été validé en évaluant les taux de D-dimères sous anticoagulant mais en très grande majorité sous AVK et avec le kit de D-dimères VIDAS uniquement.
- Dans le diagnostic biologique de coagulation intravasculaire systémique (CIVD),en effet dans cette situation d’urgence (thrombopénie, diminution du TP, du FV et du fibrinogène) mais parfois difficile en cas de sepsis (car D-dimères souvent déjà élevés). Dans cette situation-là, les monomères de fibrines semblent plus pertinents car un vrai marqueur d’activation de la coagulation.
- Nouvelle indication des D-dimères dans la COVID-19,mais attention à ce qu’on veut leur faire dire. Dans la COVID-19, ces taux importants de D-dimères reflètent la microthrombose vasculaire associée à la maladie et font partie de la nouvellement nommée « coagulopathie associée à la COVID-19 ».
Les D-dimères comme marqueurs pronostiques uniquement : de nombreuses études ont montré que le taux de D-dimères à l’admission pour COVID-19 était associé à la gravité de la maladie mais aussi prédictible au risque de passage en réanimation et de mortalité (Zhou et al., Lancet 2020 et Tang JTH 2020). Par ailleurs, notre équipe (INSERM_1140, Pr D SMADJA) a montré à partir d’une étude multicentrique de la Société Française de Cardiologie qu’un seuil supérieur à 1120 ng/mL de D-dimères chez les patients en unité médicale COVID-19 était prédictif de mortalité indépendamment du risque de MVTE.
Au cours de la COVID-19, de nombreuses équipes ont voulu « réinventer » le rôle des D-dimères dans la MTEV,et donc de prédire le risque de faire une thrombose… Il faut recourir à l’imagerie et non pas faire des D-dimères pour leur valeur prédictive positive (ce qui n’a jamais été leur rôle). Le dépistage systématique de la MTEV n’est pas recommandé par l’ISTH (Spyropoulos AC et al., JTH 2021). Les stratégies classiques devant une suspicion de TVP ou d’EP proposent d’évaluer les D-dimères devant une probabilité clinique faible, ce qui n’est pas applicable dans cette population du fait de la coagulopathie et des D-dimères élevés, il faudrait probablement définir un seuil de D-dimères adapté à cette pathologie (des études sont en cours…). En attendant, l’ISTH suggère donc de réaliser un angio-TDM pulmonaire ou une scintigraphie ventilation/perfusion d’emblée devant une suspicion clinique d’EP.
Question 3
Aujourd’hui on assiste à des demandes de dosages des D Dimères à tort et à travers, notamment en médecine de ville. Ces demandes ne sont pas toujours justifiées. Pouvez- vous nous dire quand faut-il vraiment les prescrire ? Dans quelles circonstances ?
Actuellement, dans le contexte de vaccination de masse anti-COVID-19 et après la description de très rares cas de VITT (vaccine-induced thrombotic thrombocytopenia) après la vaccination par AstraZeneca et Janssen, certains médecins prescrivent des contrôles de NFS et de D-dimères après vaccination pendant 15-21 jours, sans que pour l’instant il n’y ait de rationnel scientifique/médical à une telle pratique.
En revanche, il y a une jolie étude des Italiens sur 30 volontaires sains vaccinés par comirnaty (Pfizer/BioNTech) avec évaluation de l’hémostase avant vaccination, à J7 et J21 qui montre, parmi les nombreux tests globaux et très spécialisés d’hémostase que rien ne bouge après vaccination (ni D-dimères, ni anticorps anti-PF4/héparine entre autres, Peyvandi F et al., Thromb Up 2021).Concernant la VITT, il faut garder en mémoire qu’elle est très rare (entre 1 :100000 et 1 :500000) et que les cas ont eu lieux chez des patients sans thrombophilie et sans antécédent de thrombose.
Il faut savoir qu’un dosage de D-dimères, c’est autour de 15 euros,ce qui en biologie médicale commence à être un examen cher. Concernant les situations où les prescrire, je reviendrais à la question précédente, n°2.
Question 4
On se retrouve quelquefois avec des D Dimères très élevés en l’absence de maladie thrombo embolique veineuse. Quelle est la conduite à tenir ? Quelles sont les circonstances cliniques qui expliquent cette augmentation ? Que faut-il faire en cas de D Dimères élevés en l’absence de toute cause à priori ? Les D Dimères élevés peuvent-ils être des annonciateurs de cancer.
Encore une fois, tout D-dimères en dehors de tout contexte évoqué plus haut n’a pas d’intérêt.
En l’absence de MTEV, si les D-dimères sont élevés chez un patient, le prélèvement peut être coagulé et la libération de D-dimères sera un marqueur de « coagulation dans le tube », votre laboratoire est sensé vérifié le « pré-analytique » c’est-à-dire si le tube est conforme (pas coagulé, bien rempli et pas hémolysé). Il s’agit de la 1èreétape de raisonnement d’un biologiste devant un D-dimères élevés.Puis évaluer le taux en fonction du reste du bilan : TP, facteurs du TP, fibrinogène et plaquettes pour s’assurer qu’il n’y ait pas de consommation de la coagulation faisant suspecter une CIVD.
Et enfin, vérifier le contexte clinique et autre cause d’élévation des D-dimères : syndrome inflammatoire aiguë ou chronique, sepsis, (COVID-19), grossesse et cancer.
En l’absence de suspicion clinique de thrombose, il ne faut pas réaliser d’examen d’imagerie à la recherche de thrombose. Vérifier le bilan inflammatoire du patient notamment. Oui les D-dimères élevés sont observés le cas du cancer, et pourraient faire donc suspecter un cancer chez un patient asymptomatique. Dans le cas d’une découverte « fortuite » de D-dimères élevés chez un sujet de + de 50 ans, il peut paraître utile de vérifier tout d’abord si les dépistages liés à l’âge et au sexe ont bien été réalisés.
Question 5
L’ajustement à l’âge du dosage des D Dimères est désormais validé en cas de suspicion de maladie thrombo embolie veineuse notamment en cas de suspicion d’embolie pulmonaire. Quelle est votre expérience dans ce domaine ?
De notre expérience, comme évoqué en question n°2, nous utilisons le score Age-Adjust. Encore une fois, bien évaluer la probabilité clinique pré-test et pas de dosage D-dimères chez des patients sous anticoagulant à dose curative.
Question 6
La Covid-19 est à l’origine d’une augmentation des D Dimères. Comment faut-il les gérer pour les patients hospitalisés en médecine et les patients en réanimation. Les D Dimères sont-ils un curseur de gravité ? Ont-ils un impact sur la décision d’augmenter éventuellement la dose des HBPM en prophylaxie ?
La COVID-19 a été rapidement associée à une forte activation de la coagulation suggérée par une élévation importante du taux de D-dimères associé à une mortalité accrue (Zhou et al., Lancet 2020), une activation endothéliale (Smadja DM et al., Angiogenesis 2020 et 2021) et à une prévalence inattendue de thromboses veineuses et artérielles. Dans ce contexte de réponse inflammatoire intense, l’activation de la coagulopathie peut être liée à des mécanismes de thrombo-inflammation.
Au début de l’épidémie chinoise, les auteurs ont évoqué une prévalence élevée de CIVD chez leur patient avec des taux de D-dimères très élevés (2). Rapidement les premières séries européennes ont démontré que l’hyperfibrinogénémie, les taux d’antithrombine et de monomères de fibrine ainsi que l’absence de thrombopénie profonde dans la majorité des cas (7) n’étaient pas en faveur d’une CIVD chez les patients mais plutôt d’une coagulopathie spécifique à la COVID-19. Les taux de D-dimères très élevés au cours de la COVID-19 seraient le reflet à de la micro et/ou macrothrombose disséminées et ainsi que d’anomalies de la fibrinolyse.Je le rappelle encore une fois, mais dans la COVID-19, les D-dimères sont à ce jour qu’un marqueur de gravité et de mauvais pronostique.
Le risque de MTEV dans la COVID-19 est élevé (environ 20% des patients avec une forme critique), même s’il reste actuellement mal défini, en particulier chez les patients ambulatoires. L’ISTH suggère un monitoring de différents paramètres de la coagulation (TP, D-dimères, plaquettes et fibrinogène) et une anticoagulation préventive par HBPM chez tous les patients COVID-19 nécessitant une hospitalisation en l’absence de contre-indication. Chez les patients atteints de COVID-19 pris en charge en ambulatoire, ou sortant d’un séjour hospitalier pour une infection à SARS-CoV-2, une thromboprophylaxie médicamenteuse systématique n’est pas recommandée (ni dosage de D-dimères) mais elle est suggérée en cas de présence de facteurs de risques additionnels tels qu’un antécédent connu de MVTE ou un cancer évolutif d’après les propositions de la Société Française de Médecine Vasculaire (Khider L et al., JMV 2020)
Par ailleurs, la posologie des traitements anticoagulants en prévention fait débat: un essai multicentrique français (via le réseau INNOVTE) a évalué l'efficacité d’une posologie d’héparine de bas poids moléculaire intermédiaire ajustée au poids, comparativement à une posologie prophylactique conventionnelle, sur la survenue d’événements thromboemboliques veineux chez les patients atteints de COVID-19 hospitalisés (COVI-DOSE; NCT04373707). Les résultats sont à venir prochainement.
Brièvement, a ce jour, on se rapproche de la « bonne dose », il semble que la théorie du « Earlier is Better » semble se confirmer. L'anticoagulation aurait un rôle important dans la phase précoce de la maladie. En tous cas, chez le patient en réanimation, la dose d’anticoagulation préventive standard semble l’idéal. En revanche, chez le patient hospitalisé en unité médical COVID-19, il semble que l’anticoagulation à dose curative semble intéressante et notamment chez ceux avec les D-dimères les plus élevés (donc la maladie la plus active ?).
De plus, nous avions montré dans une étude rétrospective multicentrique avec la Société Française de Cardiologie que les patients hospitalisés pour COVID-19 et qui étaient sous anticoagulation orale à dose curative pour de la FA ou MTEV présentaient un meilleur pronostique que ceux non (Chocron R et al., JAHA 2021). Affaire à suivre !Dernière question : carte blanche
Si je peux donner un conseil, je pense que tout Médecin ayant appétence pour la MTEV et les traitements anticoagulants doit se rapprocher de son laboratoire (hospitalier et/ou libéral) et de son biologiste médical afin de connaître les types de tests que réalise son laboratoire (Kit de D-dimères, dosage des anticoagulants, délai de rendu) et ses besoins pour sa pratique clinique afin d’identifier les axes de prescription biologique à améliorer.
Le dialogue clinico-biologique est important et fait progresser le Biologiste Médicale ainsi que le Médecin (Vasculaire ou Généraliste, entre autres) mais surtout la prise en charge des patients atteints de MTEV.
Un grand MERCI,les D Dimères font partie de notre quotidien en Médecine Vasculaire, nous allons grâce à ces réponses claires et pertinentes encore mieux les maîtriser et mieux les utiliser...et mieux les faire prescrire....... -
Et pendant ce temps là !
 “L'information n'est souvent qu'un empêchement à la vraie connaissance.”Louis Gauthier
“L'information n'est souvent qu'un empêchement à la vraie connaissance.”Louis Gauthier
“Le plus grand danger des autoroutes de l'information, une fois de plus, ça sera pour les hérissons de l'information...”JM Gourio
"La lecture apporte à l'homme plénitude, le discours assurance et l'écriture exactitude."Francis Bacon
La 7° Vague , nous y sommes.Chacune d'entre elles , correspond à une symphonie de Beehoven, la 7° symphonie en la majeur, op. 9. Il nous en reste encore 2 , puis nous passerons à autre chose, tout au moins on l'espère.Que faire ? Comme avant......masque commpris, vaccination , notamment le deuxième rappel à partir de 60 ans et pour les personnes à sur risque avant 60 ans
La population ne comprend pas il faut donc répéter et répéter.....
La symphonie N° 7 :la prodigieuse énergie . Otto Klemperer faisait d’ailleurs remarquer qu’« il n’existe rien de plus difficile pour un chef d’orchestre que les symphonies de Beethoven. » (Musical America, 19 février 1927). Pour la pandémie ce sont les vagues successives qui sont difficile pour à la fois la population et les responsables de Santé.
Mais nous nous habituons à tout , la pandémie mais aussi la geurre en Ukraine, la anicule, les feux et ce quelque soit le degré dans l'horreur.
La banalisation des faits , mêmes graves et très graves est aujourd'hui. Leur sur médiatisation par les chaines INFOS H24, finalement les banalisent car trop c'est trop et on passe à autre chose. La pression de l'INFO est trop forte et elle tue l'INFO et chacun fait ce qu'il peut, ce qu'il veut. L'excès d'INFOS est délétère, il est assoursissant, il dégrade l'INFO, en répétant toujours la même chose. C'est ainsi ! Maatraque voulu, la question mérité d'être posée.
"Des torrents d’e-mails, des rafales de textos, des bombardements de flashs info, des ribambelles de tweets, des tonnes d’invitations Facebook, des kyrielles de messages WhatsApp… Face à ce flot de sollicitations, vous frôlez l’overdose, non ? ! "
"Avec Internet, les réseaux sociaux, les blogs, les chaînes YouTube, tout le monde, aujourd’hui, produit sa propre information, donne son point de vue, partage un bout de sa vie, relaie ses trouvailles 2.0. Chacun devient en quelque sorte son propre rédacteur en chef et hiérarchise (ou pas) l’information comme il le souhaite. Certains sont constamment sur la brèche, abonnés à toutes les alertes possibles. D’autres sont adeptes de la « Web errance », se laissant entraîner d’une vidéo à un site, d’un site à un autre, et ainsi de suite… Internet étant un amplificateur des chaînes d’info en continu, avec un déferlement de contenus qui ne s’interrompt jamais…"
https://www.cairn.info/2h-chrono-pour-deconnecter-et-se-retrouver--9782100776979-page-21.html
Et oui on frôlait l'overdose et maintenant nous y sommes totalement dans l'overdose, on ne contrôle plus rien, on subit....et on a peur. Les médias de manière volontaire ou involontaire jouent sur la peur.
C'est pourquoi la pandémie et la guerre , auxquelles on peut rajouter la canicule et les feux nous font passer un été apocalytique et en même temps d'une grande banalité. L'avalanche d'infos va jusqu'à la détestation de ce qui se passe. La politique de l'autruche est le résultat de tout cela. On fuit l'info, inconsciemment et en même temps sciemment....car on n'en peu plus.
Au milieu de ce déferlement des informations il y a la sur information, et les Infoxs en plus, tout cela secrète un rejet bien compréhensible de l'info et donc de ce qui se passe tout près de chez nous. Mais il ya des choses dont on parle aussi , qui inquiètent la population, le coût de la vie. On en parle mais moins que le reste......On se demande si le matraquage qui associe pendémie, guerre et canicule sont là pour étouffer le reste des infos.
"Nous vivons dans un monde où les funérailles sont plus importantes que les morts, le mariage est plus important que l'amour, l'apparence est plus importante que l'esprit. Nous vivons dans une culture de l'emballage qui méprise le contenu." Anthony HopkinsCruciale destinée des infos, les infos para tonnerres, sont les infos pandémie,guerre et canicule.
La Lecture reste le plus sûr refuge dans ses conditions, je lie et relie beaucoup, à l'abri du sensationalisme délirant, la lecture est la solution aujourd'hui, celle de la reflexion. Ne pas oublier enfin la Musique
A écouter, 7° Symphonie , 2° mouvement de Beethoven
https://www.youtube.com/watch?v=mgHxmAsINDk&ab_channel=thehappymonkey
A relire, Globalia de JC Rufin
"Une heure de lecture est le souverain remède contre les dégoûts de la vie." Montesquieu
Et pendant ce temps là...........................
"Le temps et lui seul est responsable de tout remettre à sa place. Pendant ce temps, patience et sagesse."Lume
Le rire et les caricatures comme les dessins de presse sont une manière efficace de déstresser et de s'apaiser.... @pedromics
@pedromics
A relire :
https://medvasc.info/1254-sant%C3%A9-publique-et-m%C3%A9dias -
Etat d'Urgence Sanitaire : mode d'emploi

"L'état d'urgence atterrit dictée par l'urgence de la situation". Claudemay
Loi votée le 21/03/2020
Selon l'article 10, "la déclaration de l’état d’urgence sanitaire donne pouvoir au Premier ministre de prendre par décret (...) les mesures générales limitant la liberté d’aller et venir, la liberté d’entreprendre et la liberté de réunion et permettant de procéder aux réquisitions de tout bien et services nécessaires afin de lutter contre la catastrophe sanitaire".
L'article 11 indique quant à lui les pouvoirs étant donnés au ministre de la Santé, à savoir de "prescrire par arrêté motivé toutes les autres mesures générales et les mesures individuelles visant à lutter contre la catastrophe".
L'article 15 du projet de loi précise que "la violation des interdictions ou le manquement aux obligations" seront punis "de l’amende prévue pour les contraventions de la quatrième classe" (135 euros). "Le fait de ne pas respecter les réquisitions mentionnées à l’article 10 (restrictions de liberté, ndlr) est puni de six mois d’emprisonnement et de 10 000 euros d’amende."(source LCI, 19/03/2020).
En fait c'est le renforcement des mesures de confinement prises depuis Mardi. Les termes état d'urgence font toujours un peu peur, l'histoire est là pour nous le rappeller. La dernière fois en France en 2015 lors des attentats.L'assimilation à la privation des libertés est toujours présente.Il ne faut pas de dérives vers l'état de siége, les misescen examens arbitraires "L'état d'urgence ne peut pas être un état permanent" rappelle Bernard Cazeneuve.
Qu'est ce que l'état d'urgence sanitaire va changer ? un reforcement drastique du CONFINEMENT, qyui est plus que nécessaire ++++
Le Parisien @le_Parisien 21/03/2020 : Le non-respect «répété» du #confinement sera puni plus sévèrement : ➡ Première violation : 135 euros d'amende ➡ Si récidive dans les 15 jours, 1 500 euros ➡ En cas de non-respect «à plus de 4 reprises» : 6 mois de prison et 3 750 euros
-
Fast Track 17 : COVID-19
 " Le mot « crise » en Chinois est représenté par deux idéogrammes qui signifient danger et opportunité. Il y a toujours dans une crise la possibilité de changer, de s'ouvrir à autre chose, d'en comprendre les causes et d'essayer d'en tirer les conséquences. Elle peut être une prise de conscience qui nous permet de vivre autrement, tant au niveau individuel que collectif." Frédéric LENOIRRisks and burdens of incident diabetes in long COVID: a cohort study Yan Xie , Ziyad Al-Aly ,Lancet Diabetes Endocrinol; 2022 Mar 21;S2213-8587(22)00044-4. doi: 10.1016/S2213-8587(22)00044-4 ,https://pubmed.ncbi.nlm.nih.gov/35325624/
" Le mot « crise » en Chinois est représenté par deux idéogrammes qui signifient danger et opportunité. Il y a toujours dans une crise la possibilité de changer, de s'ouvrir à autre chose, d'en comprendre les causes et d'essayer d'en tirer les conséquences. Elle peut être une prise de conscience qui nous permet de vivre autrement, tant au niveau individuel que collectif." Frédéric LENOIRRisks and burdens of incident diabetes in long COVID: a cohort study Yan Xie , Ziyad Al-Aly ,Lancet Diabetes Endocrinol; 2022 Mar 21;S2213-8587(22)00044-4. doi: 10.1016/S2213-8587(22)00044-4 ,https://pubmed.ncbi.nlm.nih.gov/35325624/
Risques de diabète dans le COVID long : une étude de cohorte
Dans la phase post-aiguë de la Covid-19 il existe des risques accrus et des charges sur 12 mois de diabète incident et d'utilisation d'antihyperglycémiques chez les personnes atteintes de COVID-19 par rapport à un groupe témoin contemporain de personnes qui étaient inscrites au cours de la même période et n'avaient pas contracté le SRAS -CoV-2, et un groupe témoin historique d'une ère pré-pandémique. Les chiffres ; RR de 1·46 (IC à 95 % 1·43-1·50) et un fardeau excessif de 18·03 (IC à 95 % 16· 59-19·51) pour 1000 personnes à 12 mois
Les soins post-aigus liés à la COVID-19 doivent impliquer l'identification et la prise en charge du diabète.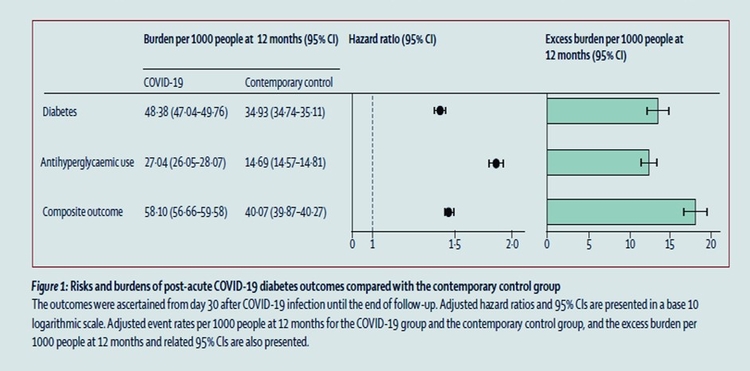
La recherche, publiée dans The Lancet Diabetes & Endocrinolog ,fait partie d'un nombre croissant d'études montrant que ae COVID-19 peut augmenter le risque de diabète d'une personne, des mois après l'infection. "Lorsque toute cette pandémie reculera, il nous restera l'héritage de cette pandémie -un héritage de maladies chroniques" pour lequel les systèmes de santé ne sont pas préparés, déclare le co-auteur de l'étude Ziyad Al-Aly, chercheur en chef pour leVeterans Aff airs (VA) St Louis Healthcare System dans le Missouri.
Proportion of newly diagnosed diabetes in COVID-19 patients: A systematic review and meta-analysis,Diabetes Obes Metab. 2021;23:870–874.https://dom-pubs.onlinelibrary.wiley.com/doi/10.1111/dom.14269
Proportion de diabète nouvellement diagnostiqué chez les patients atteints de COVID-19 : une revue systématique et une méta-analyse
Cette méta-analyse de huit études portant sur plus de 3 700 patients montre une proportion combinée de 14,4 % de diabète nouvellement diagnostiqué chez les patients hospitalisés atteints de COVID-19. Des rapports récents ont montré que le diabète nouvellement diagnostiqué peut conférer un plus grand risque de mauvais pronostic de COVID-19 que l'absence de diabète ou un diabète préexistant. Par conséquent, les patients atteints de COVID-19 avec un diabète nouvellement diagnostiqué doivent être pris en charge tôt et de manière appropriée et étroitement surveillés pour l'émergence d'un diabète à part entière et d'autres troubles cardiométaboliques à long terme. Nous voyons maintenant un exemple classique d'intersection mortelle entre une maladie transmissible et une maladie non transmissible.
Il est utile de rechercher un diabètedans la Covid-longue
One-Year Trajectory of Cognitive Changes in Older Survivors of COVID-19 in Wuhan, China A Longitudinal Cohort Study, Yu-Hui Liu et Coll,JAMA Neurol. doi:10.1001/jamaneurol.2022.0461 Published online March 8, 2022.
https://pubmed.ncbi.nlm.nih.gov/35258587/
Evolution sur un an des changements cognitifs chez les survivants âgés de la COVID-19 à Wuhan, en Chine : une étude de cohorte longitudinale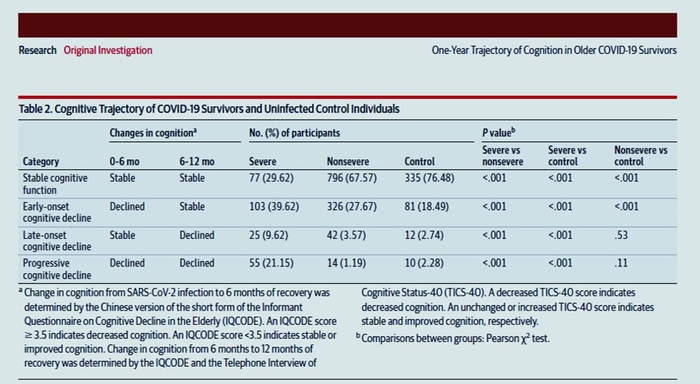
Parmi les 3233 survivants du COVID-19 et les 1317 conjoints non infectés dépistés, 1438 participants qui ont été traités pour le COVID-19 (691 hommes [48,05 %] et 747 femmes [51,95 %] ; âge médian [IQR], 69 [66-74] ans ) et 438 personnes témoins non infectées (222 hommes [50,68 %] et 216 femmes [49,32 %] ; âge médian [IQR], 67 [66-74] ans) ont terminé le suivi de 12 mois. L'incidence des troubles cognitifs chez les survivants 12 mois après la sortie était de 12,45 %. Les personnes atteintes de cas graves avaient des scores inférieurs à ceux des cas non graves et des personnes témoins à 12 mois (médiane [IQR] : graves, 22,50 [16,00-28,00] ; non graves, 30,00 [26,00-33,00] ; témoins , 31.00 [26.00-33.00]). La COVID-19 sévère était associé à un risque plus élevé de déclin cognitif précoce (rapport de cotes [OR], 4,87 ; IC à 95 %, 3,30-7,20),
Dans cette étude de cohorte, la survie au COVID-19 était associée à une augmentation du risque de déclin cognitif longitudinal, soulignant l'importance de mesures immédiates pour faire face à ce défi.
Communiqué de Presse ALZHEIMER ASSOCIATION : https://aaic.alz.org/downloads2021/COVID-19_and_Long-Term_Cognitive_Dysfunction.pdf
https://www.alz.org/?_ga=2.190817835.1868166081.1648918140-453751412.1648918140&_gl=1*1kxlj6z*_ga*NDUzNzUxNDEyLjE2NDg5MTgxNDA.*_ga_9JTEWVX24V*MTY0ODkxODEzOS4xLjEuMTY0ODkxODI1OC40MA..
En plus des symptômes respiratoires et gastro-intestinaux qui accompagnent la COVID-19, de nombreuses personnes atteintes du virus présentent des symptômes neuropsychiatriques à court et/ou à long terme, notamment une perte de l'odorat et du goût, et des déficits cognitifs et d'attention, connus sous le nom de « brouillard cérébral ». ” Pour certains, ces symptômes neurologiques persistent, et les chercheurs s'efforcent de comprendre les mécanismes par lesquels ce dysfonctionnement cérébral se produit, et ce que cela signifie pour la santé cognitive à long terme.Des responsables scientifiques, dont l'Association Alzheimer et des représentants de près de 40 pays - avec les conseils techniques de l'Organisation mondiale de la santé (OMS) - font partie d'un consortium international multidisciplinaire pour collecter et évaluer les conséquences à long terme de COVID-19 sur le système central système nerveux, ainsi que les différences entre les pays. Les premiers résultats de ce consortium présentés à l'AAIC 2021 de Grèce et d'Argentine suggèrent que les personnes âgées souffrent fréquemment de troubles cognitifs persistants, notamment d'un manque persistant d'odorat, après la guérison d'une infection par le SRAS-CoV-2.Les autres résultats clés rapportés à l'AAIC 2021 incluent :
Les marqueurs biologiques des lésions cérébrales, de la neuroinflammation et de la maladie d'Alzheimer sont fortement corrélés à la présence de symptômes neurologiques chez les patients atteints de COVID-19.
Les personnes connaissant un déclin cognitif après une infection au COVID-19 étaient plus susceptibles d'avoir un faible taux d'oxygène dans le sang après un bref effort physique ainsi qu'une mauvaise condition physique générale.
« Ces nouvelles données indiquent des tendances inquiétantes montrant que les infections au COVID-19 entraînent des troubles cognitifs durables et même des symptômes d'Alzheimer », a déclaré Heather M. Snyder, Ph.D., vice-présidente des relations médicales et scientifiques de l'Alzheimer's Association. « Avec plus de 190 millions de cas et près de 4 millions de décès dans le monde, le COVID-19 a dévasté le monde entier. Il est impératif que nous continuions à étudier ce que ce virus fait à notre corps et à notre cerveau. L'Association Alzheimer et ses partenaires sont en tête, mais davantage de recherches sont nécessaires.
Diabète, troubles cognitifs après une Covid-19 sévère, le risque existe, le rechercher précocément.Transcriptomic profiling of cardiac tissues from SARS-CoV-2 patients identifies DNA damage, Arutha Kulasinghe et Coll,medRxiv preprint doi: https://doi.org/10.1101/2022.03.24.22272732; this version posted March 31, 2022.
Le profilage transcriptomique des tissus cardiaques des patients atteints du SRAS-CoV-2 identifie les dommages à l'ADN
Mise en garde : Cet article est une préimpression et n'a pas été certifié par un examen par les pairs [qu'est-ce que cela signifie ?]. Il fait état de nouvelles recherches médicales qui n'ont pas encore été évaluées et ne devraient donc pas être utilisées pour guider la pratique clinique.Le transcriptome est l'ensemble des ARN issus de la transcription du génome. L'analyse transcriptomique peut caractériser le transcriptome d'un tissu particulier, d'un type cellulaire, ou comparer les transcriptomes entre différentes conditions expérimentales.Le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) est connu pour présenter des complications pulmonaires et extra-pulmonaires. Par rapport à la pandémie de 2009 (pH1N1), l'infection par le SRAS-CoV-2 est susceptible d'entraîner une maladie plus grave, avec des effets multi-organes, y compris les maladies cardiovasculaires. Le SRAS-CoV-2 a été associé à des maladies cardiovasculaires aiguës et à long terme, mais les changements moléculaires qui régissent cela restent inconnus.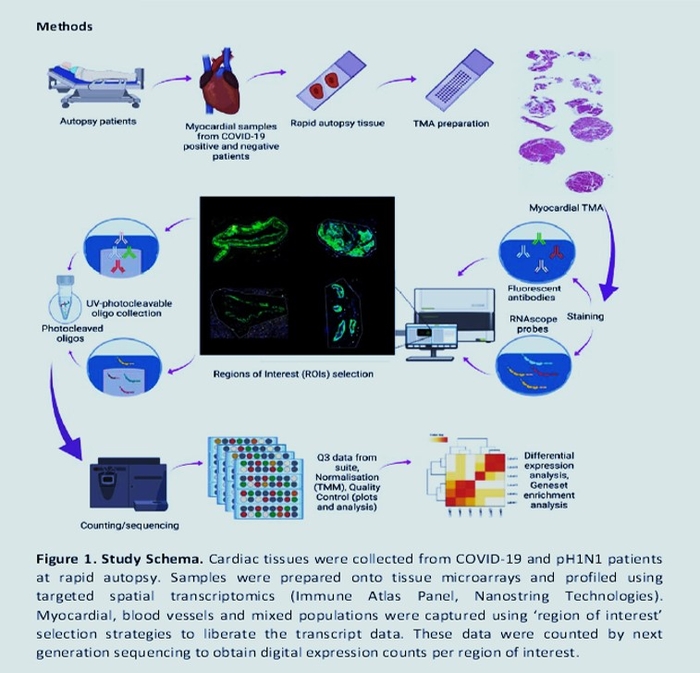 Dans cette étude, nous avons étudié le paysage des tissus cardiaques prélevés lors d'une autopsie rapide du SRAS-CoV-2, pH1N1 et des patients témoins à l'aide d'approches de transcriptomique spatiale ciblées. Bien que le SRAS-CoV-2 n'ait pas été détecté dans les tissus cardiaques, la transcriptomique de l'hôte a montré une régulation positive des gènes associés aux dommages et à la réparation de l'ADN, au choc thermique et à l'infiltration de macrophages de type M1 dans les tissus cardiaques des patients COVID-19. Les dommages à l'ADN présents dans les échantillons de patients SARS-CoV-2 ont été confirmés par immunohistochimie γ-H2Ax. En comparaison, pH1N1 a montré une régulation à la hausse des gènes stimulés par l'interféron (ISG), en particulier les voies de l'interféron et du complément, par rapport aux patients COVID-19.Ces données démontrent l'émergence de profils transcriptomiques distincts dans les tissus cardiaques de l'infection par le SRAS-CoV-2 et la grippe pH1N1, soutenant la nécessité d'une meilleure compréhension des effets sur les organes extra-pulmonaires, y compris le système cardiovasculaire des patients COVID-19, pour délimiter l'immunopathobiologie de l'infection par le SRAS-CoV-2 et l'impact à long terme sur la santé.
Dans cette étude, nous avons étudié le paysage des tissus cardiaques prélevés lors d'une autopsie rapide du SRAS-CoV-2, pH1N1 et des patients témoins à l'aide d'approches de transcriptomique spatiale ciblées. Bien que le SRAS-CoV-2 n'ait pas été détecté dans les tissus cardiaques, la transcriptomique de l'hôte a montré une régulation positive des gènes associés aux dommages et à la réparation de l'ADN, au choc thermique et à l'infiltration de macrophages de type M1 dans les tissus cardiaques des patients COVID-19. Les dommages à l'ADN présents dans les échantillons de patients SARS-CoV-2 ont été confirmés par immunohistochimie γ-H2Ax. En comparaison, pH1N1 a montré une régulation à la hausse des gènes stimulés par l'interféron (ISG), en particulier les voies de l'interféron et du complément, par rapport aux patients COVID-19.Ces données démontrent l'émergence de profils transcriptomiques distincts dans les tissus cardiaques de l'infection par le SRAS-CoV-2 et la grippe pH1N1, soutenant la nécessité d'une meilleure compréhension des effets sur les organes extra-pulmonaires, y compris le système cardiovasculaire des patients COVID-19, pour délimiter l'immunopathobiologie de l'infection par le SRAS-CoV-2 et l'impact à long terme sur la santé.
La Covid-19 au coeur de l'ADN , sommes devenus des êtres génétiquement modifiés ?
The ongoing enigma of SARS-CoV- 2 and platelet interaction,Zaid Y, Guessous F, Res Pract Thromb Haemost. 2022;6:e12642.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8787413/
L'énigme persistante du SRAS‐CoV‐2 et de l'interaction plaquettaire
Alors que la pandémie continue de faire des ravages à travers le monde, de plus en plus d'études sont menées et la compréhension de la physiopathologie du COVID‐19 évolue continuellement, éclairant davantage les mécanismes encore énigmatiques sous-jacents à l'hyperactivation plaquettaire lors de l'infection par le SRAS‐CoV2. Suite à la tempête de cytokines déclenchée par l'infection virale, la réactivité des plaquettes peut être une étape critique de la réponse inflammatoire et prothrombotique, appelée immunothrombose.La façon dont l'interaction SARS‐CoV‐2-plaquettes se produit est encore obscure, et donc plus d'études sont justifiées pour découvrir de tels mécanismes, en tenant compte de l'ethnicité et en se concentrant sur l'expression de récepteurs d'entrée alternatifs potentiels du SARS‐CoV‐2 ou de voies autres que le récepteur ACE2 précédemment établi et la sérine protéase d'amorçage de pointe TMPRSS2.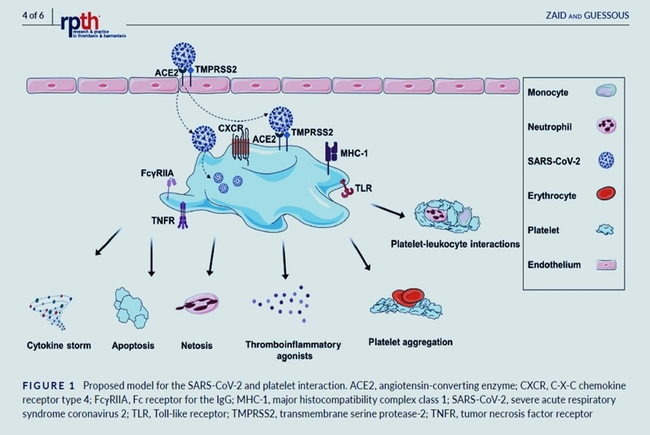 Outre l'efficacité inégale du système de santé dans différents pays, la compilation de données cliniques dans le monde a démontré un fardeau inégal de cette maladie parmi certaines populations, exhortant ainsi la communauté de recherche à explorer une expression différentielle probable basée sur la population des récepteurs clés du SRAS-CoV-2 sur le surface des plaquettes et/ou d'autres cellules immunitaires.De plus, les mégacaryocytes étant les précurseurs plaquettaires et considérés comme le cargo transportant toutes les molécules et facteurs nécessaires au fonctionnement des plaquettes avant leur mise en circulation, toutes les études futures devraient explorer l'interaction SARS‐CoV‐2 et plaquettes sans perdre de vue les différences de comportement. entre ces deux entités interdépendantes.
Outre l'efficacité inégale du système de santé dans différents pays, la compilation de données cliniques dans le monde a démontré un fardeau inégal de cette maladie parmi certaines populations, exhortant ainsi la communauté de recherche à explorer une expression différentielle probable basée sur la population des récepteurs clés du SRAS-CoV-2 sur le surface des plaquettes et/ou d'autres cellules immunitaires.De plus, les mégacaryocytes étant les précurseurs plaquettaires et considérés comme le cargo transportant toutes les molécules et facteurs nécessaires au fonctionnement des plaquettes avant leur mise en circulation, toutes les études futures devraient explorer l'interaction SARS‐CoV‐2 et plaquettes sans perdre de vue les différences de comportement. entre ces deux entités interdépendantes.
SRAS-CoV-2, une énigme de plus
Le COVID-19 peut-il altérer votre personnalité ? Voici ce que montrent les recherches sur le cerveau. La maladie d'Alzheimer, la maladie de Parkinson et les lésions cérébrales traumatiques peuvent entraîner des changements de comportement en modifiant l'anatomie du cerveau. Maintenant, il semble que le coronavirus le puisse aussi.
https://www.nationalgeographic.com/science/article/can-covid-19-alter-your-personality-heres-what-brain-research-shows
Maintenant, près de deux ans après le début de la pandémie, il est devenu clair que les problèmes neurologiques du COVID-19 peuvent persister ou s'intensifier. Après s'être remis du virus, un nombre alarmant de patients restent enveloppés dans un brouillard cérébral, souffrant d'anxiété ou de dépression, incapables de penser correctement ou de s'accrocher à des souvenirs, et tâtonnant pour trouver des mots. Tous n'avaient pas été hospitalisés; certains n'avaient que des infections bénignes.
Une étude prospective des résultats à long terme chez les patients hospitalisés COVID-19 avec et sans complications neurologiques, Jennifer A. Frontera et Coll Journal of the Neurological Sciences 426 (2021) 117486, https://www.jns-journal.com/article/S0022-510X(21)00180-5/fulltext#%20
Cette étude portant sur 395 personnes hospitalisées avec COVID-19 a révélé que 91% avaient des problèmes cognitifs, de la fatigue, de la dépression, de l'anxiété, des problèmes de sommeil ou avaient du mal à effectuer des activités de routine six mois après leur retour à la maison.
Des troubles cognitifs sont survenus chez 50 % des patients atteints de COVID-19 et 47 % n'ont pas pu reprendre le travail à 6 mois.
Les patients présentant des complications neurologiques avaient des résultats fonctionnels significativement moins bons et étaient moins susceptibles de retourner au travail.
Even Mild COVID-19 May Change the Brain, Jennifer Abbasi, JAMA 2022, March 23,
https://jamanetwork.com/journals/jama/fullarticle/2790595#:~:text=A%20large%20study%20comparing%20brain,of%20even%20mild%20COVID%2D19.
et SARS-CoV-2 is associated with changes in brain structure in UK Biobank,Gwenaëlle *Douaud et Coll, SARS-CoV-2 is associated with changes in brain structure in UK Biobank. Nature (2022). https://doi.org/10.1038/s41586-022-04569-5
Une vaste étude comparant les scintigraphies cérébrales des mêmes individus avant et après l'infection par le SRAS-CoV-2 suggère que les changements cérébraux pourraient être un résultat persistant d'un COVID-19 même léger. Écrivant dans Nature , des chercheurs du Wellcome Center for Integrative Neuroimaging de l'Université d'Oxford ont rapporté que plusieurs mois après que les participants à l'étude ont eu des infections par le SRAS-CoV-2, ils avaient plus de perte de matière grise et d'anomalies tissulaires, principalement dans les zones du cerveau associées à l'odorat, et plus de rétrécissement de la taille du cerveau que les participants qui n'avaient pas été infectés par le virus.
Dans leur article, l'équipe de Douaud* a proposé plusieurs mécanismes potentiels par lesquels l'infection par le SRAS-CoV-2 pourrait modifier directement ou indirectement la structure cérébrale, notamment-
entrée sensorielle réduite liée à la perte d'odorat
-
neuroinflammation ou réactions immunitaires
-
infection virale directe des cellules du cerveau
D'autre part, dans une FAQ écrite fournie aux médias, Douaud a suggéré que les dommages observés dans l'étude de son équipe pourraient s'améliorer en temps voulu : « Étant donné que les changements anormaux que nous voyons dans le cerveau des participants infectés pourraient être liés à leur perte de odorat, il est possible que la récupération de leur odorat fasse en sorte que ces anomalies cérébrales s'atténuent avec le temps. De même, il est probable que les effets nocifs du virus (qu'ils soient directs ou indirects via l'inflammation ou la réaction immunitaire) diminuent avec le temps après l'infection. Elle a cité de petites études antérieures indiquant que les problèmes détectés sur l'imagerie cérébrale fonctionnelle peuvent en partie s'améliorer plus de 6 mois après l'infection par le SRAS-CoV-2.L'essentiel pour l'instant, selon Josephson : « S'assurer que nous sommes vigilants et attentifs aux préoccupations cognitives des patients après la COVID reste extrêmement important."
Le "BROUILLARD CEREBRAL" post covid-19 , une REALITE ! Les atteintes cognitives post Covid-19 existe, ne pas mes sous estimer -
-
FAST Track Biblio 19 : AIT,RCV, Glifozine, THM
 « Je sais que je ne sais rien » Socrate, dans l’Apologie de Socrate et le Ménon de Platon (IVe s. av. J.-C.)
« Je sais que je ne sais rien » Socrate, dans l’Apologie de Socrate et le Ménon de Platon (IVe s. av. J.-C.)
« Ose savoir ! » Emmanuel Kant
ARTICLE 1 Incidence of Ischemic Stroke in Patients With Asymptomatic Severe Carotid Stenosis Without Surgical Intervention RobertW. Chang, et Coll, JAMA May 24/31, 2022 Volume 327, Number 20
https://www.acc.org/Latest-in-Cardiology/Journal-Scans/2022/05/26/14/11/Incidence-of-Ischemic-Stroke
Incidence AVC ischémique en cas de l sténose carotidienne sévère asymptomatique
Contexte- Il existe une incertitude quant à la supériorité de la prise en charge médicale ou de l'intervention chirurgicale (endartériectomie carotidienne ou stenting carotidien) en cas de sténose carotidienne asymptomatique sévère (70-99%).
- Cette incertitude est due en partie à l'amélioration de la thérapie médicale moderne, qui peut être associée à un taux plus faible d'accidents vasculaires cérébraux ischémiques liés à une maladie carotidienne par rapport aux données d'études plus anciennes.
- Les chercheurs de cette étude rétrospective ont cherché à définir le risque d'accident vasculaire cérébral ischémique parmi une cohorte plus contemporaine de patients atteints de sténose carotidienne asymptomatique sévère identifiée entre 2008 et 2012.
- Parmi 3 737 patients avec ≥ 1 carotide asymptomatique sévèrement sténosée, le risque annuel d'AVC ischémique ipsilatéral était faible, à environ 1 %.
Questions d'étude :
Quel est le risque à long terme d'AVC ischémique ipsilatéral chez les patients présentant une sténose carotidienne asymptomatique sévère ?
Méthodes :
Les patients inclus dans cette analyse rétrospective présentaient une sténose de 70 à 99 % de ≥ 1 artère carotide identifiée entre 2008 et 2012 et n'avaient aucun antécédent d'accident ischémique transitoire (AIT)/AVC au cours des 6 mois précédents. Si un patient avait une sténose sévère asymptomatique bilatérale, chaque artère était évaluée indépendamment. Le critère de jugement principal était l'AVC ischémique aigu ipsilatéral à la carotide sévèrement sténosée.
Résultats:
Un total de 4 230 artères présentant une sténose sévère asymptomatique chez 3 737 patients ont été incluses dans l'analyse finale : 133 (3,1 %) AVC ischémiques carotidiens sont survenus chez 129 (3,5 %) patients sur une moyenne de 4,1 années de suivi. Le taux annuel d'AVC ipsilatéral était de 0,9 % (intervalle de confiance à 95 %, 0,7-1,2 %).
Conclusion :
Dans cette étude rétrospective de patients présentant une sténose carotidienne asymptomatique sévèrement sténosée sans intervention chirurgicale, le risque annuel d'AVC ipsilatéral était d'environ 1 %.
Perspective:
Il n'est pas certain que la prise en charge médicale ou l'intervention chirurgicale (endartériectomie carotidienne ou stenting carotidien) soit supérieure chez les patients présentant une sténose carotidienne asymptomatique sévère.
Dans cette étude rétrospective, le risque annuel d'AVC lié à la carotide chez ces patients n'était que d'environ 1 %. Compte tenu de ce faible risque annuel, le taux de complications d'une intervention chirurgicale pour une maladie asymptomatique devrait être extrêmement faible pour fournir un profil risque-bénéfice favorable. L'essai multicentrique CREST-2 en cours de recrutement (NCT02089217), dans lequel les patients atteints de sténose carotidienne sévère asymptomatique sont randomisés pour recevoir un traitement médical plutôt qu'une intervention, aidera à clarifier la meilleure approche pour ces patients.
ARTICLE 2 : Preclinical atherosclerosis and cardiovascular events: Do we have a consensus about the role of preclinical atherosclerosis in the prediction of cardiovascular events?Poredos B et Coll, Atherosclerosis, Volume 348, May 2022, Pages 25-35Athérosclérose préclinique et événements cardiovasculaires : Existe-t-il un consensus sur le rôle de l'athérosclérose préclinique dans la prédiction des événements cardiovasculaires?
Points forts
- • Les facteurs de risque traditionnels des maladies cardiovasculaires (CV) renseignent sur la probabilité de développer une athérosclérose et les événements CV associés.
- • La détection de l'athérosclérose préclinique permet d'identifier les personnes atteintes d'athérosclérose en cours.
- • L'athérosclérose préclinique peut être identifiée par une détérioration fonctionnelle/morphologique de la paroi artérielle ou par des biomarqueurs circulants.
- • La valeur prédictive des indicateurs d'athérosclérose préclinique pour les événements CV futurs n'est pas complètement élucidée.
- • L'indice cheville-bras, le score calcique et les plaques asymptomatiques peuvent améliorer la stratification du risque d'événements CV au-delà des facteurs de risque traditionnels.
Résumé
L'athérosclérose a une longue phase préclinique et le risque d'événements cardiovasculaires (CV) peut être élevé chez les sujets asymptomatiques. Les facteurs de risque conventionnels fournissent des informations sur la probabilité statistique de développer des événements CV, mais ils manquent de précision chez les sujets asymptomatiques. Cette revue vise à résumer le rôle de certains indicateurs largement diffusés de l'athérosclérose précoce dans la prédiction des événements CV.
Le premier indicateur mesurable du processus athéroscléreux est le dysfonctionnement endothélial, mesuré par la dilatation médiée par le flux (FMD) de l'artère brachiale. Cependant, une réduction de la fièvre aphteuse est un meilleur prédicteur d'événements CV futurs chez les patients atteints d'une maladie CV existante que chez les personnes apparemment en bonne santé.
Alternativement, la mesure de l'épaisseur intima-média de l'artère carotide n'améliore pas la valeur prédictive des scores des facteurs de risque, tandis que la détection de plaques athérosclérotiques asymptomatiques dans les artères carotides ou fémorales communes par échographie indique un risque CV élevé.
Le score clacique est une aide robuste et validée dans l'estimation des changements vasculaires et du risque, ce qui peut améliorer la stratification du risque au-delà des facteurs de risque traditionnels avec une exposition aux rayonnements relativement faible.
La rigidité artérielle de l'aorte, mesurée par la vitesse de l'onde de pouls carotido-fémorale, est un marqueur indépendant du risque CV au niveau de la population, mais elle n'est pas recommandée comme procédure de routine en raison des difficultés de mesure.
Un faible indice cheville-bras (IPS) indique une athérosclérose limitant le débit dans les membres inférieurs et indique un risque CV élevé, tandis qu'un ICB normal n'exclut pas une athérosclérose asymptomatique avancée.
De nouveaux biomarqueurs circulants sont associés au processus athéroscléreux. Cependant, en raison d'une spécificité limitée, leur capacité à améliorer la classification des risques reste actuellement faible.
Résumé graphique
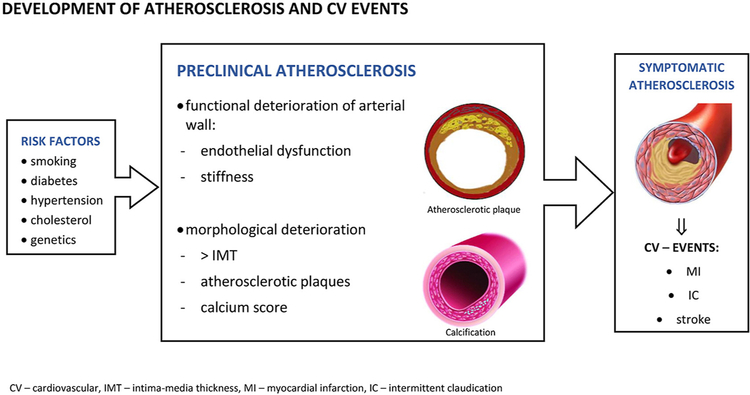 Article 3 : Gliflozins in the Management of Cardiovascular Disease,Braunwald E, NEJM 20221;386:2024-2034
Article 3 : Gliflozins in the Management of Cardiovascular Disease,Braunwald E, NEJM 20221;386:2024-2034SYNTHESE
En 2022, pour les patients atteints de diabète de type 2 et d'une maladie cardiovasculaire artérioscléreuse établie, de facteurs de risque multiples ou d'une maladie rénale diabétique, l'American Diabetes Association a recommandé un traitement avec un inhibiteur du SGLT2, un agoniste du récepteur du peptide 1 de type glucagon, ou les deux pour réduire le risque d'un événement cardiovasculaire indésirable majeur. Les lignes directrices 2021 de la Société européenne de cardiologie et les lignes directrices 2022 de l'American Heart Association pour le traitement de l'insuffisance cardiaque ont formulé des recommandations similaires.La FDA a approuvé l'empagliflozine pour réduire le risque de décès cardiovasculaire et d'hospitalisation pour insuffisance cardiaque chez les adultes souffrant d'insuffisance cardiaque, quelle que soit la fraction d'éjection. L'approbation de la dapagliflozine par la FDA était similaire mais était limitée (au moment d'écrire ces lignes) aux patients avec une fraction d'éjection réduite. La canagliflozine a été approuvée pour réduire le risque d'événements cardiovasculaires indésirables majeurs chez les adultes atteints de diabète de type 2 et d'une maladie cardiovasculaire établie. Un examen détaillé a identifié les inhibiteurs du SGLT2 comme traitement précoce de première intention chez les patients souffrant d'insuffisance cardiaque nouvellement diagnostiquée et d'une fraction d'éjection réduite. La dapagliflozine et la canagliflozine ont également été approuvées par la FDA pour réduire le risque d'insuffisance rénale terminale.
The Kidney–Heart Connection for Organ Protection by SGLT2Inhibitors.
NHE3 denotes sodium–hydrogen exchanger 3. Modified from Tuttle et al.39ARTICLE 4 : The effect of hormone replacement therapy on the survival of UK women: a retrospective cohort study 1984−2017,Akter N et Coll, BJOG 2022;129:994-1003
L'effet de l'hormonothérapie substitutive sur la survie des femmes britanniques : une étude de cohorte rétrospective de 1984 à 2017
Objectif
Estimer l'effet des œstrogènes seuls et de l'hormonothérapie substitutive (HTS) combinée sur les risques de mortalité globale et par âge, toutes causes confondues, chez les femmes en bonne santé âgées de 46 à 65 ans lors de la première prescription.
Conception
Étude de cohorte appariée.Paramètre
Dossiers électroniques de soins primaires de la base de données The Health Improvement Network (THIN), Royaume-Uni (1984-2017).Population
105 199 utilisatrices de THS (cas) et 224 643 non utilisatrices (témoins) appariées sur l'âge et la pratique générale.Méthodes
Modèles de régression de Weibull-Double-Cox ajustés pour l'âge au premier traitement, la cohorte de naissance, le diabète de type 2, l'hypertension et le traitement de l'hypertension, la maladie coronarienne, l'ovariectomie, l'hystérectomie, l'indice de masse corporelle, le tabagisme et le statut de privation.Principaux critères de jugement
Mortalité toutes causes confondues.
Résultats
Au total, 21 751 femmes sont décédées sur une moyenne de 13,5 ans de suivi par participante, dont 6 329 utilisatrices et 15 422 non-utilisatrices. Le rapport de risque (HR) ajusté de la mortalité globale toutes causes confondues chez les utilisatrices de THS combinés était de 0,91 (IC à 95 % 0,88-0,94) et chez les utilisatrices d'œstrogènes seuls était de 0,99 (0,93-1,07), par rapport aux non-utilisatrices. Les RR ajustés selon l'âge pour les participants âgés de 46 à 50, 51 à 55, 56 à 60 et 61 à 65 ans au premier traitement étaient de 0,98 (0,92 à 1,04), 0,87 (0,82 à 0,92), 0,88 (0,82 à 0,93) et 0,92 (0,85-0,98) pour les utilisatrices combinées de THS par rapport aux non-utilisatrices, et 1,01 (0,84-1,21), 1,03 (0,89-1,18), 0,98 (0,86-1,12) et 0,93 (0,81-1,07) pour les utilisatrices d'œstrogènes seuls, respectivement .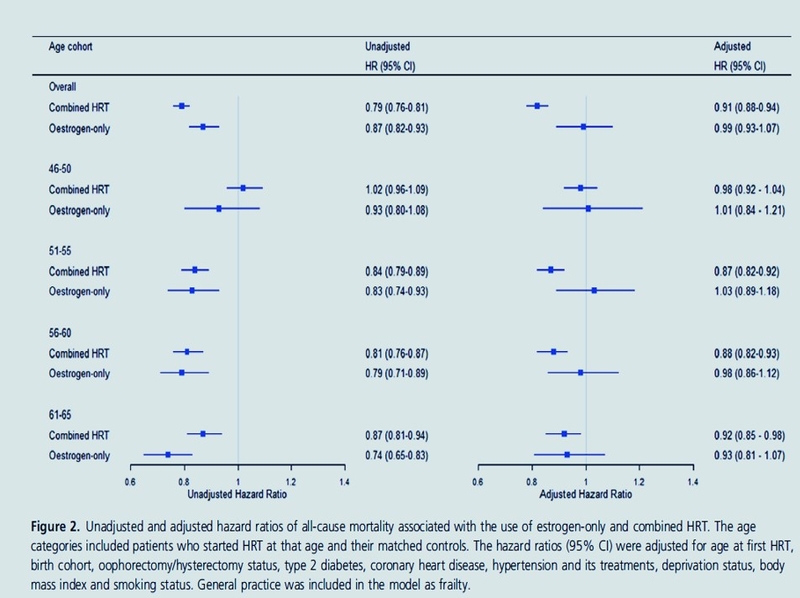
Conclusion
Le THS combiné était associé à un risque inférieur de 9 % de mortalité toutes causes confondues et la formulation à base d'œstrogène seul n'était associée à aucun changement significatif.
Le THS aux œstrogènes seuls n'est pas associé à la mortalité toutes causes confondues et le THS combiné réduit les risques.
MAIS attention aux femmes à risque artériel MAIS attention aux femmes à risque veineux (dias Dr J Hugon-Rodin et Pr G Plu Bureaux, Hôpital Cochin Paris)
MAIS attention aux femmes à risque veineux (dias Dr J Hugon-Rodin et Pr G Plu Bureaux, Hôpital Cochin Paris)

 Aprs l’arrêt d’un THM, il est necessaire de maintenir un suivi medical specifique comprenant entre autres un suivi gynécologique annuel mais aussi la réalisation des examens dedépistage des différents cancers gynécologiques (en particulier pour le cancer du sein) en fonction des facteurs de risque individuels de chaque patiente (avis d’expert).
Aprs l’arrêt d’un THM, il est necessaire de maintenir un suivi medical specifique comprenant entre autres un suivi gynécologique annuel mais aussi la réalisation des examens dedépistage des différents cancers gynécologiques (en particulier pour le cancer du sein) en fonction des facteurs de risque individuels de chaque patiente (avis d’expert).
file:///E:/Downloads/1-s2.0-S2468718921000696-main.pdf -
HBPM et Covid : toujours des incertitudes
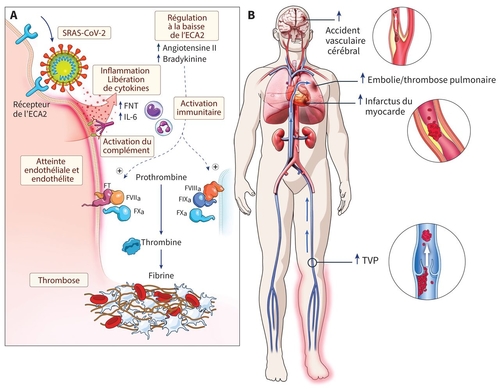 iconographie : https://www.cmaj.ca/content/192/50/E1816
iconographie : https://www.cmaj.ca/content/192/50/E1816
" L'ignorant affirme, le savant doute, le sage réfléchit. " Aristote
"Le tout dans l'audace c'est de savoir jusqu'où aller trop loin."Jean Cocteau
"Apprenez à apprécier ce que vous avez avant que le temps vous oblige à apprécier ce que vous aviez. » Morgan Freeman
Deux articles récents publiés dans le NEJM abordent de nouveau la question de la dose d' anticoagulant en prévention de la maladie thrombo- embolique veineuse (MTEV) au décours de la Covid-19.
"Parmi les 75 essais cliniques enregistrés de différentes stratégies antithrombotiques avec différents agents chez des patients atteints de Covid-19, une majorité ont impliqué l'utilisation d'héparine ou d'HBPM. L'essai INSPIRATION, qui comparait des doses intermédiaires d'HBPM à une prophylaxie à dose standard chez 562 patients traités dans une unité de soins intensifs, n'a montré aucune différence entre les groupes dans le critère de jugement principal (un composite de MTEV aiguë, thrombose artérielle, traitement par oxygénation extracorporelle par membrane ou mort) mais plus de saignements dans le groupe à dose intermédiaire. Dans un article de prépublication, les auteurs ont rapporté les résultats de l'essai RAPID, qui a évalué l'héparine thérapeutique par rapport à l'héparine prophylactique ou à l'HBPM chez 465 patients qui n'étaient pas gravement malades. Dans cet essai, il n'y avait pas non plus de différence entre les groupes dans le critère de jugement principal (un composite d'admission en soins intensifs, de ventilation mécanique non invasive ou invasive ou de décès), mais le groupe d'anticoagulation thérapeutique avait une incidence plus faible de décès à 28 jours."
"Les articles publiés das le NEJM rapportent les résultats d'un essai clinique international, multiplateforme et randomisé qui a combiné les données de patients qui ont été inscrits dans un essai randomisé conventionnel (ACTIV-4a) et dans deux essais qui ont utilisé la randomisation adaptative de la réponse (REMAP-CAP et ATTACC).L'essai REMAP-CAP a été réaliseé aux Royaume-Uni, les patients atteints d'une maladie modérée ont été recrutés principalement dans les essais ATTACC et ACTIV-4a aux États-Unis et au Brésil, mais aussi en Australie, Nouvelle Zélande, , Asie,Canada, en France......un mixe artificiel et hétérogène avec des "habitudes thérapeutiques " très différentes, des spécialités tout aussi différentes et trés peu de spécialistes de la thrombose.
La lecture des "supplementary" est édifiante à ce sujet.(https://www.nejm.org/doi/suppl/10.1056/NEJMoa2105911/suppl_file/nejmoa2105911_appendix.pdf
Le premier article se concentre sur les patients atteints d'une maladie grave et l'autre sur ceux atteints d'une maladie modérée, tous les deux en réanimation. Dans les deux articles, les bénéfices et risques potentiels de l'héparine à dose thérapeutique ou de l'HBPM (cette dernière étant utilisée chez > 90 % des patients des deux groupes) sont évalués par rapport à la thromboprophylaxie standard.
https://www-nejm-org.proxy.insermbiblio.inist.fr/doi/full/10.1056/NEJMe2111151Article 1 : Therapeutic Anticoagulation with Heparin in Noncritically Ill Patients with Covid-19 The ATTACC, ACTIV-4a, and REMAP-CAP Investigators*,N Engl J Med 2021;385:790-802.,Article 1.Contexte : La thrombose et l'inflammation peuvent contribuer au risque de décès et de complications chez les patients atteints de la maladie à coronavirus 2019 (Covid-19). Nous avons émis l'hypothèse que l'anticoagulation à dose thérapeutique pourrait améliorer les résultats chez les patients non gravement malades hospitalisés avec Covid-19.
MÉTHODES
Dans cet essai contrôlé ouvert, adaptatif, multiplateforme, nous avons assigné au hasard des patients hospitalisés pour Covid-19 et qui n'étaient pas gravement malades (ce qui était défini comme une absence de soutien des organes au niveau des soins intensifs au moment de l'inscription) pour recevoir de manière pragmatique des schémas thérapeutiques définis d'anticoagulation à dose thérapeutique avec de l'héparine ou de thromboprophylaxie pharmacologique en soins habituels. Le critère de jugement principal était le nombre de jours sans soutien d'organes, évalué sur une échelle ordinale qui combinait la mort à l'hôpital (une valeur de −1) et le nombre de jours sans soutien d'organes cardiovasculaires ou respiratoires jusqu'au jour 21 chez les patients ayant survécu à sortie de l'hôpital. Ce résultat a été évalué à l'aide d'un modèle statistique bayésien pour tous les patients et selon le niveau de d- dimère de base .
RÉSULTATS
L'essai a été arrêté lorsque les critères prédéfinis de supériorité de l'anticoagulation à dose thérapeutique étaient remplis. Parmi les 2 219 patients de l'analyse finale, la probabilité que l'anticoagulation à dose thérapeutique augmente le nombre de jours sans soutien organique par rapport à la thromboprophylaxie en soins habituels était de 98,6 % (rapport de cotes ajusté, 1,27 ; intervalle de crédibilité à 95 %, 1,03 à 1,58). La différence absolue ajustée de survie entre les groupes jusqu'à la sortie de l'hôpital sans soutien organique en faveur d'une anticoagulation à dose thérapeutique était de 4,0 points de pourcentage (intervalle de crédibilité à 95 %, 0,5 à 7,2). La probabilité finale de la supériorité de l'anticoagulation à dose thérapeutique par rapport à la thromboprophylaxie habituelle était de 97,3 % dans la cohorte des d- dimères élevés, de 92,9 % dans la cohorte des d- dimères faibles et de 97,3 % dans la cohorte inconnue.cohorte d- dimères. Des saignements majeurs sont survenus chez 1,9 % des patients recevant une anticoagulation à dose thérapeutique et chez 0,9 % de ceux recevant une thromboprophylaxie.
CONCLUSION
Chez les patients non gravement malades atteints de Covid-19, une stratégie initiale d'anticoagulation à dose thérapeutique avec de l'héparine ou HBPM a augmenté la probabilité de survie à la sortie de l'hôpital avec une utilisation réduite de l'assistance des organes cardiovasculaires ou respiratoires par rapport à la thromboprophylaxie habituelle.
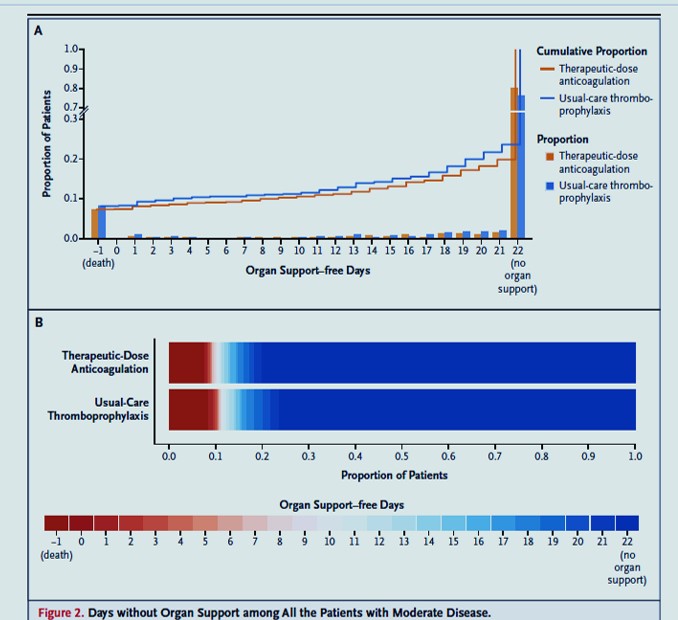 Jours sans soutien d'organes chez tous les patients atteints d'une maladie modérée.
Jours sans soutien d'organes chez tous les patients atteints d'une maladie modérée.
Le panneau A montre la distribution des jours sans soutien d'organes parmi tous les patients atteints d'une maladie modérée. L'échelle ordinale comprend un score de –1 (décès à l'hôpital, le pire résultat possible), un score de 0 à 21 (le nombre de jours de vie sans soutien d'organe) et un score de 22 (survie jusqu'à la sortie de l'hôpital sans reçu de soutien d'organe, le meilleur résultat possible). La différence de hauteur des deux courbes en tout point représente la différence de probabilité cumulée d'avoir une valeur pour les jours sans support d'organe inférieure ou égale à ce point sur l'axe des x. Le panneau B montre le nombre de jours sans soutien d'organe sous forme de proportions empilées horizontalement de patients dans les deux groupes de traitement, avec les résultats possibles suivants : décès à l'hôpital avec ou sans réception d'un soutien d'organe (rouge foncé, le pire résultat possible, correspondant à un score de -1 sur l'échelle ordinale) ; survie avec soutien d'organe fourni dans une unité de soins intensifs (USI) (gradient de couleur rouge à bleu basé sur le nombre de jours de vie sans soutien d'organe ; résultat intermédiaire, correspondant à un score de 0 à 21 sur l'échelle ordinale) ; et la survie jusqu'à la sortie de l'hôpital sans soutien d'organe au niveau de l'USI (bleu foncé, le meilleur résultat possible, correspondant à un score de 22 sur l'échelle ordinale).
DISCUSSIONChez les patients non gravement malades hospitalisés avec Covid-19, l'anticoagulation à dose thérapeutique avec de l'héparine (le plus souvent, de l'héparine de bas poids moléculaire) a augmenté la probabilité de survie jusqu'à la sortie de l'hôpital avec un besoin réduit de soutien des organes au niveau des soins intensifs à 21 jours par rapport avec une thromboprophylaxie habituelle. L'anticoagulation à dose thérapeutique a été bénéfique quelle que soit la ligne de base du patient d-niveau de dimère. Les saignements majeurs sont survenus plus fréquemment dans le groupe anticoagulant (1,9 % contre 0,9 %). Sur la base de ces résultats, pour 1000 patients hospitalisés atteints d'une maladie modérée, une stratégie initiale d'anticoagulation à dose thérapeutique, par rapport à la thromboprophylaxie habituelle, devrait permettre la survie de 40 patients supplémentaires jusqu'à la sortie de l'hôpital sans organe. prise en charge au détriment de 7 événements hémorragiques majeurs supplémentaires. Les avantages absolus du traitement étaient plus apparents dans la cohorte à d- dimères élevés que dans la cohorte à d- dimères faibles . Les patients de la cohorte à d- dimères élevés étaient généralement plus âgés et présentaient une prévalence plus élevée de maladies coexistantes que ceux de la cohorte à d- dimères faibles
Article 2 : Therapeutic Anticoagulation with Heparin in Critically Ill
Patients with Covid-19 The REMAP-CAP, ACTIV-4a, and ATTACC Investigators* Article 2CONTEXTE
La thrombose et l'inflammation peuvent contribuer à la morbidité et à la mortalité chez les patients atteints de la maladie à coronavirus 2019 (Covid-19). Nous avons émis l'hypothèse que l'anticoagulation à dose thérapeutique améliorerait les résultats chez les patients gravement malades atteints de Covid-19.
MÉTHODES
Dans un essai clinique ouvert, adaptatif, multiplateforme et randomisé, des patients gravement malades atteints de Covid-19 sévère ont été assignés au hasard à un schéma pragmatique défini d'anticoagulation à dose thérapeutique avec de l'héparine ou de thromboprophylaxie pharmacologique conformément aux soins habituels locaux. Le critère de jugement principal était le nombre de jours sans soutien d'organes, évalué sur une échelle ordinale qui combinait la mort à l'hôpital (une valeur de −1) et le nombre de jours sans soutien d'organes cardiovasculaires ou respiratoires jusqu'au jour 21 chez les patients ayant survécu à sortie de l'hôpital.
RÉSULTATS
L'essai a été arrêté lorsque le critère prédéfini de futilité était rempli pour l'anticoagulation à dose thérapeutique. Les données sur le critère de jugement principal étaient disponibles pour 1098 patients (534 affectés à l'anticoagulation à dose thérapeutique et 564 affectés à la thromboprophylaxie habituelle). La valeur médiane des jours sans soutien d'organe était de 1 (intervalle interquartile, -1 à 16) parmi les patients assignés à l'anticoagulation à dose thérapeutique et était de 4 (intervalle interquartile, -1 à 16) parmi les patients assignés à la thromboprophylaxie habituelle. (rapport de cotes proportionnel ajusté, 0,83 ; intervalle de crédibilité à 95 %, 0,67 à 1,03 ; probabilité postérieure de futilité [définie comme un rapport de cotes < 1,2], 99,9 %). Le pourcentage de patients ayant survécu à la sortie de l'hôpital était similaire dans les deux groupes (62,7 % et 64,5 %, respectivement ; rapport de cotes ajusté, 0,84 ; intervalle de crédibilité à 95 %, 0. 64 à 1.11). Une hémorragie majeure est survenue chez 3,8% des patients assignés à une anticoagulation à dose thérapeutique et chez 2,3% de ceux assignés à une thromboprophylaxie pharmacologique habituelle.
CONCLUSION
Chez les patients gravement malades atteints de Covid-19, une stratégie initiale d'anticoagulation à dose thérapeutique avec de l'héparine n'a pas entraîné une plus grande probabilité de survie à la sortie de l'hôpital ou un plus grand nombre de jours sans assistance cardiovasculaire ou respiratoire que les soins pharmacologiques habituels. thromboprophylaxie. (Numéros REMAP-CAP, ACTIV-4a et ATTACC ClinicalTrials.gov, NCT02735707.
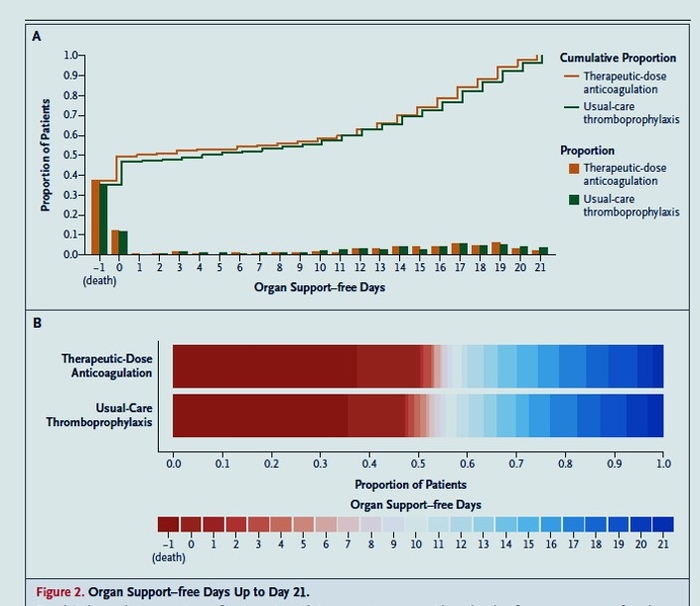 Jours sans soutien d'organes jusqu'au jour 21.
Jours sans soutien d'organes jusqu'au jour 21.
Le panneau A montre les proportions de patients dans chaque groupe d'intervention avec chaque valeur pour les jours sans soutien d'organe, le décès étant indiqué en premier sur l'axe des x (−1). Les courbes qui montent plus lentement indiquent une distribution plus favorable du nombre de jours vivants et sans support d'organes. La hauteur de chaque courbe à -1 indique la mortalité hospitalière associée à chaque intervention. La hauteur de chaque courbe à n'importe quel point de 0 à 21 jours indique la proportion de patients avec ce nombre de jours sans soutien d'organe ou moins (par exemple, à 10 jours, la courbe indique la proportion de patients avec ≤10 jours sans soutien d'organe jours). La différence de hauteur entre les deux courbes en tout point représente la différence de probabilité cumulée d'avoir un nombre de jours sans soutien d'organe inférieur ou égal à ce nombre sur l'axe des x. Le panneau B montre les valeurs des jours sans soutien d'organes sous forme de proportions empilées horizontalement pour chaque groupe d'intervention. Le rouge représente les pires résultats et le bleu les meilleurs résultats. L'odds ratio médian ajusté dans l'analyse principale était de 0,83 (intervalle de crédibilité à 95 %, 0,67 à 1,03 ; probabilité postérieure de futilité, 99,9 %). Parmi les patients de REMAP-CAP, 12 patients assignés à recevoir une anticoagulation à dose thérapeutique et 19 patients assignés à recevoir une thromboprophylaxie pharmacologique de soins habituels ont eu 21 jours sans soutien d'organes ; le soutien cardiovasculaire ou respiratoire que ces patients recevaient au moment de la randomisation a été interrompu dans les 12 heures suivant la randomisation. L'odds ratio médian ajusté dans l'analyse principale était de 0,83 (intervalle de crédibilité à 95 %, 0,67 à 1,03 ; probabilité postérieure de futilité, 99,9 %). Parmi les patients de REMAP-CAP, 12 patients assignés à recevoir une anticoagulation à dose thérapeutique et 19 patients assignés à recevoir une thromboprophylaxie pharmacologique de soins habituels ont eu 21 jours sans soutien d'organes ; le soutien cardiovasculaire ou respiratoire que ces patients recevaient au moment de la randomisation a été interrompu dans les 12 heures suivant la randomisation. L'odds ratio médian ajusté dans l'analyse principale était de 0,83 (intervalle de crédibilité à 95 %, 0,67 à 1,03 ; probabilité postérieure de futilité, 99,9 %). Parmi les patients de REMAP-CAP, 12 patients assignés à recevoir une anticoagulation à dose thérapeutique et 19 patients assignés à recevoir une thromboprophylaxie pharmacologique de soins habituels ont eu 21 jours sans soutien d'organes ; le soutien cardiovasculaire ou respiratoire que ces patients recevaient au moment de la randomisation a été interrompu dans les 12 heures suivant la randomisation. 12 patients assignés à recevoir une anticoagulation à dose thérapeutique et 19 patients assignés à recevoir une thromboprophylaxie pharmacologique en soins habituels ont eu 21 jours sans soutien d'organes ; le soutien cardiovasculaire ou respiratoire que ces patients recevaient au moment de la randomisation a été interrompu dans les 12 heures suivant la randomisation. 12 patients assignés à recevoir une anticoagulation à dose thérapeutique et 19 patients assignés à recevoir une thromboprophylaxie pharmacologique en soins habituels ont eu 21 jours sans soutien d'organes ; le soutien cardiovasculaire ou respiratoire que ces patients recevaient au moment de la randomisation a été interrompu dans les 12 heures suivant la randomisation.DISCUSSION
Dans cet essai randomisé multiplateforme impliquant plus de 1 000 patients gravement malades atteints de Covid-19 confirmé, l'anticoagulation à dose thérapeutique n'a pas augmenté la probabilité de survie à la sortie de l'hôpital ou le nombre de jours sans assistance cardiovasculaire ou respiratoire et a eu un probabilité d'être inférieure à la thromboprophylaxie pharmacologique habituelle. Il y avait une probabilité de 89 % que l'anticoagulation à dose thérapeutique conduise à une probabilité de survie à la sortie de l'hôpital plus faible que la thromboprophylaxie habituelle. Les complications hémorragiques étaient peu fréquentes dans les deux groupes d'intervention. Nos résultats réfutent l'hypothèse selon laquelle l'anticoagulation à dose thérapeutique de routine profite aux patients gravement malades atteints de Covid-19. Cette hypothèse était basée en partie sur des études d'observation qui ont rapporté une association entre l'anticoagulation à dose thérapeutique et l'amélioration des résultats. 14,20,21 De multiples essais randomisés de petite et moyenne taille continuent d'évaluer différentes stratégies d'anticoagulation dans le Covid-19
SYNTHESE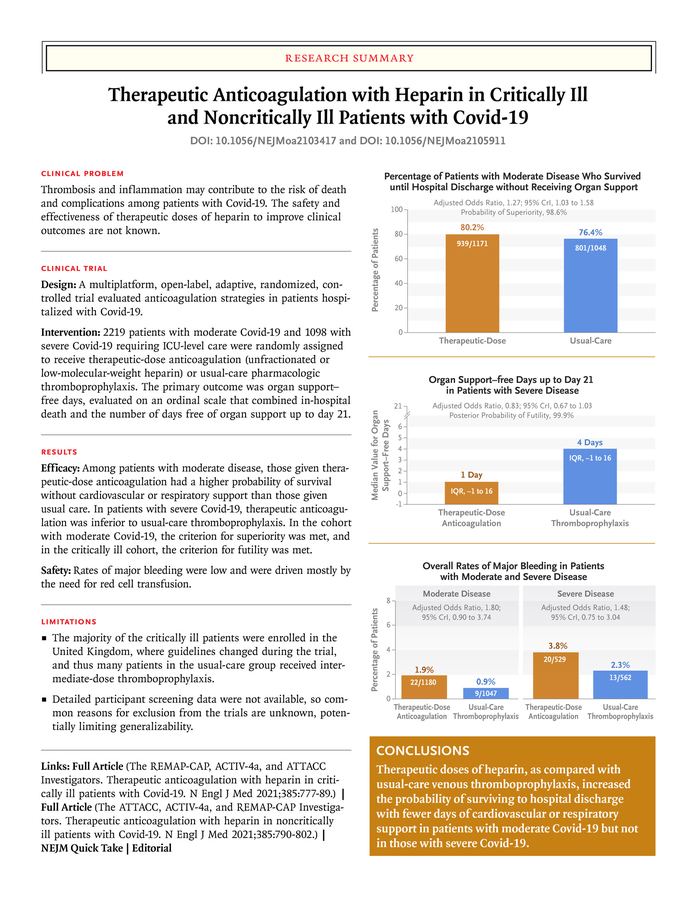
Commentaires
Ces deux études par les mêmes groupes différencient la prévention de la MTEV chez des patients en réanimation en état critique et des patients en réanimations sans soins de supports.Les patients les plus "lourds" doivent bénéficirer d'une prévention de la MTEV classique par HBPM préventive. Les autres justifieraient d'une prévention de la MTEV à dose curative. Ces deux articles rejoignent les recommandations du GIHP en Avril 2020, tout au moins en partie. De plus différentes études sur cette même thématique ne nous éclarent pas vraiement mais sont en faveur des HBPM à dose préventive dans tous les cas de figure pour la prévention de la MTEV au décours de la Covid-19
De plus différentes études sur cette même thématique ne nous éclarent pas vraiement mais sont en faveur des HBPM à dose préventive dans tous les cas de figure pour la prévention de la MTEV au décours de la Covid-19
Les principaux résultats étaient que l'héparine à dose thérapeutique ou l'HBPM n'améliorait pas le critère de jugement principal des jours sans soutien organique chez les patients gravement malades et était associée à plus de complications hémorragiques majeures que la prophylaxie habituelle (3,8 % contre 2,3 %). En revanche, chez les patients modérément malades, l'héparine à dose thérapeutique ou l'HBPM semblait augmenter la probabilité de survie jusqu'à la sortie de l'hôpital avec un besoin réduit de soutien organique.Hugo Ten Cate ; "Comment pouvons-nous concilier ces différents résultats dans différentes populations ? Un facteur peut être que chez les patients gravement malades, les dommages thrombotiques et inflammatoires sous-jacents peuvent avoir été trop avancés pour avoir été influencés par des doses plus élevées d'héparines. En cas de Covid-19 sévère, la formation de thrombus est entraînée par un orchestre de cytokines, de complément activé, de plaquettes, de cellules endothéliales et inflammatoires et de microvésicules qui fournissent une surface catalytique efficace pour les réactions de coagulation. Ces complexes liés à la surface et la thrombine liée à la fibrine sont assez résistants à l'inhibition par l'antithrombine, le cofacteur clé de l'héparine et de l'HBPM. Si nous supposons que de tels mécanismes sont légèrement moins actifs chez les patients atteints d'une maladie modérée, cela pourrait aider à expliquer le bénéfice observé de la thromboprophylaxie chez les patients non gravement malades."On peut cependant shématiser les choses ainsi :
 Il faut surtout pour la prévention à dose intermédiare ou curative mettre en place des curseurs de risque dont le risque hémorragique dans une population qui reste très hétérogène. Quand on caonnaît le risque hémorragique de la prévention "banale" de la MTEV en médecine et en chirurgie chez des patients beuacoup moins grave,
Il faut surtout pour la prévention à dose intermédiare ou curative mettre en place des curseurs de risque dont le risque hémorragique dans une population qui reste très hétérogène. Quand on caonnaît le risque hémorragique de la prévention "banale" de la MTEV en médecine et en chirurgie chez des patients beuacoup moins grave,
Curseur du choix de la dose d' HBPM en prévention de la MTEV au décours de la Covid-19
- Facteurs de co morbidités présents : cardio vasculaires, fonction rénale, diabète, plaquettes etc
- Age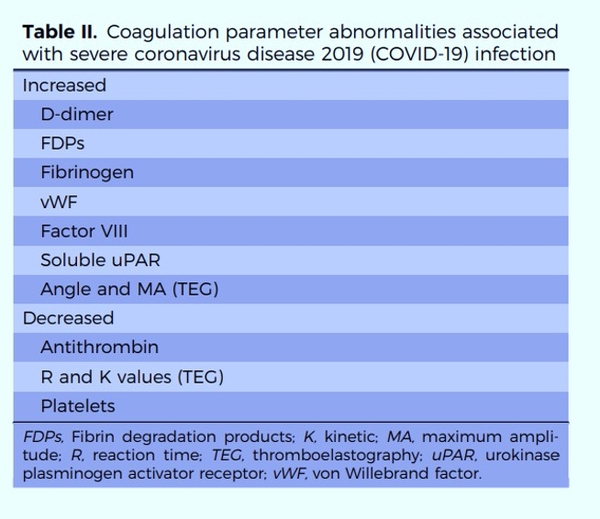 Un Bilan Hémostase complet est nécessaire pour affiner la dose de l'anticoagulation préventive, tout ne doit pas être basé sur les D Dimères. Alors que faire aujourd'hui ?
Un Bilan Hémostase complet est nécessaire pour affiner la dose de l'anticoagulation préventive, tout ne doit pas être basé sur les D Dimères. Alors que faire aujourd'hui ?
Tous les patients dès lors qu'il sont hospitalisés dans un service de médecine et ou de raanimation doivent bénéficier d'une prévention systématique de la MTEV par une HBPM ou de l'HEPARINE à dose préventive. C'est une certitude absolue. Une incertitude, celle des patients en réanimation à risque intermédiaire : HBPM intermédiaire ou curative ou préventive ? Raisonnablement et en attendant les résultats de Covi-Dose , la décision doit se faire au cas par cas en tenant compte des paramètres sus cités. Le risque hémorragique doit toujours être évalué dans ce contexte, comme le fonction rénale, l'état du patient , ses facteurs de comorbidités etc........
Conclusion de Hugo Ten Cate comme l'a conclu le regretté Ed Salzman dans les débuts de la recherche clinique sur les HBPM « une innovation prometteuse dans le traitement antithrombotique, mais le jury n'est toujours pas là......." adaptable à la question de la prévention de la MTEV au décours de la Covid-19. De plus malgré les signaux d'un bénéfice de l'anticoagulation chez les patients non gravement malades atteints de Covid-19, les médecins doivent faire face aux problèmes clés concernant le manque de compréhension des mécanismes par lesquels l'héparine ou l'HBPM protège (ou non) et la question de savoir si risque de saignement du patient individuel l'emporte sur le bénéfice
(https://www.nejm.org/doi/full/10.1056/NEJMe2111151)WAIT COVI-DOSE !#VACCINE2.0 -
ISTH : recommandations traitement antithrombotique et Covid-19
 "L’homme se transporte dans l’avenir parce qu’il n’est jamais content du présent." Edward Young
"L’homme se transporte dans l’avenir parce qu’il n’est jamais content du présent." Edward Young
"Saisissez-vous du présent, vous dépendrez moins de l’avenir." Sénèque
ISTH draft guidelines for antithrombotic treatment in COVID‐19
https://cdn.ymaws.com/www.isth.org/resource/resmgr/guidance_and_guidelines/covid19/covid-19-draft_for_comment.pdf?_zs=g0fNf1&_zl=xTVI8
Ce document est évolutif +++, donc NON DEFINITIF
Recommendations in this guideline are based on high‐ or moderate‐quality evidence available through March 2022. Future evidence supporting changes to these recommendations will be incorporated into focused updates.
Lien pour participer à l'évolution de ces recommandations ISTH non définitives
https://survey.alchemer.com/s3/6813979/ISTH-COVID-19-Public-Comment
L'ISTH invite le public à commenter le projet de lignes directrices pour le traitement antithrombotique du COVID-19
L'ISTH invite la grande communauté de la thrombose et de l'hémostase à commenter son projet de recommandations pour le traitement antithrombotique chez les patients atteints de COVID-19. Les cliniciens, les chercheurs, les professionnels paramédicaux, les décideurs, les représentants de l'industrie, les patients, les soignants et les autres membres du public sont invités à contribuer à ce processus.Les recommandations sont basées sur un examen systématique des données probantes, suivi d'une discussion structurée par un groupe d'experts composé d'experts cliniques, de méthodologistes et de représentants de patients. Le processus d'élaboration des lignes directrices respecte la méthodologie de l'American College of Cardiology Foundation/American Heart Association pour évaluer le niveau de preuve (LOE) et la classe de recommandation (COR).Tous les commentaires recueillis au cours de la période de consultation publique seront fournis au comité des lignes directrices pour examen avant la finalisation des lignes directrices. Les commentaires sur le contenu sont les bienvenus, mais les recommandations - élaborées à l'aide d'un processus structuré, d'une gestion formelle des conflits d'intérêts et d'un vote anonyme par le panel - ne peuvent pas être modifiées à ce stade. Les commentaires sont également pris en compte au cours des multiples étapes qui suivent, y compris l'examen par les pairs des lignes directrices pour la publication des revues, les efforts de mise en œuvre et de diffusion après la publication et la révision future des lignes directrices.
DRAFT MARS 2022 Antithrombotiques, COVID-19 , patients à la maison: antiplaquettes et AOD NON, SULODEXIDE probablement, non disponible en France. Pour les patients à SUR-RISQUE de MTEV une prévention de la MTEV à dose prohylactique peut être indiquée. Le mieux c'est d'évaluer soit le Score de PADOUE ou le Score IMPROVE, mais rien de systématique. On peut conseiller aussi la marche et le port de MOIBAS de classe 2
Antithrombotiques, COVID-19 , patients à la maison: antiplaquettes et AOD NON, SULODEXIDE probablement, non disponible en France. Pour les patients à SUR-RISQUE de MTEV une prévention de la MTEV à dose prohylactique peut être indiquée. Le mieux c'est d'évaluer soit le Score de PADOUE ou le Score IMPROVE, mais rien de systématique. On peut conseiller aussi la marche et le port de MOIBAS de classe 2
SULODEXIDE : https://medvasc.info/1404-fast-track-biblio-7-ftb,%20la%20mol%C3%A9cule%20%22manquante%22 : la molécule "manquante" Pour les patients hospitalisés en médecine mais " NON GRAVE" , prévention MTEV par HBPM ; dose prophylactique. Pour des patients "PLUS SEVERES" , une prévention de la MTEV par HBPM à dose curative est préférable à la dose PREVENTIVE ou INTERMEDIAIRE d'HBPM.Pou les patients "NON GRAVES" la dose intermédiare d'HBPM n'est pas recommandée, la dose prohylcatique oui +++
Pour les patients hospitalisés en médecine mais " NON GRAVE" , prévention MTEV par HBPM ; dose prophylactique. Pour des patients "PLUS SEVERES" , une prévention de la MTEV par HBPM à dose curative est préférable à la dose PREVENTIVE ou INTERMEDIAIRE d'HBPM.Pou les patients "NON GRAVES" la dose intermédiare d'HBPM n'est pas recommandée, la dose prohylcatique oui +++ La prévention de la MTEV pour les patients en réanimation seule la dose PROHYLACTIQUE d'HBPM est recommandée etnotamment pas la dose INTERMEDIAIRE.
La prévention de la MTEV pour les patients en réanimation seule la dose PROHYLACTIQUE d'HBPM est recommandée etnotamment pas la dose INTERMEDIAIRE. Au retour à domiclela prévention de la MTEV peut être envisagée par un un AOD type RIVAROXABAN 10 mg, 30 jours au cas par cas . Option à moduler à priori au cas par cas en fonction du risque de MTEV surajouté du patient
Au retour à domiclela prévention de la MTEV peut être envisagée par un un AOD type RIVAROXABAN 10 mg, 30 jours au cas par cas . Option à moduler à priori au cas par cas en fonction du risque de MTEV surajouté du patient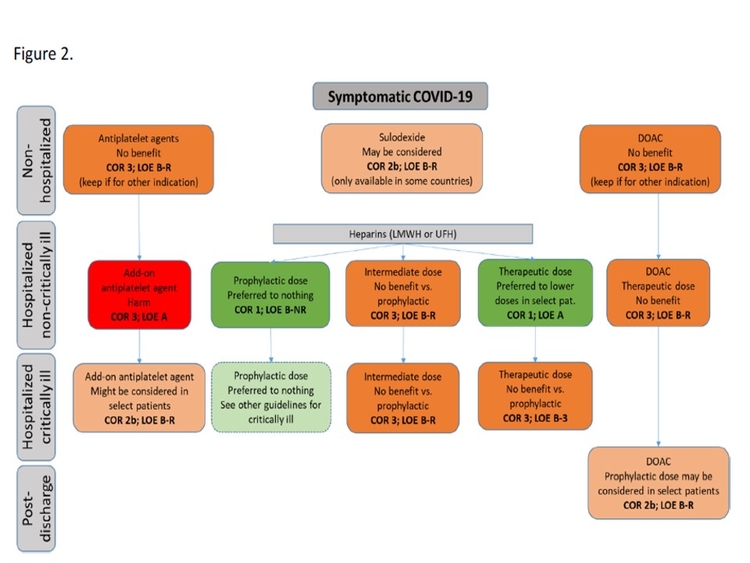
Rien n'est à ce jour gravé dans le marbre. Il reste une incertiutude sur le rôle de la DOSE INTERMEDIAIRE d'HBPM : COVI-DOSE devra être au rendez-vous
Je vous invite à lire le DRAFT et en suivre l'évolution et participer à son évolution.
-
ISTH2023 : TTT antithrombotique COVID-19
Recommandations actualisées
-
ITAC2022 : MTEV/CANCER/COVID19
 “Le meilleur de vos serviteurs est celui qui ne cherche pas à entendre de vous ce qu'il souhaite, mais à souhaiter ce qu'il a entendu.”Saint Augustin
“Le meilleur de vos serviteurs est celui qui ne cherche pas à entendre de vous ce qu'il souhaite, mais à souhaiter ce qu'il a entendu.”Saint Augustin
2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19,Dominique Farge, Corinne Frere, Jean M Connors, Alok A Khorana, Ajay Kakkar, Cihan Ay, Andres Muñoz, Benjamin Brenner, Pedro H Prata, Dialina Brilhante, Darko Antic, Patricia Casais, María Cecilia Guillermo Esposito, Takayuki Ikezoe, Syed A Abutalib, Luis A Meillon-García, Henri Bounameaux, Ingrid Pabinger, James Douketis, the International Initiative on Thrombosis and Cancer (ITAC) advisory panel,Lancet Oncol 2022; 23: e334–47, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9236567/pdf/main.pdf, article libre d'accès
Recommandations internationales de pratique clinique 2022 pour le traitement et la prophylaxie de la maladie thromboembolique veineuse (MTEV) chez les patients atteints de cancer, y compris les patients atteints de COVID-19
The International Initiative on Thrombosis and Cancer (ITAC)est un groupe de travail universitaire indépendant d'experts visant à établir un consensus mondial pour le traitement et la prophylaxie de la thrombose associée au cancer.
Les lignes recommandations de pratique clinique 2013, 2016 et 2019 d'ITAC ont été mises à disposition via une application Web gratuite pour téléphone mobile. Les recommandations de pratique clinique de 2022, qui sont basées sur une revue de la littérature jusqu'au 1er janvier 2022, comprennent des conseils pour les patients atteints de cancer et de COVID-19.
Les principales recommandations (grade 1A ou 1B) comprennent :
- (1) les héparines de bas poids moléculaire (HBPM) pour le traitement initial (10 premiers jours) et le traitement d'entretien de la thrombose associée au cancer ;
- (2) des anticoagulants oraux directs pour le traitement initial et le traitement d'entretien de la thrombose associée au cancer chez les patients qui ne sont pas à haut risque d'hémorragie gastro-intestinale ou génito-urinaire, en l'absence d'interactions médicamenteuses fortes ou de troubles de l'absorption gastro-intestinale ;
- (3) HBPM ou anticoagulants oraux directs pendant au moins 6 mois pour traiter la thrombose associée au cancer ;
(4) une prophylaxie prolongée (4 semaines) avec des HBPM pour prévenir la MTEV postopératoire après une chirurgie abdominopelvienne majeure chez les patients ne présentant pas de risque élevé de saignement ;
(5) la prophylaxie primaire de la MTEV avec des HBPM ou des anticoagulants oraux directs (rivaroxaban ou apixaban) chez les patients ambulatoires atteints d'un cancer du pancréas localement avancé ou métastatique qui sont traités par un traitement anticancéreux et ont un faible risque de saignement. en l'absence d'interactions médicamenteuses fortes ou d'altération de l'absorption gastro-intestinale ;
LES RECOMMANDATIONS dans le détail

 COVID/CANCER/MTEV
COVID/CANCER/MTEV
The CoVID-TE risk assessment model for venous thromboembolism in hospitalized patients with cancer and COVID-19, Ang Li et coll, J Thromb Haemost. 2021;19:2522–2532., accès libre : https://onlinelibrary.wiley.com/doi/10.1111/jth.15463Un score de risque de MTEV chez les patients porteurs à la fois d'un cancer et de la Covid-19 , ou comment quantifier ce sur risque
Le contexte
Les patients hospitalisés atteints de COVID-19 présentent des risques accrus de maladie thromboembolique veineuse (MTEV) et artérielle (TEA). Le diagnostic et le traitement actif du cancer sont des facteurs de risque bien connu. Cependant, un modèle d'évaluation des risques par un score pour la MTEV chez les patients atteints à la fois de cancer et de COVID-19 fait défaut.
Objectifs
Évaluer l'incidence et les facteurs de risque de thrombose chez les patients hospitalisés atteints de cancer et de COVID-19.
Méthodes
Parmi les patients atteints de cancer dans l'étude de cohorte COVID-19 et Cancer Consortium Registry (CCC19), les auteurs évalué l'incidence de la MTEV et de l'ETA dans les 90 jours suivant l'hospitalisation associée au COVID-19. Un modèle de régression logistique multivariable spécifiquement pour la MTEV a été construit en utilisant des facteurs de risque cliniques déterminés a priori. Un score simplifié a été dérivé et validé en interne à l'aide de bootstrap.
Résultats
Du 17 mars 2020 au 30 novembre 2020, 2804 patients hospitalisés ont été analysés de manière rétrospective. L'incidence de la MTEV et de l'ETA était respectivement de 7,6 % et 3,9 %. L'incidence de la MTEV, mais pas de l'ETA, était plus élevée chez les patients recevant récemment un traitement anticancéreux. Un score simplifié de MTEV a été dérivé et nommé Covid-TE ( C ancer sous - type risque élevé à très élevé par le score de Khorana, score de +1, V histoire TE 2, I admission CU 2, D -dimer altitude +1, récente anti-cancer systémique T herapy +1 et non-hispaniques E thnicity +1). Le score a stratifié les patients en deux cohortes (à faible risque, 0–2 points, n = 1423 vs. à haut risque, 3+ points, n = 1034) où la MTEV est survenue chez 4,1 % des patients à faible risque et 11,3 % des patients à haut risque (statistique c 0,67, intervalle de confiance à 95 % 0,63-0,71). le score a donné de bons résultats de manière similaire dans les sous-groupes de patients ne prenant pas d'anticoagulants avant l'admission et les patients modérément malades ne nécessitant pas d'admission directe en USI.
Rappel : Score de KHORANA (https://www.researchgate.net/figure/Khorana-score-risk-factors-predictive-model-for-chemotherapy-associated-venous_tbl1_343241456)
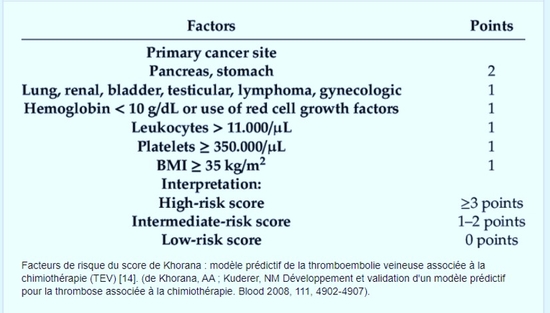
Le score CoVID-TE
Conclusion
Les patients hospitalisés atteints de cancer et de COVID-19 présentent des risques thrombotiques élevés. Le score CoVID-TE pour la prédiction de la MTEV peut aider à prendre des décisions basées sur les données en temps réel dans cette population vulnérable.
Le risque exact de MTEV chez les patients atteints de cancer et de COVID-19 est inconnu.
Les auteurs ont évalué l'incidence de la MTEV et dérivé un modèle d'évaluation des risques (RAM), ou score dans le consortium CCC19. Les patients hospitalisés atteints à la fois d'un cancer actif et de COVID-19 ont un risque élevé de MTEV (7,6%). Un score de MTEV nouvellement dérivée à l'admission (CoVID-TE) peut stratifier le risque des patients (11,3 % contre 4,1 %). Ce qui est important pour ce type de score, plus que le score lui même ce sont les items du score. L'originalité est d'avoir inclu le score de Khorana et l'orientation en réanimation à partir de la gravité des patients, le tri des patients, si important. C'est une approche intéressante mais qui ne résoud pas tout," on avance pas à pas vers la connaissance" : quelle type de prévention par HBPM et à quelle dose compte tenu de ce score ? Une analyse précise des différentes thérapies du cancer sont aussi importantes. Ce que l'on sait depuis longtemps : le cancer augmente le risque de MTEV, les traitements du cancer aussi et enfin la Covid-19 aussi. Mais est - il possible de quantifier avec précision la sommation de ces 3 risques ? Ce qui est certain c'est que dans une telle situation la prévention de la MTEV s'impose obligatoirement , mais avec encore la même question : à quelle dose ? Pour combien de temps ? Avec quelle molécule ? Les auteurs préviennent que le score CoVID-TE, après validation externe, peut servir d'outil d'aide à la décision clinique en temps réel pour aider à des décisions personnalisées sur l'initiation de la thromboprophylaxie chez les patients hospitalisés atteints de cancer et de COVID-19. Une étude de plus qui fait avancer nos connaissances dans le bon sens. Retenez les items de de ce score afin de mieux décider notamment en RCP dans ce contexte qui reste compliqué. La fonction rénale est à ne pas oublier comme les traitements associés hors cancer et l'évaluation du risque hémorragique.
La COVID-19 vient compliquer le cancer qui lui même reste très compliqué. Aussi il est très important qu'un score ait la propriété de prévenir......qu'il est possible de mieux prévenir.
Commentaire
Belle actualisation des recommandations MTEV/CANCER et Cancer /Covid-19. Ce que l'on constate c'est la prise de pouvoir des AOD , ce qui est normal compte tenu des différentes études qui ont confirmé leur action positive en cas de MTEV et Cancer. Bine entendu les contre indications que l'on connaît bien maintenant sont rappelés. Le risque hémorragique en cas de cancer gastro intestinaux en place, les interactions médicamenteuses AOD et traitemenst des cancers. Quant à l'association Cancer/Covid-19, la prévention de la MTEV est très importante. En cas de MTEV installée, le traitement anticoagulant rest classique. Si les AOD sont très présents , les HBPM gardent encore une place significative. Un bémol en cas de MTEV et Cancer, en phase aigue le reciurs aux AOD dans la vraie vie est de plus en plus fréquente.Le recours à une RCP ONCO-THROMBOSE est de plus en plus fréquente surtout pour le choix entre HBPM et AOD , de plus la durée de l'anticiagulation fait aussi le débat. C'est au cas par cas que l'on solutionne les problèmes.Je rajouterai que la Covid-19 a générer des retards de prise en charge des patients atteints de cancer très préjudiciables.
La place des AOD "low dose " sera définitivement réglée quand API-CAT sera terminée (Pr Isabelle Mahé). Pour l'instant si on prescrit un AOD, il faut le prescrire à la dose "normale" et éviter des "cuisines personnelles" . Mais là encore dans la vrie vie les AOD "low dose" en cas de MTEV et Cancer sont prescrits, peu , mais prescrits.
La VIE REELLE en avance sur les recommandations ?
Ce qui est intéressant c'est l'évolution régulière des recommandations depuis 2013, évolution attendue et nécessaire.
Il serait intressant et nécessaire que ITAC ait un compte TWEETER poour assurer une meilleure diffusion des recommandations et de ses activités ainsi qu'un compte LINKEDIN ainsi que les leaders d'ITAC, Merci !
Appli SMARTPHONE: https://www.itaccme.com/wp-content/uploads/2021/04/Fr-2019-GFTC-pocket-CPGs_CF31122019.pdf -
JAMA Hit Parade des articles 2022 COVID-19

“On oublie, dans le classement des grands événements ayant marqué le millénaire, d'inclure la vogue des classements.” Jean DionClassement qui repose sur les scores ALTMETRIC
-
L'affaire des masques
 Dans l'hitoire des masques Il y a eu le masque de fer et l'absence de masque en 2020, dans le premier cas on ne sais pas qui était derrière le masque et dans le deuxième le masque était invisible ! En 2011 il y avait en France 1 milliard de masques : NO COMMENT , je ne veux pas savoir ce qu'ils sont devenus. L'armée vient d'en découvrir 5 millions, trop fort ! La France, qui avait le meilleur systéme de santé au monde il y a quelques années doit se réveiller et c'est une urgence. Comment imaginer que le COVID-19 allait entrainer outre des attaques léthales mais révéler une pénurie inimaginable de masques de protection et de respirateurs et de lits et de tout. Insensé et inadmissible. Mais où est la réserve de masques. Les a-t-on vendu au Carnaval de Venise, aux figurants du film MASK, aux enfants pour Halloween ? Tout est possible. Voici le premier point de l'affaire des masques. Le deuxième point quand les mettre quand on a la chance d'en posséder au moins un . Le consensus est clair pour les porteurs symptomatiques, pour les porteurs suspects de COVID-19, pour les asymptomatiques qui restent indéctables la contoverse arrive. Enfin systématique pour les soignants.En effet on peut dire que tout le monde doit porter un masque car tout le monde est un asymptomatique potentiel qui s'ignore. De plus les porteurs de masques se protégent un peu des postillons de votre interlocuteur et vice versa, c'est un confinement à minima qui plus est rassure. Pour ma part masque pour toutes et tous. C'est ce que l'on a vu en Chine et c'est le cas de l'Italie et de la Corée.Mais en France on se démarque pour les masques comme pour tout. Troisiéme point quel type de masques. Les masques dits chirurgicaux de type I filtre 95% des bactéries et de type II filtre plus de 98% des bactéries. On distingue les masques de type 2 normaux et ceux de type R qui sont plus étanches et résistants aux projections. Dans le cas de l'épidémie de COVID-19, ce sont ces masques chirurgicaux qui sont réservés aux malades. Le masque de protection respiratoire (masque coque, canard, masque FFP2 ou FFP3) est un masque de sécurité avec un très haut niveau de filtration qui est utilisé en milieu de soins pour des agents infectieux comme celui de la tuberculose par exemple. Ce masque, qui pour être efficace doit avoir une forme adaptée au visage de la personne qui le porte, ne filtre plus uniquement des bactéries, mais également des aérosols. Il est réservé aux professionnels de la santé de toute la chaîne (transport sanitaire, pompiers, médecins libéraux, infirmiers...) et n'est pas à destination du grand public. (cf : https://sante.journaldesfemmes.fr). Je signe pour #1MASQUEPOURTOUS, malades et non malades. Ceci n'est pas négociable !Et il faut arrêter les plateaux TV d'experts plus ou moins experts en dehors des universitaires, pour moi le plateauTV c'est se faire une bouffe devant la TV avec un bon divertissement. Aujourd'hui ces plateaux TV c'est la majoration du panique syndrome qui existe et qui s'amplifie. Les experts en masque les plus redoutables surtout lorsqu'ils ne sont pas issus du milieu médical à éviter. Il faut 3 rdv /j TV, de 30 mn et basta cosi ! #CONFINEMENTet #RESTEZCHEZVOUS sont les deux mamelles de la #FRANCECOVID-29.....NEWS, des masques sont volés , vraiment on vit une époque formidable, le bagne aux voleurs de masques (12 000 au CHU de Montpellier il y a 48 h) !Réfléchission chers Amis, les autoriés conscientes du manque de masque , conseillent de ne pas en porter à part les exceptions précisées ci dessus. Quand on aura retrouvé les masques, fabriqués en ce moment mais la France c'est loin.... le#1MASQUEPOURTOUSsera vivement recommandé. Le 19/03/2020, j'ai vu 7 urgences vasculaires, ces 7 patients sont tous venus porteurs d'un masque et 4 avaient des gants ! (ils ne présentaient aucun signe de COVID-19), j'ai demandé pourquoi portez vous un masque ? Réponse pour moi et pour les autres, on se sent un peu protégé avec un masque...docteur vous portez un masque et pourquoi pas moi...logique NON ? . Le 21/03/2020, Olivier Veran annonce la commande de 270 millions de masques, étonnant !
Dans l'hitoire des masques Il y a eu le masque de fer et l'absence de masque en 2020, dans le premier cas on ne sais pas qui était derrière le masque et dans le deuxième le masque était invisible ! En 2011 il y avait en France 1 milliard de masques : NO COMMENT , je ne veux pas savoir ce qu'ils sont devenus. L'armée vient d'en découvrir 5 millions, trop fort ! La France, qui avait le meilleur systéme de santé au monde il y a quelques années doit se réveiller et c'est une urgence. Comment imaginer que le COVID-19 allait entrainer outre des attaques léthales mais révéler une pénurie inimaginable de masques de protection et de respirateurs et de lits et de tout. Insensé et inadmissible. Mais où est la réserve de masques. Les a-t-on vendu au Carnaval de Venise, aux figurants du film MASK, aux enfants pour Halloween ? Tout est possible. Voici le premier point de l'affaire des masques. Le deuxième point quand les mettre quand on a la chance d'en posséder au moins un . Le consensus est clair pour les porteurs symptomatiques, pour les porteurs suspects de COVID-19, pour les asymptomatiques qui restent indéctables la contoverse arrive. Enfin systématique pour les soignants.En effet on peut dire que tout le monde doit porter un masque car tout le monde est un asymptomatique potentiel qui s'ignore. De plus les porteurs de masques se protégent un peu des postillons de votre interlocuteur et vice versa, c'est un confinement à minima qui plus est rassure. Pour ma part masque pour toutes et tous. C'est ce que l'on a vu en Chine et c'est le cas de l'Italie et de la Corée.Mais en France on se démarque pour les masques comme pour tout. Troisiéme point quel type de masques. Les masques dits chirurgicaux de type I filtre 95% des bactéries et de type II filtre plus de 98% des bactéries. On distingue les masques de type 2 normaux et ceux de type R qui sont plus étanches et résistants aux projections. Dans le cas de l'épidémie de COVID-19, ce sont ces masques chirurgicaux qui sont réservés aux malades. Le masque de protection respiratoire (masque coque, canard, masque FFP2 ou FFP3) est un masque de sécurité avec un très haut niveau de filtration qui est utilisé en milieu de soins pour des agents infectieux comme celui de la tuberculose par exemple. Ce masque, qui pour être efficace doit avoir une forme adaptée au visage de la personne qui le porte, ne filtre plus uniquement des bactéries, mais également des aérosols. Il est réservé aux professionnels de la santé de toute la chaîne (transport sanitaire, pompiers, médecins libéraux, infirmiers...) et n'est pas à destination du grand public. (cf : https://sante.journaldesfemmes.fr). Je signe pour #1MASQUEPOURTOUS, malades et non malades. Ceci n'est pas négociable !Et il faut arrêter les plateaux TV d'experts plus ou moins experts en dehors des universitaires, pour moi le plateauTV c'est se faire une bouffe devant la TV avec un bon divertissement. Aujourd'hui ces plateaux TV c'est la majoration du panique syndrome qui existe et qui s'amplifie. Les experts en masque les plus redoutables surtout lorsqu'ils ne sont pas issus du milieu médical à éviter. Il faut 3 rdv /j TV, de 30 mn et basta cosi ! #CONFINEMENTet #RESTEZCHEZVOUS sont les deux mamelles de la #FRANCECOVID-29.....NEWS, des masques sont volés , vraiment on vit une époque formidable, le bagne aux voleurs de masques (12 000 au CHU de Montpellier il y a 48 h) !Réfléchission chers Amis, les autoriés conscientes du manque de masque , conseillent de ne pas en porter à part les exceptions précisées ci dessus. Quand on aura retrouvé les masques, fabriqués en ce moment mais la France c'est loin.... le#1MASQUEPOURTOUSsera vivement recommandé. Le 19/03/2020, j'ai vu 7 urgences vasculaires, ces 7 patients sont tous venus porteurs d'un masque et 4 avaient des gants ! (ils ne présentaient aucun signe de COVID-19), j'ai demandé pourquoi portez vous un masque ? Réponse pour moi et pour les autres, on se sent un peu protégé avec un masque...docteur vous portez un masque et pourquoi pas moi...logique NON ? . Le 21/03/2020, Olivier Veran annonce la commande de 270 millions de masques, étonnant !
NEWS : la loi autorise depuis le 22/03/2020 la commande masques à l'étranger, ce qui était interdit précedemment
Article écrit le 18 Mars avec des retours négatifs, aujourd'hui le 4 Avril 2020, #1MASQUEPOURTOUS a gagné, MERCIOn a beau masquer la vérité, tôt ou tard elle se dévoile.
Citation de Pierre Reverdy ; Le livre de mon bord (1948) -
La BD de la Covid Longue
 Iconographie Covid-Longue
Iconographie Covid-Longue
"Le souvenir commence avec la cicatrice.” Alain
"La médecine n'aime pas ne pas comprendre; souvent, lorsqu'elle ne comprend pas, elle renvoie la patientèle en souffrance à un «C'est dans la tête» (sous entendu, «Ce n'est rien, ça passera tout seul») aussi frustrant que violent pour des personnes dont la qualité de vie est parfois grandement altérée."Laure Dasinieres et Antoine Flahault... à propos de la Covid-longue (http://www.slate.fr/story/223440/covid-long-brouillard-mental-essoufflement-vaccination)
Cette BD a été rélalisé à partir d'un article de Cardiologie Pratique, inscrivez vous c'est gratuit.https://www.cardiologie-pratique.com/journal/article/0033153-covid-longue-en-question
Titre de l'article initilal La Covid longue en question, Covid Long ou Covid Longue , as you want!
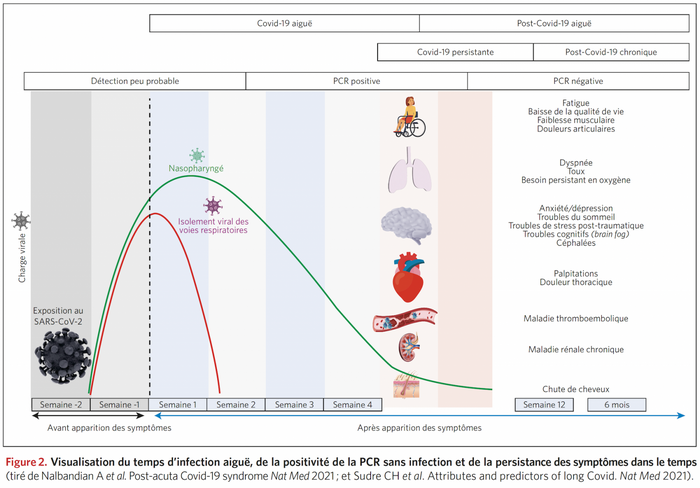
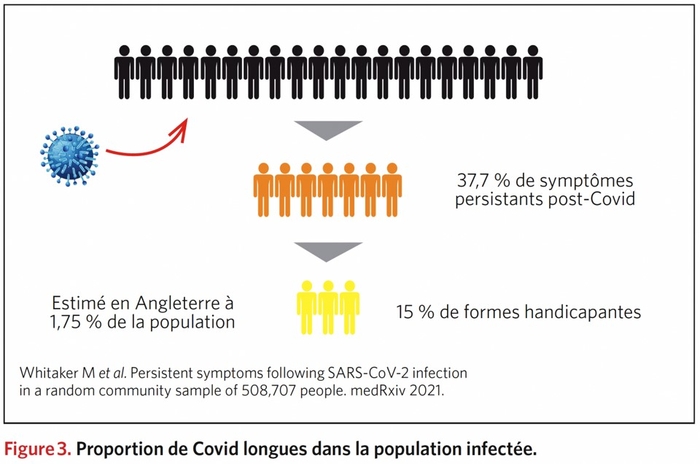
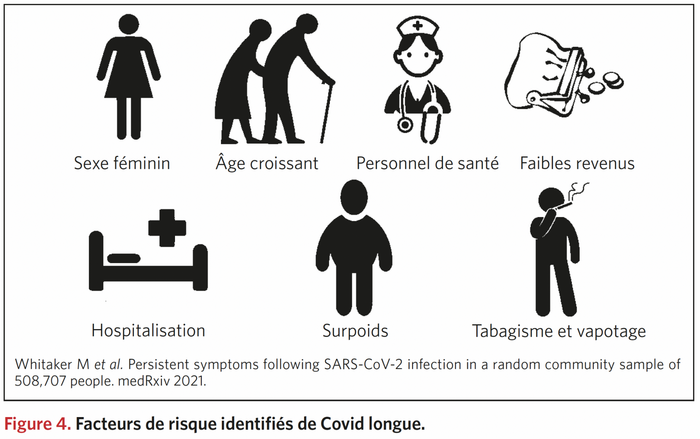
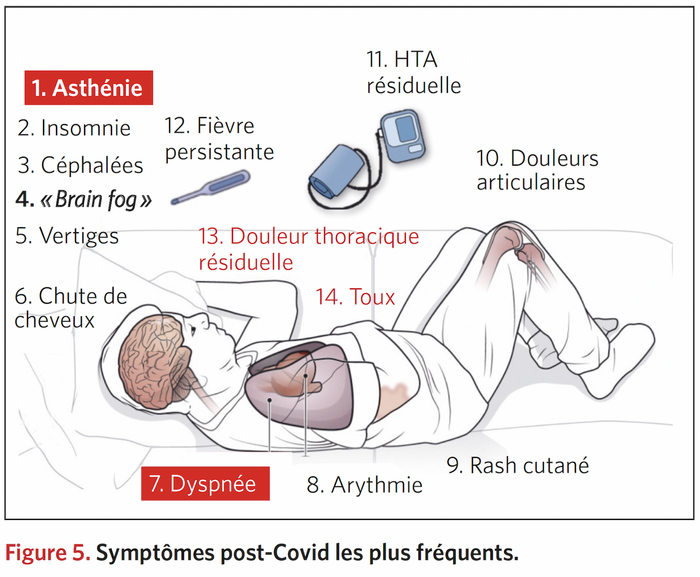
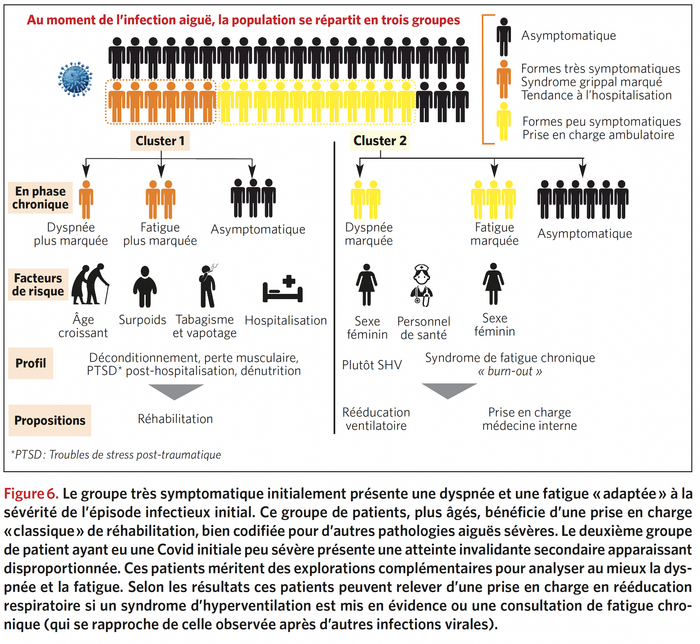
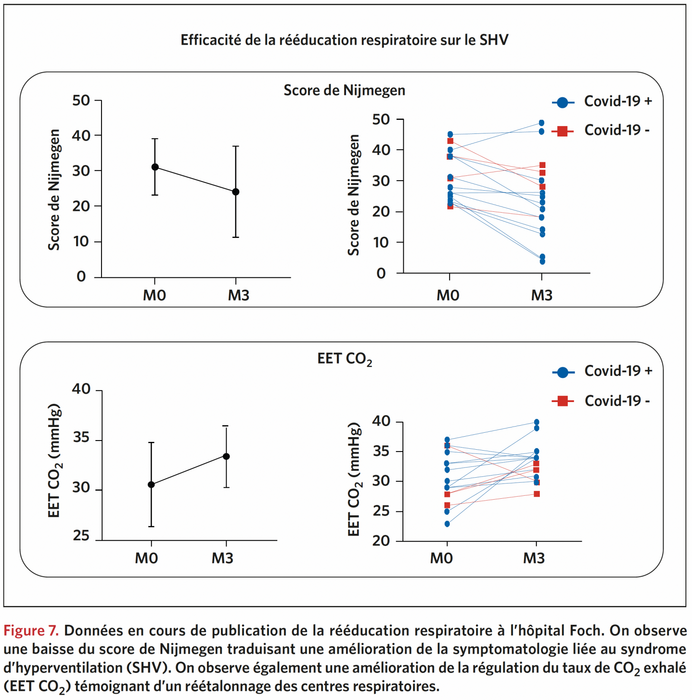
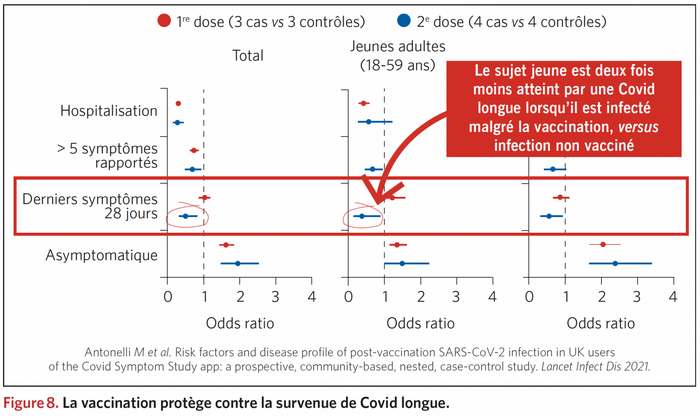

 Ce dossier ce Cardiologie Pratique est excellent, félicitations aux auteurs
Ce dossier ce Cardiologie Pratique est excellent, félicitations aux auteurs
On peut le compléter par 4 articles récents
1/ Alzheimer’s-like signaling in brains of COVID-19 patient, Reiken, S, Sittenfeld, L, Dridi, H, Liu, Y, Liu, X, Marks, AR. Alzheimer's-like signaling in brains of COVID-19 patients. Alzheimer's Dement. 2022; 1- 11. https://doi.org/10.1002/alz.12558
La neuropathologie du COVID-19 comprend des caractéristiques de type AD et les canaux RyR2 qui fuient pourraient être une cible thérapeutique pour l'amélioration de certains défauts cognitifs associés à l'infection par le SRAS-CoV-2 et au long COVID.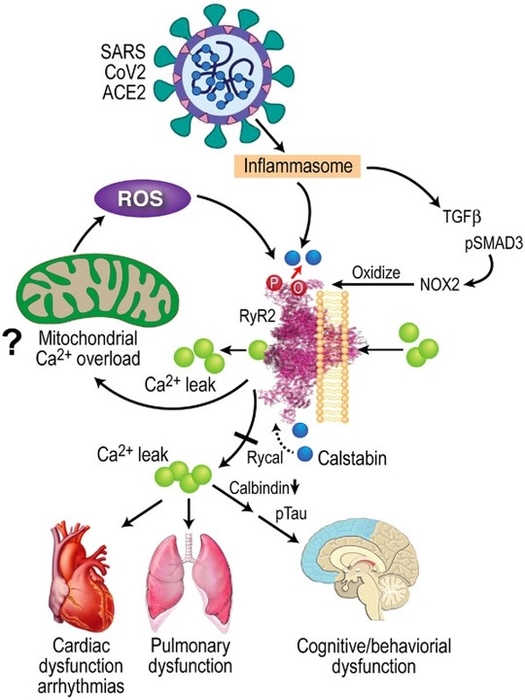
L'infection par le SRAS-CoV-2 entraîne une fuite du récepteur 2 de la ryanodine (RyR2) qui peut contribuer à un dysfonctionnement cardiaque, pulmonaire et cognitif. L'infection par le SRAS-CoV-2 cible les cellules via le récepteur de l'enzyme de conversion de l'angiotensine 2 (ACE2), induisant une réponse au stress de l'inflammasome/activation des voies de signalisation du stress. Il en résulte une augmentation de la signalisation du facteur de croissance transformant-β (TGF-β), qui active SMAD3 (pSMAD) et augmente l'expression de la NADPH oxydase 2 (NOX2) et la quantité de NOX2 associée à RyR2. L'activité accrue de NOX2 au niveau de RyR2 oxyde le canal, provoquant une déplétion en calstabine2 du complexe macromoléculaire du canal, une déstabilisation de l'état fermé et une fuite de calcium ER / SR connue pour contribuer au dysfonctionnement cardiaque, 55 arythmies, 61 insuffisance pulmonaire,et des anomalies cognitives et comportementales associées à la neurodégénérescence. La diminution de la calbindine dans le COVID-19 peut rendre le cerveau plus sensible à la pathologie tau. Les médicaments Rycal corrigent la fuite du canal RyR2 en restaurant la liaison calstabin2 et en stabilisant l'état fermé du canal. La réparation du RyR2 qui fuit peut améliorer la fonction cardiaque, pulmonaire et cognitive dans le COVID-19.2/ Long-term cardiovascular outcomes of COVID-19, Xie, Y., Xu, E., Bowe, B. et al. Long-term cardiovascular outcomes of COVID-19. Résultats cardiovasculaires à long terme de COVID-19,Nat Med (2022). https://doi.org/10.1038/s41591-022-01689-3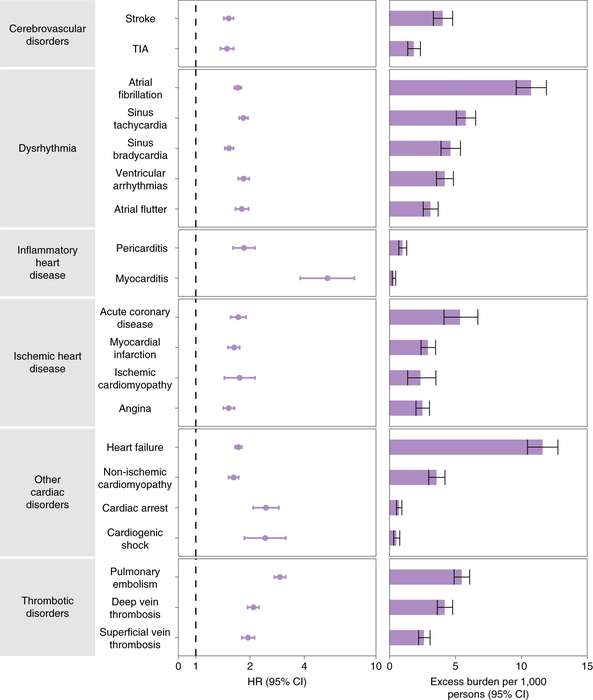
Les complications cardiovasculaires de la maladie à coronavirus aiguë 2019 (COVID-19) sont bien décrites, mais les manifestations cardiovasculaires post-aiguës du COVID-19 n'ont pas encore été caractérisées de manière exhaustive. Ici, nous avons utilisé des bases de données nationales sur les soins de santé du Département américain des anciens combattants pour constituer une cohorte de 153 760 personnes atteintes de COVID-19, ainsi que deux ensembles de cohortes témoins avec 5 637 647 (témoins contemporains) et 5 859 411 (témoins historiques) personnes, pour estimer les risques et fardeaux sur 1 an d'un ensemble de résultats cardiovasculaires incidents pré-spécifiés. Nous montrons qu'au-delà des 30 premiers jours après l'infection, les personnes atteintes de COVID-19 présentent un risque accru de maladies cardiovasculaires incidentes couvrant plusieurs catégories, notamment les troubles cérébrovasculaires, les dysrythmies, les cardiopathies ischémiques et non ischémiques, la péricardite, la myocardite, insuffisance cardiaque et maladie thromboembolique. Ces risques et fardeaux étaient évidents même chez les personnes qui n'ont pas été hospitalisées pendant la phase aiguë de l'infection et ont augmenté de façon graduelle selon le milieu de soins pendant la phase aiguë (non hospitalisé, hospitalisé et admis aux soins intensifs). Nos résultats fournissent des preuves que le risque et le fardeau sur 1 an des maladies cardiovasculaires chez les survivants de la COVID-19 aiguë sont considérables. Les parcours de soins des personnes survivant à l'épisode aigu de COVID-19 devraient inclure une attention à la santé et aux maladies cardiovasculaires. hospitalisé et admis aux soins intensifs). Nos résultats fournissent des preuves que le risque et le fardeau sur 1 an des maladies cardiovasculaires chez les survivants de la COVID-19 aiguë sont considérables. Les parcours de soins des personnes survivant à l'épisode aigu de COVID-19 devraient inclure une attention à la santé et aux maladies cardiovasculaires. hospitalisé et admis aux soins intensifs). Nos résultats fournissent des preuves que le risque et le fardeau sur 1 an des maladies cardiovasculaires chez les survivants de la COVID-19 aiguë sont considérables. Les parcours de soins des personnes survivant à l'épisode aigu de COVID-19 devraient inclure une attention à la santé et aux maladies cardiovasculaires.
3/ The Pathogenesis and Long-Term, Consequences of COVID-19 Cardiac Injury, Siripanthong B et coll, Siripanthong B et Coll, J Am Coll Cardiol Basic Trans Science . 09 février 2022 . DOI publié en ligne :10.1016/j.jacbts.2021.10.011https://www.jacc.org/doi/10.1016/j.jacbts.2021.10.011
Les mécanismes des lésions myocardiques liées à la maladie à coronavirus 2019 (COVID-19) comprennent à la fois une invasion virale directe et des lésions cellulaires indirectes (hypercoagulabilité et à médiation immunitaire). Certains patients atteints d'atteinte cardiaque liée au COVID-19 ont de mauvais résultats cliniques, les données préliminaires suggérant des changements structurels et fonctionnels à long terme. Ceux-ci comprennent une fibrose myocardique persistante, un œdème et des thrombi intraventriculaires avec des événements emboliques, tandis que fonctionnellement, le ventricule gauche est élargi, avec une fraction d'éjection réduite et des arythmies d'apparition récente signalées chez un certain nombre de patients. La myocardite post-COVID-19 est rare mais plus fréquente chez les jeunes patients de sexe masculin. Des études plus vastes, y compris des données prospectives provenant de biobanques, seront utiles pour élargir ces premiers résultats et déterminer leur validité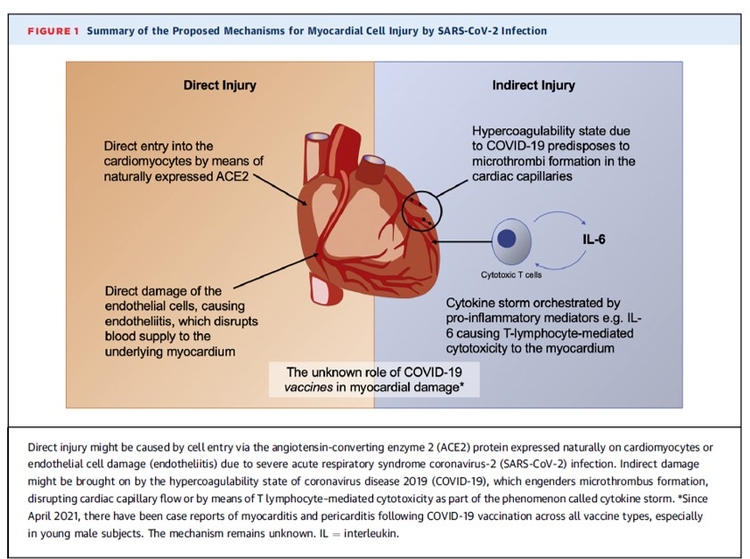
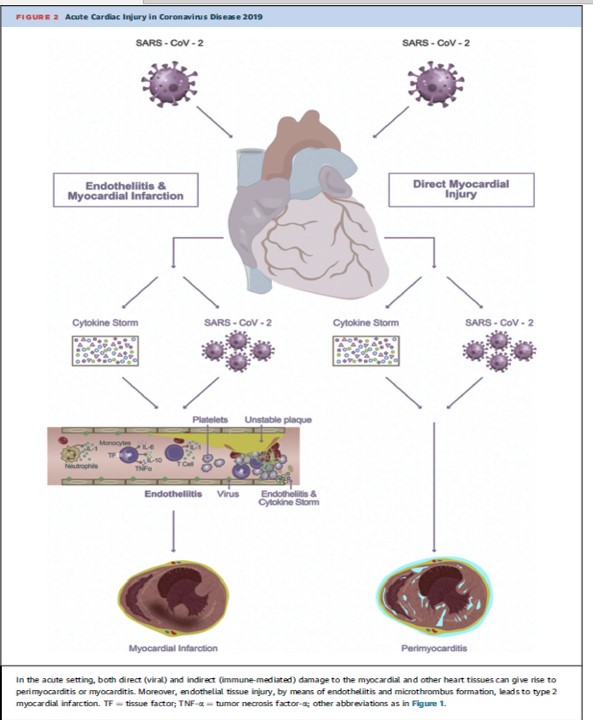
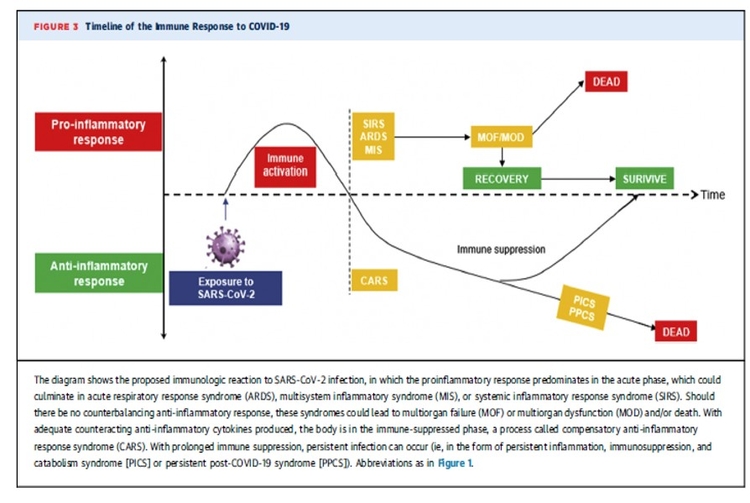
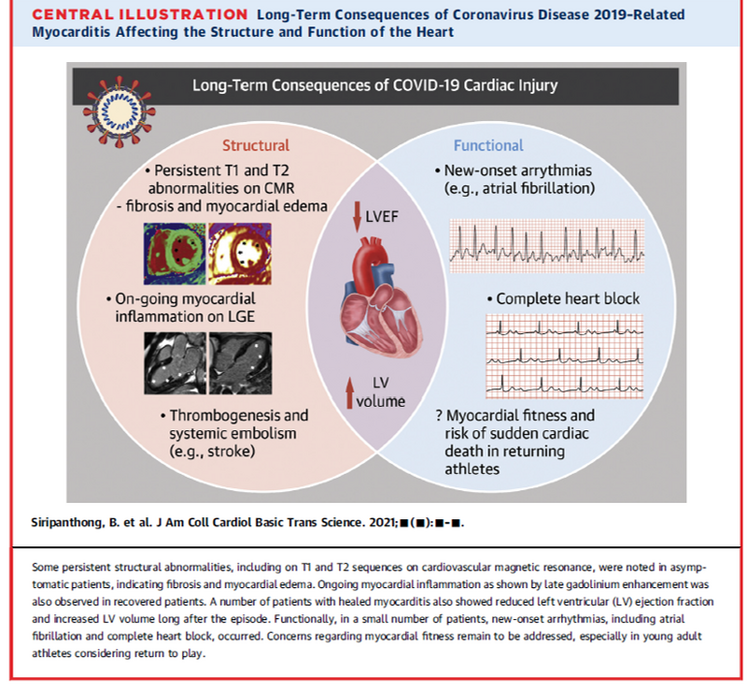 4/Long COVID symptoms in SARS-CoV-2-positive adolescents and matched controls (LongCOVIDKidsDK): a national, cross-sectional study.Selina Kikkenborg Berg, Susanne Dam Nielsen, Ulrikka Nygaard, Henning Bundgaard, Pernille Palm, Camilla Rotvig, Anne Vinggaard Christensen,Lancet Child Adolesc Health 2022Published Online February 7, 2022 https://doi.org/10.1016/ S2352-4642(22)00004-9
4/Long COVID symptoms in SARS-CoV-2-positive adolescents and matched controls (LongCOVIDKidsDK): a national, cross-sectional study.Selina Kikkenborg Berg, Susanne Dam Nielsen, Ulrikka Nygaard, Henning Bundgaard, Pernille Palm, Camilla Rotvig, Anne Vinggaard Christensen,Lancet Child Adolesc Health 2022Published Online February 7, 2022 https://doi.org/10.1016/ S2352-4642(22)00004-9
Symptômes COVID longs chez les adolescents positifs pour le SRAS-CoV-2 et les témoins appariés (LongCOVIDKidsDK) : une étude nationale et transversale
 Au début de la pandémie de COVID-19, des études sans groupes témoins ont signalé que la longue durée de COVID était très répandue. Cependant, des études récentes incluant des groupes témoins ont signalé que les symptômes étaient également très répandus chez les témoins. Les résultats de cette étude LongCOVIDKidsDK combinés aux résultats d'autres études récentes incluant un groupe témoin suggèrent que les symptômes persistants sont plus fréquents chez les adolescents après une infection par le SRAS-CoV-2 que chez les témoins. La connaissance du long COVID chez les adolescents est importante pour guider la reconnaissance clinique et la gestion de cette condition, ainsi que pour éclairer les décisions sur les stratégies vaccinales. Les résultats sur les défis psychologiques et sociaux chez les adolescents des deux groupes suggèrent que ces domaines nécessitent une attention particulière, en particulier pendant les périodes de confinement et de fermeture des écoles où les relations sociales sont restreintes.
Au début de la pandémie de COVID-19, des études sans groupes témoins ont signalé que la longue durée de COVID était très répandue. Cependant, des études récentes incluant des groupes témoins ont signalé que les symptômes étaient également très répandus chez les témoins. Les résultats de cette étude LongCOVIDKidsDK combinés aux résultats d'autres études récentes incluant un groupe témoin suggèrent que les symptômes persistants sont plus fréquents chez les adolescents après une infection par le SRAS-CoV-2 que chez les témoins. La connaissance du long COVID chez les adolescents est importante pour guider la reconnaissance clinique et la gestion de cette condition, ainsi que pour éclairer les décisions sur les stratégies vaccinales. Les résultats sur les défis psychologiques et sociaux chez les adolescents des deux groupes suggèrent que ces domaines nécessitent une attention particulière, en particulier pendant les périodes de confinement et de fermeture des écoles où les relations sociales sont restreintes.
Cette étude confirme d’une part la possibilité de persistance de symptômes au long cours chez les adolescents infectés par le SARS-CoV-2, et d’autre part, mais ce n’est pas une surprise, l’impact important de la pandémie pour la santé et la qualité de vie de tous les adolescents.
SYNTHESE , infographie "@LePoint" , COVID-LONGUE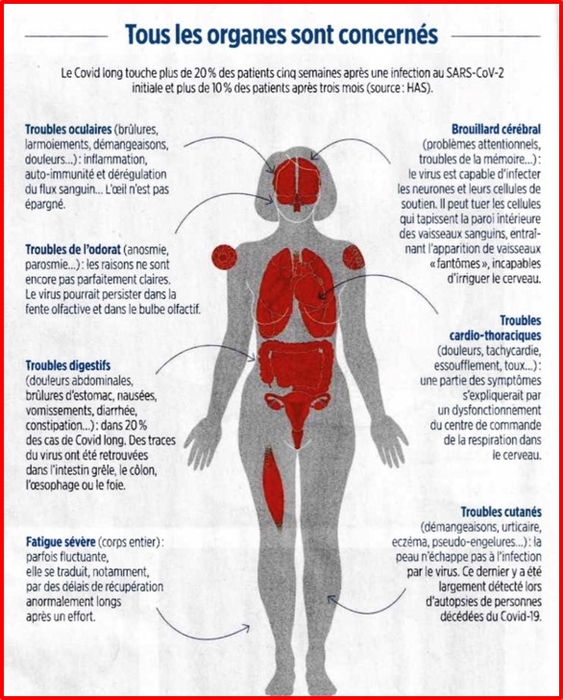
 La COVID-LONGUE est une réalité, il est nécessaire d'être à l'écoute des patients, adultes et adolescents. Elle peut durer des mois, générer des arrêts de travail, voire des reclassements professionnels poour les adultes, un stop dan sles études pour les adolescents.
La COVID-LONGUE est une réalité, il est nécessaire d'être à l'écoute des patients, adultes et adolescents. Elle peut durer des mois, générer des arrêts de travail, voire des reclassements professionnels poour les adultes, un stop dan sles études pour les adolescents.
Pour une "grippette" , c'est lourd, très lourd.
Une solution LA VACCINATION ,encore et encore !
Témoignage : Dans Libération, le philosophe Paul B. Preciado, lui-même atteint de Covid long, écrit: «Les docteures Dominique Salmon et Françoise Linard, (magnifiques et débordées) spécialistes françaises des maladies liées au Covid long, m'ont avoué l'autre jour que nombre de leurs patients atteints de Covid long ont –ou plutôt nous avons– l'impression de devenir fous. Fous par la variété et la ténacité des symptômes qui deviennent progressivement chroniques, mais aussi fous face à l'indifférence des institutions de travail et de santé qui ne reconnaissent pas la maladie et ne veulent pas la prendre en charge.»http://www.slate.fr/story/223440/covid-long-brouillard-mental-essoufflement-vaccination
Références complémentaires
https://medvasc.info/1043-covid-19-longue-de-multiples-symp%C3%B4mes,
https://www.bloomberg.com/graphics/2020-opinion-covid-long-haulers-chronic-illness/?srnd=opinion&sref=iF3fCXi9&cmpid%3D=socialflow-twitter-view&utmcontent=view&utmsource=twitter&utmmedium=social&utmcampaign=socialflow-organic
https://medvasc.info/1008-la-covid-longue
https://www.revmed.ch/RMS/2020/RMS-N-719/Covid-19-evolution-des-symptomes-chez-des-patients-ambulatoires
https://medvasc.info/1494-fast-track-13
https://medvasc.info/1187-post-covid-h%C3%A9matologique
https://www-sciencedirect-com.proxy.insermbiblio.inist.fr/science/article/pii/S0049384821001079#f0010
https://medvasc.info/1506-post-covid
#VACCINE3.0 + grippe -
Les vaccins ne doivent pas être l'apanage des pays riches
 « L'homme sait que le monde n'est pas à l'échelle humaine ; et il voudrait qu'il le fût. » André Malraux
« L'homme sait que le monde n'est pas à l'échelle humaine ; et il voudrait qu'il le fût. » André Malraux
“Tu cesseras de craindre en cessant d'espérer. La crainte et l'espoir qui paraissent inconciliables sont pourtant étroitement unies.” Sénèque
"L'écart d'inégalité suscite toute forme de révolte." Aziz Baira
Vaccines should not be the preserve of rich countriesExcellent éditorial de Fiona Godlee, rédactrice en chef du BMJ
Cite : BMJ 2021;374:n2044http://dx.doi.org/10.1136/bmj.n2044 Published: 19 August 2021
"Depuis leurs débuts au XVIIIe siècle, les vaccins ont été l'une des interventions de santé publique les plusi mportantes de l'humanité, prévenant la maladie et la mort à grande échelle, éradiquant le fléau mondial de lavariole et faisant potentiellement de même bientôt pour la polio.
Mais tandis que certaines parties du monde se réjouissent du succès de leurs programmes de vaccination contre la covid, d'autres ont du mal à prendre même le tournant.De telles inégalités flagrantes causent beaucoup de souffrances évitables, prolongent inutilement la pandémie et nous exposent tous à des variants résistants aux vaccins. Fatima Hassan et ses collègues ne doutent pas des causes de cet « apartheid vaccinal » (https://www.bmj.com/content/374/bmj.n2027)Ce n'est pas un manque de capacité de fabrication : il est possible de fabriquer suffisamment de vaccins pour le monde. Au lieu de cela, des décès et des maladies évitables par la vaccination se produisent en Afrique, en Asie et en Amérique latine à une vitesse et à une échelle sans précédent.
Et la raison ?
Un marché libre, une entreprise axée sur le profit qui repose sur la protection des brevets et de la propriété intellectuelle, combinée à un manque de volonté politique.Ainsi, alors que les pays riches accumulent un milliard de doses inutilisées, les pays plus pauvres, avec seulement 1 à 2% de leur population vaccinée,restent à la merci du virus...
La réponse est claire.
La fabrication de vaccins doit être mondialisée, les droits de propriété intellectuelle assouplis pour permettre le transfert de technologie et des centres de fabrication régionaux établis.
Plus de 100 pays ont soutenu cette approche, mais elle est bloquée par les fabricants de vaccins et les pays riches.
D'autres voix confirment la dévastation causée par cette iniquité mondiale. Des siècles d'injustice ont détourné la richesse de l'Afrique, laissant le continent sans l'infrastructure de fabrication nécessaire, (https://blogs.bmj.com/bmj/2021/08/13/the-legaciesof-colonialism-putting-african-covid-19-vaccinationinto- context).En revanche, l'Inde ne manque pas de capacités de fabrication, mais la production a été limitée aux deux fabricants de vaccins titulaires de droits de brevet, et la moitié des doses produites en Inde sont exportées ou données en aide.L'approvisionnement erratique a conduit à la confusion, à la discrimination et à la corruption (https://blogs.bmj.com/bmj/2021/08/10/covid-19-inindia-vaccine-shortages-are-leading-to-discrimination- in-access).Les pays riches ne sont pas sortis du bois. Ceux qui ont bien réussi à contrôler le virus dans la première phase de la pandémie ont de faibles niveaux d'immunité naturelle et doivent maintenant atteindre une couverture vaccinale élevée pour s'ouvrir en toute sécurité. Le déploiement lent et turbulent du vaccin en Australie a arraché la défaite aux griffes de la victoire, déclare Renza Scibilia ((https://blogs.bmj.com/bmj/2021/08/12/australiascovid-19-experience-pride-before-the-fall).
Les pays d'Asie de l'Est devront atteindre une couverture vaccinale élevée avant d'assouplir d'autres mesures, déclarent Jingyi Xiao et ses collègue
(https://blogs.bmj.com/bmj/2021/08/12/australiascovid-19-experience-pride-before-the-fall).Les vaccins sont la seule issue prévisible,disent-ils, comblant la transition de l'élimination à«l'endémicité durable». Pour le moment, les vaccins actuels semblent protéger contre le variant delta dominant réduisant le risque d'infection, de maladie grave et de décès, mais pas aussi bien que contre le type sauvage d'origine ou le variant alpha . Des données longitudinales sont nécessaires pour mainyenir l'efficacité des vaccins face à l'émergence potentielle de nouvelles variantsLes enseignements et défis de la covid seront différents pour chaque région et paysMais le monde ne sortira sain et sauf de cette pandémie que si les vaccins ne sont plus considérés comme une marchandise commerciale.Ils devraient être un bien public librement accessible."Commentaires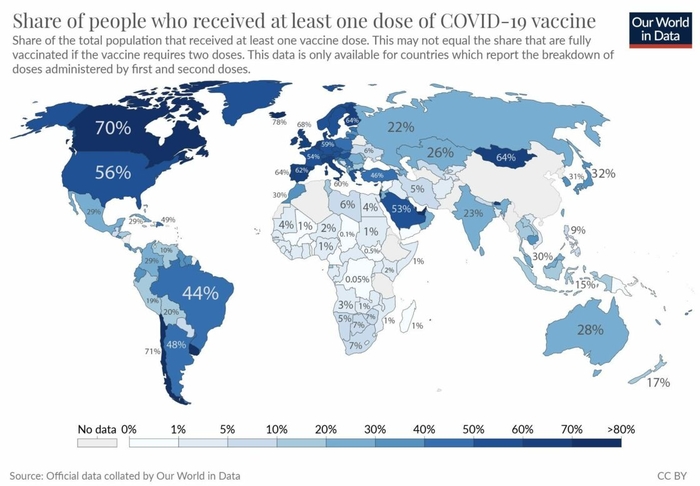
Je rappelle à ce sujet fréquemment ce que Jonas Salk a fait , il n'a jamais breveté son vaccin contre la poliomyélite afin d'en permettre une plus large diffusion. Lorsqu'un journaliste lui demande qui détenait le brevet ? Il répond : « Eh bien, au peuple je dirais. Il n’y a pas de brevet. Pourrait-on breveter le soleil ? »
La vaccination c'est du business et rien que du business,au-delà de leur efficacité médicale incontestable bien entendu, il faut en être conscient mais aussi une affaire très politique. Des pays comme la Chine , la Russie, les Emirats, l'Arabie Saoudite se servent de la vaccination pour étendre leurs pouvoirs, c'est un service rendu qui justifiera un jour d'un retour de service de la part des pays "aidés".
Les USA agissent aussi de la même manière.
Tout ceci représente "la diplomatie du vaccin". Selon le Président Xi Jinping, le vaccin chinois sera un "bien public mondial".... Ceci veut dire que la Chine partagera ses vaccins avec les pays les plus pauvres, qui ne sont pas en mesure de produire ces vaccins, mais aussi qu’elle pourrait partager la technologie de production du vaccin avec des pays qui ont une capacité de production comme le Brésil et l’Indonésie, et même certains pays de l’OCDE. C’est une approche réaliste dans la perspective d’élargir les capacités de production...et de jouer les sauveurs de la planète, restons lucides.
Mais attention si la planète n'est pas vaccinée, notamment les pays pauvres, nous ne serons jamais préservés de la Covid-19, effet boomerang assuré. Les migrations seront alors des vecteurs viraux et nous nous retrouverons au point de départ.
La version très naïve de cette histoire est évidente, vaccination gratuite pour la planète compte tenu de l'ampleur de la pandémie, morts et désastre économique...." version si tous les gas du monde".....
La version de la vraie vie est tout autre : "business is business", sans pitié et qu'avec du profit.
Qu'on le veuille ou non , soyons réalistes, le virus à accentué , la précarité, les inégalités, le vaccin fera la même chose, il participera lui aussi aux inégalités entre pays riches et pays pauvres. C'est une évidence, à moins que les pays riches dans un sursaut de générosité et de compassion réagissent enfin.......Loin d’enrichir l’ensemble de la planète, la mondialisation induit de nombreux effets pervers et provoque l’exacerbation des inégalités. Le développement de la pauvreté n’est plus concentré dans quelques poches oubliées du globe, mais devient un phénomène planétaire, la vaccination aussi. Jamais le contraste de richesse n’a été aussi importante : les revenus de 1 % de la population mondiale (moins de 50 millions de personnes) équivalent à ceux des 2,7 milliards les plus pauvres. Et en dépit de quelques effets de rattrapage en Asie orientale, particulièrement en Chine, la tendance va au creusement de ces écarts : les 20 % les plus riches de la population mondiale voient leurs revenus augmenter, alors que ceux des 50 % les plus démunis baissent en chiffres réels. Les dirigeants des grandes firmes multinationales perçoivent des rémunérations extravagantes, qui équivalent à plusieurs centaines de milliers de salaires mensuels des ouvriers non qualifiés de leurs filiales en pays pauvres.
En paraphrasant le dernier livre du regretté Axel Khan : "Et le Bien dans tout ça ?".......à vous de réfléchir et de répondre. Pour moi, l'universalité du vaccin anti Covid-19 doit être la règle, son accessibilité pour tous et au moindre coût , voir au coût ZERO.Utopique ? Non, projet ambitieux ? Cette vaccination est un test grandeur réelle de ce que pourrait être la solidarité et l'entraide mondiale par un effet salutaire de la pandémie.. Cette solution faciliterait un ré-équilibrage des inégalités, puis leur affaissement et enfin une remise à niveau des nations.
Attention si rien ne se passe, si rien ne bouge on va vers un "business vaccinal criminel". Il faut dire les choses.........telles qu'elles sont, n'est-il pas ?
Suivez Fiona sur Twitter @fgodleeCette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser. SOURCEhttps://www.bmj.com/content/374/bmj.n2044
https://medvasc.info/1137-vaccination-et-in%C3%A9galit%C3%A9#VACCINE2.0 -
MTEV et COVID-19 : une réalité affirmée
 iconographie : Réalités Biomédicales
iconographie : Réalités Biomédicales
“La science est du savoir organisé.”Herber Spencer
Clinical and Genetic Risk Factors for Acute Incident Venous Thromboembolism in Ambulatory Patients With COVID-19 JunQing Xie, BSMed, MSc1; Albert Prats-Uribe, DPhil1; Qi Feng, PhD2; YunHe Wang, MSc2; Dipender Gill, MD, PhD3,4,5; Roger Paredes, MD, PhD6; Dani Prieto-Alhambra, MD, PhD1 JAMA Intern Med. Published online August 18, 2022. doi:10.1001/jamainternmed.2022.3858
Facteurs de risque cliniques et génétiques de thromboembolie veineuse incidente aiguë chez les patients ambulatoires atteints de COVID-19
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2795466
Article libre d'accésRésumé
Le risque de thromboembolie veineuse (MTEV) dans la COVID -19 ambulatoire est controversé. De plus, l'association de la vaccination avec la MTEV liée à la COVID-19 et les facteurs de risque cliniques et génétiques pertinents restent à élucider.Objectif
Quantifier l'association entre la COVID-19 ambulatoire et le risque à court terme de MTEV, étudier le rôle protecteur potentiel de la vaccination et étudier les facteurs de risque cliniques et génétiques de la MTEV post-COVID-19.Conception
Cette étude de cohorte basée sur la population de patients atteints de COVID-19 de UK Biobank comprenait des participants atteints d'une infection par le SRAS-CoV-2 qui a été confirmée par un résultat positif de réaction au test en chaîne de la polymérase entre le 1er mars 2020 et le 3 septembre , 2021, qui ont ensuite été appariés au score de propension à des personnes naïves au COVID-19 au cours de la même période. Les participants ayant des antécédents de MTEV qui ont utilisé des médicaments antithrombotiques (1 an avant les dates index) ou qui ont été testés positifs à l'hôpital ont été exclus.Expositions
Première infection par le SRAS-CoV-2, âge, sexe, origine ethnique, statut socio-économique, obésité, statut vaccinal et thrombophilie héréditaire.
Principaux critères de jugement et mesures
Le critère de jugement principal était une MTEV omposite, comprenant une thrombose veineuse profonde ou une embolie pulmonaire, survenue 30 jours après l'infection. Les rapports de risque (HR) avec des IC à 95 % ont été calculés à l'aide de modèles de Cox spécifiques à la cause.Résultats
Chez 18 818 patients ambulatoires atteints de COVID-19 (10 580 femmes [56,2 %] ; âge moyen [ET], 64,3 [8,0] ans) et 93 179 participants non infectés appariés (52 177 femmes [56,0 %] ; âge moyen [ET] , 64,3 [7,9] ans), l'infection était associée à un risque accru de TEV à 30 jours (taux d'incidence de 50,99 et 2,37 pour 1000 personnes-années pour les personnes infectées et non infectées, respectivement ; RR, 21,42 ; IC à 95 %, 12,63 -36.31). Cependant, le risque était considérablement atténué chez les personnes entièrement vaccinées (RR, 5,95 ; IC à 95 %, 1,82-19,5 ; interaction P = .02). Chez les patients atteints de COVID-19, l'âge avancé, le sexe masculin et l'obésité étaient indépendamment associés à un risque plus élevé, avec des RR ajustés de 1,87 (IC à 95 %, 1,50-2,33) pour 10 ans, 1,69 (IC à 95 %, 1,30-2,19) , et 1,83 (IC à 95 %, 1,28-2,61), respectivement. De plus, la thrombophilie héréditaire était associée à un RR de 2,05 (IC à 95 %, 1,15-3,66) pour la MTEV post-COVID-19.Conclusions et pertinence
Dans cette étude de cohorte basée sur la population de patients atteints de COVID-19, la COVID-19 ambulatoire était associé à un risque considérablement accru d'incident de MTEV, mais ce risque était considérablement réduit chez les personnes entièrement vaccinées présentant une infection. L'âge avancé, le sexe masculin et l'obésité étaient des facteurs de risque cliniques de MTEV post-COVID-19 .La thrombophilie du facteur V Leiden était en outre associée à un risque double, comparable au risque de vieillissement de 10 ans. Ces résultats peuvent renforcer le besoin de vaccination, éclairer la stratification des risques de MTEV et appeler à des stratégies de prophylaxie ciblées de la MTEV pour les patients ambulatoires non vaccinés atteints de COVID-19.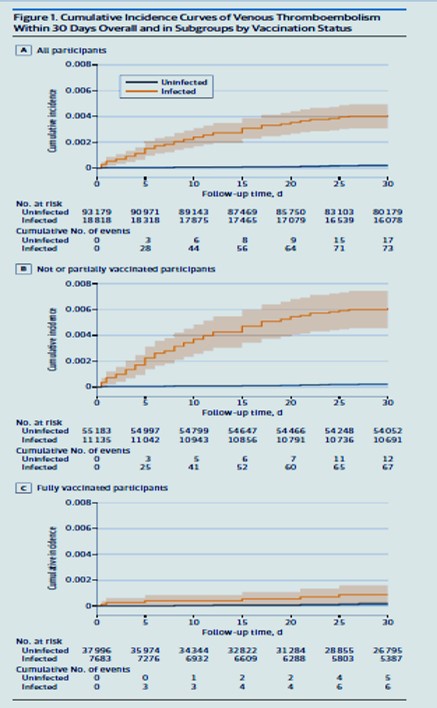
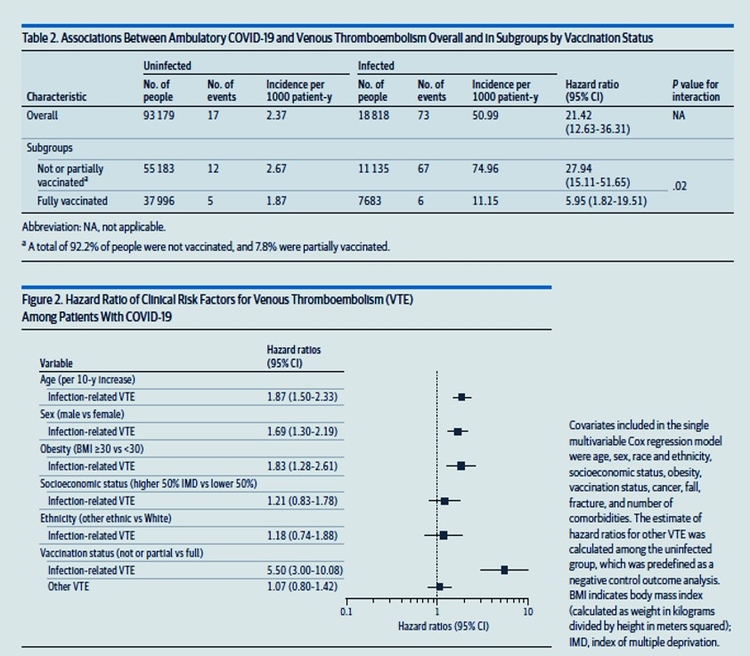
Les résultats de cette étude suggèrent que les patients ambulatoires atteints de COVID-19, vaccinés ou non, présentent un risque accru cliniquement pertinent d'incident de MTEV pendant la phase aiguë, le risque étant aggravé par des facteurs d'âge avancé, de sexe masculin, d'obésité, d'une vaccination incompléte et de la présence d'une thrombophilie , mutation facteur V de Leiden.
Commentaire
Cette étude confirme ce que l'on sait sur COVID-19 et MTEV .Le risque de MTEV au cours de la Covid-19 est augmenté ainsi qu'en post Covid. La conséquence est simple, chez tout patient qui présente la Covid-19 il faut avoir le réflexe PREVENTION MTEV par une HBPM ainsi qu'en post Covid. La question de la dose d'HBPM en cours d'hospitalisation pour les patients étiquetés "graves", n'est pas complétement résolue. Mais peu importe le réflexe PREVENTION MTEV chez ses patients doit toujours être présent. En POST COVID et dans le contexte de retour à la maison, la prévention se fera au cas par cas en fonction des FDR de MTEV surajoutés. Le score de PADOUE est d'une grande aide.L'intérêt de cette étude c'est de démontrer scientifiquement la réalité de la MTEV au décours de la Covid-19. Il ya encore des esprtis chagrins qui en doutent. Alors la science est là pour lever le doute chez tous les septiques COVID/MTEV. L'anti science n'existe pas , elle est poussière. Indirectement la vaccination compléte la protection contre la MTEV aussi ++++. Quant aux thrombophilies connues elles renforcent les raisons de cette prévention eu augmentant la durée de la prévention.
RappelBonus Draft ISTH , non validé complétement...en attendent l'étude française Covi-DoseA lire: https://www.lemonde.fr/blog/realitesbiomedicales/2020/04/29/covid-19-est-aussi-une-maladie-inflammatoire-vasculaire/ @MarcGozlan
ISTH DRAFT : WORK n PROGRESS, non DEFINITIF ++++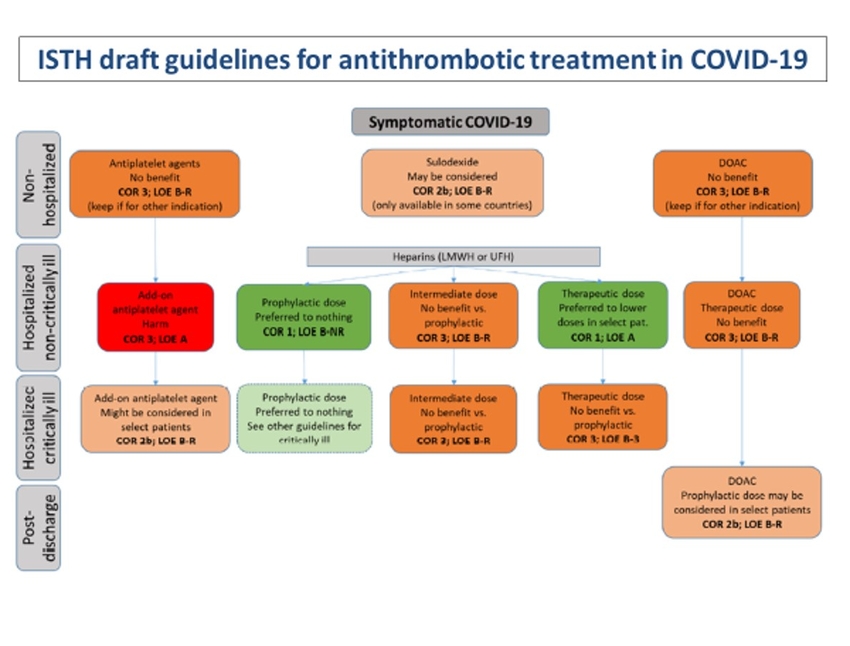
-
Myocardite et Covid-19 : le point
 iconographie : myocardite et Covid-19
iconographie : myocardite et Covid-19
"J'ai eu une crise cardiaque, ce qui prouve que j'ai un coeur." Serge Gainsbourg
"Un coeur qui bat c'est une âme qui respire." Laurent Sagalovitsch
2022 ACC Expert Consensus Decision Pathway on Cardiovascular Sequelae of COVID-19 in Adults: Myocarditis and Other Myocardial Involvement, Post-Acute Sequelae of SARS-CoV-2 Infection, and Return to Play: A Report of the American College of Cardiology Solution Set Oversight Committee,Comité de rédaction Ty J. Gluckman, MD, MHA, coprésidente du FACC Nicole M. Bhave, MD, coprésidente du FACC Larry A. Allen, MD, MHS, vice-président du FACC Eugene H. Chung, MD, MSc, vice-présidente du FACC Erica S. Spatz, MD, MHS, vice-président du FACC Enrico Ammirati, MD, PhD Aaron L. Baggish, MD, FACC Biykem Bozkurt, MD, PhD, FACC William K. Cornwell, III, MD, MSCS Kimberly G. Harmon, MD Jonathan H. Kim, MD, MSc, FACC Anuradha Lala, MD, FACC Benjamin D. Levine, MD, FACC Matthew W. Martinez, MD, FACC Oyere Onuma, MD, MSc Dermot Phelan, MD, PhD, FACC Valentina O. Puntmann, MD, PhD Saurabh Rajpal, MD, FACC Pam R. Taub, MD, FACC Amanda K. Verma, MD, FACC,J Am Coll Cardiol. 16 mars 2022. DOI épublié: 10.1016/j.jacc.2022.02.003 2022 ACC Expert Consensus Decision Pathway on Cardiovascular Sequelae of COVID-19 in Adults: Myocarditis and Other Myocardial Involvement, Post-Acute Sequelae of SARS-CoV-2 Infection, and Return to Play: A Report of the American College of Cardiology Solution Set Oversight Committee | Journal de l’American College of Cardiology (jacc.org) LIBRE d'ACCES
Cheminement décisionnel ACC 2022 sur les séquelles cardiovasculaires de la COVID-19 : points clés
La pandémie à coronavirus 2019 (COVID-19) a eu un impact sans précédent dans le monde entier. Rien qu’aux États-Unis, plus de 78 millions de cas ont été signalés, avec plus de 948 000 décès attribués directement à l’infection par le coronavirus du syndrome respiratoire aigu sévère (SARS-CoV-2) .Parmi les patients hospitalisés pour COVID-19, diverses anomalies dans les tests cardiaques (par exemple, anomalies électrocardiographiques, biomarqueurs cardiaques élevés) et un large éventail de complications cardiovasculaires (par exemple, lésion myocardique, thrombose, arythmie) ont été rapportées.Chez certains patients infectés par le SRAS-CoV-2, les symptômes cardiaques (par exemple, douleurs thoraciques, essoufflement, fatigue et palpitations) persistent, pendant des mois après la maladie initiale. Des preuves de laboratoire et d’imagerie de lésions et d’atteintes myocardiques ont également été observées chez des personnes symptomatiques et asymptomatiques, ainsi qu’après réception du vaccin à ARNm contre la COVID-19. Pour les cliniciens qui traitent ces personnes, un nombre croissant de questions existent liées à l’évaluation et à la gestion de ces affections, ainsi qu’à la reprise sécuritaire de l’activité physique.Pour aider à recueillir d’autres idées, l’ACC a organisé une table ronde virtuelle sur la Maison du cœur en mai 2021, réunissant des experts dans les domaines suivants:
1) myocardite
2) séquelles post-aiguës de l’infection par le SRAS-CoV-2 (PASC)
3) la cardiologie sportive.
Ce PCE représente un résultat clé de cette réunion et est destiné à servir de ressource pour les cliniciens qui s’occupent de ces patients, principalement en milieu ambulatoire. Plus précisément, ce document tente de répondre aux questions fréquemment posées concernant les soins aux adultes (âgés de ≥18 ans) présentant des symptômes cardiaques (par exemple, douleur thoracique, dyspnée, palpitations, syncope) après une infection par le SRAS-CoV-2. En l’absence de données d’essais cliniques solides, il est prévu de fournir des conseils pratiques liés à l’évaluation et à la gestion. Scope of the Expert Consensus Decision Pathway on Cardiovascular Sequelae of COVID-19 in Adults
Scope of the Expert Consensus Decision Pathway on Cardiovascular Sequelae of COVID-19 in Adults Cadre d'évaluation et de gestion des séquelles cardiovasculaires de la COVID-19 chez l'adulte
Cadre d'évaluation et de gestion des séquelles cardiovasculaires de la COVID-19 chez l'adulte
Boîtes dorées et violettes = symptômes COVID-19. Cases oranges = test cardiaque. Cases rouges et bleues = diagnostics (séquelles). ∗Comprend un cTn élevé ; ECG avec inversion diffuse de l'onde T, sus-décalage du segment ST sans sous-décalage réciproque du segment ST et/ou allongement de la durée du complexe QRS ; et échocardiogramme avec anomalies du mouvement de la paroi ventriculaire, souvent dans une distribution non coronarienne, et/ou déformation ventriculaire anormale. †Informé par la présentation et peut inclure une coronarographie en cas de suspicion de syndrome coronarien aigu ou une angiographie pulmonaire par tomodensitométrie en cas de suspicion d'embolie pulmonaire (voir Figure 3). ‡ Comprend d'autres tests de laboratoire (p. ex., numération globulaire complète, bilan métabolique de base, protéine C-réactive), un moniteur de rythme ambulatoire, une radiographie pulmonaire ou une imagerie CT et des tests de la fonction pulmonaire, ainsi que des tests supplémentaires pour une suspicion de PASC-CVD ou PASC-CVS Pour les patients atteints de myocardite, le traitement médical peut comprendre des médicaments immunosuppresseurs (p. ex., des corticostéroïdes); pour les patients présentant une atteinte péricardique, le traitement médical peut inclure des anti-inflammatoires non stéroïdiens, de la colchicine et des corticostéroïdes. Pour les patients atteints de PASC-CVS, le traitement médical empirique peut inclure un bêta-bloquant, un inhibiteur calcique non dihydropyridinique, de l'ivabradine, de la fludrocortisone et/ou de la midodrine. #Comprend un test d'effort maximal et/ou un moniteur de rythme ambulatoire (voir Figure 9 ). CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019 ; CT =PASC-Syndrome Cardiovasculaire ; RTP = retour au jeu ; SARS-CoV-2 = coronavirus du syndrome respiratoire aigu sévère 2. tomodensitométrie ; cTn = troponine cardiaque ; ECG = électrocardiogramme, MCS = assistance circulatoire mécanique ; PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; PASC-CVD = PASC-Maladie cardiovasculaire ; PASC-CVS = Commentaire
CommentaireÉvaluation et prise en charge des patients suspects de myocardite ou d'atteinte du myocarde
Cases vertes = tests cardiaques pour l'évaluation de la myocardite/atteinte du myocarde. Boîte orange = autres tests cardiaques/non cardiaques. Cases violettes = gestion. ∗ Informé par des symptômes évoquant une atteinte cardiaque, y compris douleur/pression thoracique, dyspnée, palpitations et syncope. †Inclut l'inversion diffuse de l'onde T, l'élévation du segment ST sans dépression réciproque du segment ST et l'allongement de la durée du complexe QRS. ‡Souvent dans une distribution non coronarienne ; peut également inclure une tension ventriculaire anormale. §Comprend l'hypotension, le choc cardiogénique, les arythmies ventriculaires soutenues et/ou le bloc auriculo-ventriculaire avancé. « Il s'agit d'une liste incomplète d'étiologies potentielles. ¶Les tests de génomes viraux doivent être effectués sur du tissu cardiaque congelé pour exclure d'autres causes de myocardite, si possible. # Suppose que la douleur thoracique est le seul symptôme, La fonction systolique VG est préservée et il n'y a pas d'arythmie ventriculaire. ∗∗Comprend un ECG, un échocardiogramme, un moniteur de rythme ambulatoire et un CMR. SCA = syndrome coronarien aigu ; CM = cardiomyopathie ; CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019 ; CT = tomodensitométrie ; cTn = troponine cardiaque ; CXR = radiographie pulmonaire ; ECG = électrocardiogramme ; EMB = biopsie endomyocardique ; IC = insuffisance cardiaque ; LV = ventriculaire gauche ; FEVG = fraction d'éjection ventriculaire gauche ; MCS = assistance circulatoire mécanique ; MIS-A = syndrome inflammatoire multisystémique chez l'adulte ; AINS = anti-inflammatoires non stéroïdiens ; EP = embolie pulmonaire ; RHC = cathétérisme cardiaque droit ; SaO CM = cardiomyopathie ; CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019 ; CT = tomodensitométrie ; cTn = troponine cardiaque ; CXR = radiographie pulmonaire ; ECG = électrocardiogramme ; EMB = biopsie endomyocardique ; IC = insuffisance cardiaque ; LV = ventriculaire gauche ; FEVG = fraction d'éjection ventriculaire gauche ; MCS = assistance circulatoire mécanique ; MIS-A = syndrome inflammatoire multisystémique chez l'adulte ; AINS = anti-inflammatoires non stéroïdiens ; EP = embolie pulmonaire ; RHC = cathétérisme cardiaque droit ; SaO CM = cardiomyopathie ; CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019 ; CT = tomodensitométrie ; cTn = troponine cardiaque ; CXR = radiographie pulmonaire ; ECG = électrocardiogramme ; EMB = biopsie endomyocardique ; IC = insuffisance cardiaque ; LV = ventriculaire gauche ; FEVG = fraction d'éjection ventriculaire gauche ; MCS = assistance circulatoire mécanique ; MIS-A = syndrome inflammatoire multisystémique chez l'adulte ; AINS = anti-inflammatoires non stéroïdiens ; EP = embolie pulmonaire ; RHC = cathétérisme cardiaque droit ; SaO MCS = assistance circulatoire mécanique ; MIS-A = syndrome inflammatoire multisystémique chez l'adulte ; AINS = anti-inflammatoires non stéroïdiens ; EP = embolie pulmonaire ; RHC = cathétérisme cardiaque droit ; SaO MCS = assistance circulatoire mécanique ; MIS-A = syndrome inflammatoire multisystémique chez l'adulte ; AINS = anti-inflammatoires non stéroïdiens ; EP = embolie pulmonaire ; RHC = cathétérisme cardiaque droit ; SaO2 = saturation artérielle en oxygène ; SARS-CoV-2 = coronavirus 2 du syndrome respiratoire aigu sévère ; WMA = anomalies du mouvement des parois.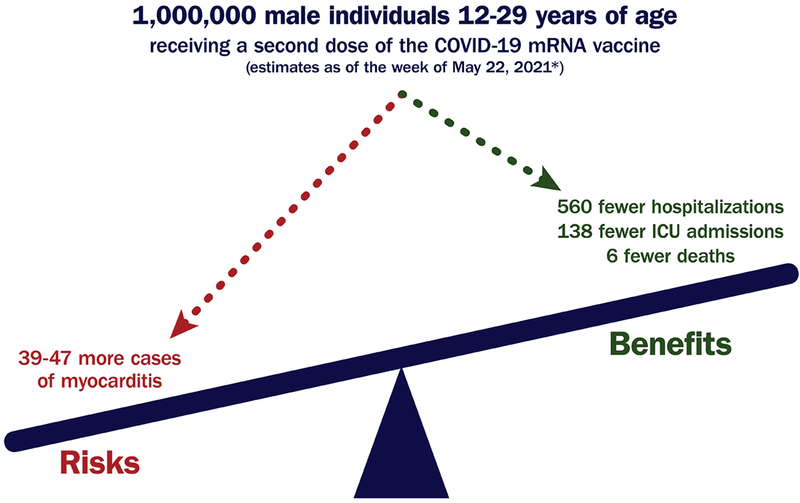 Rapport bénéfice/risque favorable pour la vaccination par ARNm de la COVID-19parmi les personnes les plus à risque de myocardite post-vaccinale ∗Centres de contrôle et de prévention des maladies. Réseau de surveillance des hospitalisations associées à la maladie à coronavirus 2019 (COVID-19) (COVID-NET). 12 , 141 COVID-19 = nouvelle maladie à coronavirus 2019 ; USI = unité de soins intensifs, ARNm = ARN messager.
Rapport bénéfice/risque favorable pour la vaccination par ARNm de la COVID-19parmi les personnes les plus à risque de myocardite post-vaccinale ∗Centres de contrôle et de prévention des maladies. Réseau de surveillance des hospitalisations associées à la maladie à coronavirus 2019 (COVID-19) (COVID-NET). 12 , 141 COVID-19 = nouvelle maladie à coronavirus 2019 ; USI = unité de soins intensifs, ARNm = ARN messager.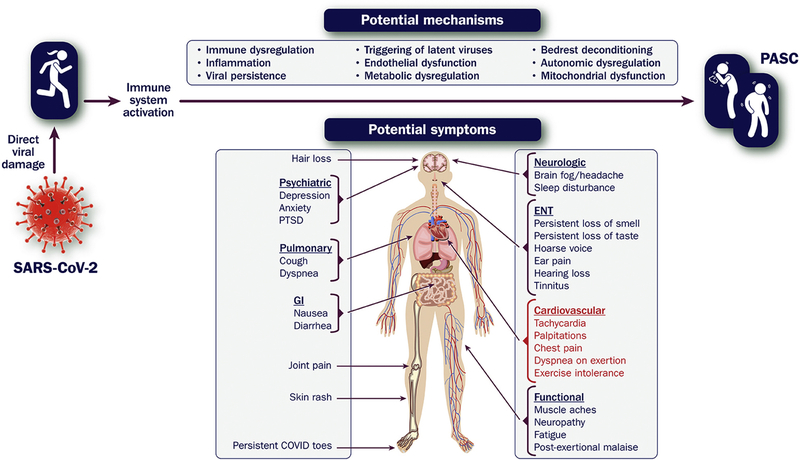 Symptômes du PASC et mécanismes potentiels COVID-19 = nouvelle maladie à coronavirus 2019 ; ORL = oreille, nez et gorge ; GI = gastro-intestinal ; PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; SSPT = trouble de stress post-traumatique ; SARS-CoV-2 = coronavirus du syndrome respiratoire aigu sévère .
Symptômes du PASC et mécanismes potentiels COVID-19 = nouvelle maladie à coronavirus 2019 ; ORL = oreille, nez et gorge ; GI = gastro-intestinal ; PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; SSPT = trouble de stress post-traumatique ; SARS-CoV-2 = coronavirus du syndrome respiratoire aigu sévère .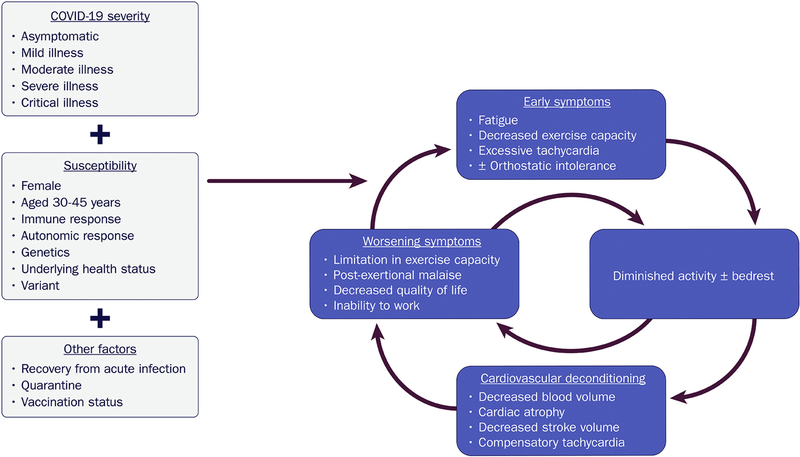 Spirale descendante du déconditionnement : un mécanisme potentiel d'intolérance à l'exercice et de tachycardie excessive dans le COVID-19
Spirale descendante du déconditionnement : un mécanisme potentiel d'intolérance à l'exercice et de tachycardie excessive dans le COVID-19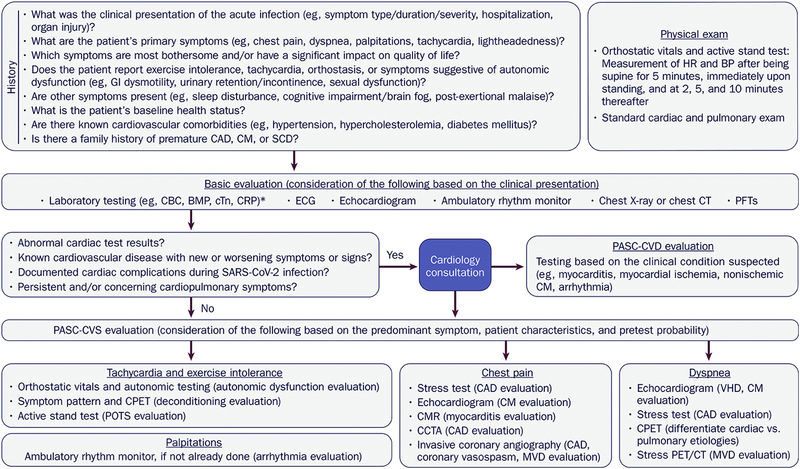 Évaluation des symptômes cardiovasculaires évocateurs de PASC
Évaluation des symptômes cardiovasculaires évocateurs de PASC
∗Il faut envisager des tests de laboratoire supplémentaires (p. ex., D-dimères, peptide natriurétique de type B/peptide natriurétique pro-B de type N-terminal, tests de la fonction thyroïdienne) en fonction de la présentation clinique. BMP = panel métabolique de base ; PA = tension artérielle ; CAD = maladie coronarienne ; CBC = numération globulaire complète ; CCTA = angiographie par tomodensitométrie coronarienne ; CM = cardiomyopathie ; CMR = imagerie par résonance magnétique cardiaque ; CPET = test d'effort cardiopulmonaire ; CRP = protéine C-réactive ; CT = tomodensitométrie ; cTn = troponine cardiaque ; CV = cardiovasculaire ; ECG = électrocardiogramme ; GI = gastro-intestinal ; FC = fréquence cardiaque ; MVD = dysfonctionnement microvasculaire ; PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; PASC-CVD = PASC-Maladie cardiovasculaire ; PASC-CVS = PASC-Syndrome Cardiovasculaire ; TEP = tomographie par émission de positrons ; PFT = tests de la fonction pulmonaire ; POTS = syndrome de tachycardie orthostatique posturale ; SARS-CoV-2 = coronavirus 2 du syndrome respiratoire aigu sévère ; SCD = mort cardiaque subite ; VHD = cardiopathie valvulaire.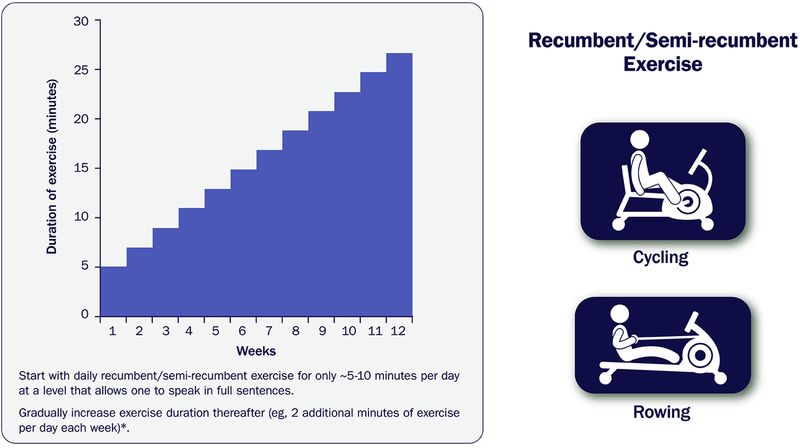 Exemple de prescription de thérapie par l'exercice couché
Exemple de prescription de thérapie par l'exercice couché
∗Pour une prescription plus précise de la thérapie par l'exercice avec des objectifs de fréquence cardiaque et des journaux d'exercices du patient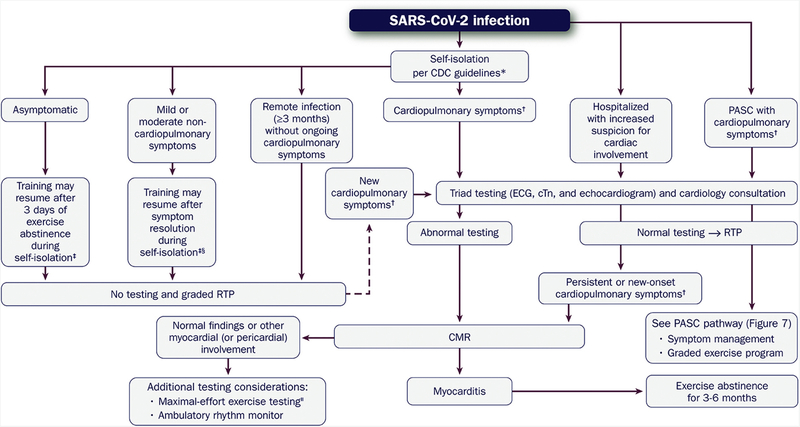 Évaluation du patient sportif convalescent du COVID-19 et conseils sur le RTP et/ou l'entraînement intensif∗Recommandations du CDC : quarantaine et isolement du COVID-19. 240†Les symptômes cardio-pulmonaires comprennent douleur/oppression thoracique, dyspnée, palpitations et étourdissements/syncope ; cela inclut également les symptômes survenant ≤ 1 semaine après la vaccination par l'ARNm de la COVID-19. ‡Les stratégies pour minimiser la transmission du SRAS-CoV-2 à d'autres athlètes 3 à 10 jours après un test COVID-19 positif comprennent 1) s'entraîner en isolement, 2) participer à un entraînement en plein air à distance sociale, 3) s'entraîner avec un masque facial dans un établissement bien ventilé avec une distance sociale appropriée, et 4) participer à une formation de groupe après un seul TAAN négatif (par exemple, test RT-PCR) ou 2 tests antigéniques rapides négatifs à 24-48 heures d'intervalle. §Exclut l'anosmie/agueusie prolongée et isolée, qui ne devrait pas retarder le retour à l'entraînement. « Les tests d'effort maximal doivent être différés jusqu'à ce qu'une myocardite ait été exclue. CDC = Centres de contrôle et de prévention des maladies ; CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019, cTn = troponine cardiaque ; ECG = électrocardiogramme ; NAAT = test d'amplification des acides nucléiques, PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; RTP = retour au jeu ; RT-PCR = amplification en chaîne par polymérase de transcription inverse, SARS-CoV-2 = coronavirus du syndrome respiratoire aigu sévère .
Évaluation du patient sportif convalescent du COVID-19 et conseils sur le RTP et/ou l'entraînement intensif∗Recommandations du CDC : quarantaine et isolement du COVID-19. 240†Les symptômes cardio-pulmonaires comprennent douleur/oppression thoracique, dyspnée, palpitations et étourdissements/syncope ; cela inclut également les symptômes survenant ≤ 1 semaine après la vaccination par l'ARNm de la COVID-19. ‡Les stratégies pour minimiser la transmission du SRAS-CoV-2 à d'autres athlètes 3 à 10 jours après un test COVID-19 positif comprennent 1) s'entraîner en isolement, 2) participer à un entraînement en plein air à distance sociale, 3) s'entraîner avec un masque facial dans un établissement bien ventilé avec une distance sociale appropriée, et 4) participer à une formation de groupe après un seul TAAN négatif (par exemple, test RT-PCR) ou 2 tests antigéniques rapides négatifs à 24-48 heures d'intervalle. §Exclut l'anosmie/agueusie prolongée et isolée, qui ne devrait pas retarder le retour à l'entraînement. « Les tests d'effort maximal doivent être différés jusqu'à ce qu'une myocardite ait été exclue. CDC = Centres de contrôle et de prévention des maladies ; CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019, cTn = troponine cardiaque ; ECG = électrocardiogramme ; NAAT = test d'amplification des acides nucléiques, PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; RTP = retour au jeu ; RT-PCR = amplification en chaîne par polymérase de transcription inverse, SARS-CoV-2 = coronavirus du syndrome respiratoire aigu sévère .Résumé des critères diagnostiques et des principales recommandations liés aux séquelles cardiovasculaires de la COVID-19 chez l'adulte
Myocardite et autres atteintes du myocarde ▪ La myocardite est définie par : 1) des symptômes cardiaques (p. ex., douleur thoracique, dyspnée, palpitations, syncope) ; 2) un cTn élevé ; et 3) résultats électrocardiographiques, échocardiographiques, CMR et/ou histopathologiques anormaux lors d'une biopsie ou d'une évaluation post-mortem en l'absence de maladie coronarienne limitant le débit.
▪ Lorsqu'il y a une suspicion accrue d'implication cardiaque avec COVID-19, les tests initiaux doivent consister en un ECG, une mesure de la cTn (de préférence à l'aide d'un test à haute sensibilité) et un échocardiogramme.
▪ Une consultation en cardiologie est recommandée pour les personnes présentant une augmentation du cTn et/ou de l'ECG ou des anomalies échocardiographiques concernant une myocardite.
▪ La RMC est recommandée chez les patients hémodynamiquement stables suspectés de myocardite.
▪ L'hospitalisation est recommandée pour les patients atteints de myocardite définie de gravité légère ou modérée, idéalement dans un centre d'insuffisance cardiaque avancée. Les patients atteints de myocardite fulminante doivent être pris en charge dans des centres spécialisés dans l'insuffisance cardiaque avancée, l'assistance circulatoire mécanique et d'autres thérapies avancées.
▪ Les patients atteints de myocardite et de pneumonie COVID-19 (avec un besoin continu d'oxygène supplémentaire) doivent être traités avec des corticostéroïdes.
▪ Pour les patients suspects d'atteinte péricardique, un traitement par AINS, colchicine et/ou prednisone est raisonnable.
▪ Les corticostéroïdes intraveineux peuvent être envisagés chez les personnes atteintes de myocardite COVID-19 suspectée ou confirmée avec compromis hémodynamique ou MIS-A. L'utilisation empirique de corticostéroïdes peut également être envisagée chez les personnes présentant des signes biopsiques d'infiltrats myocardiques sévères ou de myocardite fulminante, mis en balance avec le risque d'infection.
▪ Le cas échéant, un traitement médical de l'insuffisance cardiaque conforme aux directives doit être instauré et poursuivi après la sortie.
▪ La myocardite après la vaccination par l'ARNm du COVID-19 est rare. Les taux observés les plus élevés ont été observés chez les jeunes hommes (âgés de 12 à 17 ans) après la deuxième dose de vaccin.
▪ La vaccination contre la COVID-19 est associée à un rapport bénéfice/risque très favorable pour tous les groupes d'âge et de sexe évalués jusqu'à présent.
▪ En général, la myocardite associée au vaccin doit être diagnostiquée, catégorisée et traitée d'une manière analogue à la myocardite après une infection par le SRAS-CoV-2.
PASC ▪ Le PASC est défini comme une constellation de problèmes de santé nouveaux, récurrents ou persistants rencontrés par les individus 4 semaines ou plus après l'infection par le SRAS-CoV-2.
▪ PASC-CVD fait référence à un large groupe d'affections cardiovasculaires qui comprennent, mais sans s'y limiter, la myocardite et d'autres formes d'atteinte du myocarde, la péricardite, l'ischémie myocardique nouvelle ou s'aggravant, le dysfonctionnement microvasculaire, la cardiomyopathie non ischémique, la thromboembolie, les séquelles cardiovasculaires d'une maladie pulmonaire, et arythmie.
▪ Le PASC-CVS est un trouble hétérogène qui comprend des symptômes cardiovasculaires très variés, sans preuve objective de maladie cardiovasculaire à l'aide de tests de diagnostic standard. Les symptômes courants comprennent la tachycardie, l'intolérance à l'effort, le malaise post-effort, les palpitations, les douleurs thoraciques et la dyspnée.
▪ Pour les patients présentant des symptômes cardiovasculaires et suspectés de PASC, une approche de test initiale raisonnable comprend : 1) des tests de laboratoire de base (y compris la cTn ); 2) un ECG ; 3) un échocardiogramme ; 4) un moniteur de rythme ambulatoire ; 5) imagerie thoracique (radiographie et/ou scanner) ; et/ou 6) tests de la fonction pulmonaire.
▪ Une consultation en cardiologie est recommandée pour les patients atteints de PASC qui ont : 1) des résultats de test cardiaque anormaux ; 2) maladie cardiovasculaire connue avec symptômes ou signes nouveaux ou s'aggravant ; 3) complications cardiaques documentées lors d'une infection par le SRAS-CoV-2 ; et/ou 4) des symptômes cardiopulmonaires persistants qui ne sont pas autrement expliqués.
▪ Les exercices couchés ou semi-couchés(p. ex., aviron, natation ou vélo) sont initialement recommandés pour les patients PASC-CVS souffrant de tachycardie, d'intolérance à l'effort/orthostatique et/ou de déconditionnement, avec une transition vers l'exercice debout à mesure que l'intolérance orthostatique s'améliore. La durée de l'exercice doit également être courte (5 à 10 minutes/jour) au départ, avec des augmentations progressives à mesure que la capacité fonctionnelle s'améliore.
▪ La charge saline et liquidienne représente des interventions non pharmacologiques qui peuvent apporter un soulagement symptomatique aux patients souffrant de tachycardie, de palpitations et/ou d'hypotension orthostatique. Les bêta-bloquants, les inhibiteurs calciques non dihydropyridiniques, l'ivabradine, la fludrocortisone et la midodrine peuvent également être utilisés de manière empirique.
RTP ▪ Les athlètes qui sont asymptomatiques après une infection récente par le SRAS-CoV-2 peuvent reprendre l'entraînement physique après 3 jours d'abstinence physique pendant l'auto-isolement.
▪ Les athlètes présentant des symptômes non cardio-pulmonaires légers ou modérés après une infection récente par le SRAS-CoV-2 peuvent reprendre l'entraînement physique une fois leurs symptômes résolus.
▪ Les athlètes atteints d'une infection à distance (≥ 3 mois) sans symptômes cardio-pulmonaires en cours peuvent reprendre l'entraînement physique sans avoir besoin de tests supplémentaires.
▪ Les athlètes qui se remettent de la COVID-19 et qui présentent des symptômes cardiopulmonaires persistants (douleur/oppression thoracique, palpitations ou syncope) et/ou ceux qui doivent être hospitalisés avec une suspicion accrue d'atteinte cardiaque doivent subir des tests de triade (ECG, cTn et échocardiogramme). Des tests de triade doivent également être effectués chez les personnes développant de nouveaux symptômes cardio-pulmonaires après la reprise de l'entraînement physique.
▪ La RMC est recommandée si les tests triadiques sont anormaux ou si les symptômes cardio-pulmonaires persistent.
▪ Les athlètes atteints de myocardite doivent s'abstenir de faire de l'exercice pendant 3 à 6 mois.
▪ Un test d'effort maximal et/ou un moniteur de rythme ambulatoire peuvent être utiles dans l'évaluation des athlètes présentant : 1) des symptômes cardio-pulmonaires persistants et 2) soit une RMC normale, soit une RMC qui démontre d'autres formes d'atteinte myocardique (ou péricardique). Cependant, les tests d'effort maximal ne doivent être effectués qu'après que la myocardite a été exclue avec la RMC.
▪ Le CMR pour dépister les athlètes asymptomatiques ou présentant des symptômes non cardiopulmonaires est susceptible d'être à faible rendement.
▪ La répétition des tests cardiaques n'est pas justifiée chez les athlètes atteints de COVID-19 récurrent en l'absence de symptômes cardiopulmonaires.
CMR = imagerie par résonance magnétique cardiaque ; COVID-19 = nouvelle maladie à coronavirus 2019 ; CT = tomodensitométrie ; cTn = troponine cardiaque ; ECG = électrocardiogramme ; MIS-A = syndrome inflammatoire multisystémique chez l'adulte ; ARNm = ARN messager ; AINS = anti-inflammatoire non stéroïdien ; PASC = séquelles post-aiguës de l'infection par le SRAS-CoV-2 ; PASC-CVD = séquelles post-aiguës de l'infection par le SARS-CoV-2–maladie cardiovasculaire ; PASC-CVS = séquelles post-aiguës de l'infection par le SARS-CoV-2–syndrome cardiovasculaire ; RTP = retour au jeu ; SARS-CoV-2 = coronavirus du syndrome respiratoire aigu sévère 2
 "Les médecins doivent considérer les antécédents de COVID-19 comme un risque de maladie cardiovasculaire. "Nous pensons qu'il est important de porter une attention particulière aux personnes atteintes de COVID-19 et d'identifier les premiers signes ou symptômes de maladie cardiaque", a écrit Al-Aly. Il a souligné que l'identification, le diagnostic et le traitement précoces seront essentiels pour réduire le risque de conséquences néfastes pour la santé en aval."
"Les médecins doivent considérer les antécédents de COVID-19 comme un risque de maladie cardiovasculaire. "Nous pensons qu'il est important de porter une attention particulière aux personnes atteintes de COVID-19 et d'identifier les premiers signes ou symptômes de maladie cardiaque", a écrit Al-Aly. Il a souligné que l'identification, le diagnostic et le traitement précoces seront essentiels pour réduire le risque de conséquences néfastes pour la santé en aval."
https://jamanetwork.com/journals/jama/fullarticle/2789793"
Voici les points clés à retenir du cheminement de décision par consensus d'experts de l'ACC de 2022 sur les séquelles cardiovasculaires de COVID-19 chez les adultes, y compris la myocardite et d'autres atteintes du myocarde, les séquelles post-aiguës de l'infection par le SRAS-CoV-2 et le retour au jeu :Myocardite et autres atteintes du myocarde
- La myocardite est une complication rare mais grave de l'infection par le coronavirus du syndrome respiratoire aigu sévère (SARS-CoV-2). La myocardite est définie par :
a) des symptômes cardiaques (p. ex., douleur thoracique, dyspnée, palpitations, syncope) b) troponine cardiaque élevée (cTn)
c) résultats électrocardiographiques, échocardiographiques, d'imagerie par résonance magnétique cardiaque (RMC) et/ou histopathologiques anormaux lors d'une biopsie ou d'une évaluation post-mortem en l'absence de maladie coronarienne limitant le débit. - L'hospitalisation est recommandée pour les patients atteints de myocardite définie, idéalement dans un centre d'insuffisance cardiaque avancée. Les patients atteints de myocardite fulminante doivent être pris en charge dans des centres spécialisés dans l'insuffisance cardiaque avancée, l'assistance circulatoire mécanique et d'autres thérapies avancées.
- Les patients atteints de myocardite et de pneumonie à coronavirus 2019 (COVID-19) (avec un besoin continu d'oxygène supplémentaire) doivent être traités avec des corticostéroïdes.
- Pour les patients suspects d'atteinte péricardique, un traitement par anti-inflammatoires non stéroïdiens, colchicine et/ou prednisone est raisonnable.
- Les corticostéroïdes intraveineux peuvent être envisagés chez les personnes atteintes d'une myocardite COVID-19 suspectée ou confirmée avec compromis hémodynamique ou syndrome inflammatoire multisystémique chez l'adulte (MIS-A). L'utilisation empirique de corticostéroïdes peut également être envisagée chez les personnes présentant des preuves biopsiques d'infiltrats myocardiques graves ou de myocardite fulminante, mis en balance avec le risque d'infection.
- Le cas échéant, un traitement médical de l'insuffisance cardiaque conforme aux directives doit être instauré et poursuivi après la sortie de l'hôpital.
- La myocardite après la vaccination par l'ARNm du COVID-19 est rare. Les taux observés les plus élevés ont été observés chez les jeunes hommes (âgés de 12 à 17 ans) après la deuxième dose de vaccin. La vaccination contre la COVID-19 est associée à un rapport bénéfice/risque très favorable pour tous les groupes d'âge et de sexe évalués jusqu'à présent.
- En général, la myocardite associée au vaccin doit être diagnostiquée, catégorisée et traitée d'une manière analogue à la myocardite après une infection par le SRAS-CoV-2.
Séquelles post-aiguës de l'infection par le SRAS-CoV-2 (PASC)
- Le PASC est défini comme une constellation de problèmes de santé nouveaux, récurrents ou persistants rencontrés par les individus 4 semaines ou plus après l'infection par le SRAS-CoV-2.
- La maladie cardiovasculaire PASC (PASC-CVD) fait référence à un large groupe d'affections cardiovasculaires qui comprennent, mais sans s'y limiter, la myocardite et d'autres formes d'atteinte myocardique, la péricardite, l'ischémie myocardique nouvelle ou s'aggravant, le dysfonctionnement microvasculaire, la cardiomyopathie non ischémique, la thromboembolie, les troubles cardiovasculaires. séquelles de maladies pulmonaires et d'arythmie.
- Le syndrome cardiovasculaire PASC (PASC-CVS) est un trouble hétérogène qui comprend des symptômes cardiovasculaires très variés, sans preuve objective de maladie cardiovasculaire à l'aide de tests de diagnostic standard. Les symptômes courants comprennent l'intolérance orthostatique, l'intolérance à l'exercice, le malaise post-effort, les palpitations, les douleurs thoraciques et la dyspnée.
- Pour les patients suspects de PASC, une approche de dépistage initiale raisonnable comprend :
a) des tests de laboratoire de base (y compris la cTn) ;
b) un électrocardiogramme (ECG);
c) un échocardiogramme transthoracique ;
d) un moniteur de rythme ambulatoire ;
e) imagerie thoracique (radiographie et/ou tomodensitométrie) ; et/ou
f) tests de la fonction pulmonaire. - Une consultation en cardiologie est recommandée pour les patients atteints de PASC qui ont :
a) des résultats de test cardiaque anormaux ;
b) maladie cardiovasculaire connue avec symptômes ou signes nouveaux ou s'aggravant ;
c) complications cardiaques documentées lors d'une infection par le SRAS-CoV-2 ; et/ou
d) des symptômes cardiopulmonaires persistants qui ne sont pas autrement expliqués. - Les exercices couchés ou semi-couchés (p. ex., aviron, natation ou vélo) sont recommandés pour les patients PASC-CVS souffrant de tachycardie, d'intolérance à l'effort/orthostatique et/ou de déconditionnement, avec une transition vers l'exercice debout à mesure que l'intolérance orthostatique s'améliore. La durée de l'exercice doit également être courte (5 à 10 minutes/jour) au départ, avec des augmentations progressives à mesure que la capacité fonctionnelle s'améliore.
- La charge saline et liquidienne représente des interventions non pharmacologiques qui peuvent apporter un soulagement symptomatique aux patients souffrant de tachycardie, de palpitations et/ou d'hypotension orthostatique. Les bêta-bloquants, les inhibiteurs calciques non dihydropyridiniques, l'ivabradine, la fludrocortisone et la midodrine peuvent également être utilisés empiriquement.
La COVID-19 a un tropisme CV important notamment chez les sujets jeunes. Ce qui est à retenir : ces recommandations sont claires et précises et très utiles. De plus il faut insister sur le poids important de la myocardite au décours de la Covid-19 par rapport à la myocardite post vaccinale. https://www.cdc.gov/mmwr/volumes/70/wr/mm7035e5.htm?s_cid=mm7035e5_x
https://www.cdc.gov/mmwr/volumes/70/wr/mm7035e5.htm?s_cid=mm7035e5_x
Une vaste étude américaine publiée indique que les patients atteints du Covid-19 ont en moyenne quasiment 16 fois plus de chances de développer une myocardite que ceux n'ayant pas contracté le virus. Un argument de poids en faveur de la vaccination, qui ne multiplierait en comparaison que par trois le risque d'inflammation du muscle cardiaque. En terme de bénéfice-risque la vaccination l'emporte largement !!!!! - La myocardite est une complication rare mais grave de l'infection par le coronavirus du syndrome respiratoire aigu sévère (SARS-CoV-2). La myocardite est définie par :



