Cancer
-
Cancer statistics 2023
 "La santé publique a pour mission d’assurer la prise en charge collective de la santé d’une population dans son milieu de vie, qu’il s’agisse de soins, de prévention,d’éducation ou d’hygiène sociale"
"La santé publique a pour mission d’assurer la prise en charge collective de la santé d’une population dans son milieu de vie, qu’il s’agisse de soins, de prévention,d’éducation ou d’hygiène sociale"
"Le monde autour de moi se dissout, laissant çà et là des îlots de temps. Le monde est un cancer qui se dévore lui-même. .. Je songe que lorsque le grand silence descendra sur tout et partout, la musique enfin triomphera. Quand, dans la matrice du temps, tout se sera à nouveau résorbé, le chaos règnera à nouveau, et le chaos, c'est la partition sur laquelle s'inscrit la réalité."Henry MillerCancer statistics 2023, Rebecca L. Siegel MPH, Kimberly D. Miller MPH, Nikita Sandeep Wagle MBBS, MHA, PhD, Ahmedin Jemal DMV, PhD,CA Cancer J Clin. 2023;73:17–48
https://acsjournals.onlinelibrary.wiley.com/doi/full/10.3322/caac.21763Article libre d'accésChaque année, l'American Cancer Society estime le nombre de nouveaux cas de cancer et de décès aux États-Unis et compile les données les plus récentes sur l'occurrence et les résultats du cancer dans la population à l'aide des données d'incidence recueillies par les registres centraux du cancer et des données de mortalité recueillies par le National Center pour les statistiques de la santé.En 2023, 1 958 310 nouveaux cas de cancer et 609 820 décès par cancer devraient survenir aux États-Unis. L'incidence du cancer du cancer de la prostate a augmenté de 3 % par an de 2014 à 2019 après deux décennies de déclin, se traduisant par 99 000 nouveaux cas supplémentaires ; sinon, cependant, les tendances de l'incidence étaient plus favorables chez les hommes que chez les femmes.
Par exemple, le cancer du poumon chez les femmes a diminué moitié moins vite que chez les hommes (1,1 % contre 2,6 % par an) de 2015 à 2019, et les cancers du sein et du corps utérin ont continué d'augmenter, tout comme le cancer du foie et le mélanome, qui se sont tous deux stabilisés chez les hommes de 50 ans et plus et ont diminué chez les hommes plus jeunes.Cependant, une baisse de 65 % de l'incidence du cancer du col de l'utérus entre 2012 et 2019 chez les femmes au début de la vingtaine, la première cohorte à recevoir le vaccin contre le papillomavirus humain, laisse présager une forte réduction du fardeau des cancers associés au papillomavirus humain, dont la majorité surviennent dans femmes.Malgré la pandémie, et contrairement aux autres principales causes de décès, le taux de mortalité par cancer a continué de baisser de 2019 à 2020 (de 1,5 %), contribuant à une réduction globale de 33 % depuis 1991 et à environ 3,8 millions de décès évités.Ces progrès reflètent de plus en plus les avancées thérapeutiques, qui sont particulièrement évidents dans les déclins rapides de la mortalité (environ 2 % par an de 2016 à 2020) pour la leucémie, le mélanome et le cancer du rein, malgré une incidence stable/en augmentation, et des déclins accélérés pour le cancer du poumon.En résumé, bien que les taux de mortalité par cancer continuent de baisser, les progrès futurs pourraient être atténués par l'augmentation de l'incidence des cancers du sein, de la prostate et du corps utérin, qui présentent également les plus grandes disparités raciales en matière de mortalité.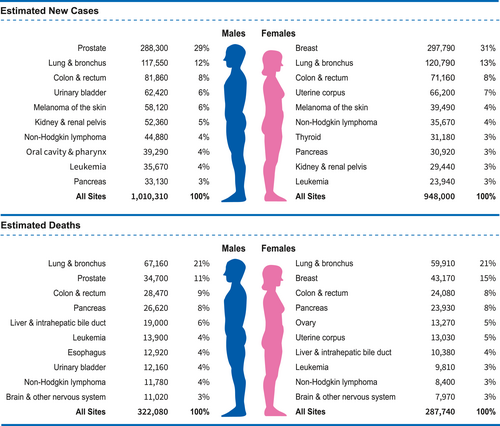 Dix principaux types de cancer pour les nouveaux cas de cancer estimés et les décès par sexe, États-Unis, 2023. Les estimations sont arrondies à la dizaine la plus proche et les cas excluent les cancers basocellulaires et épidermoïdes de la peau et les carcinomes in situ à l'exception de la vessie. Le classement est basé sur des projections modélisées et peut différer des données observées les plus récentes.
Dix principaux types de cancer pour les nouveaux cas de cancer estimés et les décès par sexe, États-Unis, 2023. Les estimations sont arrondies à la dizaine la plus proche et les cas excluent les cancers basocellulaires et épidermoïdes de la peau et les carcinomes in situ à l'exception de la vessie. Le classement est basé sur des projections modélisées et peut différer des données observées les plus récentes.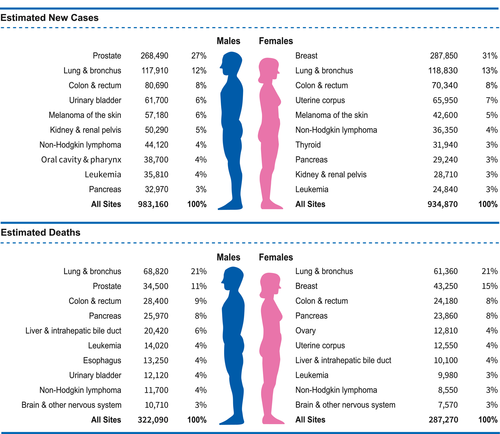 https://acsjournals.onlinelibrary.wiley.com/doi/10.3322/caac.21708
https://acsjournals.onlinelibrary.wiley.com/doi/10.3322/caac.21708
Ten Leading Cancer Types for the Estimate New Cancer Cases and Deaths by Sex, États-Unis, 2022. Les estimations sont arrondies à la dizaine la plus proche et excluent les cancers basocellulaires et épidermoïdes de la peau et les carcinomes in situ à l'exception de la vessie. Le classement est basé sur des projections modélisées et peut différer des données observées les plus récentes.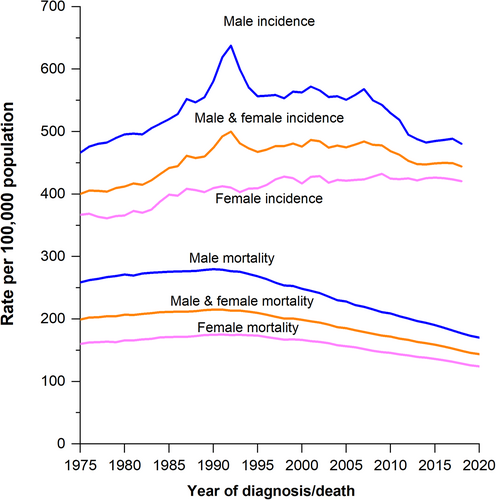
Tendances des taux d'incidence du cancer (1975-2019) et de mortalité (1975-2020) par sexe,États-Unis. Les taux sont ajustés selon l'âge à la population standard des États-Unis de 2000. Les taux d'incidence sont également ajustés en fonction des retards de déclaration.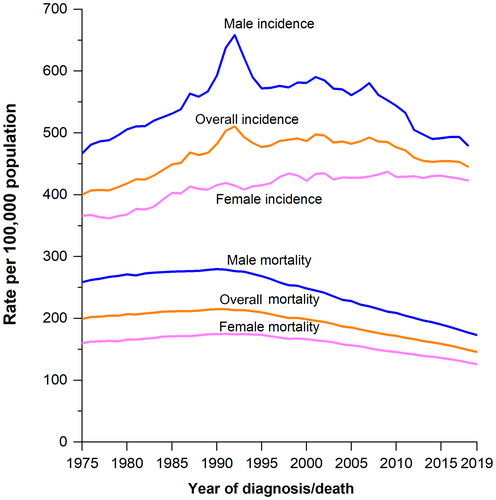 https://acsjournals.onlinelibrary.wiley.com/doi/10.3322/caac.21708
https://acsjournals.onlinelibrary.wiley.com/doi/10.3322/caac.21708
Tendances des taux d'incidence du cancer (1975-2018) et de mortalité (1975-2019) par sexe, États-Unis. Les taux sont ajustés selon l'âge à la population standard des États-Unis de 2000. Les taux d'incidence sont également ajustés en fonction des retards de déclaration.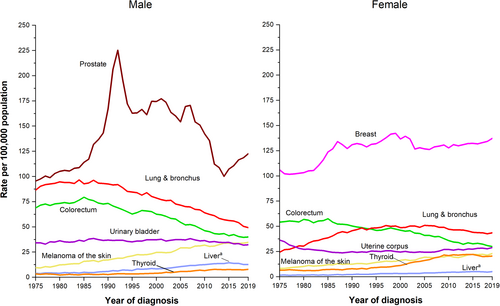
Tendances des taux d'incidence pour certains cancers par sexe, États-Unis, 1975-2019. Les taux sont ajustés en fonction de l'âge de la population standard des États-Unis de 2000 et ajustés en fonction des retards de déclaration. a Le foie comprend les voies biliaires intrahépatiques.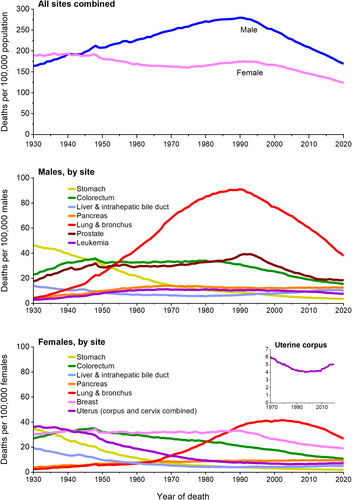
Tendances des taux de mortalité par cancer par sexe dans l'ensemble et pour certains cancers, États-Unis, 1930-2020. Les taux sont ajustés selon l'âge à la population standard des États-Unis de 2000.En raison des améliorations apportées au codage de la Classification internationale des maladies au fil du temps, les données du numérateur pour les cancers du poumon et des bronches, du côlon et du rectum, du foie et de l'utérus diffèrent de la période contemporaine. Par exemple, les taux pour les poumons et les bronches comprennent la plèvre, la trachée, le médiastin et d'autres organes respiratoires.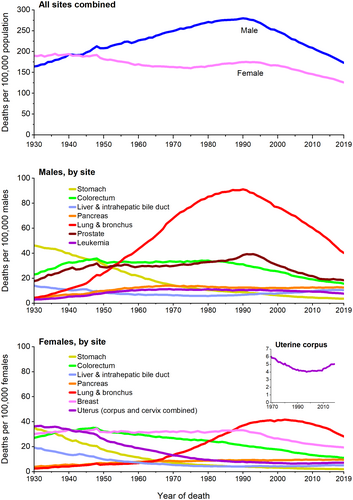
Tendances des taux de mortalité par cancer par sexe dans l'ensemble et pour certains cancers,États-Unis, 1930 à 2019. Les taux sont ajustés en fonction de l'âge de la population standard des États-Unis de 2000. En raison des améliorations apportées au codage de la Classification internationale des maladies au fil du temps, les données du numérateur pour les cancers du poumon et des bronches, du côlon et du rectum, du foie et de l'utérus diffèrent de la période contemporaine. Par exemple, les taux pour les poumons et les bronches comprennent la plèvre, la trachée, le médiastin et d'autres organes respiratoires.
Le taux de mortalité par cancer a diminué de façon continue depuis 1991, entraînant une baisse globale de 33 % et environ 3,8 millions de décès par cancer évités.Ce progrès constant est dû à la réduction du tabagisme ; adoption du dépistage des cancers du sein, colorectal et de la prostate ; et des améliorations dans les traitements, comme les chimiothérapies adjuvantes pour les cancers du côlon et du sein.Plus récemment, les avancées dans le développement de traitements ciblés et d'immunothérapie ont accéléré les progrès de la mortalité par cancer du poumon bien au-delà des réductions d'incidence et se sont traduites par des réductions importantes de la mortalité pour les cancers à incidence croissante ou stable (leucémie, mélanome et cancer du rein).Les percées thérapeutiques ont particulièrement amélioré la prise en charge de certains cancers difficiles à traiter, comme le cancer du poumon non à petites cellules et le mélanome métastatique.L'augmentation de l'incidence des cancers du sein, de la prostate et du corps utérin, qui présentent tous une grande disparité raciale en matière de mortalité et se prêtent à une détection précoce, est préoccupante.L'élargissement de l'accès aux soins et l'augmentation des investissements pour l'application à grande échelle des interventions existantes de lutte contre le cancer et pour la recherche afin de faire progresser les options de traitement et de développer des interventions efficaces pour réduire les inégalités contribueraient à atténuer les disparités et à accélérer les progrès contre le cancer.CommentaireCe type de stastitique est toujours très informatif sur l'état de cette pathologier qu'est le cancer. Incontestablement la lutte contre le cancer, leur dépistage, les avancées thérapeutiques ont révolutionné le cancer.
Le dépistage en France , un réel problème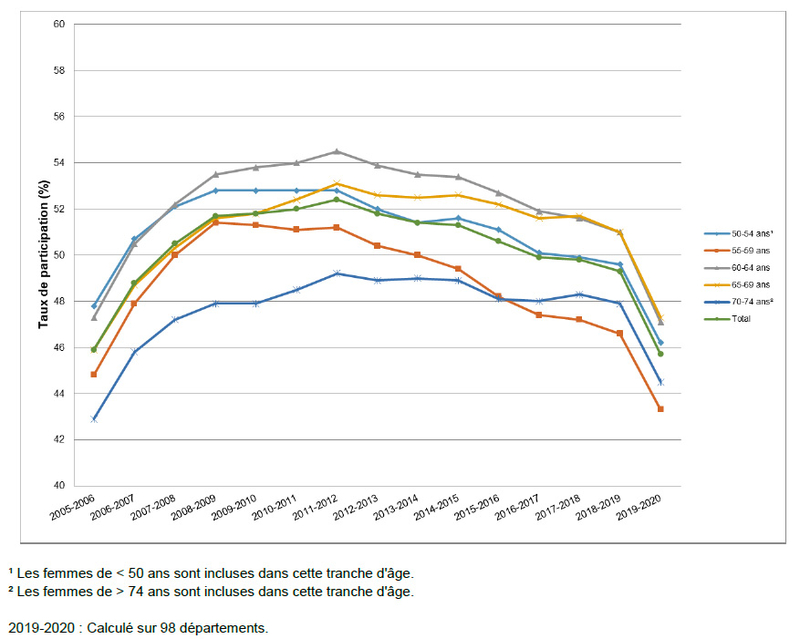 Evolution du taux de participation au dépistage organisé du cancer du sein, par âge - Période 2005-2020, attention à l'effet COVID, mais le dépistage est en baisse depuis 2014/2015.Au cours de l’année 2020, 2,5 millions de femmes ont effectué une mammographie de dépistage organisé, ce qui correspond à un taux national de participation de 42,8 %.C’est une baisse importante par rapport aux années précédentes.
Evolution du taux de participation au dépistage organisé du cancer du sein, par âge - Période 2005-2020, attention à l'effet COVID, mais le dépistage est en baisse depuis 2014/2015.Au cours de l’année 2020, 2,5 millions de femmes ont effectué une mammographie de dépistage organisé, ce qui correspond à un taux national de participation de 42,8 %.C’est une baisse importante par rapport aux années précédentes.
https://www.santepubliquefrance.fr/les-actualites/2021/depistage-du-cancer-du-sein-quelle-participation-des-femmes-en-2020
Près de 29% de la population a réalisé un test de dépistage du cancer colorectal en 2019-2020, un chiffre en baisse constante depuis plusieurs années 5,1 millions de personnes ont réalisé un test de dépistage du cancer colorectal (positif, négatif ou non analysable) en 2019-2020 représentant un taux de participation de 28,9% (comparé à 30,5% en 2018-2019)
https://www.santepubliquefrance.fr/les-actualites/2021/cancer-colorectal-donnees-de-depistage-2019-2020#:~:text=5%2C1%20millions%20de%20personnes,%25%20en%202018%2D2019).D'un côté la science progresse et de l'autre les français se font de moins en moins dépistés
"Le modèle des croyances relatives à la santé (Health Belief Model – HBM), développé dans les années 1950, aide à comprendre le manque de participation de la population aux programmes de prévention .
Selon ce modèle, la probabilité qu’un individu réalise un test de dépistage dépendrait de plusieurs facteurs :* penser que l’on peut être atteint par la maladie concernée ;
* avoir conscience de la gravité de la maladie ;
* être convaincu qu’il y a un bénéfice au dépistage supérieur aux barrières perçues (coût, inconfort, risques…)."
"La non-participation peut relever de déterminants divers dont la liste est longue : manque de sensibilisation, refus de l’action proposée, non-compréhension de l’enjeu et de l’intérêt du dépistage, peur du résultat, volonté de liberté, autres priorités ou contraintes de la vie quotidienne, fragilité économique et sociale, handicap, inadaptation ou approche impersonnelle des campagnes d’information organisées, ou encore manque d’implication du médecin traitant. Le choix des politiques de santé publique n’est pas, dans ces situations, de considérer la non-participation à un dépistage comme un fait immuable, mais de tout mettre en œuvre pour s’assurer que les populations ont bien compris les enjeux de cette démarche et de mieux aider et accompagner ceux qui seraient en difficulté pour la réaliser."
https://www.cairn.info/revue-sante-publique-2019-HS2-page-67.html
"Depuis 2003, trois plans cancer ont vu le jour, le dernier ayant pris fin en 2019. Le 4 février 2021, le Président Emmanuel Macron a présenté sa stratégie décennale de lutte contre le cancer (2021-2030), assorti d’un objectif ambitieux : réaliser un million de dépistages supplémentaires d’ici à 2025. Bonne nouvelle, la marge de progression est importante, si l’on s’en tient aux chiffres de la participation, plutôt faibles."
https://www.france-assos-sante.org/2022/10/04/le-depistage-organise-des-cancers-a-la-loupe/
QUELS SONT LES PRINCIPAUX FREINS CONNUS À LA PARTICIPATION AU DÉPISTAGE ?
Plusieurs catégories de freins au dépistage ont été identifiées. Ces freins interviennent souvent simultanément. Ils sont parfois plus difficiles à lever quand les femmes sont en situation socio-économique défavorable et/ou isolées culturellement ou géographiquement.LES FREINS LIÉS AU DÉPISTAGE DES CANCERS :
sentiment de fatalité face à la maladie ;
peur du cancer ;
peur du résultat ;
inégalités face à la prévention ;
manque de temps.
UN exemple : LES FREINS LIÉS AU CANCER DU COL DE L’UTÉRUS :
méconnaissance de la pathologie et de son dépistage ;
ne se sent pas concernée (âge, symptômes…) ;
gêne à l’égard de la localisation (sujet tabou, partie intime) ;
jamais proposé en consultation médicale par un professionnel de santé ;
sans accès à un suivi gynécologique (délais, coût…) ;
peur des traitements (laser, conisation…) ;
précédents tests normaux ;
caractère intrusif de l’examen ou mauvaise expérience ;
facteurs d’inégalités (niveau d’éducation, CSP, culture, pathologies chroniques, obésité, handicap…).
https://www.e-cancer.fr/Professionnels-de-sante/Depistage-et-detection-precoce/Depistage-du-cancer-du-col-de-l-uterus/Les-freins-au-depistage-sensibiliser-et-convaincreLe Ministère de la Santé est maintenant le Ministère de la Santé et de la PREVENTION !
Etonnant non ?
Alors la PREVENTION va être boostée ?
L'incitation à la prévention du cancer devrait être plus importante mais non coercitive mais il faut aller vers plus d'obligation. comme cela est réalisé dans plusieurs pays.
Il est maintenant possible de dépister aisément les cancer par une simple prise de sang : la BIOPSIE LIQUIDE
Schématiquement, trois outils sont utilisés dans les biopsies liquides :- L’ADN tumoral circulant : Il faut savoir que les cancers relarguent des petits bouts de leur ADN (le code génétique de la tumeur, localisée dans le noyau des cellules tumorales) dans le sang. Grâce à des équipements de plus en plus perfectionnés, il est désormais possible de détecter les anomalies génétiques de la tumeur en analysant l’ADN circulant librement dans le sang des patients. Il est ainsi possible de détecter un grand nombre d’anomalie (essentiellement les mutations de l’ADN du cancer) directement sur une prise de sang.
- L’ARN tumoral circulant : De la même manière, les cancers relarguent de l’ARN (molécules codées à partir de l’ADN et servant ensuite à fabriquer les protéines). De la même manière que précédement, il est possible d’analyser l’ARN de la tumeur et d’obtenir des informations précieuses sur les anomalies de fabrication des protéines dans les cellules cancéreuses. Cette approche permet d’obtenir d’autres informations qu’avec l’ADN.
- Les cellules tumorales circulantes : Les cancers peuvent également relarguer dans le sang des cellules tumorales entières et vivantes. Désormais, plusieurs techniques perfectionnées permettent de les isoler dans le sang et de les étudier. Les informations disponibles sont très importantes puisque ces cellules sont entières ; elles renferment donc leur ADN et leurs ARN qui peuvent être étudiées. Il est également possible d’étudier leur forme et leurs propriétés, deux informations très importantes pour le diagnostic et pour mieux cibler les traitements optimaux.
Hormis certains cancers du poumon, la biopsie liquide est aujourd’hui proposée uniquement dans le cadre de la recherche. Les patients peuvent toutefois en parler avec leur médecin oncologue référent qui pourra éventuellement leur dire si des études sont actuellement disponibles dans leur situation.
https://www.chu-lyon.fr/biopsie-liquide
Enfin aujourd'hui coût prohibitif.
Risque de faux positifs ou faux négatifsAlors WAIT !
A LIRE sur la biopsie liquide qui incite à la prudence : https://www.nytimes.com/2022/06/10/health/cancer-blood-tests.html -
Cancer/Cardiotoxicité/Cancer
Cardio-oncologie
-
Cancer/Exercice physique
 Mieux vivre le cancer avec l'exercice physique
Mieux vivre le cancer avec l'exercice physique -
CANCER/MTEV : les liens
 Cancer MTEV, récidive, hémorragie
Cancer MTEV, récidive, hémorragieCancer/MTEV/ ICI
 CRP et MTEV
CRP et MTEVCancer/MTEV/HBPM/AOD
 Prespectives
PrespectivesCancer/MTEV/Qualité de Vie
 Etre présent !
Etre présent !Cancers évitables
 Prévention des cancers
Prévention des cancersCAT et les AOD

CAT : cancer associated thrombosis
COMMAND VTE Registry
 Command VTE Registre le "Riete Japonais"
Command VTE Registre le "Riete Japonais"De l'instrumentalisation du cancer

Une désinformation de plus
De quoi meurent les patients atteints d'un cancer ?
 La doulreuse question, fin de vie et cancer
La doulreuse question, fin de vie et cancerDébat AOD et VTE/CANCER
 Un débat justifié
Un débat justifiéDépistage des cancers : utile ?
 Cancer Dépistage Durée de vie
Cancer Dépistage Durée de vieDépistage sanguin multi cancer
 IA à la rescousse
IA à la rescousseDépsitage précoce des cancers
 On entre dans un autre monde
On entre dans un autre monde
Entretien avec Grégoire Le Gal : la MTEV veineuse fait découvrir le cancer

“Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire.” A Kirwan
“Si il n'y avait pas la Science, combien d'entre nous pourraient profiter de leur cancer pendant plus de cinq ans ?” Pierre Desproges
Thème : la MTEV veineuse fait découvrir le cancer
Dans la pratique, la recherche d'un cancer en cas de MTEV sans facteur déclenchant pose toujours de nombreux problèmes.
Doit-on,trop en faire ou pas assez ?Quel est le juste milieux ?
J'ai donc demandé à Grégoire Le Gal , "un de nos cousins canadiens" de nous éclairer sur ce sujet.
Merci d'avoir accepté Grégoire. Dr. Grégoire Le Gal MD PHD
Dr. Grégoire Le Gal MD PHD
ProfessorDepartment of Medicine, University of Ottawa
Physician, Thrombosis Unit, Division of Hematology
The Ottawa Hospital - General Campus
Senior Scientist, Clinical Epidemiology Program
Ottawa Hospital Research InstituteQUESTION 1
Grégoire pourrais-tu définir ce qu’est exactement une MTEV sans facteur déclenchant ?
Malheureusement non, pas ‘exactement’. Certaines situations sont faciles à identifier. Une fracture de hanche récente traitée chirurgicalement est un facteur déclenchant évident, mais quid d’une arthroscopie en ambulatoire par exemple ? Par ailleurs, certains facteurs déclenchants telle que la période post-opératoire sont transitoires et réversibles, mais d’autres peuvent être persistants, comme un cancer ou une maladie inflammatoire chronique de l’intestin (MICI).
L’ISTH propose de classer les évènements thrombotiques en trois catégories :
1) provoqués par un facteur déclenchant transitoire « majeur » (chirurgie avec anesthésie générale de plus de 30 minutes, hospitalisation avec alitement d’au moins trois jours, césarienne), « mineur bien qu’important »(chirurgie avec anesthésie de moins de 30 minutes, hospitalisation courte, estrogénothérapie, grossesse ou post-partum, alitement à domicile, traumatisme des membres inférieurs avec mobilité réduite) ;
2) provoqués par un facteur déclenchant persistant : cancer, MICI, anticorps antiphospholipides ; 3) les évènements non provoqués, sans facteur déclenchant.
Mais comme vous le voyez, tout n’est pas noir ou blanc, et si certaines thromboses sont clairement non provoquées (« le coup de tonnerre dans un ciel bleu »), un jugement au cas par cas est indispensable.QUESTION 2
Quel est le % de cancer retrouvé en cas de MTEV sans aucun facteur déclenchant ?
On a longtemps pensé que le risque était de 10% à un an. Les essais randomisés récents ont rapporté des chiffres plus bas, de l’ordre de 5% de cancers occultes. Il est probable que dans les études de cohorte anciennes étaient comptabilisés des cancers qui étaient d’emblée apparents au moment du diagnostic de la thrombose.
QUESTION 3
La recherche d’un cancer dans le contexte de MTEV sans facteur déclenchant crée sas cesse la polémique. Il existe une grande distorsion entre les recommandations et la réalité du terrain. La tentation du scanner Thoraco Abdomino Pelvien est grande. Alors chez qui proposer cette recherche de cancer et comment ?
L’essai randomisé canadien SOME (https://www.nejm.org/doi/full/10.1056/NEJMoa1506623) n’a pas montré de bénéfice du scanner abdomino-pelvien par rapport à un dépistage limité (examen clinique, biologie de routine, mise à jour des examens de dépistage recommandés pour l’âge et le sexe), ni sur le nombre de cancers diagnostiqués au moment du diagnostic, ni sur le risque de cancer au suivi. L’essai français MVTEP (https://clinicaltrials.gov/ct2/show/NCT04304651) a montré qu’un PET-scanner augmentait, mais de façon non statistiquement significative, le nombre de cancers diagnostiqués initialement. En revanche, le risque de cancer au cours du suivi était significativement plus faible dans le groupe des patients ayant eu un PET-scanner par rapport à ceux du groupe ayant eu un dépistage limité. Nous avons entrepris un nouvel essai clinique de plus grande ampleur pour évaluer l’intérêt du PET-scanner dans cette indication.
Dans l’attente des résultats, les guides de pratique français et internationaux préconisent de réaliser un interrogatoire et un examen clinique complets, une biologie de routine et une analyse d’urine, une radiographie pulmonaire, et de mettre à jour les examens de dépistage habituels pour les cancers du sein, du col, de la prostate ou du colon.
Un message important pour finir sur cette question : en pratique, nous sommes souvent très inquiets du risque de cancer chez les patients jeunes présentant une thrombose non provoquée (« pourquoi lui, sportif, en santé etc… »), alors que dans les études récentes, nous avons pu montrer que le risque de cancer était très faible chez les patients jeunes atteints de thrombose (moins de 1%), augmentait de façon assez nette à partir de 50 ans pour atteindre 9% chez les patients de plus de 80 ans. Nous devons donc être particulièrement vigilants chez les patients de plus de 50 ans.
QUESTION 4
En cas de cancer à l’origine d’une MTEV, ce cancer est-il évolué ou au stade occulte, en dehors des tableaux cliniques évolués de cancer.
Dans les essais cités plus hauts, un tiers des cancers solides étaient diagnostiqués à un stage précoce (stade I/II) et deux tiers à un stade plus avancé (III/IV) sans différence significative entre les bras dépistage limité ou intensif. Il faut toutefois noter que quand bien même un dépistage intensif permettrait de diagnostiquer les cancers à un stade plus précoce, le bénéfice sur le pronostic resterait à démontrer. En effet, les études épidémiologiques montrent que la maladie thromboembolique est associée à une mortalité accrue chez les patients avec cancer, et que ceci est particulièrement vrai chez les patients avec un cancer localisé. Même en cas de cancer localisé, la thrombose est probablement la manifestation d’une maladie plus agressive.
QUESTION 5
Existe-t-il une valeur prédictive de cancer en fonction de la localisation initiale de la MTEV : TVP distale versus TVP proximale, EP proximale versus EP distale voire sous segmentaire
Des études antérieures ont montré une association entre thrombose distale bilatérale et diagnostic ultérieur de cancer. Dans les essais de dépistage cités plus haut, le risque de cancer occulte était le même chez les patients avec TVP isolée, TVP et EP ou EP isolée. A noter toutefois que la plupart de ces études avaient exclu les patients avec thromboses distales isolées, et que l’information sur le caractère unilatéral ou bilatéral de la TVP, le caractère sous-segmentaire ou plus proximal de l’EP, n’était pas collectée. Ces points précis n’ont donc pas pu être analysés.
QUESTION 6
Une fois le cancer découvert, le patient est anticoagulé pour sa MTEV. Doit-on envisager alors une modification de ce traitement anticoagulant, selon le type de cancer, selon son évolution ?
Oui. Sans rentrer dans les détails, car cela pourrait faire l’objet d’un entretien complet, la prise en charge de la maladie thromboembolique est bien sûr différente chez les patients avec cancer.
Même si de plus en plus de patients peuvent être traités par AOD, le traitement par héparine de bas poids moléculaire au long cours est toujours indiqué dans certaines situations. Il existe aussi une indication à la poursuite du traitement anticoagulant tant que le cancer est actif et/ou que des traitements sont poursuivis (hormonothérapie…).
Dans l’attente des résultats de l’essai français APICAT,nous manquons de données sur la réduction de la dose d’AOD après 6 mois chez les patients avec cancer.
Etude APICAT : https://clinicaltrials.gov/ct2/show/NCT03692065?cond=API-CAT&draw=2&rank=1
Etude MVPT : https://www.em-consulte.com/article/1029759Merci Grégoire pour la clarté ,la justesse de ton analyse et la pertinence de tes réponses.
Entretien avec Isabelle Mahé : Thrombose et cancer
 "L'esprit humain est plus fort que tout ce qui peut lui arriver." C.C. Scott
"L'esprit humain est plus fort que tout ce qui peut lui arriver." C.C. Scott
« Trois idéaux ont éclairé ma route et m'ont souvent redonné le courage d'affronter la vie avec optimisme : la bonté, la beauté et la vérité. » Albert Einstein
Thrombose et cancer : c'est au quotidien que nous sommes de plus en plus concernés par cette association, une liaison dangereuse, dont il faut écarter tous les pièges. Qui est le mieux placé aujourd'hui pour décrypter cette thématique ? Isabelle Mahé a bien voulu répondre à https://medvasc.info/. Merci Isabelle d'avoir accepté cet entretien.
Isabelle Mahé , Professeur des Universités, Praticien Hospitalier en Médecine Interne
Chef du service de Médecine Interne, Hôpital Louis Mourier, APHP, Université Paris Cité
INNOVTE-FCRIN, Cedex2 ,Saint EtienneEpidémiologie de la MTEV au cours du cancer actif et typologie (localisation, récurrence, risque hémorragique)
Avec les progrès notables des traitements anticancéreux ces dernières années, l’espérance de vie des patients avec cancer s’allonge. Dans le même temps, et dans le contexte des progrès réalisés en imagerie, l’incidence des événements thromboemboliques veineux associés au cancer progresse, quel que soit le site du cancer. Dans une étude récente, le risque thromboembolique chez les patients avec cancer a été estimé à 9 fois celui des patients sans cancer.Le risque thromboembolique veineux dépend du site et du stade du cancer, mais aussi des caractéristiques du patient et des traitements du cancer. Ainsi, les cancers du pancréas, gastrique, du poumon et les tumeurs cérébrales sont les plus à risque thromboembolique en risque relatif ; mais en terme d’effectifs, les patients avec cancers du sein, de la prostate et colorectal, en raison de leur prévalence élevée et bien qu’à moindre risque relatif de thrombose, sont les plus nombreux des patients avec thrombose et cancer.
Quel que soit le type de tumeur, la survenue d’un événement thromboembolique veineux est associée à un mauvais pronostic. Par ailleurs, après un premier épisode, sous traitement anticoagulant bien conduit, les patients avec cancer ont un risque majoré de développer une récidive veineuse thromboembolique et d’avoir des complications hémorragiques par rapport aux patients sans cancer.
Pendant longtemps les HBPM ont été le traitement référence de la MTEV au cours du cancer depuis l’étude CLOT. Aujourd’hui les choses changent, les AOD ont le vent en poupe. Qu’apportent les AOD par rapport aux HBPM dans ce contexte ?Par rapport aux HBPM administrés au long cours par voie injectable, les AOD ont l’avantage de la voie orale. Les HBPM sont longtemps restées la seule alternative thérapeutique recommandée chez les patients atteints de thrombose et cancer. Désormais, 2 alternatives s’offrent au prescripteur et au patient, HBPM et AOD, qui ne sont pas exclusives, puisque l’une ou l’autre des options peut être privilégiée au cours du suivi du patient selon le contexte et les préférences, ce qui est très positif.
Que reste-t-il des indications des HBPM en 2022 ?Les HBPM sont et restent une alternative de premier choix dans la prise en charge thérapeutique de la thrombose associée au cancer, comme cela a été rappelé dans la mise à jour des Recommandations Françaises en 2021 (https://doi.org/10.1016/j.
rmr.2021.03.001). De plus, chez les patients avec une insuffisance rénale sévère, situation où les AOD sont contre-indiqués, les HBPM sont privilégiées (Recommandations Françaises 2021).
La prévention de la MTEV au décours d’un cancer actif se pose régulièrement. Quelle est ta pratique à ce sujet ?Les patients avec cancer sont à risque thromboembolique veineux, à l’origine d’un surcroît de morbidité, de mortalité et de coûts de santé. Dans ce contexte, la thromboprophylaxie semble attractive.
Bien que les HBPM aient démontré une efficacité par rapport au placebo dans la prévention du risque thromboembolique veineux chez les patients avec cancer recevant une chimiothérapie en ambulatoire, leur prescription systématique n’est pas recommandée compte tenu de la réduction modeste du risque de survenue d’événement thromboembolique veineux, du risque hémorragique et de la contrainte de la voie injectable.
Plus récemment, les AOD ont été évalués prospectivement chez les patients avec cancer les plus à risque thromboembolique veineux (score de Khorana ≥2), mettant en évidence une réduction du risque thromboembolique veineux à 6 mois, au prix d’une augmentation significative du risque de saignements majeurs.
En pratique, en dehors du cas du myélome qui justifie une prophylaxie, la thromboprophylaxie doit être discutée au cas par cas devant les cancers les plus thrombogènes, en l’absence de facteur de risque hémorragique.
L’étude APICAT qui tu diriges est très attendue, peux-tu nous en rappeler la philosophie ?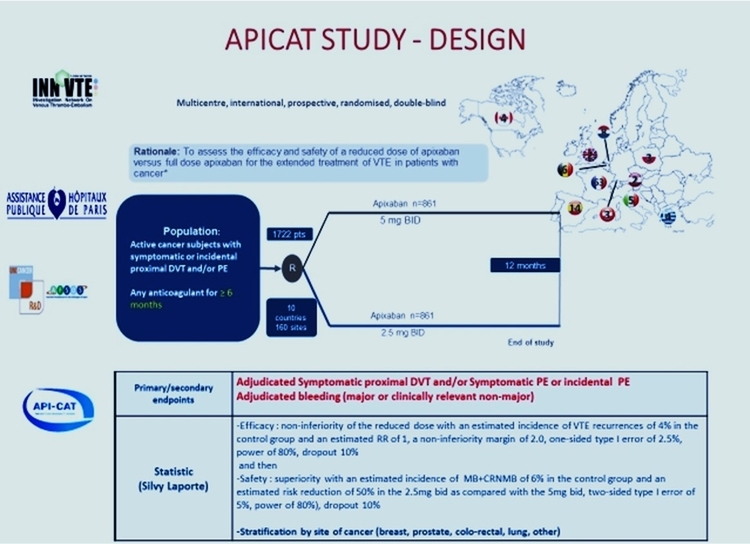
Mahé I, et al. Thromb Haemost 2021. doi: 10.1055/a-1647-9896Les essais thérapeutiques évaluant les différents schémas thérapeutiques d’anticoagulants chez des patients avec un cancer ont pour la plupart été menés avec une évaluation à 6 mois de l’événement index.
Avec les progrès des traitements anticancéreux et des soins de support, près de 60% des patients pris en charge pour un événement thromboembolique veineux associé à un cancer sont encore vivants 6 mois plus tard. La question de leur traitement se pose alors.
Après un épisode thromboembolique veineux dans un contexte de cancer, le risque de récidive est élevé, surtout dans les premières semaines suivant l’événement. Après 6 mois, ce risque persiste, même s’il est moins élevé que dans les 6 premiers mois alors que le risque hémorragique est significatif. Dans ce contexte, l'option d’une dose réduite d’anticoagulant semble attractive et justifie d'être évaluée prospectivement.
L’objectif principal de l’étude API-CAT (étude prospective randomisée en double aveugle) est d’évaluer la non infériorité sur le risque de récidive thrombo-embolique veineux d’une dose réduite d’anticoagulant (apixaban 2.5 mg X2/j) par rapport à la dose pleine (5 mg X2/j) chez des patients avec cancer actif ayant reçu au moins 6 mois d’anticoagulant pour un événement thrombo-embolique veineux ; si cet objectif est atteint, la supériorité de la dose réduite sur le risque hémorragique sera recherchée. L’analyse sera stratifiée selon le site de cancer.
A ce jour, plus de 1100 patients sur les 1722 patients attendus ont été inclus dans les 11 pays participant à l’étude.
Les AOD présentent des interactions avec les traitements du cancer. Peux-tu nous rappeler les interactions les plus dangereuses. Existe-t-il un ou des sites qui permettent en consultation lorsque que la prescription d’un AOD est possible d’éviter des associations à risqueLa question des interactions médicamenteuses entre AOD et anticancéreux est souvent évoquée. Elle peut s’envisager sous 2 angles ; le premier : peut-on attendre un effet de l’AOD sur l’effet antitumoral ? La réponse est non, il y a peu ou pas d’effet attendu de l’AOD sur l’effet du traitement antitumoral ; le deuxième : peut-on attendre un effet de l'anti tumoral sur l’effet de l’AOD ? La question se pose pour les traitements dont le métabolisme passe par le CYP3A4 et qui sont substrats de la P-gp. Dans la plupart des cas, l’intervalle thérapeutique large des AOD permet de ne pas anticiper d’impact clinique. La question reste posée pour les inhibiteurs/inducteurs puissants du 3A4 et de la P-gp, qui étaient des critères de non inclusion des essais thérapeutiques évaluant les AOD dans la thrombose associée au cancer. Il faut rappeler que pour ces situations, les données disponibles concernant les interactions n’ont pas été obtenues chez des patients.
https://cancer-<wbr< a=""> />druginteractions.org</wbr<>
https://www.afsos.org/fiche-
referentiel/prise-charge-de- maladie-thromboembolique- veineuse-cancerologie/
Les nouveaux AOD arrivent. Est-ce que les Anti XI par exemple ont été testés pour traiter la MTEV dans le cancer ou la prévenir ?Les anti XI semblent avoir un profil intéressant : en agissant au niveau du facteur XI, ces traitements permettent de prévenir le risque thromboembolique tout en minimisant le risque hémorragique.
A ce jour des données sont disponibles dans la prévention du risque thromboembolique dans la chirurgie du genou et la prévention du risque cardio-embolique dans la fibrillation auriculaire.
Un tel profil semble particulièrement attractif dans la prise en charge de la maladie veineuse thromboembolique associée au cancer. Des études prospectives randomisées sont sur le point de débuter en France dans la prise en charge initiale de la thrombose associée au cancer, avec un suivi à 6 mois.
Merci à Isabelle Mahé, des réponses claires, pour une meilleure connaissance sur THROMBOSE et CANCER, avec des retombées pratiques précieuses.Entretien avec l'autrice Géraldine Poénou (Hgie/Cancer/MTEV)
 "Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire." A Kirwan
"Quand il lut quelque part que fumer pouvait provoquer le cancer, il arrêta de lire." A Kirwan
« Presque tous les hommes meurent de leurs remèdes et non pas de leurs maladies. » MOLIÈRE (1622-1673), Le Malade imaginaire
Entretien ave Géraldine Poénou à propos de l'article
( inCancers 2022, 14, 1937. https://doi.org/10.3390/cancers14081937 Le point de départ :Les patients présentant des événements thromboemboliques veineux dans le cadre d'un cancer relèvent d’un traitement anticoagulant (quand il est possible) tant que le cancer est actif. De plus, malheureusement le cancer actif est autant un facteur de risque de récurrence d’événements thromboemboliques veineux qu’un facteur de risque hémorragique sous anticoagulant. Par conséquent, une stratégie d'anticoagulation sur mesure doit reposer sur une évaluation individualisée des risques de récidive thromboembolique veineuse et d'hémorragie associée aux anticoagulants. Aucun modèle d'évaluation des risques existant pour le risque de saignement associé aux anticoagulants n'a été validé pour la thrombose associée au cancer.
Le point de départ :Les patients présentant des événements thromboemboliques veineux dans le cadre d'un cancer relèvent d’un traitement anticoagulant (quand il est possible) tant que le cancer est actif. De plus, malheureusement le cancer actif est autant un facteur de risque de récurrence d’événements thromboemboliques veineux qu’un facteur de risque hémorragique sous anticoagulant. Par conséquent, une stratégie d'anticoagulation sur mesure doit reposer sur une évaluation individualisée des risques de récidive thromboembolique veineuse et d'hémorragie associée aux anticoagulants. Aucun modèle d'évaluation des risques existant pour le risque de saignement associé aux anticoagulants n'a été validé pour la thrombose associée au cancer.
Pour obtenir un meilleur modèle d'évaluation des risques, il semble nécessaire de se poser plusieurs questions que l'on a directement posé à Géraldine
Dr Géraldine Poénou@zudenstein
Assistante spécialiste en médecine vasculaire et thérapeutique
(Pr Laurent Bertoletti)
Service de Médecine Interne, Hôpital Louis Mourier, APHP Paris, Colombes
(Pr Isabelle Mahé)
Tout d’abord félicitations à toute l’équipe du Pr Isabelle Mahé pour cet article passionnant et très utile car il met en évidence des points majeurs sur l’anticoagulation de la MTEV au cours du cancer et notamment sur le risque hémorragique.
Le résumé graphique de l'article est hautement pertinent et didactique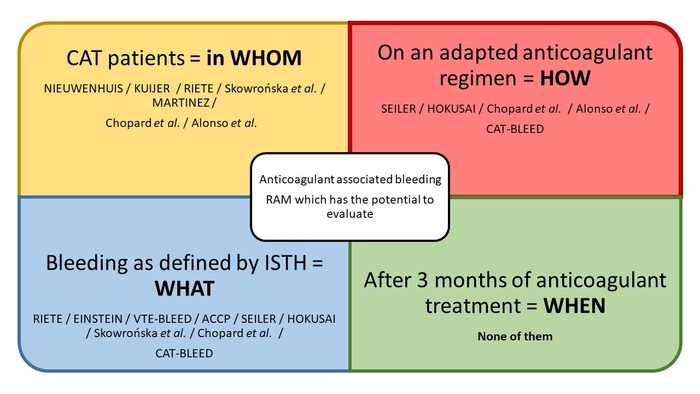
Alors première question : quelles sont les particularités du risque hémorragique, durant l’anticoagulation d’une MTEV au décours d’un cancer actif ?
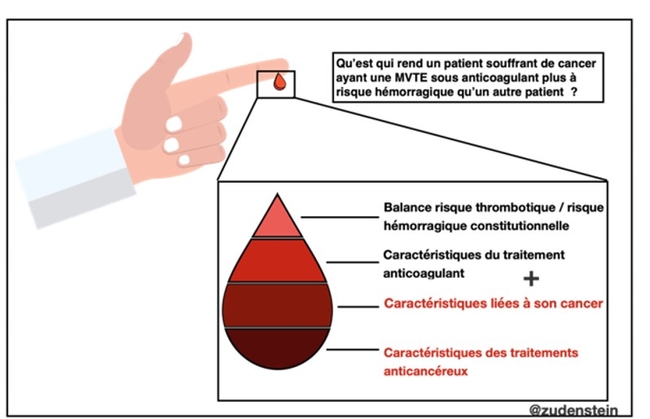
Merci pour les félicitations, nous sommes tous très heureux des retours positifs que nous avons pour l’article ! Je pense que le plus important dans notre approche est que nous avons tenu à recentrer la question autours du patient : « Qu’est qui rend un patient souffrant de cancer ayant une MVTE sous anticoagulant plus à risque hémorragiquequ’un autre patient ? ». En se posant la question de cette façon cela force à se pencher, tout d’abord sur les caractéristiques intrinsèques du patient puis sa relation avec son environnement notamment thérapeutique.
Les caractéristiques intrinsèques du patient regroupent sa balance risque thrombotique/ risque hémorragique constitutionnelle propre à ce dernier (âge, situation à risques hémorragiques, insuffisance d’organe…) ainsi que les caractéristiques liées à son cancer (site, type, métastase…). Ces facteurs de risques sont immuables et doivent être recherché de manière systématique.
En association aux deux caractéristiques sus citées, il est important d’ajouter l’influence des traitements anticoagulant d’une part et des traitements anti cancéreux d’autre part. En effet, la sensibilité à certains traitements, ses propriétés pharmacologiques, sa toxicité et ses interactions médicamenteuses influent sur le risque hémorragique.
Si deux aspects sont systématiquement à évaluer chez tout patient ayant une MVTE (sa balance hémorragie/thrombose et son type de traitement anticoagulant) les particularités de notre patient dans cette situation est qu’il est nécessaire de prendre en compte aussi de manière de manière simultanée les caractéristiques liées à son cancer et l’impact de son traitement anticancéreux.
Le risque hémorragique dans ce contexte est il supérieur ou inférieur au risque de récidive de la MTEV ?Cette question à une réponse variable au cours du temps. D’après la littérature, chez un patient ayant une MTEV ce que l’on sait c’est qu’au moment du diagnostic risque de récidive et risque hémorragique sont égaux. Mais là où le risque de récidive diminue au fil des mois, le risque hémorragique reste constant sous anticoagulant et devient donc supérieur. C’est sur ce raisonnement qu’après la phase initiale de traitement, il est proposé une demi-dose en prévention des récidives de MVTE en population général. La même cinétique est observée chez les patients atteints de cancer. D’où l’idée de l’essai randomisé contrôlé international APICAT du Professeur Isabelle MAHÉ qui j’espère avec la participation active de tous permettra une limitation des expositions évitables à un surrisque hémorragique.
Dans cet article les différents scores de risque hémorragiques sont passés en revue. Pour mémoire il n’existe qu’un score de risque hémorragique Cancer et MTEV associé le score CAT-BLEED. Nous savons toutes et tous que les scores ont des limités ce que souligne la littérature et que le score parfait n’existe pas. Les items des scores sont plus pertinents. Alors quels seraient les paramètres les plus utiles dans la pratique quotidienne pour évaluer le risque hémorragique, en cas de MTEV/Cancer actif ?
Question difficile !La liste des facteurs influençant le risque hémorragique est longue voir fastidieuse pour une pratique en routine. Dans un monde idéal, il faudrait arriver à développer pour la pratique quotidienne une évaluation de la balance risque thrombotique/ risque hémorragiquerespectant la balance bénéficie/risque.
Cela passera potentiellement par l’intégration de nouveaux outils faciles d’emploi comme des biomarqueurs pour évaluer l’ensemble des éléments de l’équation « à quel risque hémorragique nous exposons les patients ? ».
Ce risque hémorragique est différent selon le type de cancer, sa localisation, les traitements du cancer et le traitement anticoagulant. Cette notion est très importante. Sans caricaturer le sujet quels sont les directions majeures à retenir des quatre questions : WHOM ? HOW ? WHAT ? WHEN ?WHOM ? => Comprendre qu’un patient cancéreux est à plus haut risque hémorragique et thrombotique que la population générale et donc doit être traité à part.
HOW? => Se rappeler qu’il est plus complexe dans sa prise en charge. Nous nous devons de trouver un moyen d’évaluer de manière globale l’addition des facteurs à prendre en compte.
WHAT? => Parler et mesurer la même chose. Nous nous devons de nous appuyer sur les critères tel que défini par l’ISTH pour parler d’hémorragie majeure, ou non majeure mais cliniquement pertinente.
WHEN? => Après 6 mois pour être plus bénéfique qu’à risque. La chose que nous souhaitons le plus en tant que médecin c’est d’abord le primum non nocere, il ne faut pas évaluer le traitement alors que ça non-prescription entrainerait une forte probabilité de décès. C’est après 6 mois de traitement, lorsque le risque de récidive est au plus bas, que l’évaluation prend tout son intérêt.
Compte tenu des bases de données sur cette thématique majeure, est ce que l’Intelligence Artificielle (Machine Learning) pourrait être d’une aide efficace ?
OUI ! L’individualisation ou personnalisation d’un traitement ne peut être que plus efficace via l’Intelligence Artificielle
Merci à toi Géraldine de nous avoir éclairé sur un sujet "délicat" auquel les médecins vasculaires sont confrontrés au quotidien.
Merci pour cet article qui pose les bonnes questions. Le réponses ne sont pas toutes au rendez-vous, la question du traitement anticoagulant devrait avancer avec les résultats de l’étude APICAT et d’autres.
Les RCP ONCO-THROMBOSE pour ces cas difficiles sont d'un grande aide.FAST TRACK BIBLIO 37 : des articles importants
 Veille bibliographique
Veille bibliographique

